文章信息
- 李振华, 李翠平, 张相强, 代立婷, 唐梦思, 王国才, 蒋建伟, 曹明溶
- LI Zhen-hua, LI Cui-ping, ZHANG Xiang-qiang, DAI Li-ting, TANG Meng-si, WANG Guo-cai, JIANG Jian-wei, CAO Ming-rong
- EM-3通过Stat3通路诱导鼻咽癌细胞凋亡和G2/M期阻滞并降低SP细胞比例
- EM-3 Targets Stat3 to Induce Apoptosis, G2/M Cell Cycle Arrest and Reduce the Proportion of SP Cells in Nasopharyngeal Carcinoma
- 中国生物工程杂志, 2016, 36(3): 1-10
- China Biotechnology, 2016, 36(3): 1-10
- http://dx.doi.org/DOI:10.13523/j.cb.20160301
-
文章历史
- 收稿日期: 2015-09-28
- 修回日期: 2015-10-20
2. 肥城市环境保护局 泰安 271600;
3. 暨南大学药学院中药及天然产物研究所 广州 510632;
4. 中山大学肿瘤防治中心 广州 510060
2. Feicheng Environment Protection Agency, Taian 271600, China;
3. Institute of Traditional Chinese Medicine and Nature Products, College of Pharmacy, Guangzhou 510630, China;
4. Cancer Center of Sun Yat-sen University, Guangzhou 510060, China
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国最为常见的头颈部恶性肿瘤,尤其以广东省最为常见,年发病率高达54.7/10万[1],因此也被称为“广东瘤”。虽然近年来鼻咽癌的诊断、治疗有了很大发展,大大提高了患者的5年生存率,但是远处转移和放化疗无效已成为鼻咽癌治疗失败的主要原因[2]。除了传统治疗方案外,鼻咽癌肿瘤干细胞研究将有可能成为突破点,因此,研究新的多靶点抗肿瘤药物对鼻咽癌的治疗具有重要临床意义。
白花地胆草(Elephantopus mollis H.B.K)属于菊科地胆草属植物,产于福建、台湾和广东沿海地区,并在各热带地区有广泛分布,白花地胆草具有清热解毒,凉血利水,以及抗菌消炎的功效,在民间可治疗癌症、骨折、腹痛、痢疾和蛇虫咬伤等[3, 4]。药理学和化学成分研究表明,其所含化学成分类型比较多,而咖啡酰奎宁酸类衍生物和倍半萜内酯类是其主要活性成分[5]。近几年,白花地胆草抗肿瘤活性研究成为热点,其有效成分可以抑制小鼠黑色素瘤细胞中黑色素原的生成[6],诱导肝癌HepG2细胞Caspase-3介导的细胞凋亡[7],提高人非小细胞肺癌细胞NCI-H23和乳腺管癌细胞T-47D抗氧化能力[8]等。
本课题组前期采用MTT追踪白花地胆草中抗肿瘤活性成分,从白花地胆草中分离出25种单体,筛选出其中抗肿瘤效果明显的活性单体,并进一步以具有代表性分子结构的化合物EM-3作为候选化合物,见图 1。经文献检索,尚未有EM-3单体抗肿瘤作用机制的报道。本研究目的在于探究EM-3对人鼻咽癌CNE2细胞的抗肿瘤作用机制,并为EM-3进入动物和临床研究提供实验依据。
 |
| 图 1 EM-3单体的化学结构 Fig. 1 The chemical structure of EM-3 monomer |
白花地胆草活性单体EM-3为本课题组库存分子。CNE2、CNE2-S18(人高侵袭、高转移鼻咽癌)细胞和L02(人正常肝脏细胞)由中山大学肿瘤防治中心提供,xIAP、Bax、Bcl-2、Caspase-3、Caspase-9、Met、p-Met、Stat3、p-Stat3、Cyclin D1、Cyclin B1、Mcl-1、Oct4、Sox2一抗均购自美国Cell Signaling Technology,MMP2和MMP2购自Santa Cruz Biotechnology,MTT购自美国Sigma公司,Hoechst33342购自Sigma-Aldrich公司,FTC购自Merck公司,Annexin V-FITC/PI双染试剂盒购自上海罗氏生物科技有限公司。
1.2 方 法 1.2.1 细胞培养CNE2、CNE2-S18和L02细胞用RPMI-1640培养液(含有10% FBS)于37℃、含5% CO2的恒温培养箱中常规培养。每两天更换新鲜培养液,细胞融合度达到80%时,用0.25%胰酶消化传代。
1.2.2 MTT法检测细胞活性实验取对数生长期的细胞加入96孔板中,每孔100μl细胞悬液,细胞密度3 000个/孔,培养24h。细胞贴壁后加入不同浓度的药物100μl,每组设4个平行孔,置于培养箱培养24h、48h、72h,实验终止前4h每孔加入10μl 5g/L MTT试剂,再孵育4h,弃去上清液,每孔加入100μl DMSO,待结晶溶解后在酶联检测仪上检测570nm波长下每孔的OD值,并计算细胞增殖率。
细胞的相对增殖率(P%):P% = OD实验组/ OD阴性对照组×100%
1.2.3 克隆形成抑制实验分别取对数生长期的CNE2和CNE2-S18细胞,胰酶消化,用RPMI-1640培养液重悬,接种于6孔板中(600个细胞/孔),每设置2个复孔,设DMSO对照组(与最高浓度药物等体积)和加药组,置于37℃、含5% CO2的恒温培养箱中,培养14天后弃去上清液,用PBS小心浸洗2遍,加入75%乙醇固定30min,吸去固定液后,适量2%结晶紫染色30min后,冲洗、干燥、拍照。
克隆形成率=克隆数/接种数×100%
1.2.4 细胞划痕实验取对数生长期的CNE2细胞接种于12孔板(105个/ml),培养24h后,用200μl的移液器枪头在每孔中央纵轴和横轴方向各划出一条创伤区域。PBS洗去漂浮细胞后,换成无血清培养液,设DMSO对照组(与最高浓度药物等体积)和加药组,每组3个复孔,置于37℃、含5% CO2的恒温培养箱,在0h和24h分别在倒置相差显微镜下观察并拍照。
1.2.5 流式细胞术检测细胞周期取对数生长期的CNE2细胞接种于6孔板,24h后加入不同浓度的EM-3,对照组加入DMSO(与最高浓度药物等体积),48h后收集细胞,1 200r/min,离心5min,弃去上清液,PBS洗1遍,弃去PBS,用残留的PBS吹匀细胞,加入900μl/孔 75%乙醇,固定过夜。1 200r/min,离心5min收集细胞,PBS洗2遍后重悬细胞加入含RNase A(终浓度50μg/ml)和PI(终浓度50μg/ml)的1ml PBS中,避光室温放置10min后,细胞筛网过滤细胞,在流式细胞仪上进行细胞周期测定。
1.2.6 流式细胞术检测细胞凋亡取对数生长期的CNE2细胞接种于6孔板,24h后加入不同浓度的EM-3,并设DMSO(与最高浓度药物等体积)对照组。48h后收集细胞,1 200r/min,离心5min,弃去上清液,PBS洗1遍,加入500μl Binding Bufffer悬浮细胞,加入5μl Annexin V-FITC、5μl PI,混匀,避光,室温放置15min,在流式细胞仪上进行细胞凋亡测定。
1.2.7 流式分选检测CNE2-S18肿瘤干细胞样SP细胞比例培养足够CNE2-S18细胞,消化离心,1 000r/min离心5min,弃去上清液,PBS洗1遍,用2% FBS PBS重悬细胞,用细胞筛网过滤成单细胞悬液。细胞计数,调整细胞至浓度为106个/ml,取1ml单细胞悬液至15ml离心管中,加入1μl FTC Fumitremorgin(阳性对照)至终浓度5μg/ml,5min后加入Hoechest 33342 (2.5mg/ml) 2μl/ml,孵育90min,每隔10min混匀一次。将剩下的单细胞悬液分装至50ml离心管,加入Hoechst 33342 (2.5mg/ml) 2μl/ml,孵育90min,每10min混匀一次。离心,PBS重悬细胞,用细胞筛网过滤成单细胞悬液。将细胞悬液分装至无菌有盖流式管中,置冰上,避光,在流式细胞超速分选仪上进行SP细胞分选。
1.2.8 Western blotting检测相关信号通路蛋白CNE2细胞用不同浓度的EM-3作用24h后,冷PBS洗2遍,加入细胞裂解液(含蛋白酶和磷酸酶抑制剂)冰上裂解15min,12 000r/min,4℃离心15min,吸取上清液至新的EP管,BCA法测定蛋白质浓度。取适量蛋白质上样至常规胶电泳,转膜,封闭。一抗4℃孵育过夜,TBST洗膜3遍,10min/遍,二抗室温孵育2h,TBST洗膜3遍,10min/遍。化学发光显色,曝光,显影洗片,扫描仪扫描。
1.2.9 统计学分析采用SPSS 17.0软件进行统计学处理,数据均以均数±标准差(x± s)表示,结果采用三次独立实验,P <0.05为统计学有显著性差异。
2 结 果 2.1 EM-3对鼻咽癌细胞增殖抑制的影响MTT细胞活性实验表明,EM-3对CNE2细胞增殖抑制作用呈现浓度和时间依赖性,即在相同作用浓度下,细胞活力随着药物浓度的增加而逐渐降低;在相同作用时间下,细胞活力随着作用时间的增加而逐渐降低,见图 2(a)。同时,EM-3作用CNE2-S18细胞48h也出现显著抑制并呈浓度依赖性,在15μmol/L和30μmol/L作用显著,而且对人正常肝脏细胞活力无显著抑制效果,见图 2(b)。
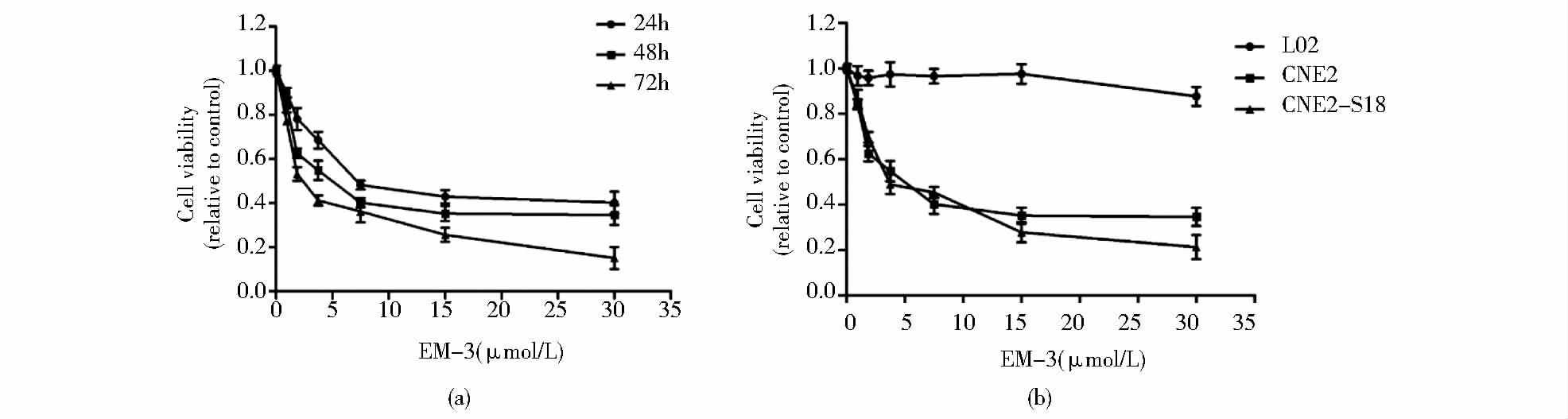 |
| 图 2 EM-3对鼻咽癌CNE2和CNE2-S18细胞增殖抑制效果 Fig. 2 Inhibitory effect of EM-3 on the proliferation of CNE2 cells(a)CNE2 cells were treated with EM-3 at the indicated concentration for 24h and 48h and 72h (b)Cell viability was presented in L02,CNE2 and CNE2-S18 cells |
EM-3作用于CNE2和CNE2-S18细胞14天,与DMSO对照组相比,随着药物浓度增加,细胞克隆数显著减少,并且克隆体积显著变小(* P<0.05)。当药物浓度为2μmol/L时,CNE2细胞克隆几乎完全被抑制,而对于高侵袭、高转移CNE2-S18细胞克隆也有显著抑制作用(*P<0.01),见图 3。
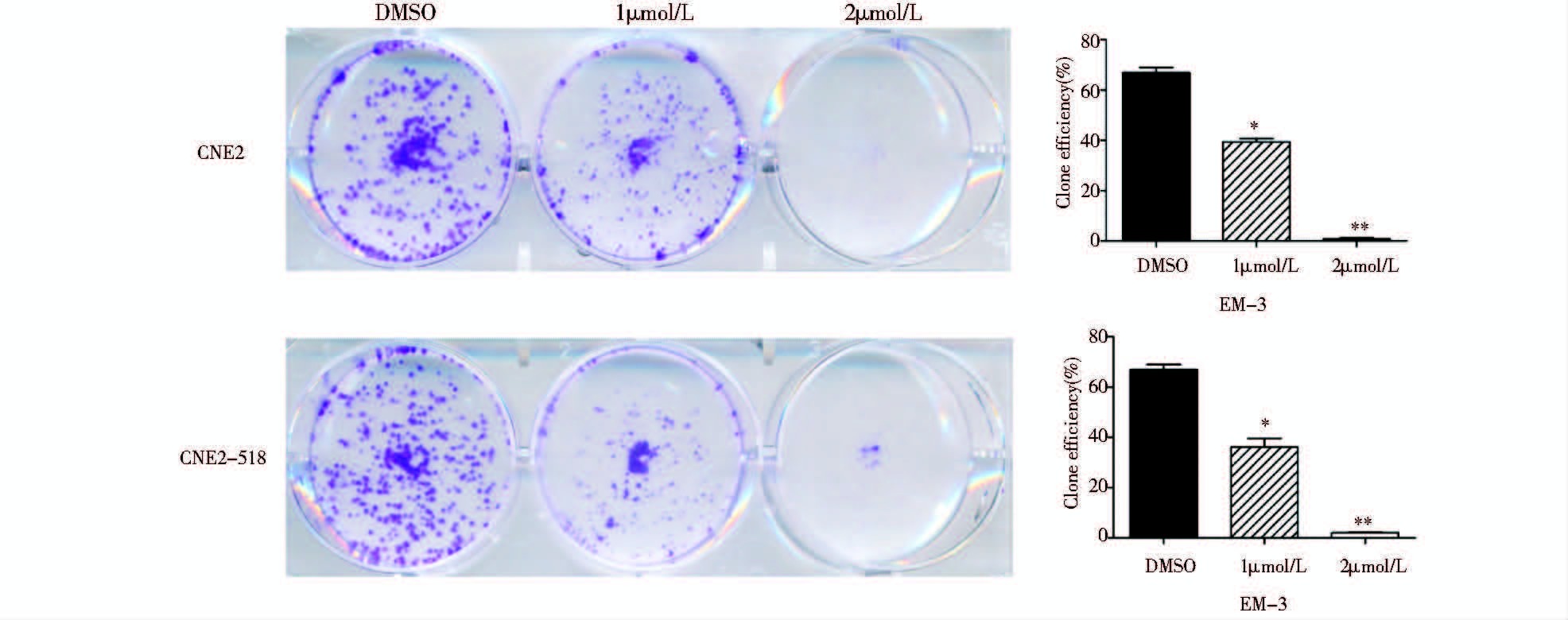 |
| 图 3 EM-3对CNE2和CNE2-S18细胞克隆形成能力的影响 Fig. 3 Effect of EM-3 on CNE2 and CNE2-S18 colony formation ability |
与DMSO对照组比较,不同浓度EM-3(4μmol/L、8μmol/L)处理CNE2细胞24h,细胞迁移能力减弱,并呈现浓度依赖性。如图 4所示,8μmol/L处理细胞24h后细胞迁移能力显著被抑制。
 |
| 图 4 EM-3对CNE2细胞迁移能力的影响 Fig. 4 The effect of cell migration ability after EM-3 treatment in CNE2 cells |
运用AnnexinV-FITC/PI双染法检测凋亡细胞,将CNE2细胞暴露于不同浓度的EM-3(2.5μmol/L、5μmol/L、30μmol/L)24h,EM-3在5μmol/L处理时,CNE2细胞中早晚期细胞凋亡率从对照组的1.3%增加至10.7%,而在30μmol/L处理后,CNE2细胞中早晚期凋亡率增加至72.1%。结果显示,随着药物浓度增加,凋亡细胞数逐渐增加,见图 5。
 |
| 图 5 流式细胞术检测EM-3诱导CNE2细胞凋亡 Fig. 5 Apoptosis was analyzed with treatment EM-3 using flow cytometry in CNE2 cells |
流式细胞仪PI单染色显示,不同浓度的EM-3作用于CNE2细胞后,随浓度增加,G1期细胞比例逐渐减少,S期细胞比例变化不大,G2/M 期比例逐渐增加。G2期细胞比例从对照组的7.64%增加至56.35%,提示EM-3诱导G2/M期阻滞,见图 6。
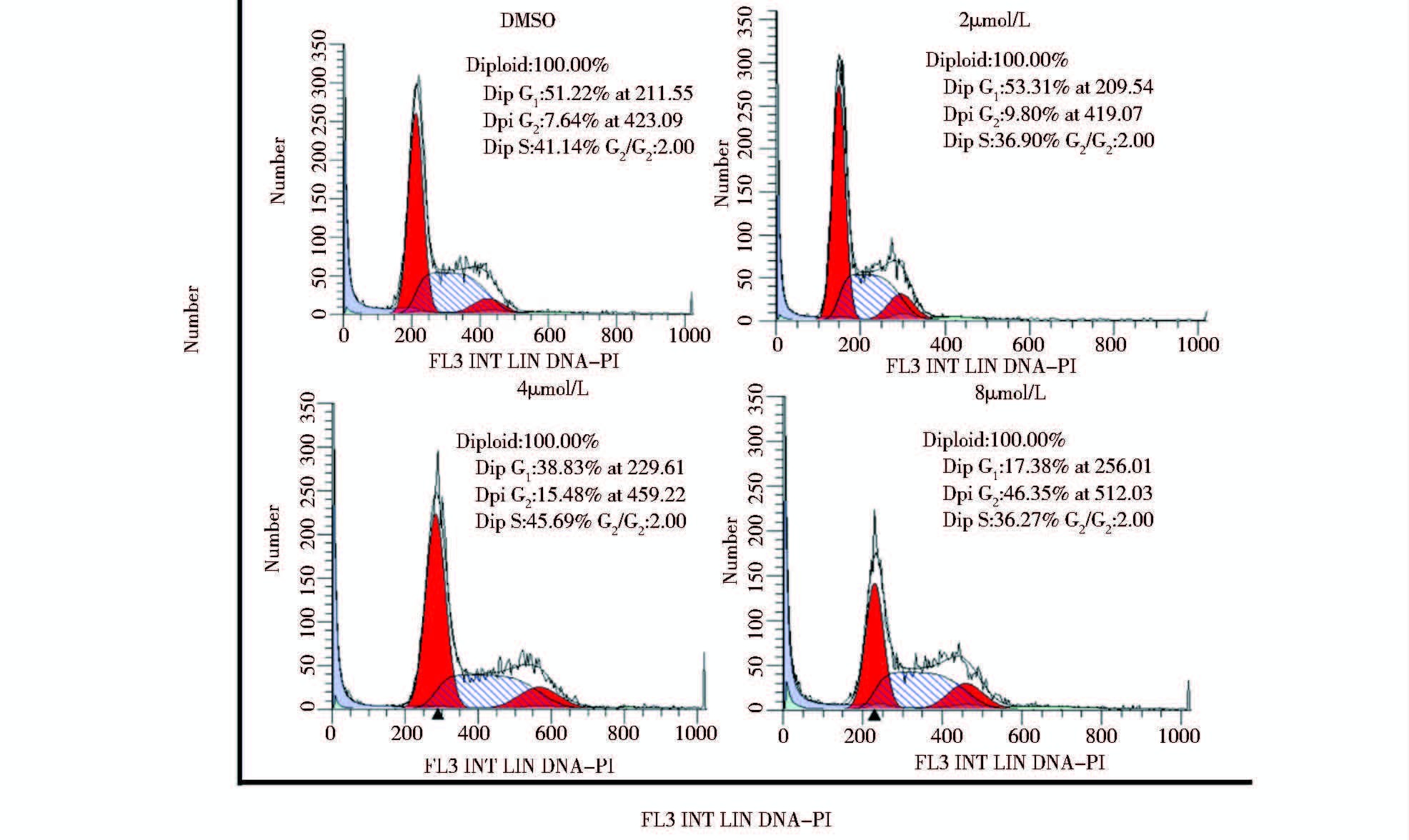 |
| 图 6 流式细胞术检测EM-3对细胞周期影响 Fig. 6 Cell cycle was analyzed with treatment EM-3 using flow cytometry in CNE2 cells |
EM-3作用于CNE2-S18细胞24h后,流式细胞术检测其中肿瘤干细胞样SP细胞的比例。结果显示,与对照组(79.9%)比较,EM-3在15μmol/L浓度时能显著降低CNE2-S18肿瘤干细胞样SP细胞比例(34.9%),见图 7。也就是说,EM-3能有效降低CNE2-S18肿瘤干细胞样SP细胞干性。
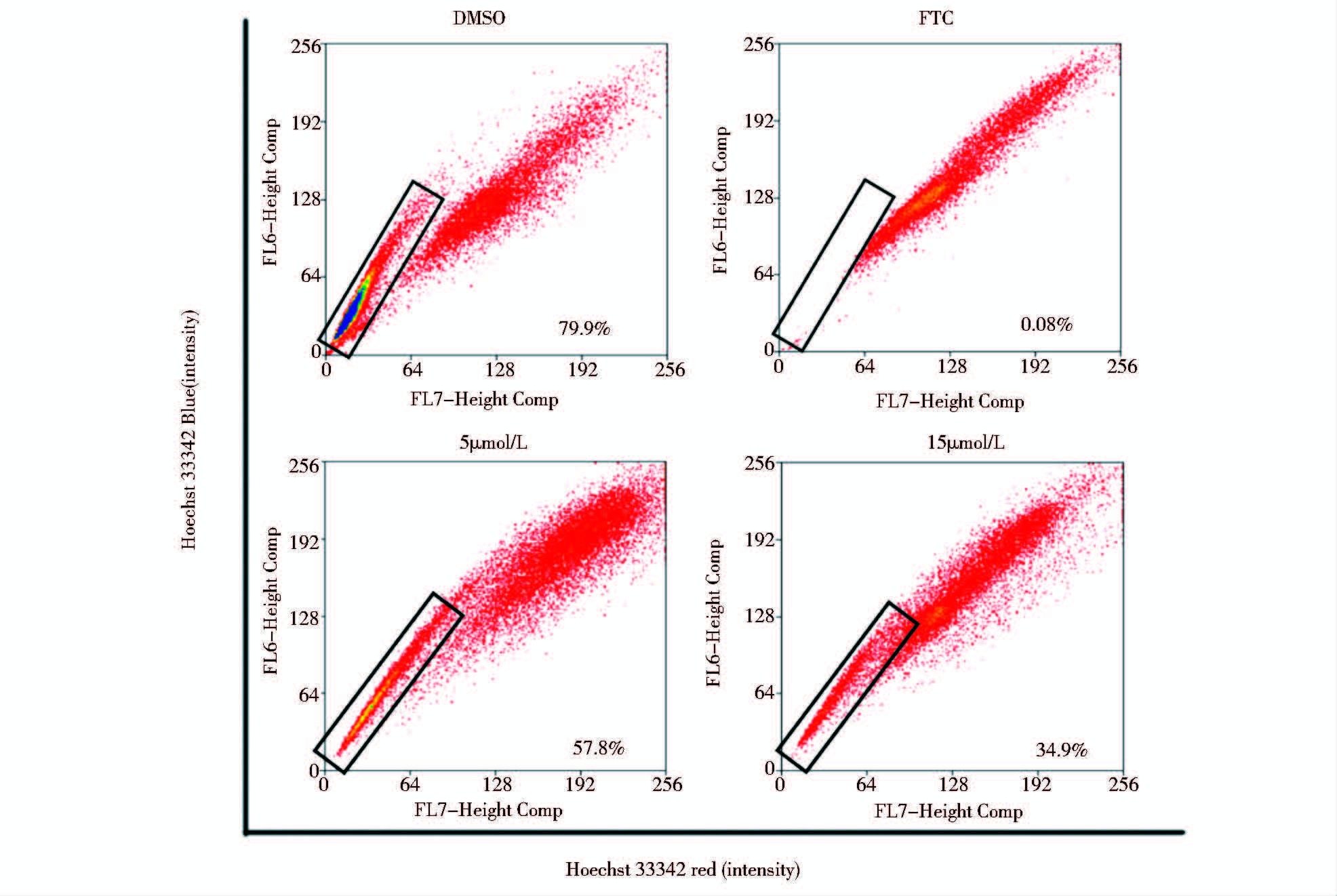 |
| 图 7 EM-3对CNE2-S18干细胞样SP细胞的抑制作用 Fig. 7 Inhibitory effect of EM-3 on CNE2-S18 stem-like SP cells |
细胞凋亡是基因控制的细胞自主的有序的死亡,包括外源性细胞凋亡(TNFR介导)、内源性细胞凋亡(Bcl家族、ROS、DNA 损伤等介导的线粒体凋亡)和内质网压力(ER stress)介导细胞凋亡。其中,内源性细胞凋亡会引起Caspase-9和Caspase-3切割活化,并导致下游多聚ADP核糖聚合酶PARP蛋白酶切失活,最终使细胞死亡。本研究发现,不同浓度EM-3处理CNE2细胞48h,Caspase-9切割活化,Caspase-3总量表达减少,PARP出现酶切条带,证明EM-3诱导CNE2细胞发生了内源性凋亡。
我们检测了Bcl-2蛋白家族:抗凋亡蛋白Bcl-2和促凋亡蛋白Bax。Western blotting结果表明,抗凋亡蛋白Bcl-2表达减少,促凋亡蛋白Bax表达增加,二者比值显著降低,同时,我们发现凋亡抑制蛋白xIAP表达减少,进一步证明了EM-3诱导活化内源性细胞凋亡。以上蛋白质表达变化均具有EM-3浓度依赖性。
2.8 Western blotting检测Stat3信号通路相关蛋白表达水平为确定细胞凋亡上游通路的调控机制,我们检测了与此相关的重要信号通路,发现EM-3处理CNE2细胞24h,Stat3信号通路被抑制,随着药物浓度的增加,p-Stat3表达水平下降,并且Stat3通路下游蛋白Mcl-1、Cyclin D1、Bcl-2表达均下降,表明EM-3通过抑制Stat3信号通路而诱导内源性细胞凋亡,见图 8和图 9。
 |
| 图 8 Western blotting检测细胞凋亡相关蛋白表达变化 Fig. 8 The expression of apotosis-related proteins of CNE2 cell detected by the Western blotting |
 |
| 图 9 Western blotting检测Stat3信号通路蛋白表达变化 Fig. 9 The expressing of Stat3 signaling pathway of CNE2 cell detected by Western blotting |
流式细胞周期分析发现,EM-3处理细胞可提高G2期细胞比例,提示CNE2细胞发生G2期阻滞,为了进一步验证EM-3使得CNE2细胞发生G2周期阻滞,我们检测了G2/M期转化调控点促进因子Cyclin B1、G1/S期转化调控点促进因子Cyclin D1。结果显示,Cyclin B1表达增加而Cyclin D1表达下降,见图 10。结果证明,EM-3导致CNE2细胞阻滞在G2期。
 |
| 图 10 Western blotting检测Cyclin D1、Cyclin B1蛋白表达变化 Fig. 10 The expressing of Cyclin D1,Cyclin B1 of CNE2 cell detected by Western blotting |
基质金属蛋白酶(matrix metalloproteinase,MMP)可以降解细胞外基质的所有成分,打破细胞外基质(extracellular matrixc,ECM)和基底膜所形成的屏障,进而促进肿瘤细胞向周围组织侵袭和转移。而MMP2和MMP9是公认的与肿瘤侵袭和转移关系最紧密的IV胶原酶,我们用不同浓度的EM-3处理CNE2细胞24h,Western blotting结果显示,MMP9表达显著下降,MMP2在EM-3相对低浓度时表达出现应急性上升,高浓度时表达下降。同时,我们发现p-Met表达水平也显著降低,提示EM-3降低了ECM和基底膜的降解及p-Met的表达,导致CNE2细胞的迁移力和侵袭力降低。
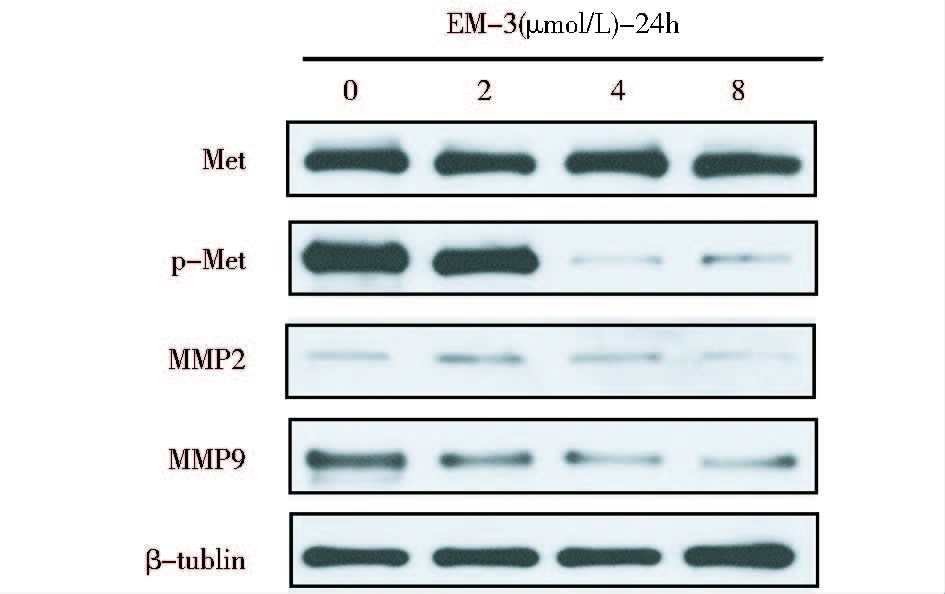 |
| 图 11 Western blotting检测Met、p-Met、MMP2、MMP9蛋白表达变化 Fig. 11 The expression of Met,p-Met,MMP2 and MMP9 of CNE2 cell detected by Western blotting |
Oct4和Sox2对维持干细胞,诱导成体多能干细胞的形成有重要作用。为了进一步探究EM-3降低CNE2-S18细胞中干细胞样SP细胞比例,我们检测了Oct4和Sox2在EM-3处理24h后的蛋白质表达变化。结果表明,EM-3能显著抑制Sox2蛋白的表达,但Oct4在EM-3相对低浓度(2μmol/L)时出现应急性表达增高,随着浓度增大,Oct4表达水平出现降低趋势。结果提示,EM-3更加倾向于降低Sox2干细胞样蛋白的表达。
 |
| 图 12 Western blotting检测Oct4、Sox2蛋白表达变化 Fig. 12 The expression of Oct4 and Sox2 of CNE2 cell detected by Western blotting |
白花地胆草(Elephantopus mollis H.B.K.)为菊科地胆草属植物,又名牛舌草,主要分布于华南和西南等热带地区,如福建、广东等地,目前,临床上主要用于治疗扁桃体炎、感冒、肝炎、毒疮等疾病。实验研究表明,白花地胆草的提取物对肺癌、神经细胞瘤、黑色素瘤等细胞增殖和迁移均有一定抑制效果,但其作用机制尚不明确[9, 10]。
EM-3是本课题组从白花地胆草乙醇提取物中提取的一种单体成分,本实验结果表明EM-3能够显著抑制鼻咽癌细胞增殖和迁移,并导致癌CNE2细胞凋亡和G2/M期阻滞。同时,超速流式分选细胞仪结果表明,EM-3可以显著降低CNE2-S18肿瘤干细胞样SP细胞的比例,有效降低CNE2-S18肿瘤干细胞样SP细胞干性。
细胞周期G2检验点可在DNA损伤条件下阻止细胞进入M期,给损伤细胞以充分的修复时间,因此来维持细胞基因组稳定性[11]。然而,这个过程需要细胞周期蛋白(Cyclin)和细胞周期蛋白依赖性激酶(Cyclin-dependent protein knase,CDK)来调控。Cyclin B1是G2期的周期蛋白,与CDK1可形成复合物,促使细胞G2/M期转变[12]。本研究发现,EM-3可以显著提高鼻咽癌细胞G2期比例,并发现Cyclin B1蛋白累积,说明细胞被阻滞于G2/M期。
细胞凋亡是基因控制的细胞自主的有序的死亡,包括外源性细胞凋亡(TNFR介导)、内源性细胞凋亡(Bcl家族、ROS、DNA 损伤等介导线粒体凋亡)和内质网压力介导细胞凋亡。其中,内源性细胞凋亡主要通过Bcl-2家族蛋白调节,引起Caspase-9和Caspase-3切割活化,并导致下游多聚ADP核糖聚合酶PARP蛋白酶切失活,最终细胞死亡[13, 14, 15],而凋亡抑制蛋白(inhibitors of apoptosis protein,IAP) 是细胞凋亡过程中的重要调控因子,通过负向调节 Caspase家族的活性来达到抑制细胞凋亡的效果[16]。
Stat3是信号转导与转录激活因子家族的重要组成部分,p-Stat3是其活化形式,近年来成为备受关注的肿瘤治疗靶标[17]。研究表明,Stat3是肿瘤细胞发生、发展的重要蛋白质,作为转录因子家族的一员,其下游转录产物在肿瘤细胞增殖、生存、侵袭、转移和血管生成方面发挥重要调控作用[18]。Stat3的持续活化被证实是肿瘤耐药的重要原因,也成为临床抗肿瘤治疗的新靶点[19]。本研究发现,EM-3诱导CNE2细胞发生内源性凋亡的原因是抑制了Stat3的活性,因此,Stat3的下游转录产物Bcl-2、Mcl-1等表达降低,这样Bcl-2与Bax形成二聚体能力下降,进而解除Bcl-2抑制Bax的作用。当Bax形成同源二聚体后,使得线粒体Cytochrome C释放,进而引起下游Caspase家族级联活化反应,诱导细胞凋亡[20]。本研究结果表明EM-3通过抑制Stat3通路诱导内源性细胞凋亡。
基质金属蛋白酶可以降解细胞外基质的所有成分,打破ECM和基底膜所形成的屏障,进而促进肿瘤细胞向周围组织侵袭和转移[21]。而MMP2和MMP9是公认的与肿瘤侵袭和转移关系最紧密的IV胶原酶,研究发现鼻咽癌、直肠癌、肝癌和乳腺癌的侵袭转移能力与MMP2和MMP9的活性密切相关[22, 23, 24]。c-Met与肿瘤细胞移动性、浸润力能力关系紧密[25],本研究发现EM-3降低了ECM和基底膜的降解及p-Met表达,导致CNE2细胞的迁移力和侵袭力降低,其中,MMP2在EM-3相对低浓度时表达出现应急性上升,高浓度时表达下降,由EM-3所造成的这种低浓度应急性表达上调的机制仍需进一步研究。
肿瘤干样细胞(cancer stem-like cell,CSLC)是指具有干细胞特征的一群细胞,即SP细胞(side population cell),也被称为“侧群细胞”,并对传统放化疗耐受,导致肿瘤侵袭和转移[26]。本研究采用Hoechst染料外排实验经超速流式分选出SP细胞,并发现EM-3可以显著降低CNE2-S18中肿瘤干细胞样SP细胞的比例,并通过Western blotting验证EM-3可以降低Sox2表达,而对于EM-3在低浓度时所造成的Oct4表达上调,可能是由于细胞在受到药物刺激后所造成的应急性表达,其上游调控机制仍需要进一步研究。
本文通过多种方法证实EM-3能抑制鼻咽癌细胞的增殖和迁移能力,并且对抑制的分子机制做了初步探讨。发现EM-3能促进鼻咽癌细胞CEN2凋亡,细胞内抗凋亡蛋白水平降低而促凋亡蛋白表达水平增加,同时EM-3能影响Stat信号通路导致其下游蛋白质表达水平发生改变。此外,EM-3阻滞细胞周期,并能显著降低CNE2-S18肿瘤干细胞样SP细胞比例,而且相关的蛋白质表达水平在EM-3处理后都发生了改变。本文实验设计合理,研究工作有助于EM-3作为抗鼻咽癌药物的研究和开发。
致谢 本研究受到暨南大学科研培育与创新基金跃升计划(11615424)资助。
| [1] | Tao Q, Chan A T. Nasopharyngeal carcinoma: molecular pathogenesis and therapeutic developments. Expert Reviews in Molecular Medicine, 2007,9(12):1-24. |
| [2] | Lee A W, Sze W M, Au J S, et al.Treatment results for nasopharyngeal carcinoma in the modern era: the Hong Kong experience. International Journal of Radiation Oncology, Biology, Physics, 2005,61(4):1107-1116. |
| [3] | Gibert-Tisseuil F. Reflections on traditional Chinese medicine and its pharmacopoeia. Annales Pharmaceutiques Francaises, 1998,56(6):282-285. |
| [4] | Tabopda T K, Ngoupayo J, Liu J, et al. Further cytotoxic sesquiterpene lactones from Elephantopus mollis KUNTH. Chemical & Pharmaceutical Bulletin, 2008,56(2):231-233. |
| [5] | Liang N, Yang X X, Wang G C, et al. Study on the chemical constituents of Elephantopus mollis.Journal of Chinese Medicinal Materials, 2012,35(11):1775-1778. |
| [6] | Hasegawa K, Furuya R, Mizuno H, et al. Inhibitory effect of Elephantopus mollis HB and K. extract on melanogenesis in B16 murine melanoma cells by downregulating microphthalmia-associated transcription factor expression. Biosci Biotech Bioch, 2010,74(9):1908-1912. |
| [7] | Ooi K L, Muhammad T S T, Lam L Y, et al. Cytotoxic and apoptotic effects of ethyl acetate extract of Elephantopus mollis Kunth. in human liver carcinoma HepG2 cells through Caspase-3 Activation. Integr Cancer Ther, 2014,13(3):Np1-Np9. |
| [8] | Ooi K L, Muhammad T S T, Tan M L, et al. Cytotoxic, apoptotic and anti-alpha-glucosidase activities of 3,4-di-O-caffeoyl quinic acid, an antioxidant isolated from the polyphenolic-rich extract of Elephantopus mollis Kunth. Journal of Ethnopharmacology, 2011,135(3):685-695. |
| [9] | Huang C C, Lo C P, Chiu C Y, et al. Deoxyelephantopin, a novel multifunctional agent, suppresses mammary tumour growth and lung metastasis and doubles survival time in mice. British Journal of Pharmacology, 2010,159(4):856-871. |
| [10] | Lee W L, Wen T N, Shiau J Y, et al. Differential proteomic profiling identifies novel molecular targets of paclitaxel and phytoagent deoxyelephantopin against mammary adenocarcinoma cells. Journal of Proteome Research, 2010,9(1):237-253. |
| [11] | Stark G R, Taylor W R. Analyzing the G2/M checkpoint. Methods in Molecular Biology, 2004,280:51-82. |
| [12] | Cabrera M, Gomez N, Remes Lenicov F, et al. G2/M Cell cycle arrest and tumor selective apoptosis of acute leukemia cells by a promising benzophenone thiosemicarbazone compound. PLoS One, 2015,10(9):e0136878. |
| [13] | Danial N N, Korsmeyer S J. Cell death: critical control points. Cell, 2004,116(2):205-219. |
| [14] | Nalluri S, Ghoshal-Gupta S, Kutiyanawalla A, et al. TIMP-1 inhibits apoptosis in lung adenocarcinoma cells via interaction with Bcl-2. PLoS One, 2015,10(9):e0137673. |
| [15] | Fan J, Li R, Zhang R, et al. Effect of Bcl-2 and Bax on survival of side population cells from hepatocellular carcinoma cells. World Journal of Gastroenterology: WJG, 2007,13(45):6053-6059. |
| [16] | Oberoi-Khanuja T K, Murali A, Rajalingam K. IAPs on the move: role of inhibitors of apoptosis proteins in cell migration. Cell Death & Disease, 2013,4:e784. |
| [17] | Jing N, Tweardy D J. Targeting Stat3 in cancer therapy. Anti-cancer Drugs, 2005,16(6):601-607. |
| [18] | Haricharan S, Li Y. STAT signaling in mammary gland differentiation, cell survival and tumorigenesis. Molecular and Cellular Endocrinology,2014,382(1):560-569. |
| [19] | Tan F H, Putoczki T L, Stylli S S, et al. The role of STAT3 signaling in mediating tumor resistance to cancer therapy. Current Drug Targets, 2014,15(14):1341-1353. |
| [20] | Yao K, Xing H C, Wu B, et al. Effect of TIEG1 on apoptosis and expression of Bcl-2/Bax and Pten in leukemic cell lines. Genetics and Molecular Research,2015,14(1):1968-1974. |
| [21] | Zhang X X, Fu Z, Zhang Z, et al. Microcystin-LR promotes melanoma cell invasion and enhances matrix metalloproteinase-2/-9 expression mediated by NF-kappaB activation. Environmental Science & Technology,2012,46(12):11319-11326. |
| [22] | Damodharan U, Ganesan R, Radhakrishnan U C. Expression of MMP2 and MMP9 (gelatinases A and B) in human colon cancer cells. Applied Biochemistry and Biotechnology, 2011,165(5-6):1245-1252. |
| [23] | Hassan Z K, Elamin M H, Daghestani M H, et al. Oleuropein induces anti-metastatic effects in breast cancer. Asian Pacific Journal of Cancer Prevention: APJCP, 2012,13(9):4555-4559. |
| [24] | Gao J, Ding F, Liu Q, et al. Knockdown of MACC1 expression suppressed hepatocellular carcinoma cell migration and invasion and inhibited expression of MMP2 and MMP9. Molecular and Cellular Biochemistry, 2013,376(1-2):21-32. |
| [25] | Gao Y, Zeng F, Wu J Y, et al. MiR-335 inhibits migration of breast cancer cells through targeting oncoprotein c-Met. Tumour Biology: The Journal of the International Society for Oncodevelopmental Biology and Medicine, 2015,36(4):2875-2883. |
| [26] | Reya T, Morrison S J, Clarke M F, et al. Stem cells, cancer, and cancer stem cells. Nature, 2001,414(6859):105-111. |
 2016, Vol. 36
2016, Vol. 36




