文章信息
- 童良琴, 曲亚军, 陈敏
- TONG Liang-qin, QU Ya-jun, CHEN Min
- 乳酸菌胞外多糖的研究进展
- Research Advance on Exopolysaccharides Synthesized by Lactic Acid Bacteria
- 中国生物工程杂志, 2015, 35(11): 85-91
- China Biotechnology, 2015, 35(11): 85-91
- http://dx.doi.org/10.13523/j.cb.20151112
-
文章历史
- 收稿日期: 2015-06-17
- 修回日期: 2015-07-27
乳酸菌(lactic acid bacteria,LAB)是一类能够利用可发酵糖产生大量乳酸的细菌的通称,作为公认安全的益生菌,乳酸菌可促进肠道有益微生物的生长,对腹泻、肠易激症、过敏、乳糖不耐症、刺激反应等均有一定的功效[1],在工业、农业、医学等与人类生活密切相关的重要领域有极高的应用价值。许多乳酸菌在发酵过程中可产生胞外多糖(exopolysaccharide,EPS)。胞外多糖是一种长链、高分子质量的多糖,由重复单元和分支组成。胞外多糖在保护微生物抵御脱水、营养缺乏、有毒物质、噬菌体、渗透压和拮抗物等不利条件时有重要作用[2]。乳酸菌胞外多糖已作为稳定剂、增稠剂被用于酸奶、奶酪等发酵奶制品的生产中。此外,乳酸菌胞外多糖还有降低胆固醇、抗氧化、抗肿瘤、对消化道的调节等作用。我们课题组一直从事微生物多糖研究,目前,已经在微生物多糖的合成、结构和生物活性构效关系几方面取得部分成果,正在进行乳酸菌胞外多糖的结构鉴定和生物功能研究。
目前,多糖的生产多集中于从植物中提取或利用真菌发酵。与其他多糖相比,乳酸菌胞外多糖的研究更具有实际价值,乳酸菌生长极为迅速[3],它的胞外多糖提取工艺更简单,安全性较高、价格便宜、比其他微生物多糖更适用于人类。对乳酸菌胞外多糖的遗传、结构进行研究,并与结构和理化性质的相关性相结合是乳酸菌胞外多糖研究的重要内容。
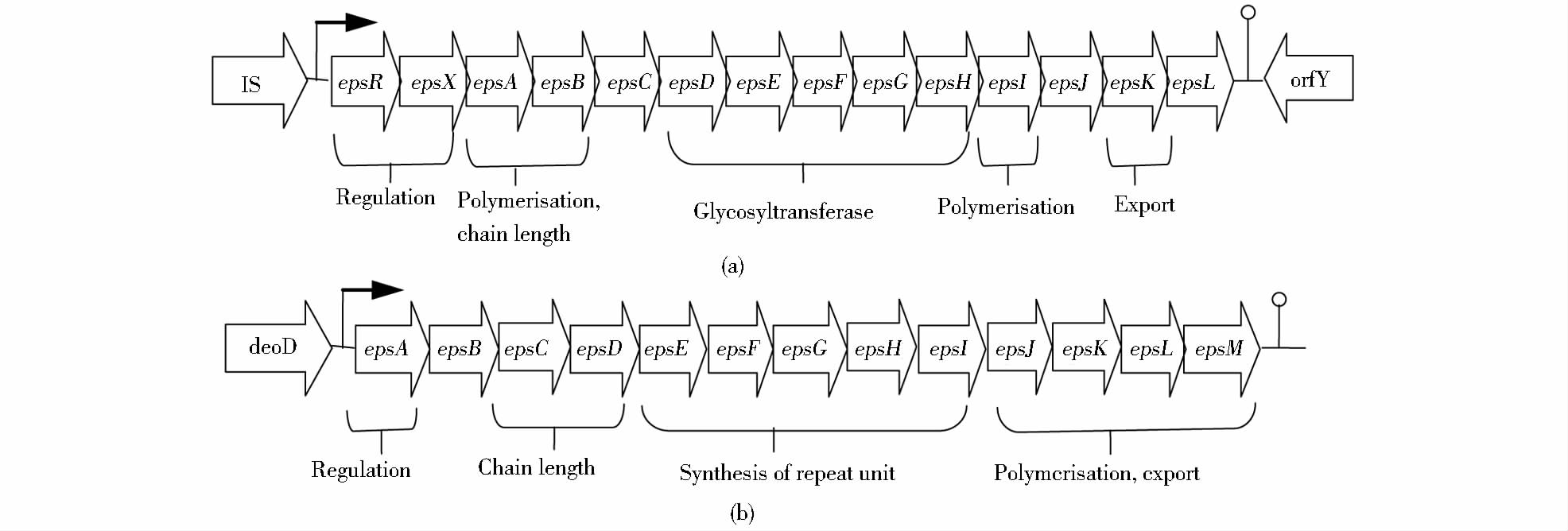
1 乳酸菌胞外多糖的遗传研究细菌胞外多糖是大量基因产物共同协作的结果,其合成过程十分复杂。有些乳酸菌编码相关酶及调节蛋白的基因大部分在质粒上,如乳酸乳球菌(Lactococcus lactis)和干酪乳酸菌(Lactobacillus casei)等。嗜热链球菌Sfi6(Stretococcus thermophilus Sfi6)的eps基因簇则位于染色体上,有15.25kb,可编码16个开放阅读框,其中,一个14.52kb的区域可编码13个基因(从epsA到epsM),这些基因决定了胞外多糖的合成[4]。通过对预测蛋白质进行同源性搜索发现,epsA、epsB、epsC、epsD、epsE基因与肺炎链球菌(Streptococcus pneumoniae)、无乳链球菌(Streptococcus agalactiae)中编码荚膜多糖的基因有很大的同源性,epsA、epsB是调控序列,epsC是聚合序列,epsD是跨膜运输序列,epsE可编码糖基-1-磷酸转移酶,在将己糖-1-磷酸加到脂载体的过程中起作用[5]。乳酸乳球菌NIZO B40(Lactococcus lactis NIZO B40) 中的胞外多糖相关基因则是一段12kb的序列,位于一个40kb的质粒上,由上游的启动子epsR驱动(图 1)。其中有11个基因与其他细菌中参与胞外多糖、荚膜多糖、脂多糖、磷壁酸合成的基因具有同源性[6]。对徳氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)的eps基因簇研究显示,这段18kb含14个基因(epsA到epsN)的DNA区域与其他乳酸菌有相似性[7]。
乳酸菌合成胞外多糖的能力不稳定,易受eps基因簇的影响[8]。目前,已有学者试图利用基因工程相关技术,解决乳酸菌胞外多糖产量问题。研究发现,过量表达限制性步骤中的酶可以激活某些糖从而提高胞外多糖的产量,但由于不同乳酸菌菌株内激活糖的水平对胞外多糖产量影响有所不同,且一些乳酸菌胞外多糖的产量和黏度在乳酸菌表达过程中并不稳定,所以对乳酸菌胞外多糖的遗传研究仍需继续深入。
2 乳酸菌胞外多糖的结构修饰胞外多糖的一级结构决定它的高级结构从而影响其功能,通过对其单糖组分、支链结构、单链间的连接方式、链长等进行修饰,就可以达到改造其功能的目的[10]。多糖的结构修饰就是通过化学、物理学或生物学的方法,对多糖的结构进行修饰改造,以获得更加丰富多样的多糖衍生物,以便进行生物学活性和结构之间相关性的研究。目前研究的主要方法有酶降解法、化学法和基因工程法。
酶降解法是对合成期或合成后的胞外多糖进行处理。常用的酶有多糖水解酶和裂解酶,多糖水解酶可作用于糖骨架,而裂解酶则作用于主链或支链末端[11]。但有的胞外多糖,如乳酸乳球菌NIZO B40能抵抗多种酶的降解。一些不能被酶水解的胞外多糖,可以用温和的化学试剂进行处理,化学试剂可以使胞外多糖去酰基,解除其对裂解酶的抑制作用。对乳酸球菌 NIZO B40胞外多糖进行酶法和化学法处理发现,两种方法的结合大大提高了特定结构胞外多糖的获得率[12]。
随着对乳酸菌胞外多糖基因簇和生物合成途径的深入了解,利用基因工程对多糖分子结构进行修饰的方法已日益受到重视。例如,通过对乳杆菌sake 0-1(Lactobacillus sake 0-1)进行诱变,获得一株产由不同糖单元组成胞外多糖的菌株[13]。胞外多糖基因簇的异源表达也可用于胞外多糖和寡糖的合成。编码糖基转移酶基因的改组可获得新型结构的胞外多糖。同时,也可将新的或已有的糖基转移酶基因转入乳酸菌中以调节胞外多糖的合成,但此法可能会引起胞外多糖的互相连接,改变相关基因的结构,从而改变胞外多糖的结构。此外,胞外多糖的结构还可能与碳源的选择有关。对德氏乳杆菌保加利亚亚种的胞外多糖结构分析发现,当其以果糖为碳源时,所产胞外多糖的重复单元中葡萄糖和乳糖之比为1∶2.4;而当以葡萄糖和果糖为碳源时,重复单元中葡萄糖、半乳糖∶鼠李糖为1∶7∶0.8[14]。但有些菌的胞外多糖组成与碳源无关,如乳杆菌sake 0-1。
3 乳酸菌胞外多糖的构效关系不同乳酸菌胞外多糖在组成、电荷、空间分布、硬度、与蛋白质相互作用的能力上有很大不同。此外,链长、支链组成均可影响胞外多糖的致密性从而影响其流变特性。活性多糖的化学结构是其生物学活性的基础,也是当前糖化学和糖生物学共同关注的焦点问题[15]。
多糖的药理活性与多糖的一级结构如分子质量、单糖组成、取代基种类和数目、支化度等有关,还与多糖的高级结构,以及多糖的溶解度、黏度等许多因素有关。目前,对多糖构效关系方面的研究也越来越多。颜炳祥等[16]研究发现,硒化的多糖总抗氧化能力及对羟自由基的清除能力增强。王雪[17]对多糖的抗肿瘤活性和结构之间的研究显示,多糖的组成和糖苷键的类型与其抗肿瘤活性有一定的关系。由β-糖苷键构成的葡聚糖的活性高于α-糖苷键,葡聚糖结构中的1,3-糖苷键和1,6-糖苷键是其发挥抗肿瘤活性不可缺少的条件。贺珍俊[18]研究发现,硫酸酯化的黄芪多糖,抗凝血活性增加,而天然黄芪多糖、乙酰化多糖的抗凝血活性极低,甚至没有活性。Franz和Alban[19]提出,多糖分子中硫酸化程度达到0.6以上时,就表现出抗凝血活性,并且随着硫酸化程度的增高活性增强。目前报道的多糖抗病毒活性研究显示,凡具有抗病毒活性的多糖,大部分都有硫酸根取代,为硫酸化多糖,其中硫酸化程度的高低、硫酸化位点等对多糖的抗病毒活性起着关键作用。许多非硫酸化的天然多糖,经人工结构修饰后,也可表现出很好的抗病毒活性。除了硫酸化以外,多糖抗病毒活性还与多糖的分子质量有关,只有分子质量满足一定范围的多糖,才能有很好的抗病毒活性,但并不是分子质量越大越好。除此之外,研究发现,糖链结构也是影响活性的重要因素,β-1,3-D-葡聚糖或以β-1,3-连接为主的葡聚糖的抗病毒抗病毒活性较好,而β-1,6-D-葡聚糖的活性比较差[20]。也有研究表明,如果多糖的构象由无序变为有序,其活性立即消失[21]。
根据乳酸菌胞外多糖的结构修饰与构效关系,可利用生物化学、分子生物学、基因工程等方法特异性改变多糖的结构,以提高胞外多糖的生物学活性,甚至获得具有目的功能的胞外多糖。部分乳酸菌胞外多糖的结构如表 1所示。
| Strain | Structure repeat unit | References |
| Lactobacillus delbrueckii subsp. bulgaricus 291 | 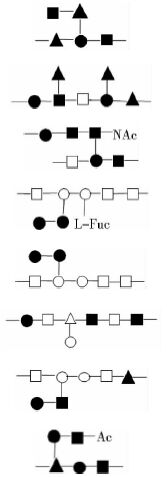 | [22] |
| Lactobacillus helveticus Lb161 | [23] | |
| Streptococcus thermophilus Sfi 20 | [24] | |
| Streptococcus thermophilus MR-1C | [25] | |
| Streptococcus thermophilus RsStreptococcus thermophilus Sts | [26] | |
| Streptococcus thermophilus EU20 | [27] | |
| Lactococcus lactis subsp.cremoris NIZO B39 | [28] | |
| Lactococcus lactis subsp. cremoris NIZO B891 | [28] | |
| Note: ■:β-D-glucose;▲:α-D-glucose;●:β-D-galactose;□:α-D-galactose;△:β-L-rhamnose;○:α-L-rhamnose;Fuc :L-fucose;NAc :N-acetyl;Ac:Acetyl | ||
早在20世纪初,人们就发现了有些细菌有益于人类身体健康。益生菌是一类对宿主有益的活性微生物。目前,含益生菌的功能性食品产业日益壮大,满足了人们对健康和经济的双重追求。目前使用的益生菌主要是乳酸杆菌和双歧杆菌,有些还可产生胞外多糖。这些胞外多糖大都有抗肿瘤、抗溃疡、免疫调节或降胆固醇的作用[29]。
4.1 抗肿瘤作用多糖可通过不同途径发挥抗肿瘤作用,有的可增强宿主免疫功能;有的有细胞毒性,可直接杀死肿瘤细胞;有的可使肿瘤细胞凋亡比例增加;有的可抑制肿瘤细胞周期,影响血液供应。Kitazawa等[30]研究发现,给小鼠腹腔内注射冻干的乳酸乳球菌乳脂亚种KVS20(Lactococcus lactis subsp. cremoris KVS20)细胞,有抑制肿瘤S-180生长的作用,但在体外实验中却不能起到相同的作用。这表明乳酸菌的抗肿瘤活性是由免疫活性物质介导的。进一步的研究发现,该菌株产生的黏性物质可显著增加B细胞依赖的促有丝分裂活性[31]。Ismail和Nampoothiri[32]发现,由Lb.plantarun MTCC 9510产的胞外多糖对乳腺癌细胞MCF-7具有显著抑制作用,其半抑制浓度为10mg/ml。目前关于胞外多糖的抗肿瘤机制还有待进一步的研究。
4.2 免疫调节作用乳酸菌胞外多糖具有免疫调节作用,但不是所有多糖都有免疫活化功能,这表明多糖的理化特性和生物功能有密切联系[33]。刘佳和潘道东[34]研究发现,硒化的胞外多糖能显著增强体外巨噬细胞的吞噬活性,提高NO和TNF-α的分泌量,即表明硒化的胞外多糖可促进巨噬细胞的细胞介导免疫反应,增强免疫调节作用。顾笑梅等[35]发现,乳酸菌Z222(Lactobacillus Z222)产生的胞外多糖能促进体外淋巴细胞增殖,且有剂量依赖关系,胞外多糖对小鼠的免疫功能有一定的调节作用。顾瑞霞[36]研究发现,唾液链球菌嗜热亚种(Streptococcus salivarius subsp. thermophilus)的胞外多糖可促进小鼠的细胞免疫和体液免疫。由于对免疫的调节作用,微生物多糖被视为免疫调节剂和生物反应修饰剂。
4.3 对消化道的调节作用乳酸菌的生长可以增加肠道的益生菌群,进一步改善人体肠胃功能,保持肠道内菌群平衡。胞外多糖能选择性促进有益菌的增殖,进而抑制有害菌的增殖和有害物质的产生[37]。乳酸菌胞外多糖在非特异性黏附和特异性黏附中均发挥重要作用[38]。Looijesteijn等[39]发现,胞外多糖并不影响胃肠道对乳酸乳球菌乳脂亚种NZ4010的保护。他们的进一步研究显示,胞外多糖经过胃肠道的过程中并没有被消化。乳酸菌的胞外多糖可提高菌株对肠道表面的非特异性黏附,从而使菌体更容易在肠道内定植。Germond等[40]发现,胞外多糖可延长发酵奶制品在肠道的滞留时间而有利于益生菌的定植。此外,胞外多糖还有防治结肠癌、保护细胞体、维持水分、吸收有害离子、防止噬菌体的侵染等作用。
5 总 结乳酸菌作为公认安全的食品益生菌,适用于功能性胞外多糖的生产,乳酸菌胞外多糖可作为天然食品添加剂满足现代消费者对安全、健康、无添加剂、口感优良的食品的需求,被大量用于酸奶、酸奶饮品、奶油、甜点等发酵奶制品的生产中[41]。但由于细胞能量的限制,至今乳酸菌胞外多糖的产量仍不尽如人意。乳酸菌胞外多糖结构组分、功能效用的不同意味着很难建立一个通用的生产方法和检测标准。如何提高产量是急需解决的问题。今后的研究可从以下几个方面进行:①在了解胞外多糖合成相关基因簇结构和功能的基础上,利用基因工程技术,在乳酸菌内同源高效表达糖基转移酶;②可在单个质粒上高拷贝克隆整个eps基因簇,使eps基因簇过量表达来调控多糖的合成;③利用各种育种方法,获得高产菌株;④通过优化发酵条件提高乳酸菌胞外多糖产量。此外,复杂的结构使胞外多糖表现不同的生物功能,可结合酶学、蛋白质组学、生物化学等相关技术,对胞外多糖结构进行修饰,以得到具有特定功能的胞外多糖。尽管乳酸菌胞外多糖有巨大的商业价值,但一些研究显示,有些胞外多糖可让食物变质,在葡萄酒和苹果酒的发酵过程中,乳酸菌胞外多糖还可能引起不需要的流变特性的改变。同时,乳酸菌胞外多糖还可能引起牙菌斑,乳酸菌胞外多糖积累造成的生物膜形成和再生可能引起生物污染。可见,关于乳酸菌胞外多糖的工业化应用仍需要大量的研究作为基础。
| [1] | Majamaa H, Isolauri E, Saxelin M, et al. Lactic acid bacteria in the treatment of acute rotavirus gastroenteritis. Journal of Pediatric Gastroenterology and Nutrition , 1995,20(3):333-338. |
| [2] | 苗君莅,于鹏,肖杨,等. 胞外多糖的研究现状与展望. 食品科技, 2014, 39(10):226-231. Miao J L, Yu P, Xiao Y,et al. Advances and prospect of exopolysaccharides. Food science and technology, 2014,39(10):226-231. |
| [3] | Saeed A, Hayek A, Ibrahim. Current limitations and challenges with lactic acid bacteria: a review. Food and Nutrition Science, 2013, 4(11):73-87. |
| [4] | Seema P, Avishek M, Arum G. Potentials of exopolysaccharides from lactic acid bacteria. Indian Journal of Microbiology, 2012,52(1):3-12. |
| [5] | Stingle F, Neeser J R, Mollet B. Identification and characterization of the eps (exopolysacharride) gene cluster from Streptococcus thermopilus Sfi6. Journal of Bacteriology, 1996, 178(6):1680-1690. |
| [6] | Van Kranenburg R, Marvgg J D, et al. Molecular characterization of the plasmid-encoded eps gene cluster essential for exopolysaccharide biosynthesis in Lactococcus lactis. Molecular Microbiology, 1997,24(2) :387-397. |
| [7] | Lamothe G T, Jolly L, Mollet B,et al. Genetic and biochemical characterization of exopolysaccharide biosynthesis by Lactobacillus delbrneckii subsp bulgaricus. Archives of Microbiology, 2002, 178(3):218-228. |
| [8] | 田政, 王辑, 郑喆, 等. 乳酸菌胞外多糖的结构及功能特性研究进展. 食品安全质量检测学报, 2013, 4(3):783-788. Tian Z, Wang J, Zheng Z, et al. Research advances on structure and function of exopolysaccharides produced by lactic acid bacteria. Journal of Food Safety & Quality, 2013,4(3):783-788. |
| [9] | Germond J E, Delley M, D'Amico N, et al. Heterologous expression and characterization of the exopolysaccharide from Streptococcus thermophilus Sfi39. European Journal of Biochemistry, 2001, 268(19):5149-5156. |
| [10] | 胡盼盼, 宋微,杜明,等. 乳酸菌胞外多糖的研究进展. 粮油食品科技, 2014,24(5):87-91. Hu P P, Song W, Du M,et al. Research progress in exopolysaccharides produced by lactic acid bacteria. Science and Technology of Cereals:Oils and Food, 2014,24(5):87-91. |
| [11] | Sutherland I. Polysaccharases for microbial exopolysaccharides. Carbohydr Polymers,1999, 38(4):319-328. |
| [12] | Ruussenaars H J, Stngele F, Hartmans S. Biodegradability of food-associated extracellular polysaccharides. Current Microbiology, 2000, 40(3):194-199. |
| [13] | Breedveld M, Bonting K, Dijkhuizen L. Mutational analysis of exopolysaccharide biosynthesis by Lactobacillus sakei 0-1. Fems Microbiology Letters, 1998,169(2):241-249. |
| [14] | Grobben G J, Smith M R, Sikkema J, et al. Influence of fructose and glucose on the production of exopolysaccharides and the activities of enzymes involved in the sugar metabolism and the synthesis of sugar nucleotides in Lactobacillus delbrueckii subsp. bulgaricus NCFB 2772. Applied Microbiol Biotechnology, 1996, 46(3):279-284. |
| [15] | 王鹏, 江晓路, 江艳华,等. 细菌胞外多糖构效关系及特性的研究[J] 食品科学, 2005, 26(11):257-260. Wang P, Jiang X L, Jiang Y H, et al. Review on research and development on structure-function relationship and characterstics of bacterial exopolysaccharides. Food Science, 2005,26(11):257-260. |
| [16] | 颜炳祥, 潘道东, 曾小群. 乳酸菌胞外多糖硒化修饰及其抗氧化活性研究. 中国食品学报, 2012, 12(2):15-23. Yan B X, Pan D D, Zeng X Q. Study on selenium modification and antioxidant activity of lactic acid bacteria exopolusaccharides. Journal of Chinese Institute of Food Science, 2012,12(2):15-23. |
| [17] | 王雪. AAP I-a黑木耳多糖的分离纯化及其抗衰老功能的研究.哈尔滨:哈尔滨工业大学, 生命科学学院,2009. Wang X. Study on Purification and Anti-aging Function of Polysaccharides from Auriculria auricula. Harbin:Harbin Institute of Technology, School of Life Science,2009. |
| [18] | 贺珍俊. 多糖的分子修饰与抗凝血活性. 呼和浩特:内蒙古大学,生命科学学院,2004. He Z J . Molecule Modification of Polysaccharides and Anticoagulation Activity. Hohhot:Inner Mongolia University,School of Life Science,2004. |
| [19] | Franz G, Alban S. Structure-activity relationship of antithrombotic polysaccharide derivatives. International Journal of Biological Macromolecules,1995,17(6):311-314. |
| [20] | 邱琳, 辛现良, 耿美玉. 多糖构效关系研究进展. 现代生物医学进展, 2009, 9(9):1764-1768. Qiu L, Xin X L, Geng M Y. Advances in the structure-function relationship of polysaccharides. Progress in Modern Biomedicine, 2009,9(9):1764-1768. |
| [21] | 周金黄, 王建华. 中药药理与临床研究进展.第三册.北京:军事医学科学出版社, 1996:179. Zhou J H, Wang J H. Progress in Pharmacology and Clinical Research of Chinese Medicine. Volume 3. Beijing:Military Medical Science Press,1996:179. |
| [22] | Faber E J, van Haaster D J, Kamerling J P, et al. Structure of the extracellular polysaccharide produced by Lactobacillus delbrueckii subsp. bulgaricus 291. Carbohydrate Research, 2001,331(2):183-194. |
| [23] | Staaf M, Yang Z, Huttunen E, et al. Structural elucidation of the viscous exopolysaccharide produced by Lactobacillus helveticus Lb161. Carbohydrate Research, 2000,326(2):113-119. |
| [24] | Navarini L, Abatangelo A, Bertocchi C, et al. Isolation and characterization of the exopolysaccharide produced by Streptococcus thermophilus SFi20. Int J Biol Macromol, 2001,28(3):219-226. |
| [25] | Low D, Ahlgren J A, Home D, et al. Role of Streptococcus thermophilus MR-1C capsular exopolysaccharide in cheese moisture retention. Applied and Environmental Microbiology, 1998, 64(6):2147-2151. |
| [26] | Fuber E J, Kamerling J P, Vliegenthat J F, et al. The exopolysaccharides produced by Streptococcus thermophilus Rs and Sts have the same repeating unit but differ in viscosity of their milk cultures. Carbohudrate Research, 1998,310(4):269-276. |
| [27] | Hong S H, Marshall R T. Natural exopolysaccharides enhance survival of lactic acid bacteria in frozen diary desserts. Journal of Dairy Science, 2001, 84(6):1367-1374. |
| [28] | van Casteren W H, Dijkema C. Structural characterisation and enzymic modification of the exopolysaccharide produced by Lactococcus lactis subsp.cremoris B39. Carbohydrate Research, 2000,324(3):170-181. |
| [29] | Vuyst D, Bart D. Heteropolysaccharides from lactic acid bacteria. Fems Microbiology Reviews, 1999, 23(2): 153-177. |
| [30] | Kitazawa H,Toba T, Itoh T, et al. Antitumoral activity of slime-forming encapsulated Lactococcus lactis subsp. cremoris isolated from Scandinavian ropy sour milk, "viili". Animal Science and Technology (Japan), 1991, 62(3): 277-283. |
| [31] | Kitazawa H, Yamaguchi T, Itoh T. B-cell mitogenic activity of slime products produced from slime-forming encapsulated Lactococcus lactis subsp. cremoris. Journal of Dairy Science, 1992,75(1):2946-2951. |
| [32] | Ismail B, Nampoothiri K M. Exposition of antitumor activity of a chemically characterized exopolysaccharide from a probiotic Lactobacillus plantarum MTCC 9510. Biologia, 2013,68(6):1041-1045. |
| [33] | 秦晓萌,张远森,柳陈坚,等. 乳酸菌胞外多糖生理功能及合成途径的研究进展.食品工业科技, 2015,36(4):389-399. Qin X M, Zhang Y S, Liu C J,et al. Progress on the physiological function and synthesis pathways of lactic acid bacteria exopolysaccharide. Science and Technology of Food, 2015,36(4):389-399. |
| [34] | 刘佳,潘道东. 硒化乳酸菌胞外多糖对小鼠腹腔巨噬细胞免疫功能的影响. 营养学报, 2013, 35(1):35-38. Liu J, Pan D D. The immunomodulatory effects of selenium exopolysaccharide on mouse peritoneal macrophages. Acta Nutrimenta Sinica, 2013, 35(1):35-38. |
| [35] | 顾笑梅,王富生,孔健,等. 乳酸菌Z222产胞外多糖对免疫细胞功能的影响. 中华微生物学和免疫学杂志, 2003,2(43):251-256. Gu X M, Wang F S, Kong J,et al. Effect of EPS I produced by Lactobacillus strain Z222 on cellular immunity. Chinese Journal of Microbiology and Immunology, 2003,2(43):251-256. |
| [36] | 顾瑞霞. 乳酸菌胞外多糖生物合成及生理功能特性的研究. 哈尔滨:东北农业大学,生命科学学院,2000:77-85. Gu R X. Studies on synthesis and physiological functions of exopolysaccharides of lactic acid bacteria. Harbin: Northeast Agricultural University,School of Life Science,2000:77-85. |
| [37] | Chong E S. Apotential role of probiotics in colorectal caention:review of possible mechanisms of action. World Journal of Microbiology and Biotechnolncer Prevogy, 2014,30(2):351-374. |
| [38] | 李超, 王春凤, 杨桂连. 乳酸菌胞外多糖肠道粘附及免疫调节作用研究进展. 食品科学, 2014, 35(11):314-318. Li C, Wang C F, Yang G L. Progress in intestinal adhension and immunoregulatory effect of extracellular polysaccharides of lactic acid bacteria. Food Science, 2014,35(11):314-318. |
| [39] | Looijesteijn P J, Trapet L, de Vries, et al. Physiological function of exopolysaccharides produced by Lactococcus lactis. International Journal of Food Microbiology, 2001, 64(1-2):71-80. |
| [40] | Germond J E, Delley M, D'Amico N, et al. Heterologous expression and characterization of the exopolysaccharide from Streptococcus thermophilus Sfi39. Eur Journal of Biochemistry, 2001, 268(19):5149-5156. |
| [41] | Monaco R D, Torrieri E, Pepe O, et al. Effect of sourdough with exopolysaccharide (EPS)-producing lactic acid bacteria (LAB)on sensory quality of bred during shelf life. Food and Bioprocess Technology, 2015, 8(3):691-701. |
 2015, Vol. 35
2015, Vol. 35