文章信息
- 孟迎迎, 王海涛, 曹旭鹏, 薛松, 杨青, 王伟良
- MENG Ying-ying, WANG Hai-tao, CAO Xu-peng, XUE Song, YANG Qing, WANG Wei-liang
- HPLC-ELSD快速测定微藻中性脂
- Rapid Detection of Neutral Lipids by HPLC-ELSD in Microalgae
- 中国生物工程杂志, 2015, 35(11): 61-69
- China Biotechnology, 2015, 35(11): 61-69
- http://dx.doi.org/10.13523/j.cb.20151109
-
文章历史
- 收稿日期: 2015-06-08
- 修回日期: 2015-08-20
2. 大连理工大学环境与生命科学学院 大连 116622;
3. 中国科学院大学 北京 100084;
4. 华东理工大学生物反应器工程国家重点实验室 上海 200237
2. School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116622, China;
3. University of Chinese Academy of Sciences, Beijing 100084, China;
4. State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
微藻,由于具有光合效率高、繁殖快、油脂含量高、不占用农业耕地等特点成为第三代生物柴油开发的重要原料[1, 2, 3]。研究微藻中甘油三酯(TAG)的积累规律是降低微藻生物柴油生产成本、实现微藻生物柴油商业化的关键。目前,微藻中TAG含量的测定主要有以下三种方法。第一种方法为固相萃取柱分离(SPE)方法:分离微藻总脂,获得低极性脂,定量为TAG的量,虽然TAG可能为地极性脂的主要成分,但溶剂洗脱的组分包含除TAG以外的如色素、甾醇类等低极性脂溶性物质,对认识TAG的含量具有很大的影响,误差较大[4, 5]。第二种方法为尼罗红荧光光谱法:用尼罗红染色后的微藻细胞荧光强度与中性脂含量具有相关性,但受藻种及样品状态等影响很大,不能准确定量不同藻种间的TAG含量,但作为一种快速比较微藻中中性脂含量变化的方法,以其样品用量少、检测快速等优点,广泛用于富油微藻的研究中[6, 7, 8]。第三种方法为TLC/GC联用方法:此方法要经过油脂提取、薄层色谱分离获得TAG,把该谱带再经转酯化,进行气相色谱测定,该方法较为复杂、测定时间长[9, 10]。随着微藻生物质应用开发研究的广泛开展和深入,尤其是微藻生物质制备生物柴油技术的开展,迫切需要一种高效准确的微藻TAG的测定方法,以作为产业发展的必备支撑技术。
高效液相色谱(HPLC)对酰基脂的分析包括正相HPLC对提取总脂的脂类的分离和反相HPLC-MS对同类脂质分子种类的分离。正相HPLC分离脂质多采用硅胶柱,在正相分离模式中主要利用分子极性的差异使各组分得以分离,因此分离程度基本上由它们的离子性和极性特征所决定。正相色谱对脂质的分离主要采用硅胶柱和二醇基柱,Lin[11]综述了这两种正相色谱柱对酰基脂的分离进展。对于低极性脂多采用极性较小的正己烷-异丙醇体系,而对于极性脂(如糖脂和磷脂)多采用极性稍强的氯仿-甲醇-水体系,两种体系分离并没有明确的使用界限。相比于反相HPLC,正相HPLC能够在单次运行下分析更多的脂类,因此在分析动物、植物及人组织来源脂质时有较多应用。Rodríguez-Alcalá和Fontecha[12]利用硅胶柱在正相色谱下分析了乳制品中的中性脂及磷脂组成。Mclaren等[13]在硅胶柱下建立了分离7种脂类(CE、TAG、 FFA、Chol、 DAG、 PE 、PC)的分析方法,并应用于人体组织来源脂质的分析。Donot等[14]利用HPLC-ELSD和APCI-MS/MS分析了葡萄藻(Botryococcus braunii)中低极性脂(TAG、DAG、甾醇类、蜡等)的组成。
湛江等鞭金藻( Isochrysis zhanjiangensis)是一种海洋微藻,属于金藻门,普林藻纲,等鞭藻目,等鞭藻科,在氮限制培养下碳水化合物含量可达到50%以上[15, 16]。微拟球藻(Nannochloropsis oceanica IMET1)是海洋单细胞微藻,属于不等鞭毛门的真眼点藻纲[17]。文献报道微拟球藻具有很高的产油潜力,它的最大总脂可高达60%,TAG含量为35.0%[18, 19, 20, 21, 22]。本文以湛江等鞭金藻为对象,建立了正相HPLC-ELSD分离分析中性脂的方法并将该方法应用于湛江等鞭金藻及微拟球藻的测定,以期为两种微藻TAG的代谢研究和脂质积累提供有力的检测方法。
1 材料与方法 1.1 仪器、试剂与材料液相色谱仪,配备自动进样器、二元泵(大连依利特分析仪器有限公司)检测器: 蒸发光散射检测器(安捷伦科技有限公司)。正己烷、异丙醇(HPLC级,德国Merk 公司)、氯仿、甲醇(分析纯,天津科密欧有限公司)。
Silica色谱柱(150mm×4.6mm,5μm)、Silica色谱柱(250mm×4.6mm,5μm)、C3色谱柱(250mm×4.6mm,10μm)、XAmide色谱柱(250mm×4.6mm,10μm)、Diol色谱柱(250mm×4.6mm,10μm )、Diol色谱柱(250mm×4.6mm,5μm),以上色谱柱均由华谱创新科技有限公司提供。
1.2 藻株及培养条件湛江等鞭金藻由辽宁省海洋水产研究所提供,保存在中国科学院淡水藻种库( 编号为FACHB-1750)。微拟球藻由中国科学院青岛生物能源与过程研究所,徐健研究员提供。两株藻均培养于f/2培养基,湛江等鞭金藻与微拟球藻分别以初始藻密度OD680nm=1、OD750nm=1培养于柱形玻璃鼓泡反应器(直径50mm,高40mm),工作体积为500ml。含2% CO2的空气过0.22μm膜维持160ml/min由反应器底部通入。温度维持在(25±2)℃。光照以单侧光14h∶10h 光暗循环. 平均光照强度为80μmol/(m2·s)。富氮培养将两株藻分别培养于3×f/2培养基 3天,缺氮培养将两株藻分别于无NaNO3 3×f/2培养基培养3天。
1.3 样品处理取样:取相当于5~10mg藻粉的藻泥,离心(4 000r/min 5min)去除上清液,冻存于-70℃冰箱备用。提取:于氯仿-甲醇(1∶2,V/V)1.5ml[干藻粉用氯仿-甲醇-水(1∶2∶0.8,V/V/V) 1.9ml]中,超声提取15min (注意把细胞超至悬浮,提取至藻渣无色),加入500μl氯仿,混合震荡30s,再加入500μl水混合震荡30s。离心除去上层溶液,氯仿层转入1ml容量瓶并定容。过0.22μm有机相滤膜,待HPLC测定。
1.4 色谱条件色谱柱:华谱Unitary Diol (250mm×4.6mm,5μm);流动相:A,正己烷(0.1% 冰乙酸);B,异丙醇(0.1% 冰乙酸),通过0.45μm尼龙滤膜过滤,并经过超声波脱气处理。流速:1ml/min(表 1)。 ELSD条件:漂移管温度为40℃,N2压力为3.5bar,增益值为6。
| Time (min) | A(%) | B(%) | Flow-rate (ml/min) |
| 0.0 | 97.0 | 3.0 | 1.0 |
| 4.0 | 97.0 | 3.0 | 1.0 |
| 5.0 | 70.0 | 30.0 | 1.0 |
| 11.0 | 70.0 | 30.0 | 1.0 |
| 11.5 | 97.0 | 3.0 | 1.0 |
| 20.0 | 97.0 | 3.0 | 1.0 |
| Note:A:Hexane containing 0.1% acetic acid ; B: Isopropanol containing 0.1% acetic acid | |||
固相萃取分离中性脂方法及TLC-GC测定微藻样品TAG含量方法参考Meng 等[22]的文献。
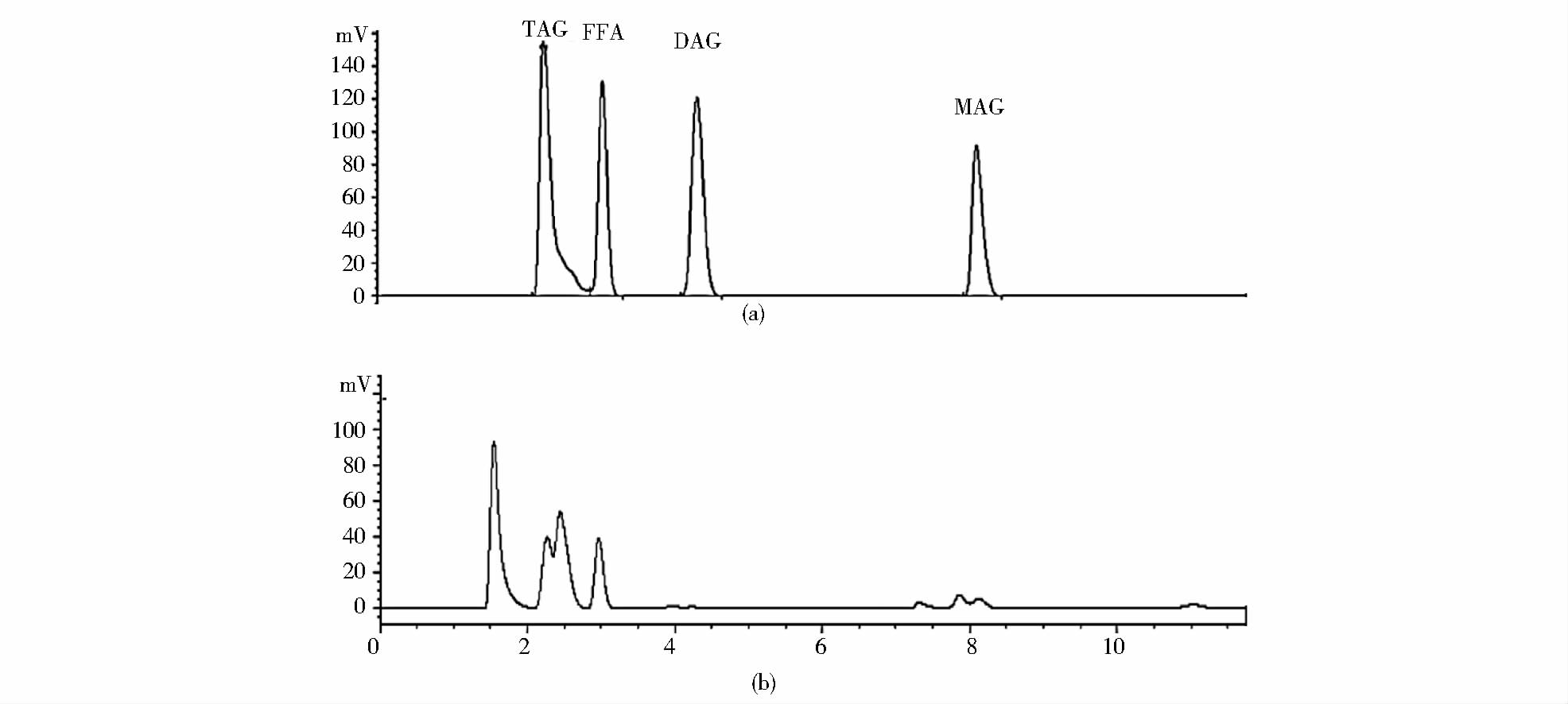
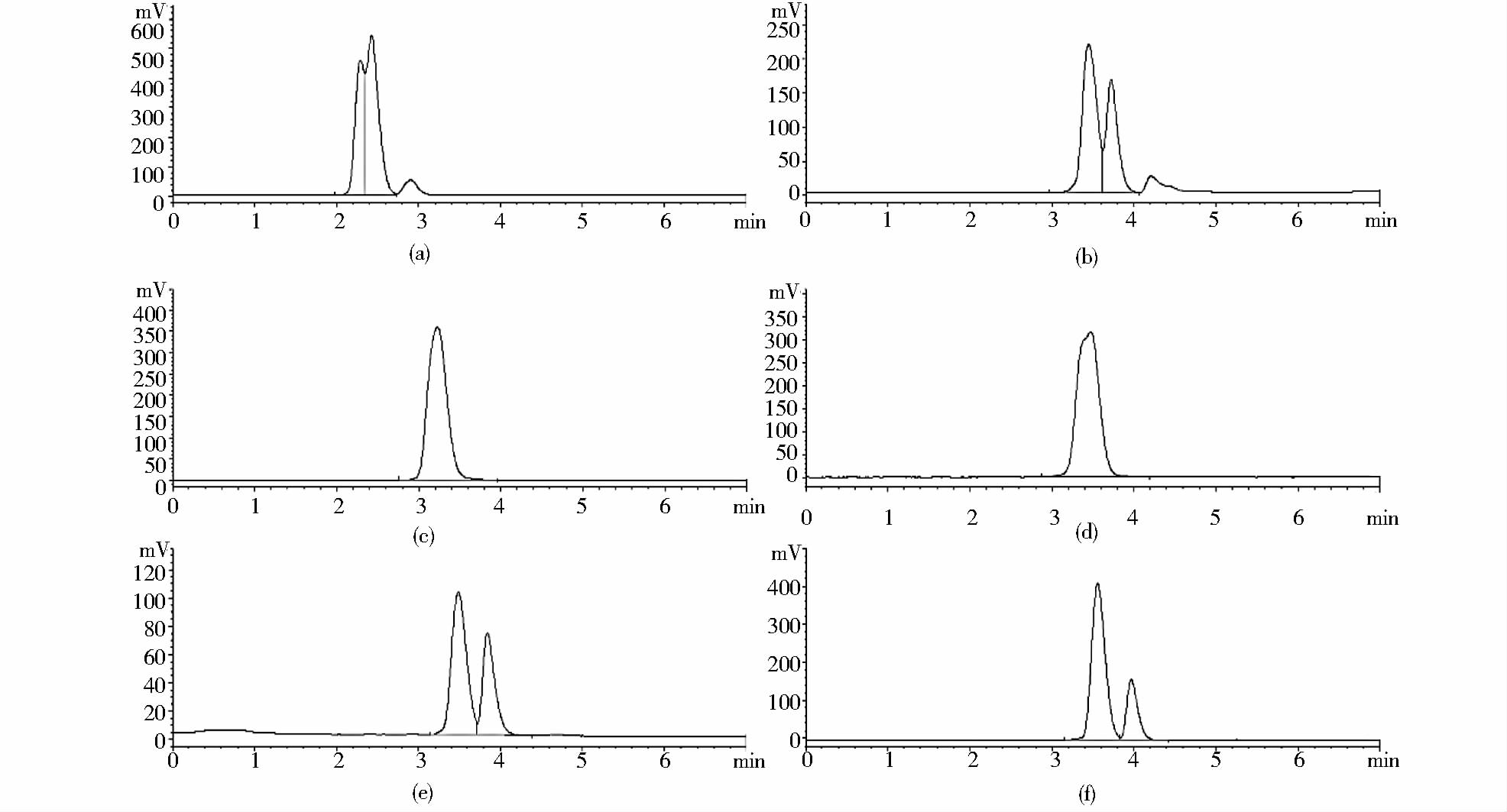
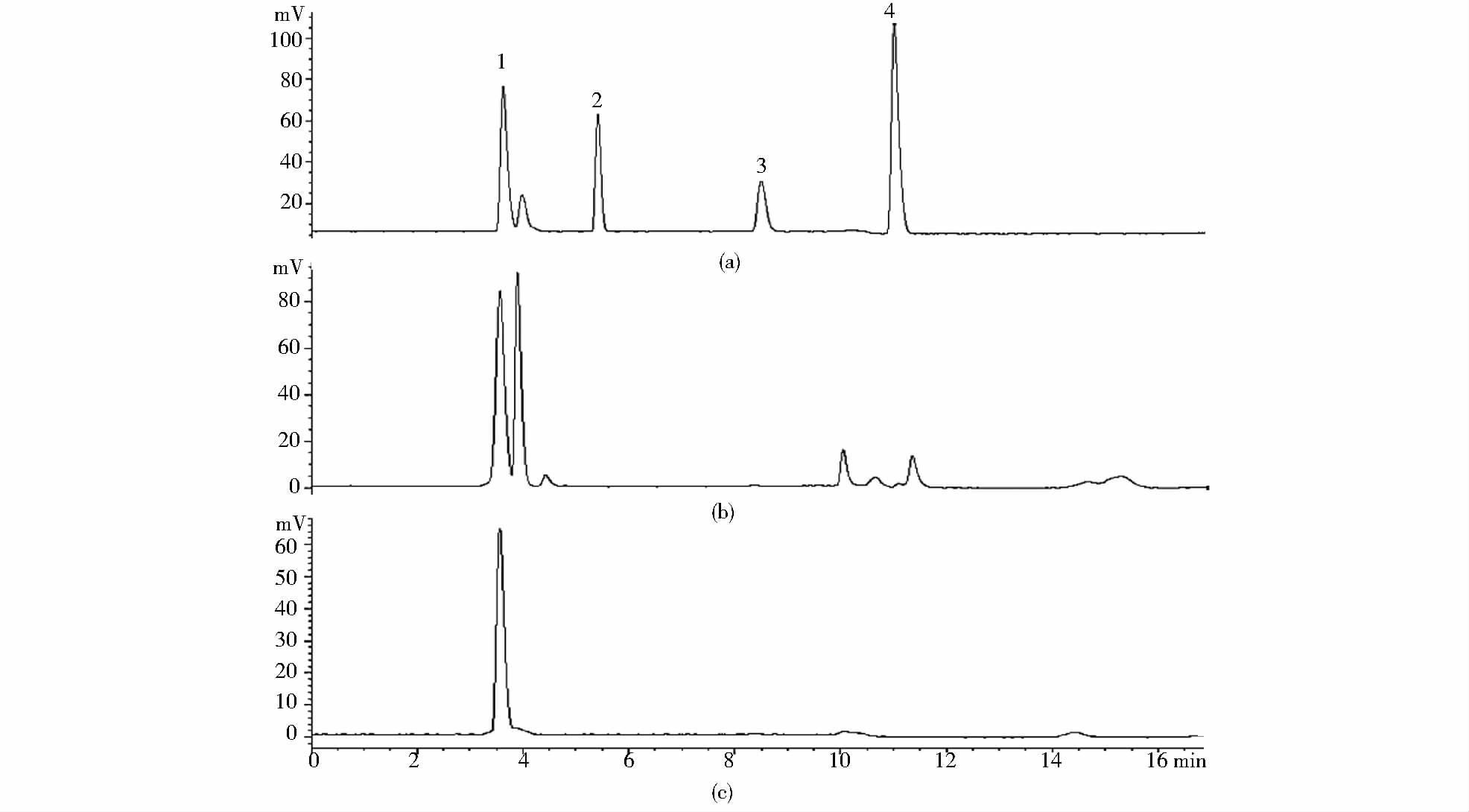
2 结果与讨论 2.1 HPLC-ELSD分析中性脂方法建立及方法评价 2.1.1 HPLC-ELSD分析中性脂色谱柱优化及方法建立对主要酰基甘油脂(TAG、DAG、MAG)及FFA的分离已有较多文献报道,多采用硅胶柱、二醇基柱等正相色谱柱。溶剂提取微藻脂质不同于植物种子来源脂质,其为全细胞提取物,成分复杂。关于微藻中中性脂的分析报道较少。 Kobayashi等[23]报道了利用硅胶柱及正己烷-异丙醇流动相体系分离莱茵衣藻和小球藻中的中性脂。本文采用硅胶柱及正己烷-异丙醇流动相体系时对4种酰基甘油脂标准品具有较好的分离,如图 1(a)所示。但将该方法应用于湛江等鞭金藻提取总脂中的中性脂测定时,由于微藻脂质组成复杂,存在与TAG色谱保留时间相近的低极性脂溶性物质,而难以与TAG进行分离[图 1(b)]。为了快速准确测定微藻油中的TAG含量,以满足微藻油脂相关研究的需求,迫切需要建立一种方法可以把微藻油中的TAG与相近的干扰物质进行分离。针对此问题进行了流动相及色谱柱的优化。发现在通常用的硅胶柱下通过优化流动相难以解决上述问题。通过色谱柱的优化(图 2),在硅胶柱下,即使加长柱长仍不能将TAG与干扰组分达到基线分离[图 2(b)]。尝试了C3及氨基柱(XAmide色谱柱),分离效果都较差。采用二醇基柱,结合优化色谱条件,可使TAG和干扰组分达到基线分离,如图 2(f)所示,确定使用Diol柱作为分离色谱柱。标准品谱图及测定的湛江等鞭金藻及微拟球藻中性脂谱图如图 3所示。
|
| 图 1 硅胶柱分离甘油酯混合标准品及测定湛江等鞭金藻样品图 Fig. 1 Separation of neutral lipid stands and sample from I. zhanjiangensis by HPLC on a silica column using a binary gradient of hexane/2-propanol (0.1% acetic acid) and ELSD detector(a) Stands (b)I.zhanjiangensis |
|
| 图 2 不同色谱柱分离湛江等鞭金藻中TAG与干扰物质的谱图 Fig. 2 The chromatograms of TAG and interference on different analytical columns(a) Silica,150mm×4.6mm,5μm (b) Silica,250mm×4.6mm,5μm (c) C3,250mm×4.6mm,10μm (d) XAmide,250mm×4.6mm,10μm (e) Diol,250mm×4.6mm,10μm (f) Diol,250mm×4.6mm,5μm |
|
| 图 3 HPLC-ELSD测定湛江等鞭金藻及微拟球藻谱图 Fig. 3 HPLC-ELSD chromatography of I. zhanjiangensis and N. oceanica IMET1(a) Stands (b) I.zhanjiangensis (c) N.oceanica IMET1 1:TAG;2:FFA;3:DAF;4:MAG |
|
| 图 4 4种脂质线性关系 Fig. 4 Calibration curves for the neutral lipid standards(a) TAG (b) FFA (c) DAG (d) MAG |
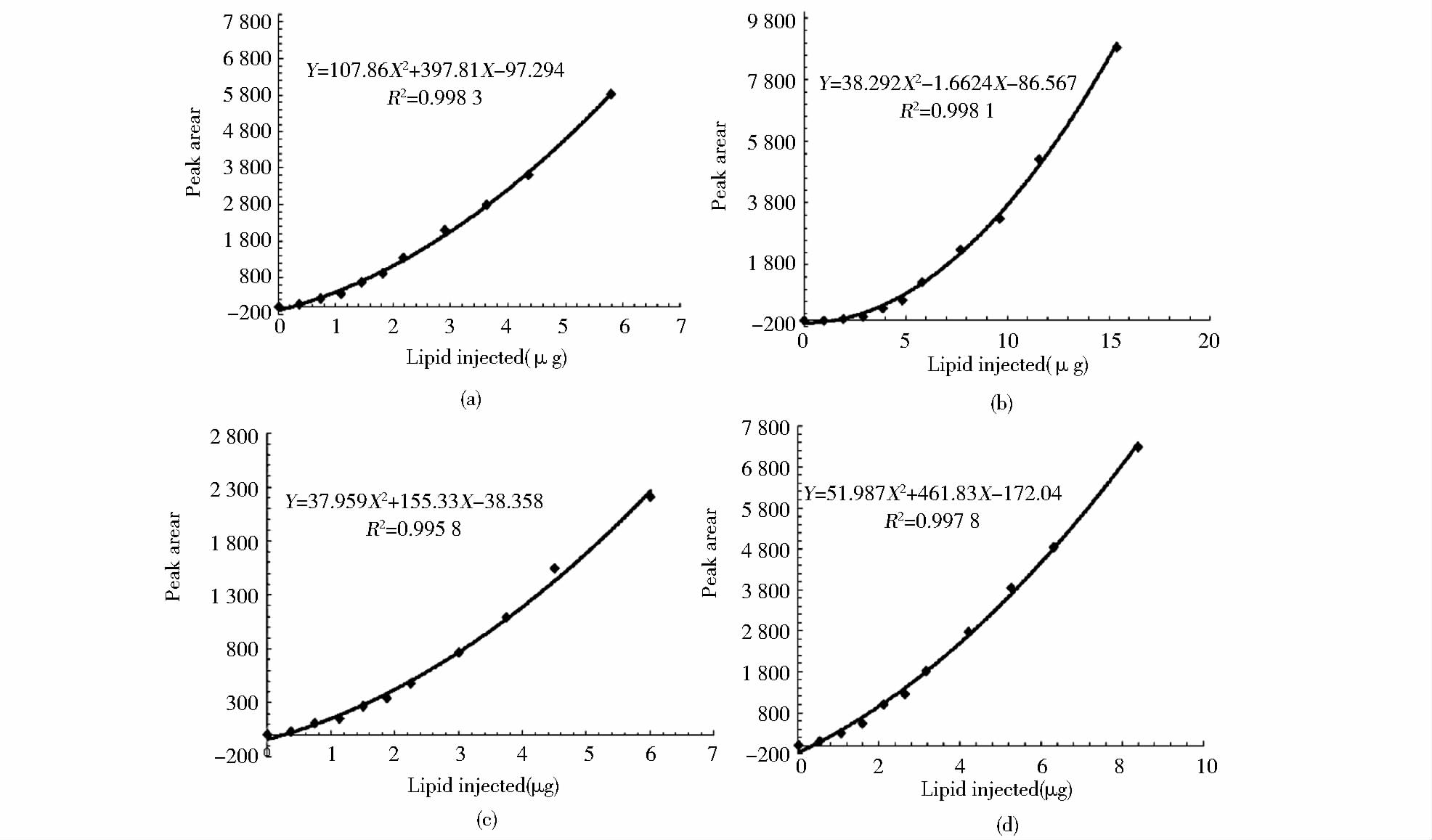
本方法采用外标法对微藻中中性脂进行定量,按“1.4”部分所述的色谱条件,分别测定系列浓度的TAG、DAG、MAG、FFA混合标准液,以分析物的峰面积为纵坐标,标准品的质量(μg)为横坐标,得线性回归方程(图 4),蒸发光散射检测器响应值与被测物浓度为二次函数关系。结果显示,TAG、FFA、DAG、MAG的质量浓度分别为0.35~5.8μg、1.9~15.4μg、0.4~6.0μg、0.5~8.4μg时呈良好的线性。所测定4种脂质的线性回归方程、相关系数(R2)及仪器检出限(LOD,S/N=3)见表 2。将标准溶液逐级稀释进样,测其峰高响应值及基线噪声强度,以3 倍信噪比计算检出限,TAG、FFA、DAG、MAG检测限分别为0.077μg、0.44μg、 0.068μg、0.075μg。
| Lipid | Regression equation | R2 | Linear range(μg) | LOD(μg) |
| TAG | Y=107.86X2+397.81X-97.294 | 0.998 3 | 0.35~5.8 | 0.07 |
| FFA | Y=38.292X2-1.662 4X-86.567 | 0.998 1 | 1.9~15.4 | 0.44 |
| DAG | Y=37.959X2+155.33X-38.358 | 0.998 3 | 0.4~6.0 | 0.068 |
| MAG | Y=51.987X2+461.83X-172.04 | 0.997 8 | 0.5~8.4 | 0.075 |
由于微藻样品中DAG、 MAG、 FFA量低于方法检测限,在本文中只考虑TAG的回收率及测定精密度。利用本文建立的方法对湛江等鞭金藻及微拟球藻样品进行加标回收率测定,以考察本方法对两种微藻TAG含量测定的准确性。分别精确称取已知TAG含量的两株微藻样品,然后按“1.3”部分脂质提取方法处理,提取总脂。从提取的总脂中取100μl定容于1ml容量瓶,另一份从提取的总脂中取100μl加入一定量的TAG标准品溶液定容于1ml,用“1.4”部分所述色谱条件测定加标回收率,结果见表 3。采用该方法湛江等鞭金藻及微拟球藻中TAG的回收率为96.2%~113.1%,精密度为0.46%~4.8%。说明本方法具有良好的准确度和精密度,可用于两株微藻样品中TAG含量的测定。
| Algae | Added(mg) | Found(mg) | Recovery(%) | RSD(%) |
| I. zhanjiangensis | 0.050 5 | 0.057 1 | 113.1 | 4.8 |
| 0.101 | 0.114 | 112.9 | 0.46 | |
| N. oceanica IMET1 | 0.050 5 | 0.048 6 | 96.2 | 2.0 |
| 0.101 | 0.1096 | 108.5 | 3.5 |
微藻在营养丰富培养条件下,在细胞大量增殖期,消耗培养基中的各种营养元素,以满足其自身生长、代谢和增殖的需要。而在营养元素限制培养条件下,微藻的生长受到限制,会积累大量的储能物质,如TAG。采用所建立的方法检测了富氮(+N)及氮限制(-N)培养下湛江等鞭金藻及微拟球藻中TAG的含量(图 5)。结果显示两株微藻在富氮条件下TAG含量分别为1.80%和1.31%,而在氮限制培养下TAG含量增至7.7%和16.8%。
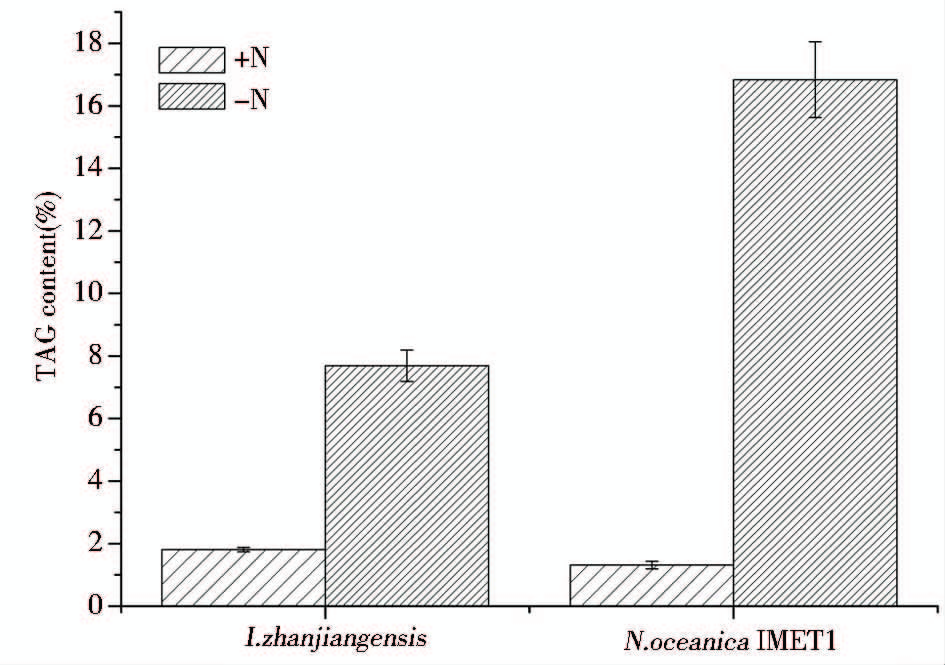
|
| 图 5 HPLC-ELSD测定+N及-N制培养下湛江等鞭金藻及微拟球藻中TAG的含量 Fig. 5 TAG content determine by HPLC-ELSD in I. zhanjiangensis and N. oceanica IMET1 under nitrogen-replete (N+) and nitrogen-depleted (N-) conditions. Values are means±standard deviation of three technical replicates |
用建立的方法检测硅藻门中的角毛藻(Chaetoceros sp.),绿藻门中杜氏盐藻(Dunaliella salina)、新月藻(Closterium sp.)及莱茵衣藻(Chlamydomonas reinhartii)的谱图如图 6所示。在角毛藻、杜氏盐藻及新月藻中同样发现有保留时间3.9min的干扰组分,在此三种微藻中将TAG与此物质分离均未见有文献报道。而TAG保留时间3.4min 处,无杂质干扰,与其他物质基线分离,可知该方法也可用于角毛藻、杜氏盐藻及新月藻中TAG的测定,说明此方法具有应用于其他微藻的潜力。而在莱茵衣藻中存在与TAG保留时间相近的物质,干扰TAG含量的测定。由于不同微藻油脂组成差异性大,很难有一种方法适用于所有微藻种类,需针对该微藻油脂成分优化分离方法。总而言之,本方法还是具有一定的广泛适用性。
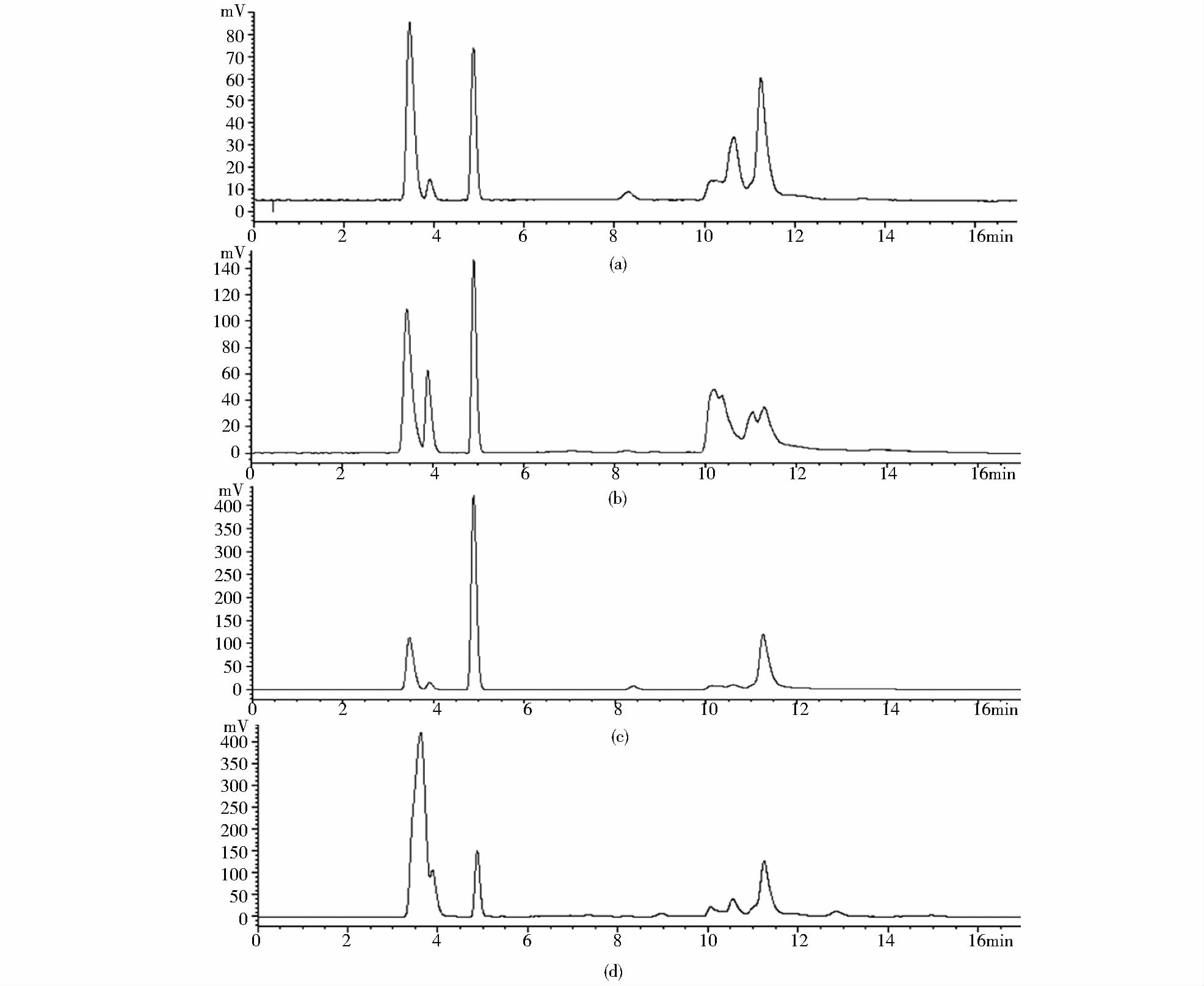
|
| 图 6 HPLC-ELSD方法测定角毛藻、杜氏盐藻、新月藻及莱茵衣藻谱图 Fig. 6 HPLC-ELSD chromatography of Chaetoceros sp.(a),Dunaliella salina (b),Closterium sp.(c) and Chlamydomonas reinhartii (d) |
利用硅胶柱固相萃取微藻总脂中的中性脂,常用来评估微藻的TAG含量,此方法由于洗脱时色素及低极性脂的干扰,存在测定偏差。而在微藻代谢研究中对TAG含量的测定较多采用TLC/GC方法[10, 15, 24, 25],该方法利用TLC将TAG从总脂中分离,再进一步转酯化可除去杂质干扰,测定方法准确,但过程耗时费力。将本方法测定的湛江等鞭金藻及微拟球藻中的TAG含量与两种方法测定的TAG含量进行对比(图 7),结果显示湛江等鞭金藻通过SPE方法测定中性脂含量为21.8%,TLC/GC测定TAG含量为3.9% 而HPLC-ELSD测定TAG含量为4.6%。在微拟球藻中通过SPE方法测定中性脂含量为28.2%,TLC/GC及HPLC-ELSD测定TAG含量分别为17.3%和15.1%。本方法测定的中性脂含量远小于SPE测定的中性脂含量,而与TLC/GC方法测定结果相近。相比上述两种方法,HPLC-ELSD方法前处理简单,需时小于30min,远小于TLC/GC的2~3h。因此本方法可提供一种快速准确测定微藻中TAG含量的方法。
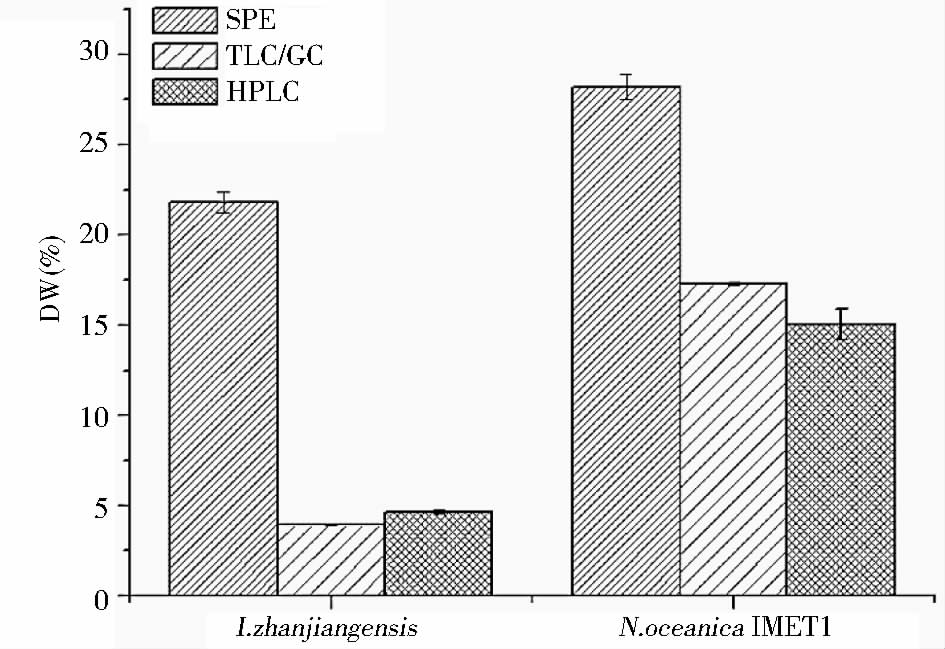
|
| 图 7 SPE、TLC/GC、HPLC-ELSD方法测定TAG含量对比 Fig. 7 Comparison of TAG quantification by HPLC-ELSD,TLC/GC and SPE in I. zhanjiangensis and N. oceanica IMET1 Values are means ± standard deviation of three technical replicates from one batch culture |
本文建立了基于二醇基柱的正相HPLC-ELSD检测微藻中性脂含量的方法,能够对微藻TAG及保留相近的干扰物进行分离。对湛江等鞭金藻、微拟球藻中TAG的含量进行测定,并将测定结果与固相萃取分离及TLC/GC联用两种TAG测定方法相比较,结果显示该方法前处理简单、分析速率快、测定准确度及灵敏度高。此外对角毛藻、杜氏盐藻、新月藻等微藻样品中中性脂的分离,显示该方法能对多数微藻中性脂进行分离分析,具有广泛适用性。该方法能够快速准确地对微藻中性脂进行分离和分析,为微藻脂质积累代谢研究提供了有力工具。
| [1] | Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. Plant J, 2008, 54(4): 621-639. |
| [2] | Chisti Y. Biodiesel from microalgae. Biotechnol Adv, 2007, 25(3): 294-306. |
| [3] | Breuer G, Lamers P P, Martens D E, et al. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains. Bioresour Technol, 2012, 124(337): 217-226. |
| [4] | Beermann C, Green A, Möbius M, et al. Lipid class separation by HPLC combined with GC FA analysis: comparison of seed lipid compositions from different Brassica napus L. varieties. J Am Oil Chem Soc, 2003, 80(8): 747-753. |
| [5] | Ruiz-Gutiérrez V, Pérez-Camino M C. Update on solid-phase extraction for the analysis of lipid classes and related compounds. J Chromatogr A, 2000, 885(1-2): 321-341. |
| [6] | Chen W, Sommerfeld M, Hu Q. Microwave-assisted Nile red method for in vivo quantification of neutral lipids in microalgae. Bioresour Technol, 2011,102(1): 135-141. |
| [7] | Isleten-Hosoglu M, Gultepe I, Elibol M. Optimization of carbon and nitrogen sources for C biomass and lipid production by Chlorella saccharophila under heterotrophic conditions and development of Nile red fluorescence based method for quantification of its neutral lipid content. Biochem Eng J, 2012, 61: 11-19. |
| [8] | Romek M, Barbara G, Ewa K, et al. New technique to quantify the lipid composition of lipid droplets in porcine oocytes and pre-implantation embryos using Nile Red fluorescent probe. Theriogenology, 2011, 75(1): 42-54. |
| [9] | Gao C F, Wang Y, Shen Y, et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics, 2014, 15: 582-595. |
| [10] | Fan J H, Cui Y B, Wan M X, et al. Lipid accumulation and biosynthesis genes response of the oleaginous Chlorella pyrenoidosa under three nutrition stressors. Biotechnol Biofuels, 2014, 7:17-30. |
| [11] | Lin J T. HPLC separation of acyl lipid classes. J Liq Chromatogr Relat Technol, 2007, 30(13-16): 2005-2020. |
| [12] | Rodríguez-Alcalá L M, Fontecha J. Major lipid classes separation of buttermilk, and cows, goats and ewes milk by high performance liquid chromatography with an evaporative light scattering detector focused on the phospholipid fraction. J Chromatogr A, 2010, 1217(18): 3063-3066. |
| [13] | McLaren D G, Miller P L, Lassman M E, et al. An ultraperformance liquid chromatography method for the normal-phase separation of lipids. Anal Biochem, 2011, 414(2): 266-272. |
| [14] | Donot F, Cazals G, Gunata Z, et al. Analysis of neutral lipids from microalgae by HPLC-ELSD and APCI-MS/MS. J Chromatogr B, 2013,942-943(24): 98-106. |
| [15] | Wang H T, Yao C H, Ai J N, et al. Identification of carbohydrates as the major carbon sink of the marine microalga Isochrysis zhangjiangensis (Haptophyta) and optimization of its productivity by nitrogen manipulation. Bioresour Technol, 2014, 171: 298-304. |
| [16] | Wang H T, Meng Y Y, Cao X P, et al. Coordinated response of photosynthesis, carbon assimilation, and triacylglycerol accumulation to nitrogen starvation in the marine microalgae Isochrysis zhangjiangensis (Haptophyta). Bioresour Technol, 2015, 177(12): 282-288. |
| [17] | Hibberd D J. Notes on taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae). Bot J Linn Soc, 1981, 82(2): 93-119. |
| [18] | Campos H, Boeing W J, Dungan B N, et al. Cultivating the marine microalga Nannochloropsis salina under various nitrogen sources: effect on biovolume yields, lipid content and composition, and invasive organisms. Biomass Bioenergy, 2014, 66(7): 301-307. |
| [19] | Rodolfi L, Zittelli G C, Bassi N, et al. Microalgae for oil: strain selection, induction of lpid synthesis and outdoor mass cultivation in a low-cost photobioreactor. Biotechnol Bioeng, 2009, 102(1): 100-112. |
| [20] | Van Vooren G, Le Grand F, Legrand J, et al. Investigation of fatty acids accumulation in Nannochloropsis oculata for biodiesel application. Bioresour Technol, 2012, 124(3): 421-432. |
| [21] | Xiao Y, Zhang J T, Cui J T, et al. Metabolic profiles of Nannochloropsis oceanica IMET1 under nitrogen-deficiency stress. Bioresour Technol, 2013, 130: 731-738. |
| [22] | Meng Y Y, Jiang J P, Wang H T, et al. The characteristics of TAG and EPA accumulation in Nannochloropsis oceanica IMET1 under different nitrogen supply regimes. Bioresour Technol, 2015, 179: 483-489. |
| [23] | Kobayashi N, Noel E A, Barnes A, et al. Rapid detection and quantification of triacylglycerol by HPLC-ELSD in Chlamydomonas reinhardtii and Chlorella Strains. Lipids, 2013, 48(10): 1035-1049. |
| [24] | Li X B, Moellering E R, Liu B S, et al. A galactoglycerolipid lipase is required for triacylglycerol accumulation and survival following nitrogen deprivation in Chlamydomonas reinhardtii. Plant Cell, 2012, 24(11): 4670-4686. |
| [25] | Simionato D, Block M A, La Rocca N, et al. The response of Nannochloropsis gaditana to nitrogen starvation includes de novo biosynthesis of triacylglycerols, a decrease of chloroplast galactolipids, and reorganization of the photosynthetic apparatus. Eukaryot Cell, 2013, 12(5): 665-676. |
 2015, Vol. 35
2015, Vol. 35




