文章信息
- 杨敏, 陈丹, 姚冬生, 谢春芳, 刘大岭
- YANG Min, CHEN Dan, YAO Dong-sheng, XIE Chun-fang, LIU Da-ling
- 技术与方法β-激动剂核酸适配体电化学生物传感器的研制
- A Novel Aptasensor for Electrochemistry Detection of β-agonists
- 中国生物工程杂志, 2015, 35(11): 52-60
- China Biotechnology, 2015, 35(11): 52-60
- http://dx.doi.org/10.13523/j.cb.20151108
-
文章历史
- 收稿日期: 2015-06-24
- 修回日期: 2015-07-15
2. 暨南大学生物医药研究院 广州 510632;
3. 暨南大学微生物技术研究所 广州 510632
2. National Engineering Research Center of Genetic Medicine, Jinan University, Guangzhou 510632, China;
3. Institute of Microbial Technology, Jinan University, Guangzhou 510632, China
β-激动剂是一类具有肾上腺素功能的苯乙醇胺类人工合成化合物,在结构上均具有苯乙醇胺的母核。因其能对养殖动物体内营养再分配起到促进作用,改善养殖动物日增重和饲料转化率,因此常被非法用于动物养殖过程[1]。 但是,β-激动剂易在动物组织中残留,当人类食用含有β-激动剂的食物后β-激动剂会在人体内积累引起急性或慢性中毒[2]。目前,β-激动剂在许多国家已被禁止使用[3, 4]。因此,建立简便、快速、灵敏的β-激动剂检测方法对于食品安全控制具有十分重要的意义。
目前文献中报道了多种检测β-激动剂的方法,如Bartolincic等[5]利用HPLC法对沙丁胺醇和班布特罗进行检测分析。该方法分辨率高,但需要专业技术人员操作,而且需要昂贵的仪器。Ramos等[6]利用气相色谱-质谱联用法检测克伦特罗,该方法获得的结果比较可靠,但是GC-MS对样品要求较高,需要将样品衍生化处理之后才能进行GC-MS分析,操作步骤繁琐。Shelver和Smith[7]建立了一种β-激动剂的酶联免疫吸附法,该方法灵敏度高,快速方便,但是假阳性发生概率较高并且不能用于在线检测。Wang等[8]利用毛细管电泳法检测猪饲料,猪尿和猪肝中的β-激动剂,该方法具有分辨率高、试剂用量少、自动化程度高的优势,但是灵敏度低、分析时间长。
电化学生物传感器具有灵敏度高、特异性好和快速简便等优点,目前已经成为一项十分具有吸引力的课题。Lin等[9]开发了一种新型的电化学传感器,可用于8种β-激动剂的检测,该传感器是在石墨烯全氟磺酸修饰的玻碳电极上通过电聚合酸铬蓝K构建而成,检测限为0.58~1.46ng/ml,但是该传感器修饰过程太过复杂。Wang等[10]制作了一种纳米银钯合金抗体修饰的电化学生物传感器,能同时检测莱克多巴胺、克伦特罗和沙丁胺醇。这种传感器具有较高的灵敏度,检测限分别为1.52pg/ml、1.44pg/ml和1.38pg/ml。但是该传感器复杂且需要三种抗体做识别分子来产生检测信号。
高灵敏度和高选择性是评估检测方法使用价值的重要标准,而获得高灵敏度和高选择性的关键是生物识别器的选择和转导系统的设计。最常见和最典型的生物识别器是核酸适配体、抗体和酶。核酸适配体[11]是指从人工合成的DNA/RNA文库中筛选得到的单链或双链寡核苷酸。与传统的免疫学和化学识别分子相比,核酸适配体靶分子范围广,既包括金属离子和抗生素等小分子,也包括蛋白质和细胞等大分子[12]。另外,核酸适配体比抗体更稳定。核酸适配体可以通过化学合成法很容易的生成,并且修饰过程简单,不易发生变性和降解[13]。此外,核酸适配体分子质量小、无毒性、无免疫原性、组织渗透性好[14]。在这种情况下,基于核酸适配体的转导系统将会使检测更加实用、更加灵敏。
本研究利用等温滴定量热法(isothermal titration calorimetric method,iTC)筛选了一条高亲和力的单链DNA核酸适配体。利用该核酸适配体,研制了一个非标记型电化学适配体生物传感器并用于检测5种β-激动剂,包括莱克多巴胺(ractopamine,RAC)、克伦特罗(clenbuterol,CLB)、沙丁胺醇(salbutamol,SAL)、苯乙醇胺(phenylethanolamine,PHL)和丙卡特罗(procaterol,PRO)。
1 材料与方法 1.1 试剂与仪器RAC、CLB、SAL、PHL和PRO由国家饲料质量监督检验中心提供;四环素及链霉素购自Sigma公司,纯度98%;单链DNA由生工生物工程(上海)股份有限公司合成。所有其他试剂均为分析纯,使用前未经进一步纯化。实验用水为超纯水(电阻率:18.2MΩ/cm)。ELISA试剂盒购自华安麦科生物科技有限公司。
iTC实验是在MicroCalTM Auto iTC200上完成的,电化学分析是在室温下通过电化学分析仪进行分析的; Epsilon电化学工作站( 美国BAS公司,差分脉冲伏安法及循环伏安法分析),CHI660C电化学工作站( 上海辰华仪器公司,交流阻抗分析)。实验均采用传统的三电极系统:以金电极( Au,内径 = 2mm) 或修饰电极为工作电极,以铂丝电极为对电极,Ag/AgCl电极为参比电极。
1.2 核酸适配体的制备用PHL作为5种β-激动剂的代表,通过等温滴定量热法[15]筛选出与PHL具有高亲和力的单链DNA作为制作传感器识别分子的核酸适配体(命名为AP-Ago),在AP-Ago 3′端引入固定基团[3′-NH2-(CH2)7-] 构建适配体传感器。
1.3 适配体传感器的制备将待修饰金电极分别用1.0μm、0.3μm、0.05μm的Al2O3 粉打磨至镜面。超纯水超声清洗5min 。然后,将处理后的电极浸入Piranha溶液(浓硫酸∶30% H2O2 =7∶3,V/V)活化10min;再分别用超纯水和无水乙醇超声清洗2次,每次5min。将清洗好的电极进行差分脉冲伏安法(differential pulsevoltammetry,DPV)分析。DPV分析之后,活化后的金电极用超纯水冲洗,然后浸入到 AP-Ago自组装液(含2μmol/L AP-Ago、1.0mol/L NaCl)中,于4℃组装24h。处理后用超纯水冲洗去除为结合的 AP-Ago,并在上述电解液中进行DPV扫描[16]。
1.4 适配体传感器对PHL的检测将AP-Ago修饰电极侵入到1.0pg/ml的PHL溶液中室温下孵育15min。用超纯水洗去未特异性结合的PHL,然后进行DPV扫描。
用同样的方法,在室温下将AP-Ago修饰电极与不同浓度的PHL(5.0pg/ml、10.0pg/ml、50.0pg/ml、1.0×102pg/ml、5.0×102pg/ml和1.0×103pg/ml)依次孵育15min。用超纯水洗去未特异性结合的PHL,然后进行DPV扫描[15]。
1.5 适配体传感器性能的优化 1.5.1 扫描速率的优化在含5mmol/L K3[Fe(CN)6]、0.1mol/L KCl的电解液中,以不同的扫描速率对AP-Ago修饰电极进行循环伏安法(cyclic voltammetry,CV)分析。分析峰信号值与扫描速率的关系,考察扫描速率对适配体传感器信号的影响[17]。
1.5.2 孵育温度的优化将AP-Ago修饰电极浸入0.1ng /ml的PHL水溶液中,依次在20℃、25℃、30℃、35℃、40℃、45℃、50℃恒温水浴锅中分别孵育15min,用超纯水洗去未特异性结合的PHL,然后进行DPV扫描。分析峰电流值(Ip)与孵育温度的关系,考察温度对适配体传感器检测信号的影响。
1.5.3 孵育时间的优化将AP-Ago修饰电极浸入0.1ng /ml的PHL溶液中,室温每孵育15min检测一次(DPV扫描),共5次。分析峰电流值(Ip)与反应时间的关系,考察反应时间对适配体传感器检测信号的影响。
1.5.4 pH的优化(1) pH对适配体传感器的影响。准备不同pH的20mmol/l Na2HPO4-柠檬酸,含50mmol/L NaCl、2mmol/L K4[Fe( CN)6]的电解液,pH分别为3.0、4.0、5.0、6.0、7.0、8.0。 在室温下将AP-Ago修饰电极依次侵入到这些电解液中,进行DPV扫描。分析峰电流值(Ip)与pH的关系。
(2)pH对检测的影响。准备不同pH的20mmol/L Na2HPO4-柠檬酸,含50mmol/L NaCl,2mmol/L K4[Fe(CN)6]的电解液,pH分别为3.0、4.0、5.0、6.0、7.0、8.0。 将AP-Ago修饰电极侵入到0.1ng/ml的PHL溶液中室温孵育15min,再依次侵入到不同pH的电解液中,进行DPV扫描。分析峰电流值(Ip)与pH的关系,考察pH对检测的影响。
1.6 AP-Ago修饰电极对不同β-激动剂灵敏度的评价将AP-Ago修饰电极依次与不同浓度(0.1pg/ml、0.5pg/ml、1.0pg/ml、5.0pg/ml、10.0pg/ml、50.0pg/ml和 1.0×102pg/ml )的SAL溶液室温下孵育15min,用超纯水洗去未特异性结合的SAL;用同样的方法将另一个AP-Ago修饰电极依次与不同浓度(5.0pg/ml、10.0pg/ml、50.0pg/ml、1.0×102pg/ml、5.0×102pg/ml和1.0×103pg/ml)的PHL溶液进行孵育,用超纯水洗去未特异性结合的PHL。然后进行DPV扫描,分析沙丁胶醇,PHL浓度与峰电流值(Ip)的关系,考察适配体传感器的灵敏度[17]。
同样的方法,将AP-Ago修饰电极依次与不同浓度(0.1pg/ml、0.5pg/ml、1.0pg/ml、5.0pg/ml、10.0pg/ml、50.0pg/ml、1.0×102pg/ml和5.0×102pg/ml )的CLB溶液室温下孵育15min;将另一个AP-Ago修饰电极依次与不同浓度(0.1ng/ml、0.5ng/ml、1.0ng/ml、5.0ng/ml和10.0ng/ml)的RAC溶液进行孵育,另一个AP-Ago修饰电极依次与不同浓度(0.01ng/ml、0.05ng/ml、0.1ng/ml、0.5ng/ml和1.0ng/ml)的PRO溶液进行孵育。然后进行交流阻抗分析(electrochemical impedance spectroscopy,EIS),将CLB、RAC、PRO的浓度与电子转移电阻值(Ret)的关系进行分析。
1.7 适配体传感器选择性评价为了评价适配体传感器的选择性,选用SAL、CLB、PRO、RAC、四环素(TET)和链霉素(STM)作为分析物进行电化学实验。根据最大残留限度将这6种分析物均进行10倍稀释[18, 19];根据适配体传感器对PHL的检测限将PHL稀释100倍;这些分析物的浓度如表 1所示。 将AP-Ago修饰电极室温依次浸入到SAL、CLB、PRO、RAC、PHL、TET和STM溶液中15min,并分别进行DPV扫描。计算相应物质的电子转移电阻率(△Ret/Ret%)的变化,考察适配体传感器的选择性。
本研究用等温滴定量热法(iTC)检测单链DNA与PHL的亲和力,筛选出对PHL有高亲和力来的单链DNA(被命名为 AP-Ago)作为识别分子制作生物传感器。所筛选出的单链DNA(AP-Ago)长度为22bp、分子质量为6.71kDa,GC% = 40.9,与PHL的解离常数Kd=3.34×10-5mol/L。AP-Ago与PHL的结合为放热过程(ΔH=-3.08×106 cal/mol),表明AP-Ago与PHL结合时,分子间有氢键等键的形成。同样说明AP-Ago在缓冲液中呈自折叠的高级结构。AP-Ago和PHL之间的相互作用如图 1所示。根据公式△G=RT lnKd,△G=-6.10×103cal/mol。△G<0,说明PHL分子与AP-Ago的结合是一个自发反应。
|
| 图 1 β-激动剂与适配体 AP-Ago的结合示意图 Fig. 1 Schematic representation of β-agonists binding to AP-Ago |
AP-Ago适配体传感器对PHL响应的DPV和CV结果如图 2所示。由图可知,以核酸适配体本身(不存在PHL)作为对照,AP-Ago适配体传感器对不同浓度的PHL响应信号强度不同,随着PHL浓度的增加,AP-Ago适配体传感器响应信号强度也随之增强,使得适配体传感器能够定量检测PHL。
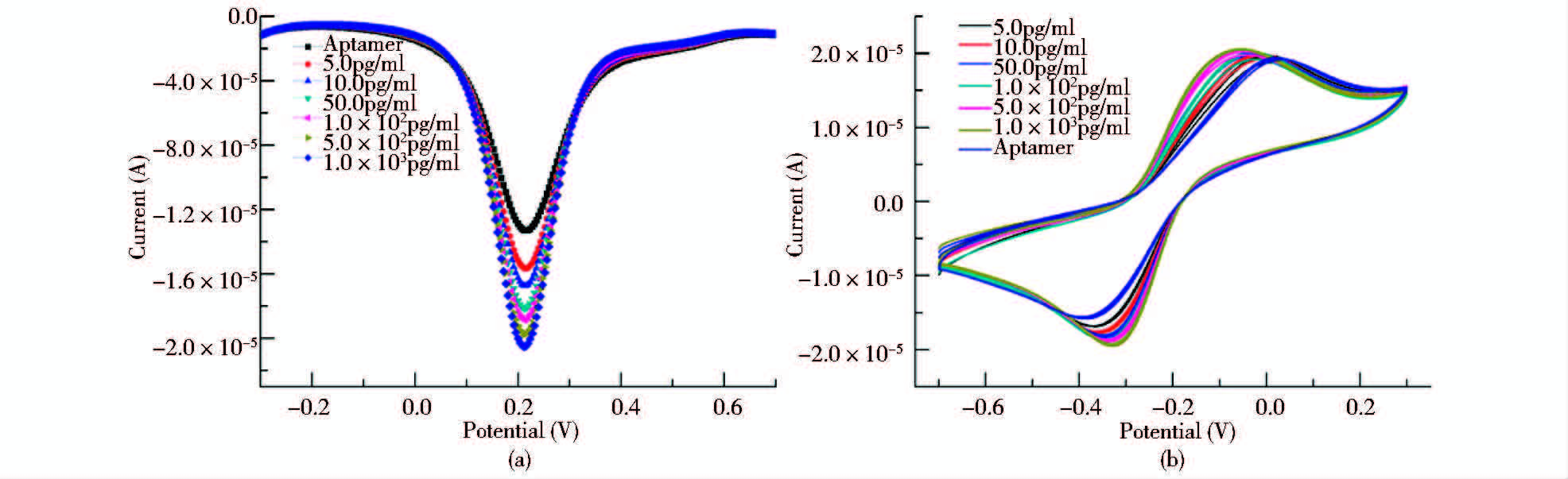
|
| 图 2 适配体传感器对PHL响应的DPV和CV扫描图 Fig. 2 DPV and CV analysis of aptasensor to PHLDPV(a) and CV(b) analysis obtained in the presence of 5.0mmol/L[Fe(CN)6]3- as a redox probe,after the aptasensor incubating in PHL solution with different concentrations |
如图 3所示,在10~200mV/s扫描范围内,电极的峰电流值(Ip)与扫描速率的对数值(lnν)呈线性关系,线性方程:Ipa (μA)= -8.58lnν (mV/s)+9.21,R2=0.988 2;Ipc (μA)= 5.35lnν (mV/s) -1.33,R2=0.987 8[图 3(b)]。在10~200mV/s的扫描速率内,峰电压(Ep)与扫描速率(ν)也呈线性关系,线性方程 :Epa(mV)= -0.22v(mV/s)+1.69×102,R2=0.986 2; Epc (mV)= 0.18v(mV/s)+2.61×102,R2=0.983 7[图 3(c)]。
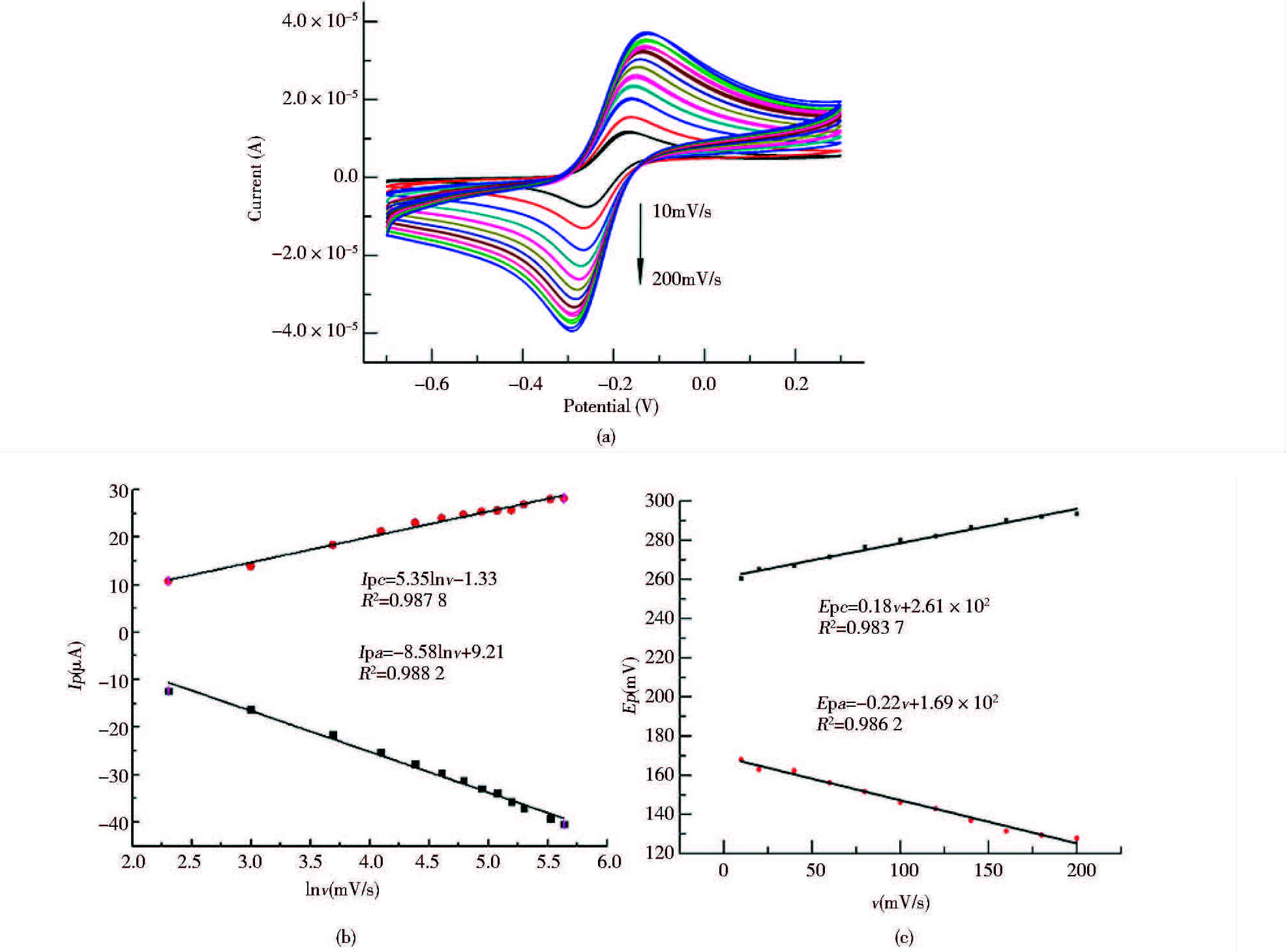
|
| 图 3 适配体传感器在不同扫描速率下的循环伏安分析 Fig. 3 CV of aptasensor at various scan rates(a)Cyclic voltammetry analysis of aptasensor at various scan rates,from inner to outer:10~200mV/s. Inset plot(b) shows the dependence of peak current value (Ip) on ln scan rate (lnν). Inset plot (c) shows the dependence of peak voltage value (Ep) on ln scan rate (lnν) |
对孵育温度的优化是为了获得高灵敏度的电化学适配体传感器。图 4展示了在20~50℃时,温度对峰电流值Ip的影响。结果表明,当温度升高时,峰电流值呈现先增后降的趋势,在37℃左右达到最大值。
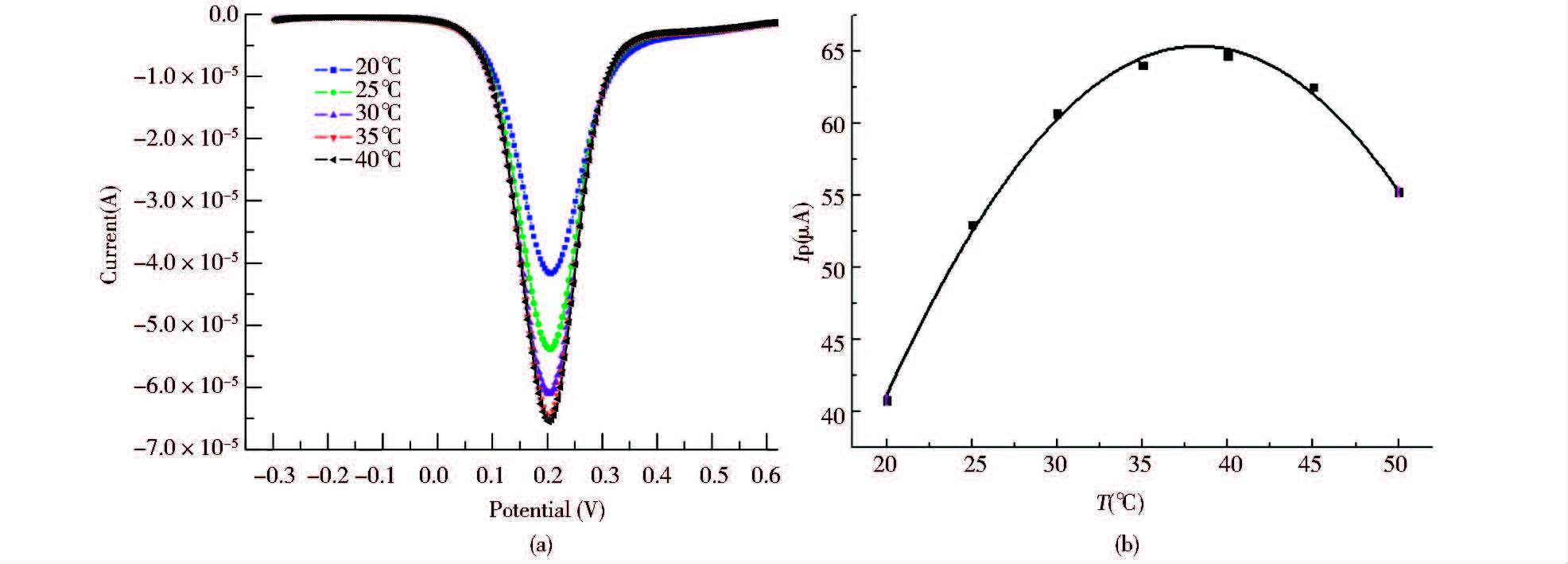
|
| 图 4 适配体传感器在不同温度下检测苯乙醇胺的DPV扫描图 Fig. 4 DPV of aptasensor detecting PHL with different temperature(a) Differential pulse voltammetry analysis of aptasensor after incubating in PHL solution with different temperature (b)The dependence of peak current value(Ip) on the temperature (T) |
对孵育时间的优化是为了缩短检测时间达到快速检测的目的。孵育时间与峰电流之间的关系如图 5所示。随着孵育时间的增加,峰电流值呈增加的趋势,在60min不再增长。峰电流值与孵育时间(0~75min)呈现指数关系,指数方程为Ip=-27.86exp (-2.86×10-2×t)+35.21,相关系数R2=0.989 5。结果表明,选择15min为孵育时间可以达到有效检测的目的。
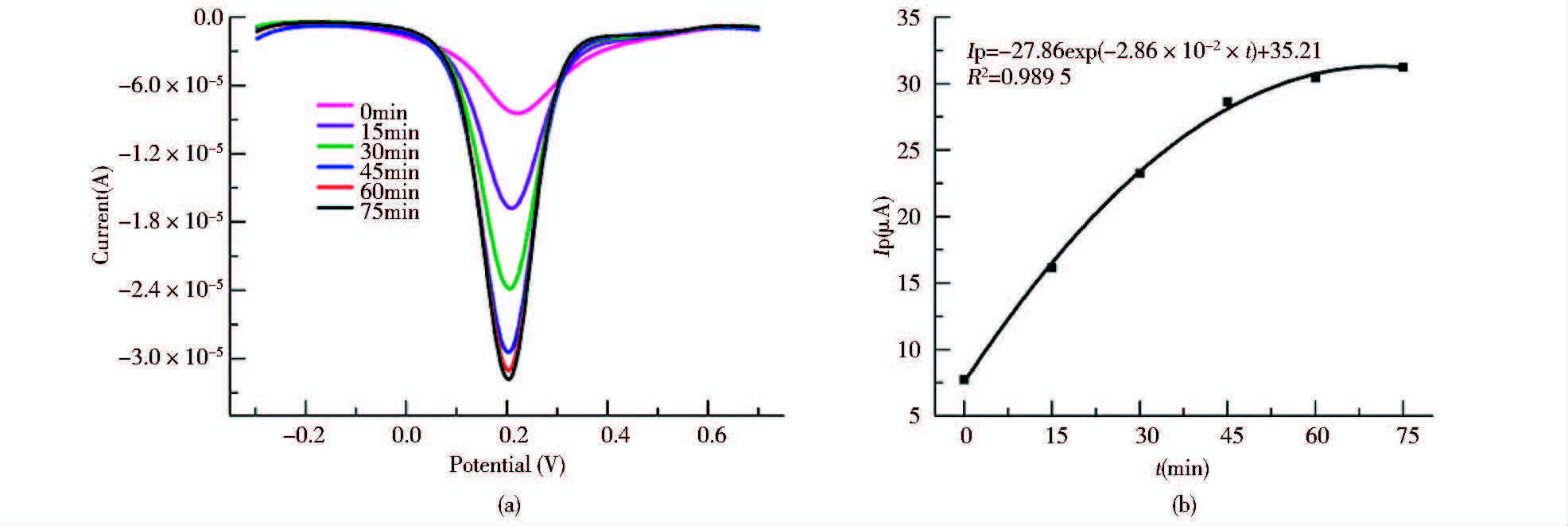
|
| 图 5 适配体传感器以不同的孵育时间检测PHL的DPV扫描图 Fig. 5 DPV of aptasensor detecting PHL with different reaction time (a)Differential pulse voltammetry analysis of aptasensor after incubating in PHL solution with different reaction time (b)The dependence of peak current value(Ip) on the reaction time(t) |
(1)不同pH的电解液对适配体传感器信号的影响。不同pH的电解液直接影响了AP-Ago所带电荷,从而间接影响了AP-Ago与PHL之间的相互作用,造成适配体传感器电流响应的变化。适配体传感器对不同pH(pH4.0~8.0)的电解质响应的DPV结果如图 6所示。结果表明,当pH升高,峰电流值(Ip)呈现先增后减的趋势,在pH6.0左右达到最大值。
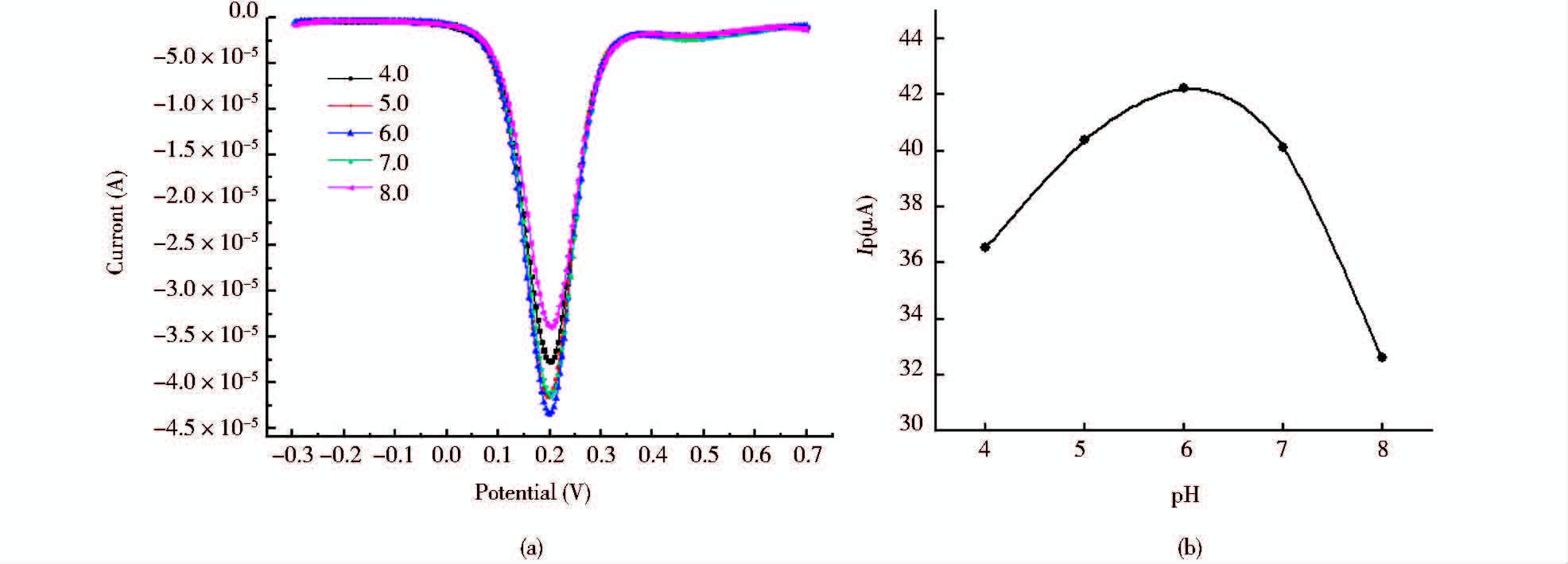
|
| 图 6 适配体传感器在不同pH电解质中的DPV扫描图 Fig. 6 DPV analysis of aptasensor in various pH electrolytes(a) Differential pulse voltammetry analysis of aptasensor in various pH electrolytes (b)The dependence of peak current value(Ip) on various pH electrolytes (pH) |
(2)不同pH的电解质对检测的影响。适配体传感器与 0.1ng/ml的PHL孵育15min后,在不同pH(4.0~8.0)的电解质中的DPV扫描结果见图 7。结果表明,随着pH升高,峰电流值呈现先增后减的趋势,在pH6.5左右达到最大值。
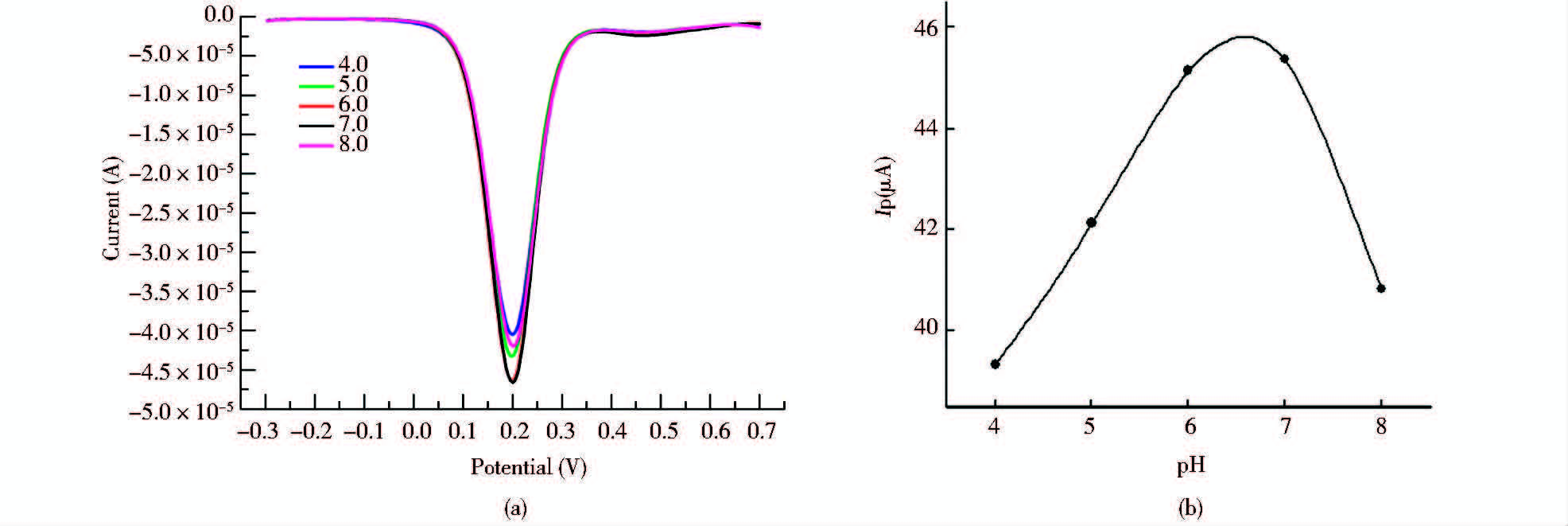
|
| 图 7 与PHL孵育后的适配体传感器在不同pH电解质中的DPV扫描图 Fig. 7 DPV analysis of aptasensor after incubating in PHL solution in various pH electrolytes(a)Differential pulse voltammetry analysis of aptasensor after incubating in PHL solution in various pH electrolytes (b)The dependence of peak current value(Ip) on various pH electrolytes (pH) |
电极检测信号来源于AP-Ago对PHL的识别作用,PHL与AP-Ago的结合引起信号的变化。用对同一浓度PHL重复检测8次的峰电流值的相对标准偏差值进行电极检测重现性的评价。峰电流值(Ip )的RSD=2.09%,说明该适配体传感器具有良好的检测重现性。
2.5 适配体传感器对不同β-激动剂的灵敏度分析不同β-激动剂的浓度与检测信号之间的关系通过DPV和EIS进行分析。如[图 8(a)]所示,在0.1~5.0×102pg/ml浓度范围内,CLB浓度的对数值与电子转移阻抗值的差值(ΔRet)呈指数关系,相关系数R2=0.991 3,检出限为0.35pg/ml。在0.1~10.0pg/ml浓度范围内,与SAL浓度与峰电流的差值(ΔIp)呈线性关系,相关系数R2=0.993 9,检出限为0.53pg/ml[图 8(b)]。在0.1~10.0ng/ml浓度范围内,RAC浓度的对数值与电子转移阻抗值的差值(ΔRet)呈线性关系,相关系数R2=0.985 1,检出限为0.04ng/ml[图 8(c)]。
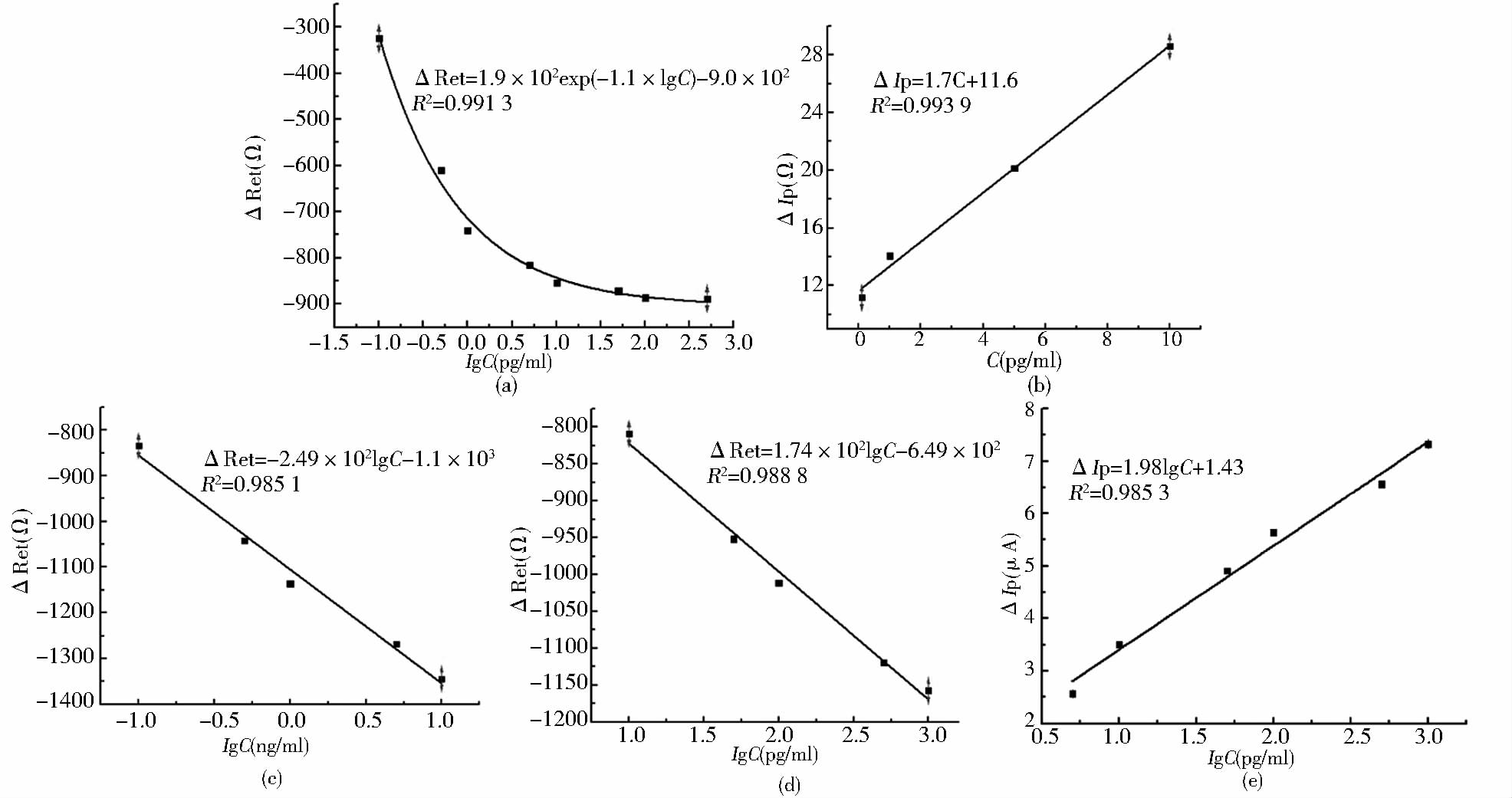
|
| 图 8 适配体传感器对5种β-激动剂的灵敏度 Fig. 8 Sensitivity of the aptasensor to β-agonists including CLB (a),SAL (b),RAC (c),PRO (d),PHL(e),respectively |
在10.0~1.0×103pg/ml浓度范围内,PRO浓度的对数值与电子转移阻抗值的差值(ΔRet)呈线性关系,相关系数R2=0.988 8,检出限为1.73pg/ml[图 8(d)]。在5.0~1.0×103pg/ml浓度范围内,PHL浓度的对数值与峰电流的差值(ΔIp)呈现很好的线性关系,R2=0.985 3,线性方程为△Ip (μA)=1.98lgC+1.43,检测限为1.0pg/ml[图 8(e)]。
2.6 适配体传感器选择性分析传感器的选择性是表征传感器是否优异的最重要指标之一。本研究中,我们研究适配体传感器对5种激动剂和2种抗生素的选择性。结果如图 9所示,适配体传感器对RAL、CLB、SAL、PHL和PRO的信号响应强度不同,但是信号都很强,而对四环素和链霉素的信号响应很弱。在本实验样品中,四环素的浓度是CLB、SAL和PRO的150倍,是RAC的7.5倍,是PHL的1 500倍;链霉素的浓度是CLB、SAL和PRO的300倍,是RAC的12倍,是PHL的3 000倍。这个实验说明,该适配体传感器对这5种激动剂具有良好的特异性,对四环素和链霉素有抗干扰能力。我们推测产生这种现象的原因可能是β-激动剂都有相似的结构,AP-Ago 对此结构具有高的亲和力,因此,对不同β-激动剂之间的选择性不明显。四环素和链霉素与β-激动剂的结构不同,所以AP-Ago表现出选择性。
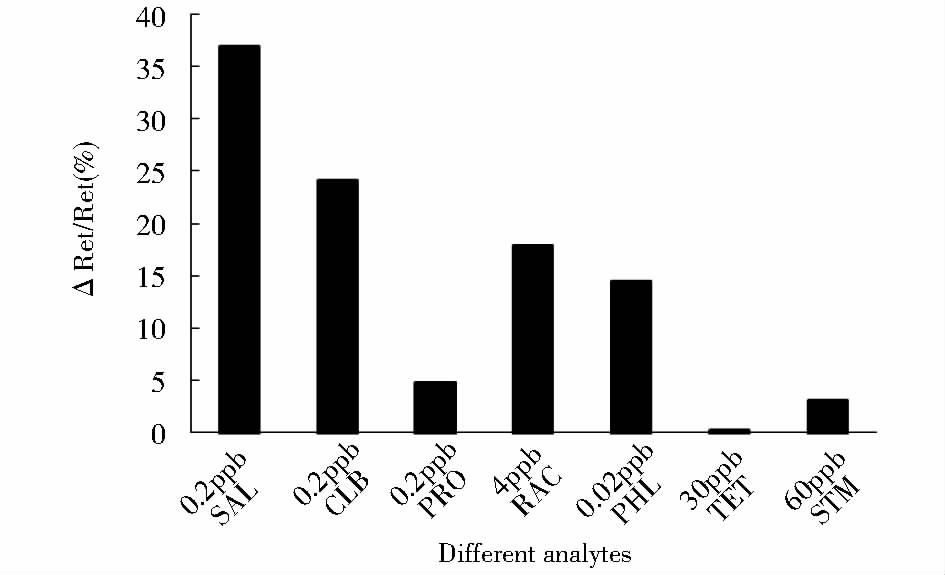
|
| 图 9 适配体传感器对不同分析物的电子转移电阻率 Fig. 9 The electron transfer resistance of the aptasensor to different analytesSpecificity of the aptasensor to 0.02ng/ml PHL by comparing it to the analytes: CLB,SAL,PRO,RAC,STM and TET at the concentration 0.2ng/ml,0.2ng/ml,0.2ng/ml,0.2ng/ml,4.0ng/ml,60.0ng/ml,30.0ng/ml respectively |
本研究以PHL作为5种β-激动剂的代表,利用等温滴定量热法筛选得到一条以5种β-激动剂为配体的适配体(AP-Ago),以此适配体作为识别元件构建了用于检测5种β-激动剂(莱克多巴胺、克伦特罗、沙丁胺醇、苯乙醇胺和丙卡特罗)的非标记型适配体电化学生物传感器。AP-Ago对苯乙醇胺的解离平衡常数为Kd=3.34×10-5mol/L。该适配体电化学传感器对莱克多巴胺、克伦特罗、沙丁胺醇、苯乙醇胺和丙卡特罗敏感。线性范围为0.1~10.0ng/ml,莱克多巴胺的检出限为0.04ng/ml; 线性范围为0.1~5.0×102pg/ml,克伦特罗的检出限为0.35pg/ml;线性范围为5.0~1.0×103pg/ml,苯乙醇胺的检出限为1.0pg/ml;线性范围为0.1~10.0pg/ml,沙丁胺醇的检出限为0.53pg/ml;线性范围为10.0~1.0×103pg/ml,丙卡特罗的检出限为1.73pg/ml。最优检测时间为15 min,最适孵育温度为37℃,最佳电解液pH6.5。该适配体电化学传感器同样具有良好的检测重现性(RSD=2.09%)。明显优于Lin等[9]报道的石墨烯全氟磺酸修饰的玻碳电极检出限0.58~1.46ng/ml;也优于Wang等[10]报道的纳米银钯合金抗体修饰的电化学生物传感器,需要多个抗体做识别分子,且只能检测莱克多巴胺,克伦特罗和沙丁胺醇,检出限也只有1.52pg/ml、1.44pg/ml和1.38pg/ml。本研究表明,适配体传感器可以被发展成为一种快速检测样品中一种或多种β-激动剂的方法。
致谢 真诚感谢广东省生物工程药物重点实验室与基因工程药物国家工程研究中心为我们提供设施,以及国家饲料质量监督检验中心为我们提供的β-agonists。
| [1] | 王培龙.β-受体激动剂及其检测技术研究.农产品质量与安全,2014,1:44-52. Wang P L.β-agonist and its detection technology.Agricultural Product Quality and Safety,2014,1:44-52. |
| [2] | 沈建忠,江海洋.畜产品中β-受体激动剂残留及其危害.中国动物检疫,2011,28(6):27-28. Shen J Z,Jiang H Y.β-agonists residues in animal products and its harm.China animal inspection,2011,28(6):27-28. |
| [3] | Commission of the European Communities.Council Directive 96/22/EC on the prohibition of the use of certain substances having a hormonal and thyreostatic action and b 2-agonists in animal husbandry. Official Journal of the European Communities, 1996,L125. |
| [4] | 中华人民共和国农业部公告第193号. 食品动物禁用的兽药及其它化合物清单.[2015-10-20]. http://www.moa.gov.cn/zwllm/tzgg/gg/201006/t20100606_1535262.htm. The Bulletin No.193 issued by Agricultural Ministry of the People's Republic of China. The disabled list of veterinary drugs and other compounds in food animals.[2015-10-20]. http://www.moa.gov.cn/zwllm/tzgg/gg/201006/t20100606_1535262.htm. |
| [5] | Bartolincic A, Druskovic V, Sporec A, et al. Development and validation of HPLC methods for the enantioselective analysis of bambuterol and albuterol. Journal of Pharmaceutical and Biomedical Analysis,2005, 36(5):1003-1010. |
| [6] | Ramos F, Cristino A, Carrola P, et al.Clenbuterol food poisoning diagnosis by gas chromatography-mass spectrometric serum analysis. Analytica Chimica Acta,2003,483(1-2):207-213. |
| [7] | Shelver W L, Smith D J. Enzyme-linked immunosorbent assay development for the beta-adrenergic agonist zilpaterol. Journal of Agricultural and Food Chemistry,2004, 52(8):2159-2166. |
| [8] | Wang W Y, Zhang Y L, Wang J Y. Determination of β-agonists in pig feed, pig urine and pig liver using capillary electrophoresis with electrochemical detection. Meat Science,2010, 85(2):302-305. |
| [9] | Lin X Y, Ni Y N, Kokotc S A .novel electrochemical sensor for the analysis of -agonists: the poly (acid chrome blue K)/graphene oxide-na?on/glassy carbon electrode. Journal of Hazardous Materials, 2013,260:508-517. |
| [10] | Wang H, Zhang Y, Li H, et al.A silver-palladium alloy nanoparticle-based electrochemical biosensor for simultaneous detection of ractopamine, clenbuterol and salbutamol. Biosensors and Bioelectronics, 2013,49:14-19. |
| [11] | Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase. Science, 1990,9968(249):505-510. |
| [12] | Citartan M, Gopinath S C, Tominag J J,et al. H.Assays for aptamer-based platforms. Biosensors and Bioelectronics, 2012,34(1):1-11. |
| [13] | White R R, Sullenger B A, Rusconi C P. Developing aptamers into therapeutics.The Journal of Clinical Investigation,2000, 106(8):929-934. |
| [14] | Shangguan D H, Li Y, Tang Z W, et al. Aptamers evolved from live cells as effective molecular probes for cancer study. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(32):11838-11843. |
| [15] | Chen D, Yao D S, Xie C F, et al. Development of an aptasensor for electrochemical detection of tetracycline. Food Control, 2014,42:109-115. |
| [16] | 陈丹,姚冬生,谢春芳,等.四环素核酸适配体电化学生物传感器的研制.中国生物工程杂志,2013,33(11): 56-62. Chen D,Yao D S,Xie C F,et al.Development of an aptasensor for electrochemical detection of tetracycline.China Biotechnology,2013,33(11):56-62. |
| [17] | 周妮,陈丹,姚冬生,等.莱克多巴胺核酸适配体电化学生物传感器的研制.中国生物工程杂志,2014,34(1):42-49. Zhou N,Chen D,Yao D S,et al.Development of an electrochemical aptasensor basic on the ssDNA aptamer of ractopamine.China Biotechnology,2014,34(1):42-49. |
| [18] | 中华人民共和国农业部公告第235号.动物性食品中兽药最高残留限量.[2015-10-20]. http://www.moa.gov.cn/zwllm/tzgg/gg/200302/t20030226_59300.htm. The Bulletin No.235 issued by Agricultural Ministry of the People's Republic of China. Maximum Residue Limits (MRL) for veterinarychemicals in animal tissues.[2015-10-20].http://www.moa.gov.cn/zwllm/tzgg/gg/200302/t20030226_59300.htm. |
| [19] | 中华人民共和国农业部公告第1519号.禁止在饲料和动物饮用水中使用的物质名单. .http://www.moa.gov.cn/zwllm/tzgg/gg/201101/t20110113_1806088.htm. The Bulletin No.1519 issued by Agricultural Ministry of the People's Republic of China. The substances banned in animal feed and drinking water. .http://www.moa.gov.cn/zwllm/tzgg/gg/201101/t20110113_1806088.htm. |
 2015, Vol. 35
2015, Vol. 35




