文章信息
- 车绕琼, 黄力, 王琳, 赵鹏, 李涛, 余旭亚
- CHE Rao-qiong, HUANG Li, WANG Lin, ZHAO Peng, LI Tao, YU Xu-ya
- 葡萄糖对单针藻异养、兼养生长及油脂合成的影响
- Effects of Glucose on Cell Growth and Lipid Synthesis of Monoraphidium sp. FXY-10 Under Mixotrophic and Heterotrophic Cultivations
- 中国生物工程杂志, 2015, 35(11): 46-51
- China Biotechnology, 2015, 35(11): 46-51
- http://dx.doi.org/10.13523/j.cb.20151107
-
文章历史
- 收稿日期: 2015-06-29
- 修回日期: 2015-07-28
目前,由于化石燃料的过度使用造成严重的能源危机和环境污染,可再生燃料的开发和利用越来越受到关注[1, 2]。微藻油脂含量高、生长周期短、光合效率高,是制备生物柴油的良好原料[3]。然而,相对较高的生产成本是限制微藻-生物柴油产业发展的主要障碍。
微藻培养方式有自养、异养、兼养。自养培养时,藻细胞进行光合代谢固定CO2 [4]。兼养培养时,藻细胞同时吸收利用有机碳源和CO2。异养培养不需要光照,藻细胞只利用有机碳源,然而有机碳源的添加增加了生产成本。Cheng等[5]报道,有机碳源的成本是培养总成本的50%。因此,合理利用有机碳源,达到最大的经济效益尤其重要。
本实验以该单针藻为研究对象,研究了不同培养模式下葡萄糖的添加对单针藻生长和油脂合成的影响。利用Andrew模型考察了兼养、异养条件下,葡萄糖对单针藻生长的影响,并建立了相应的动力学模型。此外,根据实验数据拟合出葡萄糖的消耗动力学模型,为微藻生产过程中培养基有机碳源的合理添加提供了参考,有利于工业化生产过程中成本的控制。
1 材料与方法 1.1 实验试剂与仪器恒温振荡摇床(TS-1102,上海),高速冷冻离心机(Centrifuge5810R,德国),分光光度仪(Specord Plus,上海);实验所用试剂均为分析纯,购自昆明鼎国试剂公司。
1.2 藻种及培养条件单针藻Monoraphidium sp.FXY-10为本实验室保藏,分离自云南高原淡水湖。以BG-11作为基础培养基。兼养、异养种子培养液添加10.0g/L葡萄糖,培养温度(25±1)℃,摇床转速150r/min。兼养光照强度4×103lx,异养种子进行避光培养。葡萄糖的质量浓度分别设置为2.5g/L、5g/L、7.5g/L、10g/L、15g/L、20g/L、50g/L。将种子液接入含有250ml培养液的500ml三角瓶中,接种后浓度约为6.0×106个/ml,培养条件与种子液培养条件相同,每组设3个平行样。
1.3 检测方法 1.3.1 比生长速率的测定培养基中添加不同质量浓度的葡萄糖进行培养,取处于对数生长期的细胞密度,根据以下公式计算藻的比生长速率:

根据单针藻Monoraphidium sp. FXY-10在OD680nm有最大吸收峰,检测样品OD680nm的吸光度,根据藻细胞密度与吸光度A680的线性关系计算出单针藻的生物量[6]。
1.3.3 葡萄糖的检测利用氧化酶-过氧化酶试剂盒测定葡萄糖浓度。
1.3.4 总油脂提取将终培养液离心富集,转速为9 000r/min,时间为6min。湿细胞在-70℃下冷冻过夜,后进行抽真空冷冻干燥。添加干藻样品2倍质量的石英砂研磨20min后用氯仿-甲醇(2∶1,V/V)进行油脂提取,有机溶剂重复提取3次后收集有机相浓缩称重。

当存在其他因素(如其他底物、环境因素等)对细胞的生长有影响时,常在Monod模型的基础上进行相应的修改。由于存在其他底物对细胞生长的影响,本文用Monod模型的衍生形式Andrew方程来研究不同培养模式下,葡萄糖对藻细胞比生长速率的影响。
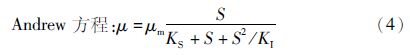
根据Yang等[7]在研究光合异养条件下Chlorella minutissimaUTEX2341细胞生长和油脂合成中建立的动力学模型,得出以下葡萄糖代谢动力学模型:
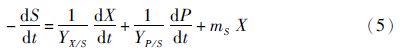
研究表明,产物的生产、生物量浓度(X)与细胞生长速率(dX/dt)具有线性关系。利用Luedeking-Piret方程描述产物的合成[8]。
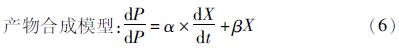
采用此模型对油脂含量的变化进行拟合,发现相关性较小,因此对模型(6)进行了修正得到

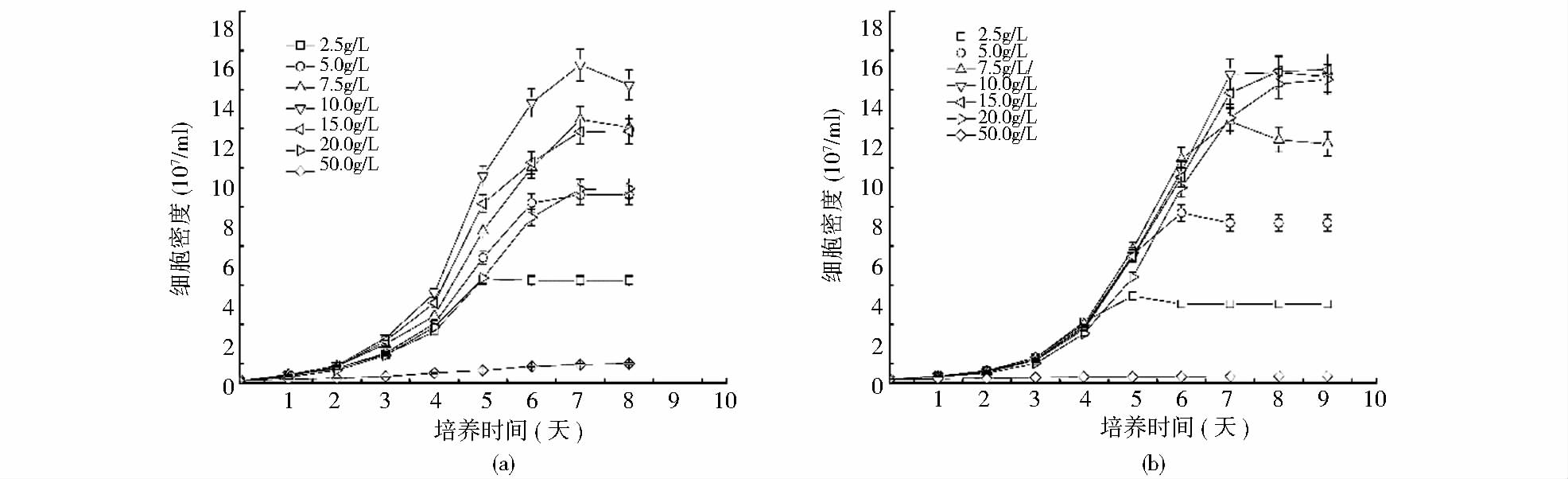
根据黄力等[9]的研究,单针藻Monoraphidium sp. FXY-10以甘油、蔗糖、果糖,乳糖及木糖醇作为唯一碳源,基本不生长。因此本文以葡萄糖作为兼养、异养培养条件下的唯一碳源,研究不同质量浓度的葡萄糖对单针藻细胞生长的影响。葡萄糖对单针藻Monoraphidium sp. FXY-10生长的影响表现出显著的浓度效应,藻细胞的生长随葡萄糖浓度的增加表现出先增加后下降的趋势(图 1)。葡萄糖浓度为2.5~10 g/L时,随着葡萄糖浓度的增大,藻细胞生长明显加快;当葡萄糖浓度为10g/L时,细胞密度达到最大值;继续增加葡萄糖浓度,藻细胞生长受到抑制。底物抑制在微生物的生长过程中普遍存在,Rai等[10]研究发现,当培养基中葡萄糖含量为5%~10%时小球藻的生长受到抑制;微藻利用有机碳时表现出的抑制作用在鞭金藻3011、三角褐指藻、绿色微囊藻等的研究中也得到了证实。本文发现,单针藻Monoraphidium sp. FXY-10利用葡萄糖时也表现出显著的浓度效应。
自养、异养、兼养是常用于微藻培养的3种方式。与自养培养相比,异养和兼养培养藻细胞生长快、周期短、油脂含量高、发酵条件易于控制,更适合于工业化生产[11, 12]。兼养、异养培养条件下,单针藻的生长具有相同的趋势,前3天处于延迟期,第3天后进入对数生长期,第7天后开始进入稳定期。与兼养培养相比,异养培养时,藻细胞的生长要落后于兼养培养,但是达到稳定期时,两者的最大生物量相近,Woodworth等[13]在碳源添加时光合作用增加Chlorella vulgaris总油脂的研究中也发现,兼养、异养培养时最大生物量相近,分别为9.4mg/ml、9.1mg/ml,与本实验结果一致。研究表明,不同的培养基组分和培养条件对藻细胞的生长和生物量的积累具有显著的影响[14]。Yang等[15]的研究表明不同的培养方式对藻细胞能源和碳源的代谢具有明显的影响。异养培养模式下,藻细胞通过吸收有机碳源来获得能源和碳源。兼养培养模式下,藻细胞固定CO2和吸收有机碳碳源同时进行光合作用和呼吸代谢。图 1表明,兼养较异养其细胞生长速率快,主要有是由于兼养培养条件下,由于光照的存在细胞能产生大量的ATP和NADPH,额外的ATP和NADPH的存在于细胞分裂之前,能够促进细胞的快速分裂和产生更多的生物量,从而导致兼养时的细胞比生长速率大于异养时的[13]。此外,兼养培养条件下可获得最高的细胞量,可能的机制是少量的外源性葡萄糖能够弥补培养基中CO2的不足,细胞在转化、利用碳源的过程中降低了对ATP和NADPH的消耗,从而促进藻细胞内产物的积累和细胞数目的增加[16]。
|
| 图 1 不同质量浓度的葡萄糖对兼养(a)、异养(b)培养模式下单针藻Monoraphidium sp. FXY-10生长的影响 Fig. 1 The growth curve of Monoraphidium sp. FXY-10 under mixotrophic (a) and heterotophic (b) cultures with different concentrations glucose |
采用SPSS软件对式(1)、式(4)所得数据进行了回归分析,根据分析结果得出回归方程及相关参数,根据回归方程,计算出单针藻在不同培养条件下和不同质量浓度葡萄糖限制条件下的最大生长速率及半饱和常数(表 1)。
| 培养方式 | 回归方程 | 显著性检验 | μmax (/d) | KS (g/L) | KI(g/L) |
| 异养 | 1/μ=5.416/S+0.146S-0.304 | R2=0.961 | 3.289 | 17.815 | 2.082 |
| 兼养 | 1/μ=1.649/S+0.055S+0.875 | R2=0.962 | 1.183 | 1.885 | 15.909 |
藻体的μm/2越大、KS越小,该营养盐环境越适合藻的生长[6]。由表 1可知,异养培养时,单针藻的最大比生长速率是兼养培养时的2.78倍,KS是兼养培养的9.45倍;然而,兼养培养时的底物抑制KI是异养培养的7.64倍。说明异养模式下,单针藻比生长速率达到μm/2所需的葡萄糖浓度大于兼养培养模式下单针藻比生长速率达到μm/2所需的葡萄糖浓度。
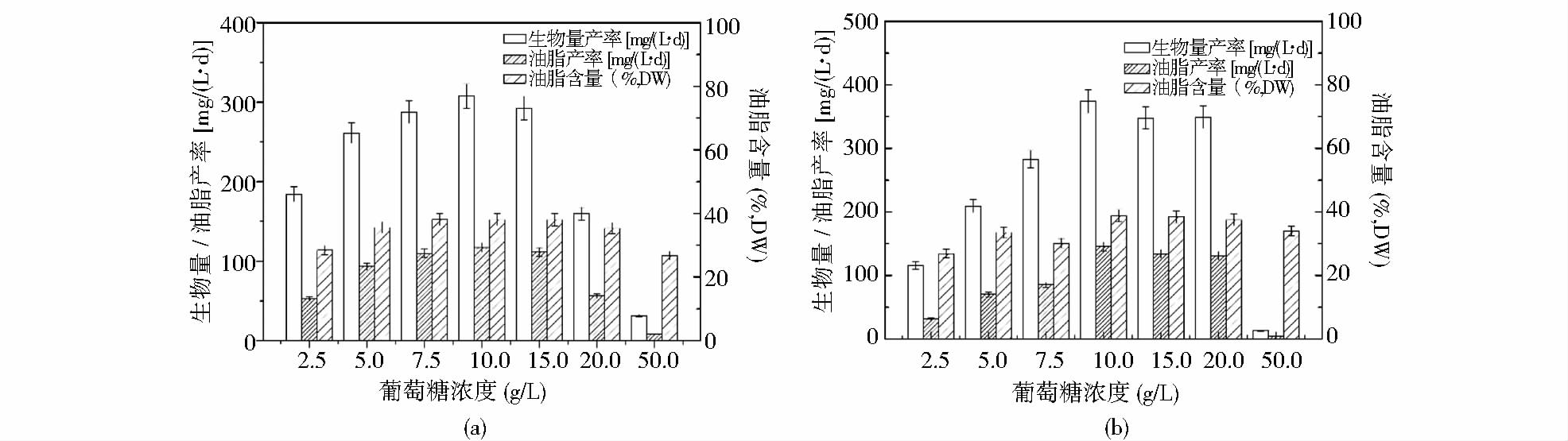
2.3 兼养、异养培养条件下,葡萄糖对油脂合成的影响兼养、异养培养条件下,不同浓度的葡萄糖对微藻生物量产率、油脂产率和油脂含量的影响如图 2所示。
|
| 图 2 葡萄糖对兼养(a)、异养(b)培养条件下单针藻Monoraphidium sp. FXY-10生物量产率、油脂产率和油脂组成的影响 Fig. 2 Effects of different glucoseconcentrations on the biomass productivity,lipid productivity and lipid content of Monoraphidium sp. FXY-10 under mixotrophic (a) and heterotrophic (b) cultures |
由图 2可以看出,在兼养、异养培养条件下,葡萄糖浓度对生物量产率、油脂产率和油脂含量都有明显的影响。葡萄糖对单针藻生物量产率、油脂产率和油脂含量的影响表现出先促进后抑制的浓度效应。Lin和Wu[4]在兼养培养条件下碳源对微藻生长和油脂积累影响的研究中发现也存在类似的现象。葡萄糖初始浓度为2.5~10g/L时,随着葡萄糖浓度的增加,生物量产率、油脂产率、油脂含量不断增加。当葡萄糖浓度为10g/L时,生物量产率、油脂产率、总油脂达到最大值,分别为307.73mg/(L· d)、117.16mg/(L· d)、38.07%(兼养),374.07mg/(L· d)、145.18mg/(L· d)、38.81%(异养)。进一步提高葡萄糖的初始浓度,单针藻Monoraphidium sp. FXY-10的生物量产率、油脂产率和油脂含量明显减少。
大量研究发现,培养基中有机碳源的添加有利于微藻细胞内油脂含量的积累。这可能是由于有机碳源的添加能导致乙酰辅酶A和丙二酰辅酶A增加,增加了油脂合成的前体,从而增加细胞内油脂的含量[17]。Yu等[18]的研究指出,单针藻Monoraphidium sp. FXY-10在自养培养时的油脂产率为6.88mg/(L· d),与自养培养相比,兼养和异养培养条件下单针藻的油脂产率明显提高。进一步的比较发现,异养培养模式下单针藻的油脂产率大于兼养培养条件下的,Heredia-Arroyo等[19]在小球藻属的研究中发现有相似的现象。但Woodworth等[13]认为,小球藻属兼养培养的油脂积累量约为异养培养的2倍,这可能是由于藻种不同所致。本研究表明,就产物产率和成本而言,单针藻Monoraphidium sp. FXY-10更适合于异养发酵培养。
2.4 兼养、异养培养条件下葡萄糖代谢与产物合成的关系根据式(5)、式(6)对实验数据进行拟合,分别得到兼养、异养培养条件下葡萄糖消耗和油脂合成动力学模型。
兼养培养条件下油脂生成的动力学模型:
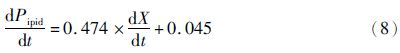
积分得
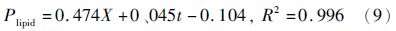
葡萄糖消耗动力学模型:
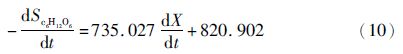
积分得
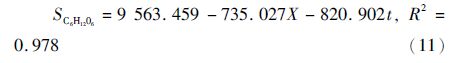
异养培养条件下油脂生成的动力学模型:
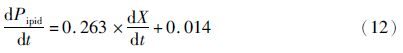
积分得
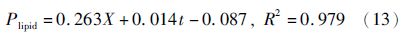
葡萄糖消耗动力学模型:
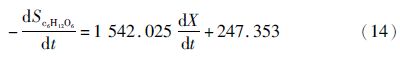
积分得
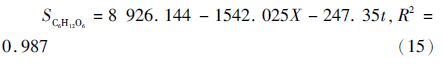
上述模型能较好的拟合兼养、异养培养条件下藻细胞油脂积累和培养基中葡萄糖变化的趋势。图 3表明,培养开始的2天葡萄糖消耗速率较小,可能是由于藻细胞处于延迟期。与兼养培养相比,异养培养前期藻细胞的生长缓慢,前4天葡萄糖的消耗速率较小,此时藻细胞的油脂含量较少。随后,葡萄糖的消耗速率不断增大,藻细胞内的油脂含量不断增加;至第9天时葡萄糖完全消耗,藻细胞内的油脂含量达到最大。模型中计算得出生物量对葡萄糖的得率系数分别为1.36g/g(兼养)、0.63g/g(异养),说明兼养条件下葡萄糖浓度的变化对藻细胞生长的影响较为显著。此外,兼养培养条件下葡萄糖的消耗速率明显大于异养培养条件下的,其油脂含量也远大于异养培养。可能的机制是不同的培养方式下,藻细胞的葡萄碳代谢存在一定的差异。异养培养条件下,葡萄糖的代谢主要是通过磷酸戊糖途径;兼养培养条件下,葡萄糖的降解主要是通过糖酵解途径,从而导致其葡萄糖的分解、吸收效率不同[20]。另外,兼养培养条件下藻细胞通过异养分解代谢葡萄糖为其生长提供能量,而分解代谢产生的CO2增加了油脂合成的有效碳源,并能够刺激藻细胞的光合作用。同时,油脂含量的增加依赖于光照强度及光合作用中光反应阶段提供的ATP和NADPH。因此,额外有效碳源的固定和光照可能是导致兼养培养条件下其油脂含量大于异养培养条件下的原因之一[21]。质体是油脂合成的主要场所,乙酰辅酶A羧化酶(ACCase)是油脂合成的关键限速酶,Sasaki等[22]研究发现,质体中ACCase能够被光合作用产生的氧化还原电位激活。这也可能是导致兼养培养条件下其油脂含量大于异养培养的原因之一。
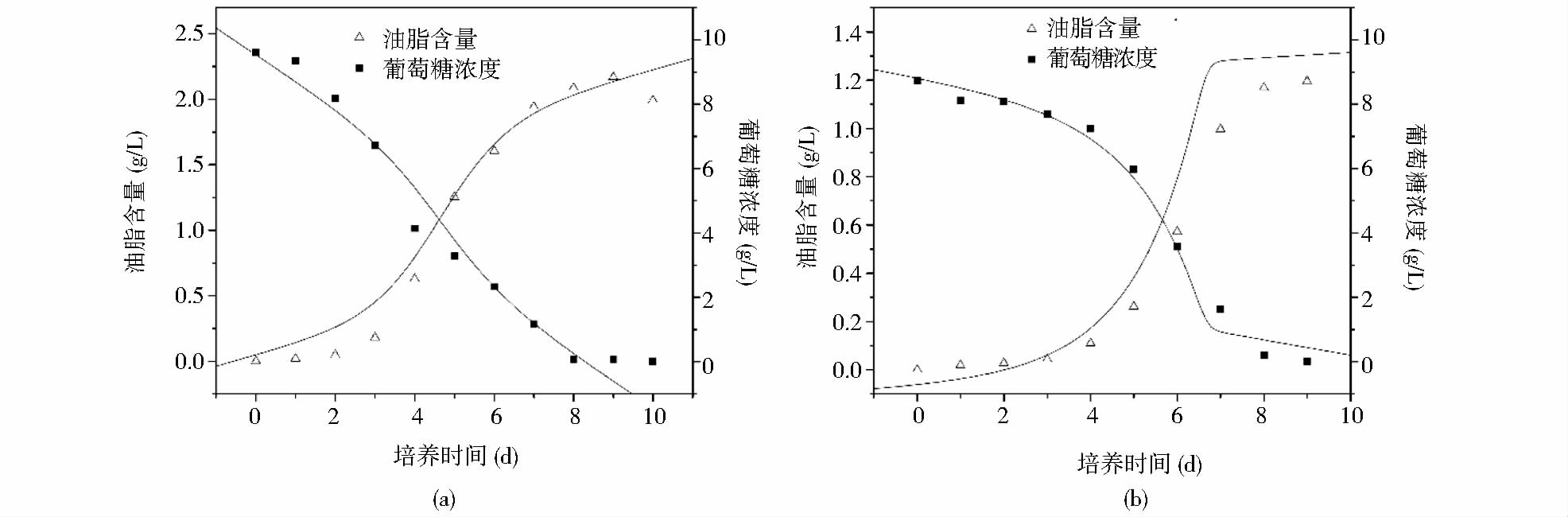
|
| 图 3 异养、兼养条件下,单针藻Monoraphidium sp. FXY-10油脂合成和葡萄糖浓度的变化曲线 Fig. 3 The variation curve of lipid synthesis and glucose consumption of Monoraphidium sp. FXY-10 in the heterotrophic and mixotrophic conditions. |
兼养、异养培养是工业上常用于微藻培养的方式。本文研究了不同质量浓度的葡萄糖对单针藻Monoraphidium sp. FXY-10生长的影响和油脂合成的影响。结果表明,葡萄糖浓度为10g/L时,兼养、异养培养的藻细胞量、油脂产率达到最大值。Andrew模型能够较好地反映兼养、异养培养条件下葡萄糖对单针藻细胞生长的影响,并得出兼养、异养培养时单针藻对葡萄糖的半饱和常数分别为KSY=17.82g/L,KSJ=1.89g/ L,且KSY>KSJ,说明兼养培养时单针藻对葡萄糖的吸收能力相对较高。所建立的兼养、异养培养方式中油脂合成和葡萄糖消耗的动力学模型,可为微藻放大生产提供参考。
| [1] | Chen C Y, Yeh K L, Aisyah R, et al. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: a critical review. Bioresource Technology, 2011, 102(1): 71-81. |
| [2] | Wang J, Yang H, Wang F. Mixotrophic cultivation of microalgae for biodiesel production: status and prospects. Applied Biochemistry and Biotechnology, 2014, 172(7): 3307-3329. |
| [3] | Zhao G L, Yu J Y, Jiang F F, et al. The effect of different trophic modes on lipid accumulation of Scenedesmus quadricauda. Bioresource Technology, 2012, 114(3): 466-471. |
| [4] | Lin T S, Wu J Y. Effect of carbon sources on growth and lipid accumulation of newly isolated microalgae cultured under mixotrophic condition. Bioresource Technology, 2015,184:100-107. |
| [5] | Cheng Y, Lu Y, Gao C, et al. Alga-based biodiesel production and optimization using sugar cane as the feedstock. Energy & Fuels, 2009, 23(8): 4166-4173. |
| [6] | 王琳, 余旭亚, 徐军伟. 氮, 磷对单针藻兼养生长与油脂合成的影响. 化学工程, 2013, 41(2): 1-5. Wang L, Yu X Y, Xu J W. Effects of nitrogen and phosphorus on growth and lipid synthesis of Monoraphidium sp. under mixotrophic cultivation. Chemical Engineering, 2013, 41(2): 1-5. |
| [7] | Yang J S, Rasa E, Tantayotai P, et al. Mathematical model of Chlorella minutissima UTEX2341 growth and lipid production under photoheterotrophic fermentation conditions. Bioresource Technology, 2011, 102(3): 3077-3082. |
| [8] | Liu J Z, Weng L P, Zhang Q L, et al. A mathematical model for gluconic acid fermentation by Aspergillus niger. Biochemical Engineering Journal, 2003, 14(2): 137-141. |
| [9] | 黄力, 贺赐安, 赵鹏, 等. 碳源, 氮源对异养单针藻Monoraphidium sp. FXY-10 油脂积累和脂肪酸组成的影响. 中国生物工程杂志, 2013, 33(2): 59-64. Huang L, He C A, Zhao P, et al. Effect of carbon, nitrogen sources on lipid accumulation and fatty acid composition of Monoraphidium sp. FXY-10 under Heterotrophic Cultivation. China Biotechnology, 2013, 33(2):59-64. |
| [10] | Rai M P, Nigam S, Sharma R. Response of growth and fatty acid compositions of Chlorella pyrenoidosa under mixotrophic cultivation with acetate and glycerol for bioenergy application. Biomass and Bioenergy, 2013, 58: 251-257. |
| [11] | Miao X, Wu Q. High yield bio-oil production from fast pyrolysis by metabolic controlling of Chlorella protothecoides. Journal of Biotechnology, 2004, 110(1): 85-93. |
| [12] | Garcí M C C, Sevilla J M F, Fernández F G A, et al. Mixotrophic growth of Phaeodactylum tricornutum on glycerol: growth rate and fatty acid profile. Journal of Applied Phycology, 2000, 12(3-5): 239-248. |
| [13] | Woodworth B D, Mead R L, Nichols C N, et al. Photosynthetic light reactions increase total lipid accumulation in carbon-supplemented batch cultures of Chlorella vulgaris. Bioresource Technology, 2015, 179: 159-164. |
| [14] | Yeh K L, Chang J S. Effects of cultivation conditions and media composition on cell growth and lipid productivity of indigenous microalga Chlorella vulgaris ESP-31. Bioresource Technology, 2012, 105: 120-127. |
| [15] | Yang C, Hua Q, Shimizu K. Energetics and carbon metabolism during growth of microalgal cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions. Biochemical Engineering Journal, 2000, 6(2): 87-102. |
| [16] | 赫冬梅, 王娜, 孙凯峰, 等. 葡萄糖和乙酸钠对湛江等鞭金藻兼养生长的影响. 生态科学, 2012, 31(2): 220-223. He D M, Wang N, Sun K F, et al. Effect of glucose and sodium acetate on mixtrophic growth of Isochrysis zhanjiangensis. Ecological Science, 2012,31(2): 220-223. |
| [17] | Ngangkham M, Ratha S K, Prasanna R, et al. Biochemical modulation of growth, lipid quality and productivity in mixotrophic cultures of Chlorella sorokiniana. Springer Plus, 2012, 1(3): 33. |
| [18] | Yu X, Zhao P, He C, et al. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresource Technology, 2012, 121: 256-262. |
| [19] | Heredia-Arroyo T, Wei W, Ruan R, et al. Mixotrophic cultivation of Chlorella vulgaris and its potential application for the oil accumulation from non-sugar materials. Biomass and Bioenergy, 2011, 35(5): 2245-2253. |
| [20] | Perez-Garcia O, Escalante F M E, de-Bashan L E, et al. Heterotrophic cultures of microalgae: metabolism and potential products. Water Research, 2011, 45(1): 11-36. |
| [21] | Li T, Zheng Y, Yu L, et al. Mixotrophic cultivation of a Chlorella sorokiniana strain for enhanced biomass and lipid production. Biomass and Bioenergy, 2014, 66: 204-213. |
| [22] | Sasaki Y, Kozaki A, Hatano M. Link between light and fatty acid synthesis: thioredoxin-linked reductive activation of plastidic acetyl-CoA carboxylase. Proceedings of the National Academy of Sciences, 1997, 94(20): 11096-11101. |
 2015, Vol. 35
2015, Vol. 35




