文章信息
- 易学瑞, 袁有成, 龚亮, 张欣蕊, 李娜, 孔祥平
- YI Xue-rui, YUAN You-cheng, GONG Liang, ZHANG Xin-rui, LI Na, KONG Xiang-ping
- 8种天然药物与硼替佐米对HBsAg抑制作用及蛋白质组学分析
- The Inhibition of HBsAg of Natural Compounds and Bortezomib on Primary Hepatocytes of HBV-Tg Mice and the Proteome Analysis
- 中国生物工程杂志, 2015, 35(11): 29-35
- China Biotechnology, 2015, 35(11): 29-35
- http://dx.doi.org/10.13523/j.cb.20151105
-
文章历史
- 收稿日期: 2015-08-10
- 修回日期: 2015-10-09
2. 天津医科大学第二医院 天津 300211;
3. 青海省人民医院 西宁 810007
2. The Department of Infection & Immunity of No.2 Hospital, Tianjin Medical University, Tianjin 300211, China;
3. The Health Deptartment of People's Hospital of Qinhai Province, Xining 810007, China
针对乙型肝炎病毒逆转录酶的抑制剂虽然能有效抑制病毒复制,但是耐药使得乙肝治疗依然面临严峻挑战[1]。寻找参与病毒生活史的宿主细胞蛋白,改变病毒生存环境成为新的抗病毒研究策略[1, 2, 3, 4]。前期我们利用建立的HBV转基因小鼠原代肝细胞观察到一种蛋白酶体抑制剂——硼替佐米体外对HBV有抑制作用[5]。推测可能与改变细胞内蛋白质有关。本文选择了可能调节细胞内蛋白质的几种药物,有的具有蛋白酶体抑制剂活性,有的可能参与宿主热休克蛋白调节。利用HBV-Tg小鼠原代肝细胞模型观察其对HBV的抑制作用。同时进一步研究硼替佐米对HBV小鼠的原代肝细胞作用的蛋白质组学,分析对HBV作用的分子机制。该体外研究模型的建立与深入的机制研究将为中药复方的多靶点抗乙肝病毒治疗研究提供新的研究思路。
1 材料与方法 1.1 材 料 1.1.1 药物硼替佐米购自天津博奥新公司;青蒿素、EGCG、扁蒴藤素、紫草素、藤黄酸、槲皮素、姜黄素购自广州牌牌生物科技有限公司;茶碱购自Sigma公司;EGCG和茶碱直接溶于DMEM(含10%FBS),过滤除菌,其他药物溶于DMSO,溶解成10mmol/L后储存于-20℃,临用时用DMEM(含10%FBS)培养基稀释至所需浓度。
1.1.2 主要试剂仪器逆转录试剂盒购自TaKaRa公司,ELX800酶标仪购自美国Bio-Tek公司;IPGphor等电聚焦仪(Pharmacia Biotech);Protean II 电泳仪(Bio-Rad);GS-800分子成像仪(Bio-Rad);串联飞行时间质谱仪[4700 Proteomics Analyzer (TOF/TOFTM) (Applied Biosystems,USA)]。PCR引物:HSP60上游:5′-AGTCC TTCGCCAGATGAG-3′;HSP60下游:5′-GTCTACACCTTGAAGCATTAAG-3′。HSP70上游:5′-G ATGAAGGAGATCGC TGAG-3′。HSP70下游:5′-CTGAGAGTCG TTGAAGTAGG-3′。HSP90上游:5′-C ACTCCAACCGCATCTACC-3′;HSP90下游:5′-GCATCCTCATCGCCTTCC-3′。GAPDH上游:5′-TCACTCAAGATTGTCAGC AATGC-3′;GAPDH下游:5′-TCATGAGCCCTTC CACAATG-3′。
1.1.3 实验动物SPF级Balb/c背景的HBV-Tg小鼠[解放军第四五八医院全军肝病中心,生产许可证号为SCSK(军)2012-0018],25只,6~8周,雄性。
1.2 方 法 1.2.1 药物对HBV-Tg小鼠原代肝细胞的毒性作用HBV-Tg小鼠原代肝细胞的分离纯化及培养参考文献[5],按8×107/L接种于明胶包被的96孔板,100μl/孔,37℃ 5% CO2培养箱培养24h,细胞贴壁后,换用含紫草素、藤黄酸、槲皮素、姜黄素、硼替佐米、青蒿素、EGCG、扁蒴藤素、茶碱各250μmol/L、50μmol/L、10μmol/L、2μmol/L、0.4μmol/L的培养基100μl,每浓度设6复孔,同时设空白对照组,继续培养24h,常规MTT法分别检测药物对细胞的A570nm,并计算各组的平均抑制率,确定最大无毒剂量,实验重复3次。
1.2.2 药物对HBV-Tg小鼠原代肝细胞HBsAg的抑制作用细胞准备同上,培养24h,换用含250μmol/L药物(扁蒴藤素为2μmol/L)的培养基100μl,每药设6复孔,继续培养24h,收集培养上清液,测HBsAg水平。对HBsAg有明显抑制作用的药物进行量效关系实验,重复3次。
1.2.3 硼替佐米作用HBV-Tg小鼠原代肝细胞蛋白质组学研究细胞准备细胞按8×107/L接种于明胶包被的培养皿(直径15cm),50ml/皿,37℃ 5% CO2培养24h,贴壁后,换用含1μmol/L硼替佐米的DMEM(含10%FBS)培养基,同时设空白对照,继续培养24h,收集细胞。
1.2.4 蛋白质组学分析细胞蛋白质的提取和定量参考文献[6, 7],双向凝胶电泳、凝胶染色和图像采集分析、胶上快速银染的蛋白质点酶解和MALDI-TOF-TOF MS鉴定参考文献[8]。
1.2.5 硼替佐米对热休克蛋白的影响HBV-Tg小鼠原代肝细胞按8×107/L接种于明胶包被的细胞培养瓶,15ml/瓶,37℃ 5% CO2培养箱培养24h,换用含1μmol/L硼替佐米的DMEM(含10%FBS)培养基,同时设空白对照,继续培养9h,收集细胞,提取总RNA,RT-PCR法检测HSP60、HSP70和HSP90的表达。用逆转录试剂盒合成cDNA。分别取5μl cDNA作为模板进行PCR反应,反应条件:93℃ 3min,93℃ 45s,55℃ 1min,共40个循环。同法准备细胞,1μmol/L硼替佐米作用6h和24h,以Balb/C小鼠原代肝细胞1μmol/L硼替佐米作用前和作用24h 为对照,分别裂解细胞West blot法检测HSP60。
1.2.6 EGCG对HSP90的影响将HBV-Tg小鼠原代肝细胞(8×107/L)接种于明胶包被的6孔板,2ml/孔,37℃ 5% CO2培养箱培养24h,换用含10μmol/L、50μmol/L、250μmol/L EGCG的DMEM(含10%FBS)培养基,同时设空白对照,继续培养9h,裂解细胞,West blot检测HSP90。
2 结 果 2.1 8种天然药物对原代肝细胞的毒性青蒿素、EGCG、茶碱、紫草素、藤黄酸、槲皮素、姜黄素的最大无毒浓度均大于250μmol/L,而扁蒴藤素毒性较大,最大无毒浓度仅为2μmol/L。
2.2 8种天然药物对HBsAg抑制作用在250μmol/L的无毒剂量下茶碱、紫草素和槲皮素,对HBsAg无抑制作用,青蒿素、EGCG、藤黄酸和姜黄素的抑制率分别为36.4%、78.5%、83.5%和79.5%。在4种药物的量效关系研究中,只有EGCG的明显,IC50=24.9μmol/L。虽然扁蒴藤素毒性较大,但是在最大无毒浓度以下却也有非常明显的量效关系,IC50=0.43μmol/L。硼替佐米作为阳性对照药物,在1.0μmol/L对HBsAg的抑制率为50%。
2.3 硼替佐米作用与对照的细胞2-DE 图谱对比分析将硼替佐米作用后的原代肝细胞与对照细胞提取的蛋白质分别做双向电泳,重复3次,一致性较好(图 1)。
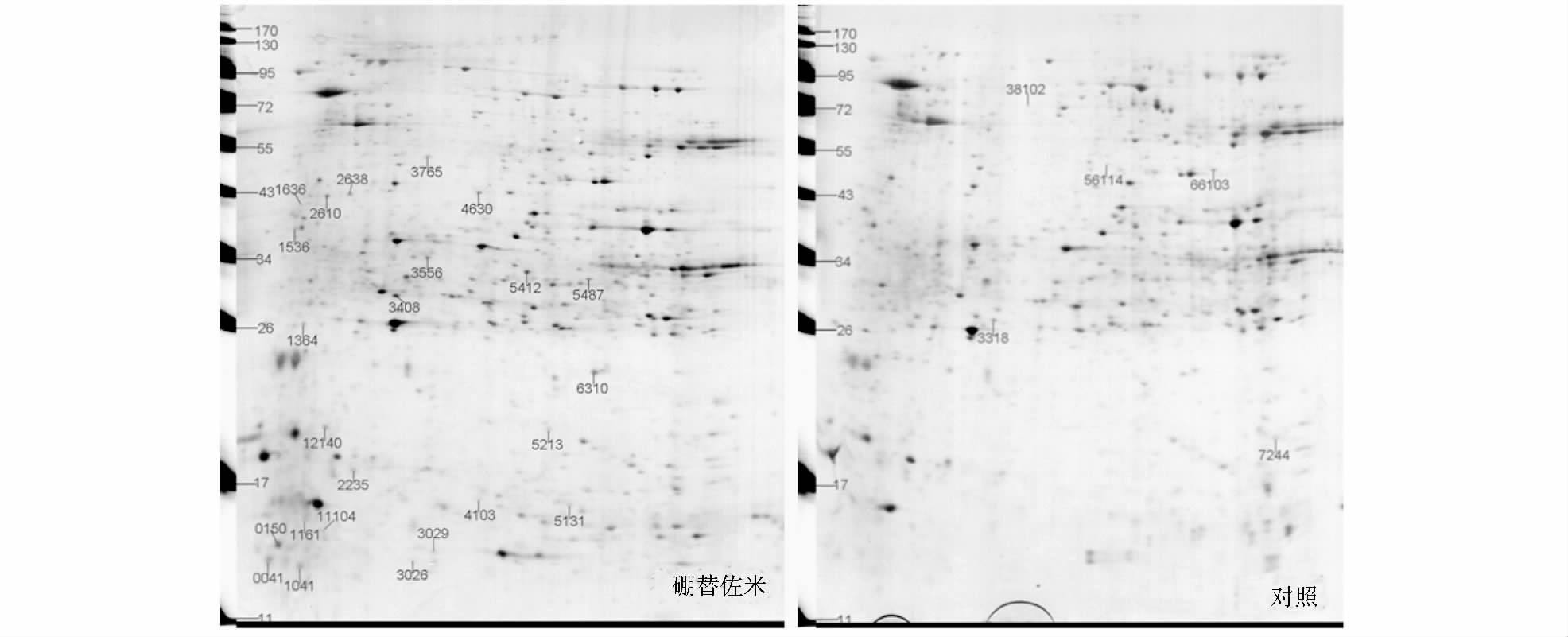
|
| 图 1 硼替佐米处理与对照细胞蛋白质2-DE图谱 Fig. 1 The 2-DE protein maps of bortezomib treated and control cells |
分析发现有21个差异点有代表性(表 1)。其中,与氧化还原酶活性相关的7个、结合活性的有2个、转移酶活性的有2个、合成酶活性的2个、分泌活性的有1个,其它类的7个。其中Arg1是肝细胞一个敏感性和特异性的标记物,可用于肝细胞癌的区分[9],体现出本文使用的细胞来源于原代肝细胞的特点。
| 分子功能 | 点序号 | 蛋白质名称 | 蛋白质主要功能 | 变化 |
| 氧化还原酶活性 | 1161 | 线粒体异柠檬酸脱氢酶 2 (NADP+) | 线粒体异柠檬酸脱氢酶 | 是① |
| 3765 | 异柠檬酸脱氢酶 3 (NAD+) alpha | 异柠檬酸脱氢酶 | 上调② | |
| 5213 | 电子传递性黄素蛋白α多肽 | 电子传递性 | 上调 | |
| 5412 | 活性脱氢酶4α1蛋白 | 乙醛脱氢酶 | 上调 | |
| 6310 | 过氧化氢酶 | 过氧化物酶活性 | 上调 | |
| 5487 | 丙氨酸脱氢酶激酶3 | 丙氨酸脱氢酶激酶 | 是 | |
| 11104 | 羟酰辅酶A脱氢酶 | 羟酰辅酶A脱氢酶 | 是 | |
| 结合活性 | 3026 | 微管微丝交联因子1 | 肌动蛋白、钙离子、微管结合蛋白 | 是 |
| 38102 | 60kDa热休克蛋白 | 与ATP结合、与未折叠蛋白结合 | 否③ | |
| 转移酶活性 | 0041 | 胆酰基辅酶A、氨基酸乙酰基转移酶 | 酰基转移酶活性 | 上调 |
| 2235 | 乙酰辅酶A酰基转移酶 | 酰基转移酶活性 | 上调 | |
| 合成酶活性 | 3556 | ATP合成酶γ亚基 | ATP合成酶 | 上调 |
| 3318 | 线粒体ATP合成酶,H+ transporting | ATP合成酶 | ||
| F1complex beta subunit | 否 | |||
| 分泌活性 | 2638 | 胞吐复合体 | 分泌蛋白活性 | 上调 |
| 其它类 | 1536 | 原肌球蛋白α1链 | 是 | |
| 2610 | 重复性丝氨酸/精氨酸基质蛋白-2 | 是 | ||
| 3408 | 同源蛋白[NADH脱氢酶(泛醌黄素蛋白2)] | 是 | ||
| 4103 | 同源蛋白[细胞色素c氧化酶亚单位5β] | 是 | ||
| 7244 | 谷氨酸脱氢酶 | 否 | ||
| 56114 | 同源蛋白[28S核糖体蛋白S22(线粒体)] | 否 | ||
| 66103 | 精氨酸酶1 | 否 | ||
| Note: ①New appeared proteins in HBV-Tg mice treated with bortezomib; ②The abundance of proteins in HBV-Tg mice treated with bortezomib is higher than that untreated; ③Disappeared proteins in HBV-Tg mice treated with bortezomib | ||||
HBV-Tg鼠原代肝细胞经1μmol/L硼替佐米作用9h,RT-PCR结果显示 HSP60为对照组的0.49倍,HSP70为对照组的4.30倍,HSP90为对照组的0.44倍[图 2(a)]。
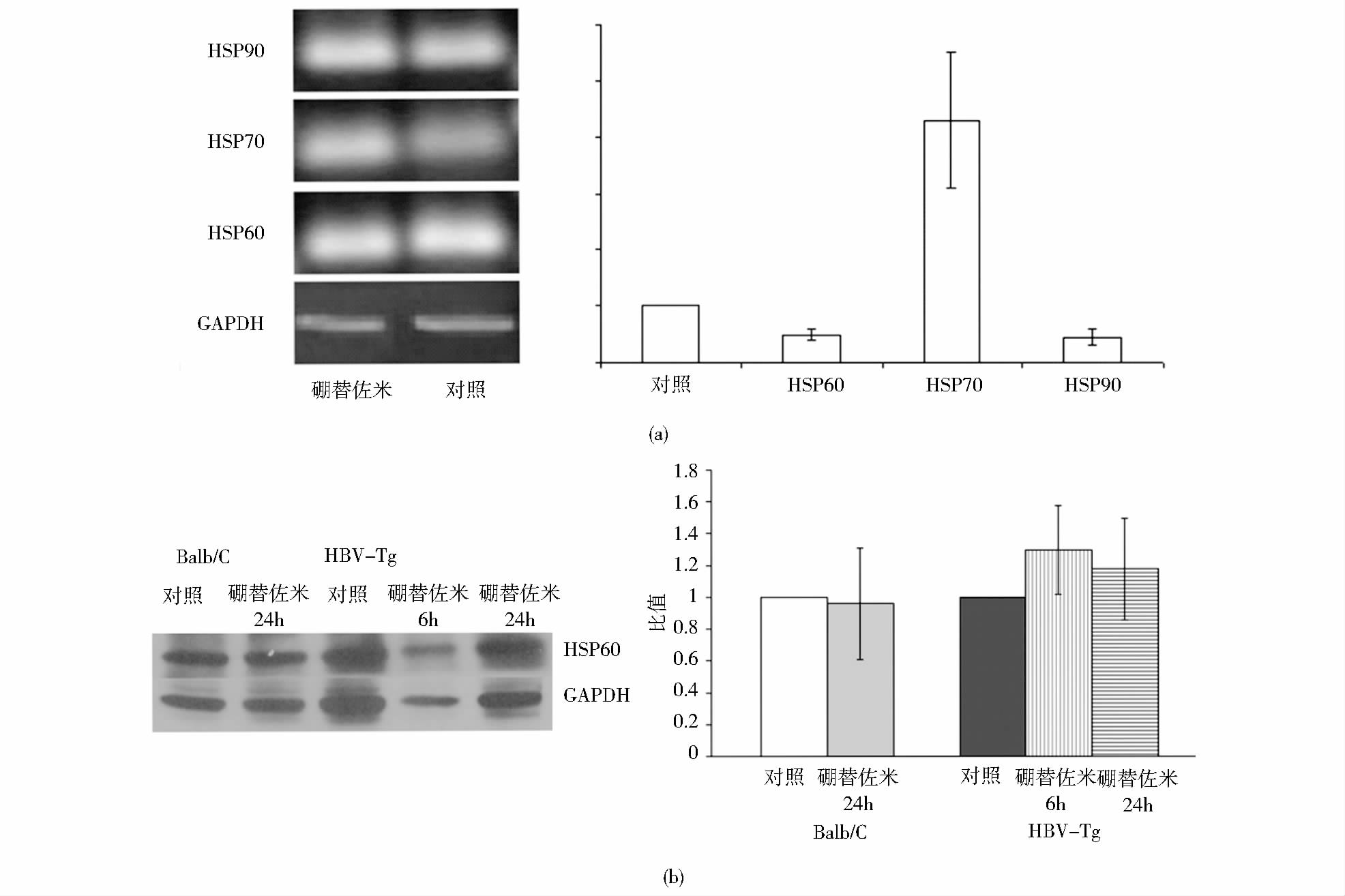
|
| 图 2 硼替佐米处理HBV-Tg小鼠原代肝细胞对热休克蛋白基因表达的影响 Fig. 2 The effect on the expression of heat shock protein gene after treated with bortezomib on primary hepatocytes of HBV-Tg mice (a) The result of RT-PCR (b) The result of West blot(HSP60) |
根据以上差异点的分析,选择与以往报道 [1, 10, 11]抗HBV相关性较强的HSP60、HSP70、HSP90,深入分析与硼替佐米的关系。RT-PCR结果表明经过硼替佐米处理后HSP60和HSP90都略有下降,而HSP70则表达增加,与文献报道一致[12]。但West blot进一步分析表明硼替佐米处理后对HSP60影响不大。
2.6 EGCG对HSP90的影响EGCG有多种生物学活性,包括在肝癌细胞株中的抗HBV的功能[13]和通过抑制HSP90的抗癌活性[14]。与癌细胞株不同,本文在原代肝细胞中观察到其对HBsAg的抑制作用,且随着药物浓度的增加对HBsAg的抑制作用逐渐增强,同时HSP90的表达逐渐降低,显示EGCG对HBsAg的抑制与HSP90表达下调的高度一致,且量效关系明显(图 3)。但究竟HSP90的下调与HBsAg的减少有何因果关系还需要深入研究。
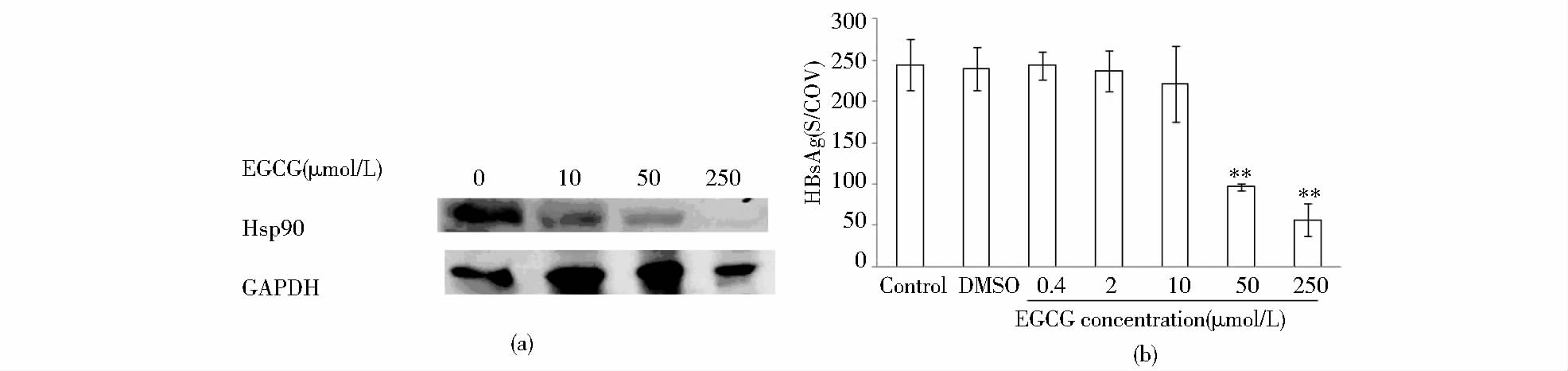
|
| 图 3 EGCG处理HBV-Tg小鼠原代肝细胞对HSP90基因表达的影响 Fig. 3 The effect on the expression of heat shock protein 90 gene after treated with EGCG on primary hepatocytes of HBV-Tg mice(a) West blot (b) The inhibition of HBsAg ** vs control P<0.01 |
EGCG在10~250μmol/L时,对HBsAg的抑制作用量效关系明显[图 3(a)],West blot结果表明,随着EGCG的浓度增高对HSP90的抑制明显增强,与对HBsAg的抑制作用是一致的。
3 讨 论针对宿主细胞蛋白抗乙肝病毒研究的新策略最近获得突破性进展,cIAPs的抑制剂表现出较好的抗HBV功能[15, 16],已经进入临床研究。本文利用HBV-Tg小鼠原代肝细胞,以硼替佐米作为阳性对照药物,观察几种天然药物的抗HBV活性。具有蛋白酶体抑制剂活性的天然药物,如藤黄酸[17]、紫草素[18]、扁素藤素[19]和EGCG[20]。具有热休克蛋白抑制剂活性的天然药物,如槲皮素[21]、EGCG[14]和茶碱、姜黄素[22]。其中EGCG同时具有蛋白酶体抑制剂和热休克蛋白抑制剂活性。
结果表明,EGCG表现出较好的安全性与抗HBsAg活性,虽然扁素藤素抗HBV活性的药物剂量相当于硼替佐米,但是毒性较大。而其它同样具有蛋白酶体抑制剂活性的紫草素,以及具有热休克蛋白抑制剂活性的槲皮素都没有显示出抗HBV活性。茶碱虽然是EGCG的类似物,却无抗HBV活性。提示该体外抗病毒研究模型可以用于中药复方的多组分、多靶点的抗乙肝抗病毒治疗探索研究。
为了深入研究该体外细胞模型的抗病毒分子机制,利用蛋白质组学比较了硼替佐米作用后HBV-Tg小鼠原代肝细胞的蛋白质组变化。结果表明,药物对HBsAg的抑制主要涉及氧化还原酶、结合、转移酶、合成酶和分泌等活性,这与以往比较HBV-Tg小鼠与正常小鼠的肝细胞蛋白质组学结果类似[23]。进一步分析发现HSP60、HSP70、HSP90可能是抗HBV潜在的靶点,与报道一致[10, 11]。
RT-PCR分析结果表明经过硼替佐米处理后HSP60和HSP90的表达都略有下降,而HSP70的表达则增加。但West blot分析表明硼替佐米对HSP60影响不大,与蛋白质组学分析结果不相符。经与原始蛋白质组数据分析后表明,差异点(38102)可能是一个未知功能的蛋白质:gi/26353954,与HSP60高度同源,只有一个氨基酸的差异,即第364位的谷氨酸代替了HSP60中的赖氨酸。虽然只有一个氨基酸的差异,但是由酸性氨基酸代替碱性氨基酸可能会对蛋白质的空间构象与功能产生很大影响[24]。由于HSP60的形成比较复杂,涉及HSP70和HSP10[25],关于HSP60与HBV的关系有待于深入研究[26]。
然而,从EGCG作用后West blot发现HSP90表达下降与抗HBV的活性是一致的,表明该细胞模型抗HBV的靶点可能与热休克蛋白相关。与以前报道的EGCG可以阻止硼替佐米的抗癌作用机制不同[27],在HBV-Tg小鼠原代肝细胞模型中,EGCG可以增强硼替佐米的抗HBV作用(另文发表),可能是因为通过HSP90影响了核衣壳的稳定性,从而影响了HBV的形成[28]。
由于原代肝细胞富含重要的药物代谢酶(P450),因此,在抗HBV药物体外研究时明显优于癌系的HepG 2.2.15 细胞系[5]。例如,氧化苦参碱在HepaG2.2.15细胞中表现为抗HBV作用,并把抑制HSP70作为潜在的药靶[1],而本文在用原代肝细胞观察到的抗HBV作用是上调HSP70,与上述观点矛盾。同时最新总结的大量临床研究表明,氧化苦参碱对慢性乙肝的治疗作用有限,且毒性不确定[29]。
当然深入的体内研究更为重要,我们在已经建立的复制型 HBV转基因小鼠[30]的基础上,经过进一步改造出年龄依赖的新型HBV耐受小鼠模型[31],以及肠道菌群[32]对HBV调节的HBV小鼠模型。相信系列的HBV小鼠模型与体外模型能为抗乙肝病毒药物研究提供更多有利条件。祖国传统医学中的中药抗HBV作用研究有很好的基础,如何进一步走向世界?结合系统生物学与组合化学的原理,在已知探明的众多抗HBV药物靶点的基础上[33],如何探讨中药复方抗乙肝病毒的可行性?可能需要我们做出更多被国际学术界接受的成果。
致谢 蛋白质组学研究的相关实验在上海复旦生物医学研究院完成,其中金红教授给予很多有益的指导,特此感谢。
| [1] | Wang Y P,Liu F,He H W,et al. Heat stress cognate 70 host protein as a potential drug target against drug resistance in hepatitis B virus.Antimicrob Agents CH,2010,54(2):2070. |
| [2] | Peng Z G, Fan B, Du N N,et al. Small molecular compounds that inhibit hepatitis C virus replication through destabilizing heat shock cognate 70 messenger RNA. Hepatology, 2010,52(3):845. |
| [3] | Gulick R M,Lalezari J, Goodrich J,et al.Maraviroc for previously treated patients with R5 HIV-1 infection.N Engl J Med,2008,359(14):1429 . |
| [4] | Phillips S, Chokshi S, Chatterji U, et al. Alisporivir inhibition of hepatocyte cyclophilins reduces HBV replication and hepatitis B surface antigen production. Gastroenterology, 2015,148(2):403. |
| [5] | 易学瑞,袁有成,陈阳述,等.硼替佐米对转基因小鼠原代肝细胞HBV的抑制作用.中国药理学通报,2011,27(5):614-617. Yi X R,Yuan Y C,Chen Y S,et al. Bortezomib inhibits hepatitis B virus replication on primary hepatocytes of HBV transgenic mice. Chinese Pharmacological Bulletin,2011, 27(5):614-617. |
| [6] | 夏其昌,曾嵘. 蛋白质化学与蛋白质组学.北京:科学出版社,2004. Xia Q C, Zeng R. Protein Chemistry and Proteomics. Beijing:Beijing Science Press,2004. |
| [7] | 梁丽珠,孙佳楠,李恺,等.蛋白质组分析油酸对 HepG2 细胞转录因子 DNA 结合活性的影响.中国生物工程杂志,2015,35(5):22-31. Liang L Z,Sun J N,Li K,et al. Proteome-wide Screening of Transcription Factor DNA Binding Activity in HepG2 Cells after Oleic Acid Treatment. China Biotechnology,2015, 35(5):22-31. |
| [8] | 陈捷敏.甲醇中毒视网膜功能结构和蛋白质组学研究.上海:复旦大学,上海医学院,2012. Chen J M.Retina Functional and Morphologic Analysis after Methanol intoxication. Shanghai:Fudan University,Shanghai Medical College,2012. |
| [9] | Yang B C, Gong C, Song J, et al. Arginase-1: a new immunohistochemical marker of hepatocytes and hepatocellular neoplasms.Am J Surg Pathol, 2010, 34(8): 1147-1154. |
| [10] | Zhao Y F, Ben H J, Qu S,et al.Proteomic analysis of primary duck hepatocytes infected with duck hepatitis B virus.[2015-10-23].http://www.ncbi.nlm.nih.gov/pubmed. |
| [11] | Liu K, Qian L, Wang J L, et al. Two-dimensional blue native/SDS-PAGE analysis reveals heat shock protein chaperone machinery involved in hepatitis B virus production in HepG2.2.15 Cells.Mol Cell Proteomics,2009,8(3):495. |
| [12] | Bardag-Gorce F, Vu J, Nan L, et al.Proteasome inhibition induces cytokeratin accumulation in vivo.Exp Mol Pathol,2004,76(2):83. |
| [13] | He W, Li L X, Liao Q J, et al. Epigallocatechin gallate inhibits HBV DNA synthesis in a viral replication - inducible cell line.W J Gastroenterol,2011,17(11):1507. |
| [14] | 罗浩铭,孙薇,尹建元,等.热休克蛋白90 抑制剂的研究进展.药学学报,2010,45(7):813-820. Luo H M,Sun W,Yin J Y, et al. Progress in the study of heat shock protein 90 inhibitors. Acta Pharmaceutica Sinica,2010, 45 (7): 813-820. |
| [15] | Ebert G, Preston S, Allison C,et al. Cellular inhibitor of apoptosis proteins prevent clearance of hepatitis B virus .P Natl Acad Sci USA,2015, 112(18): 5797. |
| [16] | Ebert G, Allison C, Preston S, et al. Eliminating hepatitis B by antagonizing cellular inhibitors of apoptosis . P Natl Acad Sci USA, 2015, 112(18): 5803. |
| [17] | Huang H B, Chen D, Li S J, et al. Gambogic acid enhances proteasome inhibitor-induced anticancer activity.Cancer Letters, 2011,301(2): 221. |
| [18] | Lu L, Qin A P, Huang H B, et al. Shikonin extracted from medicinal Chinese herbs exerts anti-inflammatory effect viaproteasome inhibition.Eur J Pharmacol,2011,658(2-3):242. |
| [19] | Yang H J, Landis-Piwowar K R, Lu D Y, et al. Pristimerin Induces Apoptosis by Targeting the Proteasome in Prostate Cancer Cells. .J Cell Biochemi,2008,103(1):234. |
| [20] | Yang H J, Sun D K, Chen D, et al. Antitumor activity of novel fluoro-substituted(-)-epigallocatechin-3-gallate analogs .Cancer Lett, 2010,292(1) : 48. |
| [21] | Gonzalez O, Fontanes V, Raychaudhuri S, et al. The Heat Shock Protein Inhibitor Quercetin AttenuatesHepatitis C Virus Production.Hepatology,2009,50(6):1756. |
| [22] | 范莹娟,许建华.姜黄素与Hsp90 相互作用以及对Hsp90 ATPase 活性的影响.中国药理学通报, 2013,29(10):1426-1431. Fan Y J,Xu J H. Interactions between curcumin and Hsp90 and effects of curcumin on Hsp90 ATPase activity. Chinese Pharmacological Bulletin,2013,29(10):1426-1431. |
| [23] | Ding C, Wei H M, Sun R, et al. Hepatocytes proteomic alteration and seroproteome analysis of HBV-transgenic mice.Proteomics,2009,9(1):87. |
| [24] | 王银,李云鸿,滕鹏,等.热休克蛋白60基因定点诱变导致其在细胞内定位的改变.宁夏医科大学学报,2011,33(7):609-618. Wang Y,Li Y H,Teng P,et al. Site-directed Mutation of Serine70 on HSP60 Subcellular Relocation. J Ningxia Medical University, 2011,33(7):609-618. |
| [25] | Böttinger L, Oeljeklaus S, Guiard B, et al. Mitochondrial heat shock protein (Hsp) 70 and Hsp10 cooperate in the formation of Hsp60 complexes.J Biol Chem,2015,290(18):11611. |
| [26] | Kondo Y, Ueno Y, Kobayashi K, et al. Hepatitis B virus replication could enhance regulatory T cell activity by producing soluble heat shock protein 60 from hepatocytes.J Infect Dis, 2010,202(2):202. |
| [27] | Golden E B, Lam P Y, Kardosh A, et al. Green tea polyphenols block the anticancer effects of bortezomib and other boronic acid-based proteasome inhibitors.Blood, 2009,113(23):5927. |
| [28] | Shim H Y, Quan X Y, Yi Y S, et al. Heat shock protein 90 facilitates formation of the HBV capsid via interacting with the HBV core protein dimers.Virology,2011,410(1):161. |
| [29] | Song W J,Luo J,Wu T,et al.Oral oxymatrine preparation for chronic hepatitis B: A systematic review of randomized controlled trials.[2015-10-23].http://www.ncbi.nlm.nih.gov/pubmed. |
| [30] | 孔祥平,吴庆洲,罗显荣,等.复制型HBV转基因小鼠遗传稳定性研究.中国生物工程杂志,2008,28 (5):17-21. Kong X P,Wu Q Z,Luo X R, et al.The genetic stability of replicating HBV transgenic mice. China Biotechnology,2008,28(5):17-21. |
| [31] | Publicover J, Goodsell A, Nishimura S, et al. IL-21 is pivotal in determining age-dependent effectiveness of immune responses in a mouse model of human hepatitis B.J Clin Invest,2011,121(3):1154. |
| [32] | Chou H H, Chien W H, Wu L L, et al.Age-related immune clearance of hepatitis B virusinfection requires the establishment of gut microbiota. P Natl Acad Sci USA,2015,112(7):2175. |
| [33] | 易学瑞,袁有成,陈文吟,等. 化学发光Southern blot法检测HBV体外复制及其应用于药物对HBV的抑制分析.中国生物工程杂志,2009,29(4):78-82. |
 2015, Vol. 35
2015, Vol. 35




