文章信息
- 聂利珍, 于肖夏, 李国婧, 孙杰, 姜超, 于卓
- NIE Li-zhen, YU Xiao-xia, LI Guo-jing, SUN Jie, JIANG Chao, YU Zhuo
- Rd29A启动子驱动AtCDPK1基因转化马铃薯的研究
- Study on Transgenic Potato Contained AtCDPK1 Gene Drived by Rd29A Promoter
- 中国生物工程杂志, 2015, 35(11): 13-22
- China Biotechnology, 2015, 35(11): 13-22
- http://dx.doi.org/10.13523/j.cb.20151103
-
文章历史
- 收稿日期: 2015-06-11
- 修回日期: 2015-07-02
2. 内蒙古农牧业科学院 呼和浩特 010031
2. Inner Mongolia Academy of Agricultural Animal-Husbandry Sciences, Hohhot 010031, China
马铃薯(Solanum tuberosum)是一种具有粮、菜及工业原料等多种用途的经济作物,是世界上仅次于小麦、水稻、玉米的四大粮食作物之一。内蒙古是中国马铃薯的种薯和商品薯重要产地之一[1],但干旱缺水一直是马铃薯生产的主要限制因子,特别是内蒙古中西部地区几乎连年干旱,使得马铃薯产量低下,严重影响着当地农民的经济收入。因此培育抗旱、高产、优质的马铃薯新品种实属必要。利用转基因技术开展农作物育种是农业科技的发展方向和必然趋势[2]。国外Yeo等[3]从酵母中克隆出海藻糖-6-磷酸合成酶基因(TPSI),通过农杆菌介导转入马铃薯中,获得的转基因马铃薯抗旱能力明显提高。张宁[4]从菠菜中克隆甜菜碱醛脱氢酶(BADH)基因,转化马铃薯获得了转基因植株,对其进行干旱和NaCl 胁迫处理研究显示,转基因马铃薯的抗旱耐盐能力均显著提高。
CDPK(calcium-dependent protein kinase,也称为CPK)是一类钙依赖钙调素不依赖的蛋白激酶,其广泛存在于植物、藻类和部分原生生物中[5, 6, 7]。在植物参与非生物胁迫反应、光周期调节和激素信号转导中具有非常重要的作用[8]。CDPK首先在豌豆中发现[9],它与细胞Ca2+信号传递有密切关系,是植物中研究较多、了解较清楚的一类蛋白激酶。Sheen[10]利用效应基因和报告基因共表达的方法,发现在玉米原生质体中转化AtCDPK1和AtCDPK1a能激活受干旱和高盐胁迫诱导的启动子,去除AtCDPK1激酶区的突变体对干旱和盐胁迫及ABA刺激没有反应;过表达AtCDPK1的拟南芥在低温、高盐和ABA胁迫下,其耐受能力明显比野生型强[11];拟南芥T-DNA插入突变体cdpk1对干旱胁迫比野生型拟南芥敏感,过表达AtCDPK1的拟南芥可提高其对干旱胁迫的耐受能力[12]。
植物基因启动子是重要的顺式作用元件,是位于结构基因5′端上游区的DNA 序列,能指导全酶与模板的正确结合,活化RNA 聚合酶,并使之具有起始特异性转录的形式,并决定转录的方向和效率,以及所使用的RNA 聚合酶类型,是转录调控的中心[13]。植物中的组成型启动子驱动的目的基因在植物各组织中的持续表达,会过度消耗受体细胞内的物质和能量,不能更好地调控目的基因的表达,因此在应用中存在一定的缺陷。例如,外源基因在植物所有器官中表达,产生的大量异源蛋白质或代谢产物在受体体内积累,打破了植物原有的代谢平衡,不利于植物的正常生长发育;有些产物对植物并非必需甚至有毒,因而会阻碍植物的正常生长,甚至导致死亡[14]。研究者[15]在研究中发现了 35S 组成型启动子调控的DREB1A基因具有抑制抗性芽生长和抗性植株生根的现象,而 Rd29A 启动子调控的DREB1A基因则没有出现这种抑制现象,证明Rd29A 启动子诱导表达的高效性,这说明用Rd29A启动子启动下游基因的表达比组成型启动子更加有利。
本研究利用启动子分析软件TSSP-TCM 和 Plantcare分析拟南芥Rd29A基因的ATG上游1 524bp的启动子区域,并克隆Rd29A基因ATG上游+83bp至-1 441bp共1 524bp的启动子区域,构建以诱导型Rd29A启动子驱动的植物表达载体pCHFRd-CDPK1,利用农杆菌介导法将AtCDPK1基因导入目前内蒙古地区种植较多的抗旱性较弱的马铃薯品种‘费乌瑞它’(Favorita)基因组,PCR和Southern blot检测AtCDPK1基因在马铃薯基因组中的整合情况,并用RT-PCR分析PEG 胁迫后Rd29A启动子驱动AtCDPK1在马铃薯中的表达情况,旨在为选育抗旱性强、生长正常的转基因马铃薯新品种奠定基础。
1 材料与方法 1.1 材 料转基因受体材料为马铃薯品种‘费乌瑞它’(Favorita),由本课题提供。野生型拟南芥(Arabidopsis thaliana)Columbia生态型(Col-0)种子及pCHF3植物表达载体由内蒙古农业大学李国婧教授馈赠。农杆菌LBA4404由本课题组保存。
1.2 马铃薯无菌苗的扩繁和试管薯诱导将马铃薯无菌苗在无菌条件下剪成1.5cm小段,每节茎段带1个或2个腋芽,接种于MS培养基,在光强2 000勒克斯(lx)、光照时间16h/d、温度(22±2)℃条件下进行扩繁培养。无菌苗生长约14d时,在无菌条件下加入微型薯诱导培养基(MS液体培养基+8%蔗糖+4.0mg/L 6-BA +0.02mg/L NAA +500mg/L CCC),使其在黑暗条件下生长,大约30d长出微型薯。
1.3 AtCDPK1基因克隆根据tare(https://www.arabidopsis.org/)数据库中At1g18890基因序列,利用Primer 3和VectorNTI 11.0软件,设计带有Kpn I与Xba I双酶切位点的特异性引物CDPK1-P5 (GA ACCCGGGATGGGTAACTGT AACGCCTG)和CDPK1-P3 (GCCTCTAGATTAAAC AGGAA C AGTTTGTC);以野生型拟南芥基因组DNA为模板进行PCR扩增,扩增片段总长度为2 269bp,反应程序为:98℃预变性3min,98℃变性30s,53℃退火30s,72℃延伸3min,30个循环,72℃延伸5min。对PCR产物经0.8%琼脂糖凝胶电泳,利用DNA纯化回收试剂盒(TaKaRa,日本)胶回收。回收产物进行加核苷酸A反应,DNA片段利用T4 DNA连接酶(NEB,美国)与pMD18-T Vector (TaKaRa,日本)连接。用热激法将连接产物转化大肠杆菌Trans1-T1,经蓝白斑筛选、PCR和酶切鉴定,鉴定正确后送上海生工有限公司测序,测序正确的保种备用,获得了T-CDPK1载体。
1.4 拟南芥Rd29A基因5′端启动子区域的分析与克隆根据tare(https://www.arabidopsis.org/)数据库中AT5G52310基因ATG上游1 524bp序列,利用启动子分析软件TSSP-TCM 和 Plantcare分析了Rd29A的ATG上游1 524bp的启动子区域;利用Primer 3和VectorNTI 11.0软件,设计带有EcoR I与Sac I 双酶切位点的特异性引物Rd29A-P5(5′-GAGAATTCAGAT TTGGGGTTTT GCTT-3′)和Rd29A-P3(5′-GCCTCGAGTTTCCAAAGAT TTTTTT C-3′);以野生型拟南芥基因组DNA为模板进行PCR扩增,扩增片段总长度为1 524bp,反应程序与克隆方法同1.3部分,获得了pMD-T-Rd29A载体。
1.5 Rd29A诱导型启动子植物表达载体的构建pMD-T-Rd29A重组载体和植物表达载体pCHF3分别用EcoR I与Sac I双酶切,回收目的基因片段,然后利用T4 DNA连接酶(NEB,美国)连接。用热激法将连接产物转化大肠杆菌Trans1-T1,经PCR和酶切鉴定,鉴定正确即完成了Rd29A启动子驱动的植物表达载体构建。将植物表达载体pCHFRd和pCHF-CDPK1分别用Kpn I(NEB,美国)与Xba I(NEB,美国)双酶切,分别回收目的片段。将二者回收的目的片段进行连接转化大肠杆菌Trans1-T1,PCR和酶切鉴定重组载体,阳性克隆提取质粒,采用冻融法导入农杆菌LBA4404,经PCR鉴定正确后保种,构建成Rd29A启动子驱动AtCDPK1基因表达的植物表达载体pCHFRd-CDPK1。
1.6 农杆菌介导法转化马铃薯 1.6.1 重组菌株的培养与活化从-80℃冰箱取出保存的含有pCHFRd-CDPK1载体的菌种,在相应抗生素平板上划线。挑取农杆菌单菌落接种到5ml LB液体培养基(抗生素Rif 30mg/L、Spect 50mg/L、Str 25mg/L)中,28℃条件下震荡培养16~20h,取1ml接种到50ml LB液体培养基中(加抗生素同上),继续震荡培养到OD600为0.5~0.8。将其转至50ml离心管,5 000r/min离心10min,弃上清液,菌体用MS培养基重悬。
1.6.2 马铃薯转化方法选择直径在2cm左右的微型薯,去掉芽眼和薯皮,切成2mm厚的薯片,放入农杆菌重悬液中浸泡10min,期间不断摇动菌液使其充分接触,取出后用无菌滤纸吸去薯片表面的菌液,转入筛选出的分化培养基(MS+2mg/L ZT+0.5mg/L 6-BA+1mg/L IAA+0.2mg/L GA3)上,于28℃黑暗下共培养2d,使农杆菌的T-DNA 有效转移。共培养后将薯片转移到附加50mg/L Kan+300mg/L Cef 的分化培养基上,在(22±2)℃、2 000lx连续光照条件下诱导芽分化。每隔 15d更换1次培养基,并淘汰褐化和死亡的薯片。待抗性芽长至 1.0~1.5cm时,切下转入附加50mg/L Kan和200mg/L Cef 的 MS 培养基上,在(22±2)℃、2 000lx连续光照下诱导生根,获得完整抗性植株。
1.7 马铃薯转化植株的分子检测PCR检测:剪取生根培养基上生长至10cm左右的马铃薯幼苗叶片提取DNA,扩增CDPK1基因的特异引物CDPK-RT-F (CCTGTGTAAGGCCAGACTCAA) 和CDPK-RT-R (ATAATAACT CCGGCACTCCAC),以含有该基因的质粒为阳性对照,非转基因马铃薯‘费乌瑞它’无菌苗的基因组DNA为阴性对照,对转基因植株进行PCR鉴定。
Southern blot检测:用 CTAB法提取 PCR 检测为阳性的转基因植株叶片总DNA,采用DIG-labeling 试剂盒(Roche,瑞士)标记AtCDPK1基因的DNA 探针,杂交、洗膜及检测方法按试剂盒(Roche,瑞士)说明书进行。
RT-PCR检测:采用TRIzol(Invitroge,美国)试剂提取经PEG胁迫处理8h的转基因马铃薯植株叶片总RNA,用1%的琼脂糖凝胶电泳检测RNA质量,选出条带完整且清晰的RNA,去除DNA后,采用cDNA合成试剂盒(天根,中国)进行转基因植株的RT-PCR检测。用于RT-PCR扩增的引物分别为:扩增CDPK1基因的特异引物CDPK-RT-F (CCTGTGTAAG GCCAGACTCAA) 和CDPK-RT-R (ATAATAACTCCGGCACTCCAC) ,扩增片段跨CDPK1基因1个内含子,扩增cDNA片段长度为742bp,扩增基因组DNA的片段为875bp。马铃薯内参基因引物为EF-1α-F (CTCA AGAAGGTAGGATACAAC)和EF-1α-R (GAAGAGCT TCGTGGTGCAT)。
1.8 转基因马铃薯PEG4000胁迫处理分别用Rd29A和35S 启动子驱动AtCDPK1基因的转基因马铃薯各7个株系,将这些转基因无菌苗进行切段扩繁,将生根的无菌苗分成两组。一组当根长为2~3cm 时,将封口膜打开炼苗,让幼苗逐渐适应外界空气湿度,2d后把小苗从三角瓶中取出,清水洗根,移栽于花盆营养土(草炭土∶沙子=1∶2)中,以未转化马铃薯为对照。每个转化株系设三个重复处理,于植物培养室20~25℃,1 500~2 000lx,14h/d光照条件下,浇灌清水进行培养。当植株高达10cm 时,进行胁迫处理。用PEG4000溶液浇灌植株,每盆浇100ml,浓度从5% PEG4000开始,每天提高5%,至终浓度为30% PEG4000。10d后观察植株的生长情况,照相记录。另一组炼苗后,清水洗根,将苗子转移至滤纸上吸去多余的水分,然后加入清水预处理2d,每天更换一次,然后分别加入100ml 20% PEG4000溶液,每个转化株系设三个重复处理,处理8h后对照和转基因植株收集样品,进行RT-PCR分析。
2 结 果 2.1 启动子分析软件预测Rd29A启动子利用启动子分析软件TSSP-TCM 和 Plantcare分析了Rd29A的ATG上游1 524bp的启动子区域,预测出转录起始位点为A,位于起始密码子ATG上游83bp处,发现该序列具有启动子的基本转录元件,如TATA-box 位于-30bp和-168bp处、CAAT-box 位于-282bp和-361bp处;还发现该序列包含多个顺式作用元件(各元件的位置如图 1 所示)。说明该序列具有启动子的核心结构和调控元件,完全具有启动子的功能。
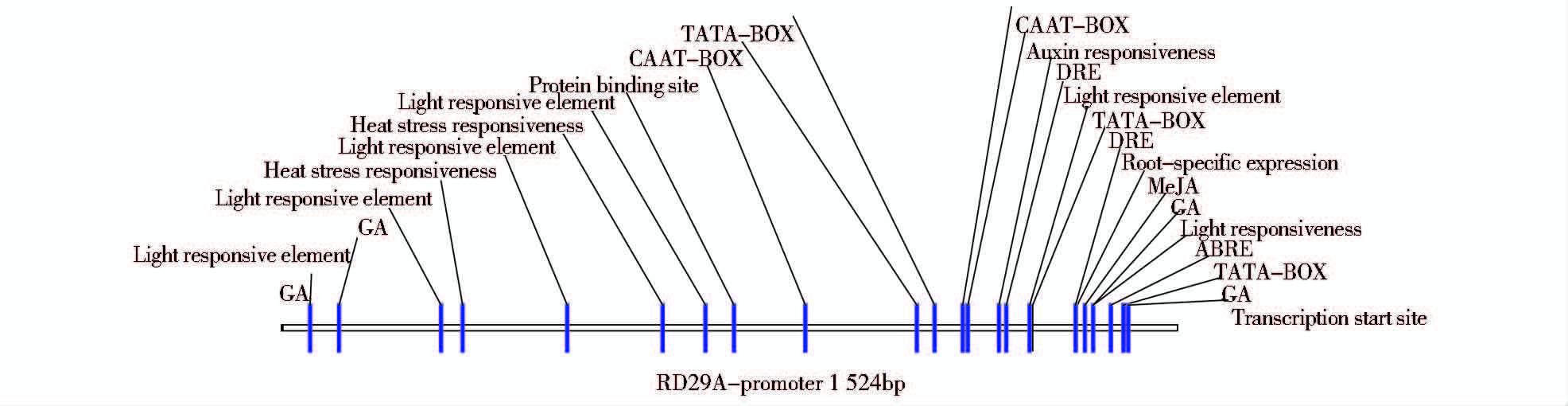
|
| 图 1 Rd29A启动子预测分析 Fig. 1 Promoter prediction analysis of Rd29A |
以拟南芥基因组 DNA 为模板,利用特异引物Rd29A-P5/P3扩增的结果显示,扩增产物大小与预期片段一致,扩增的RD29A基因启动子5′端序列长为1 524bp[图 2(a)]。将PCR产物回收后进行加核苷酸A反应,获得的回收片段末端带有碱基A,利于目的片段与载体上的T连接,将纯化回收的目的片段连接到pMD18-T克隆载体上,转化大肠杆菌Trans1-T1,从转化的平板上挑取白色克隆进行菌落PCR,经检测扩增出大小约为1 524bp的条带[图 2(b)]。对阳性克隆进行菌液培养提取质粒DNA,然后做酶切鉴定,酶切后获得长度为1 524bp的条带[图 2(c)]。对经PCR和酶切鉴定正确的克隆测序,测序结果利用DNAStar软件分析,其DNA序列与已知的拟南芥Rd29A 5′端启动子序列同源性为100%(图 3)。克隆了拟南芥Rd29A基因ATG上游+83bp至-1 441 bp共1 524bp的启动子区域,这表明拟南芥Rd29A基因启动子序列克隆成功。
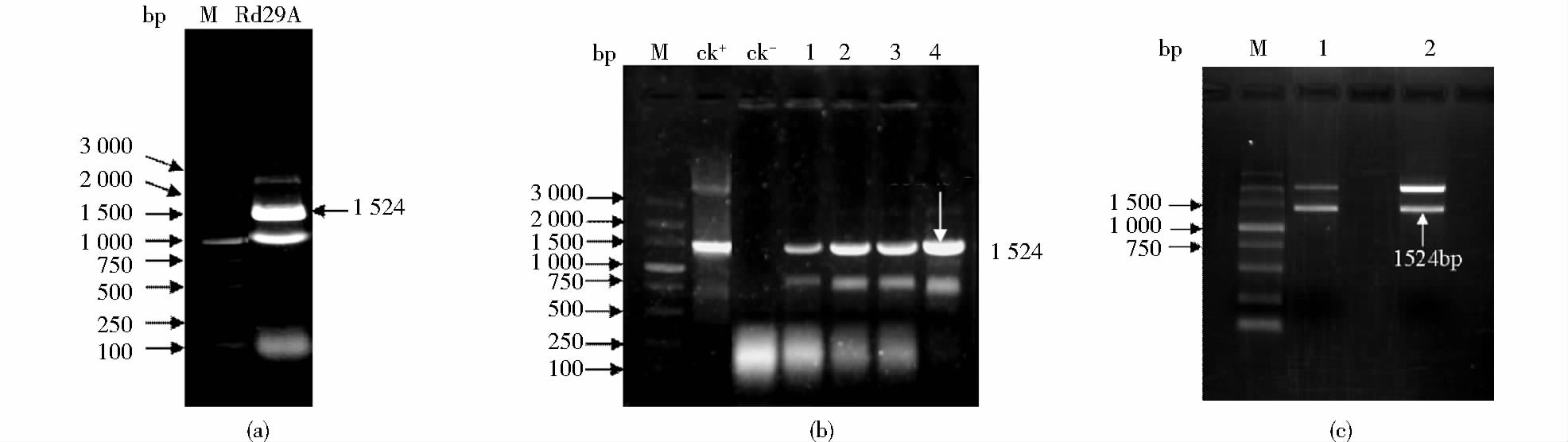
|
| 图 2 Rd29A 5′端启动子序列克隆及阳性克隆的鉴定 Fig. 2 Cloning of Rd29A promoter and identification of plasmids recombinant (a) Amplification of Rd29A promoter by PCR M: DL3000 (b) Identification of the recombinant pMD-T-Rd29A by colony PCR ck+: Positive control (Arabidopsis genomic DNA); ck-: Negative control; 1~4: Random single colony (c) Identification of pMD-T-Rd29A digested by restriction enzyme |
pMD-T-Rd29A重组载体和植物表达载体pCHF3分别用EcoR I与Sac I双酶切[图 4(a)],将切下的Rd29A启动子插入用EcoR I与Sac I 切去 CaMV 35S 启动子的pCHF3 表达载体中,回收目的片段后用T4 DNA连接酶将Rd29A启动子片段与pCHF3片段连接,连接产物转化大肠杆菌Trans1-T1,然后进行菌落PCR鉴定,随机挑选6个单菌落进行PCR,结果显示,有5个单菌落扩增出一条1 524bp的条带[图 4(b)]。随机选PCR鉴定正确的菌落提取质粒进行相应位点的双酶切,结果显示,质粒酶切后获得一条约1 524bp的条带[图 4(c)]。PCR产物和酶切产物的目的条带与预期结果一致,这表明诱导型启动子驱动的植物表达载体pCHFRd构建成功。

|
| 图 3 Rd29A基因启动子DNA序列 Fig. 3 Rd29A promoter DNA sequence |
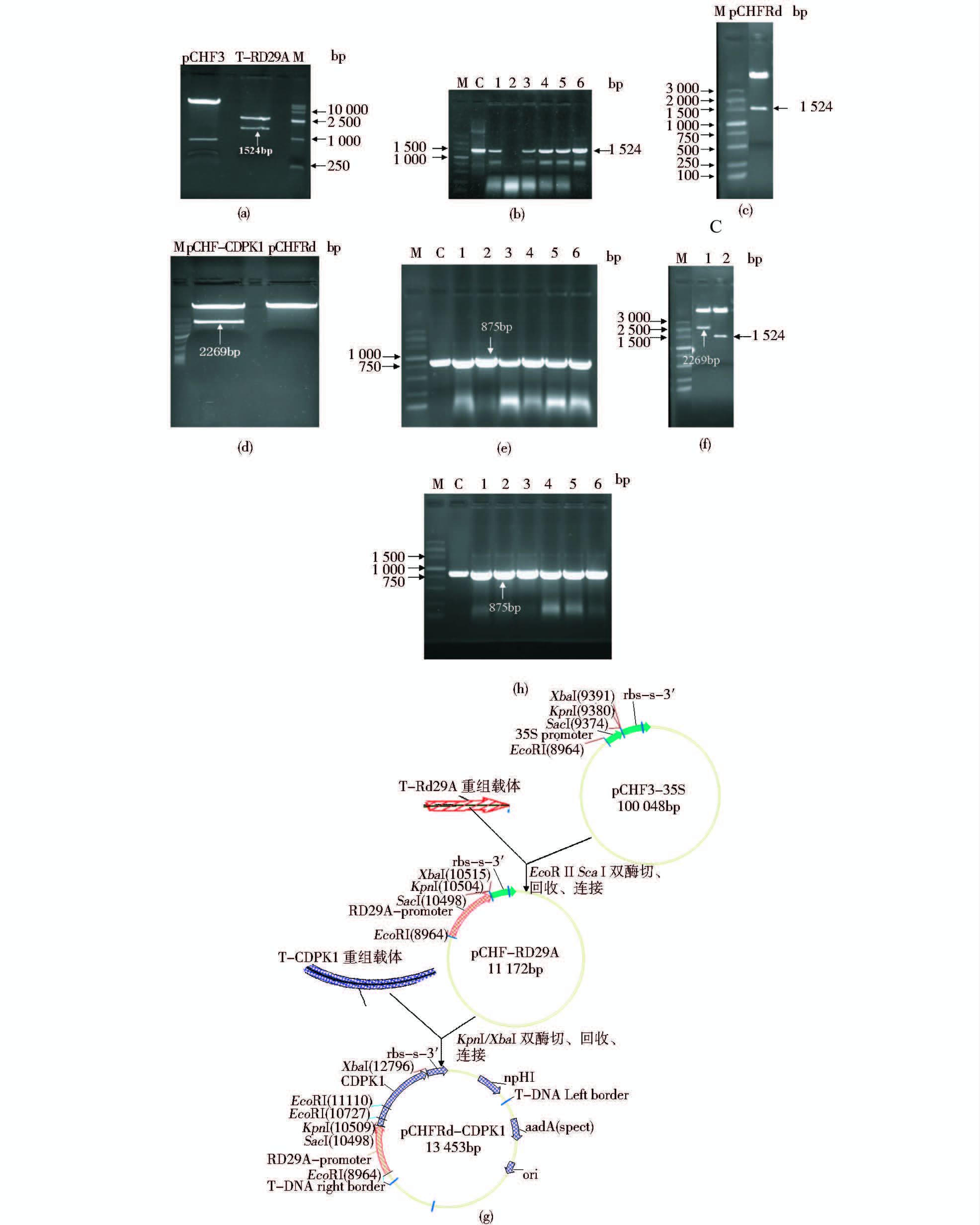
|
| 图 4 Rd29A 启动子驱动的植物表达载体pCHFRd-CDPK1的构建与鉴定 Fig. 4 Construction and identification of pCHFRd-CDPK1 expression vector drived by Rd29A promoter (a) pMD-T-Rd29A and pCHF3 vector digested by restriction enzyme M: DNA Marker (b) Identification of pCHFRd amplificated by PCR (c) Identification of the pCHFRd digested by restriction enzyme (d) pCHFRd and pCHF-CDPK1 digested by restriction enzyme (e) Identification of pCHFRd-CDPK1 amplificated by PCR (f) Identification of pCHFRd-CDPK1 digested by restriction enzyme (h) Identification of pCHFRd-CDPK1 amplificated in the Agrobacterium by PCR (g) Construction picture of pCHFRd-CDPK1 vector c: Positive control (pMD-T-Rd29A and pCHF-CDPK1); 1~6: Random single colony |
pCHFRd和pCHF-CDPK1重组载体分别用Kpn I和Xba I双酶切[图 4(d)],分别回收pCHFRd的大片段和pCHF-CDPK1的小片段,然后用T4 DNA连接酶将两个片段连接,连接产物转化大肠杆菌Trans1-T1,然后进行菌落PCR鉴定,每个克隆都扩增出875bp的目的条带[图 4(e)],酶切鉴定出2 269bp和1 524bp的条带[图 4(f)],证明获得了Rd29A 启动子驱动AtCDPK1基因的表达载体pCHFRd-CDPK1[图 4(g)][16]。将构建好的植物表达载体采用冻融法转入农杆菌LBA4404菌株中用于转化马铃薯。通过菌落PCR 扩增对表达载体导入农杆菌进行了检测,结果表明,Rd29A 启动子驱动AtCDPK1基因的表达载体已转入农杆菌中[图 4(h)]。
2.4 Rd29A 启动子驱动AtCDPK1基因转化马铃薯AtCDPK1基因通过农杆菌介导转化马铃薯,马铃薯无菌苗经过暗培养后,形成微型薯,微型薯去皮和芽眼后切成2mm左右的薄片,薯片经农杆菌浸染[图 5(a)],再经过共培养和诱导培养后在分化培养基上培养 5~6 周后从微型薯薄片上直接再生出抗性小芽[图 5(b)]。当薄片上的抗性芽长到 1~2cm 时,将其切下转入 MS 附加 50mg/L Kan 和 200mg/L Cef 的培养基上诱导生根,转化植株具有 Kan 抗性的在抗性培养基上生根,从而获得完整植株[图 5(c)、(d)]。

|
| 图 5 抗性再生植株的形成 Fig. 5 Resistant regenerated plants (a) Potato chips infected by Agrobacterium (b) Adventitious buds induction of explants on the selection medium (c) Resistant buds formed root (d) Complete plants |
对获得的抗性再生植株进行PCR检测,提取抗性植株叶片的基因组DNA,利用AtCDPK1基因特异引物CDPK-RT-F/R进行PCR。检测结果显示,在检测的30个植株中有13株呈阳性,这些阳性转基因植株能扩增出约875bp的目的条带,部分检测的电泳结果见图 6(a),非转基因植株没有相应的条带,这表明AtCDPK1基因可能被成功导入马铃薯基因组中。
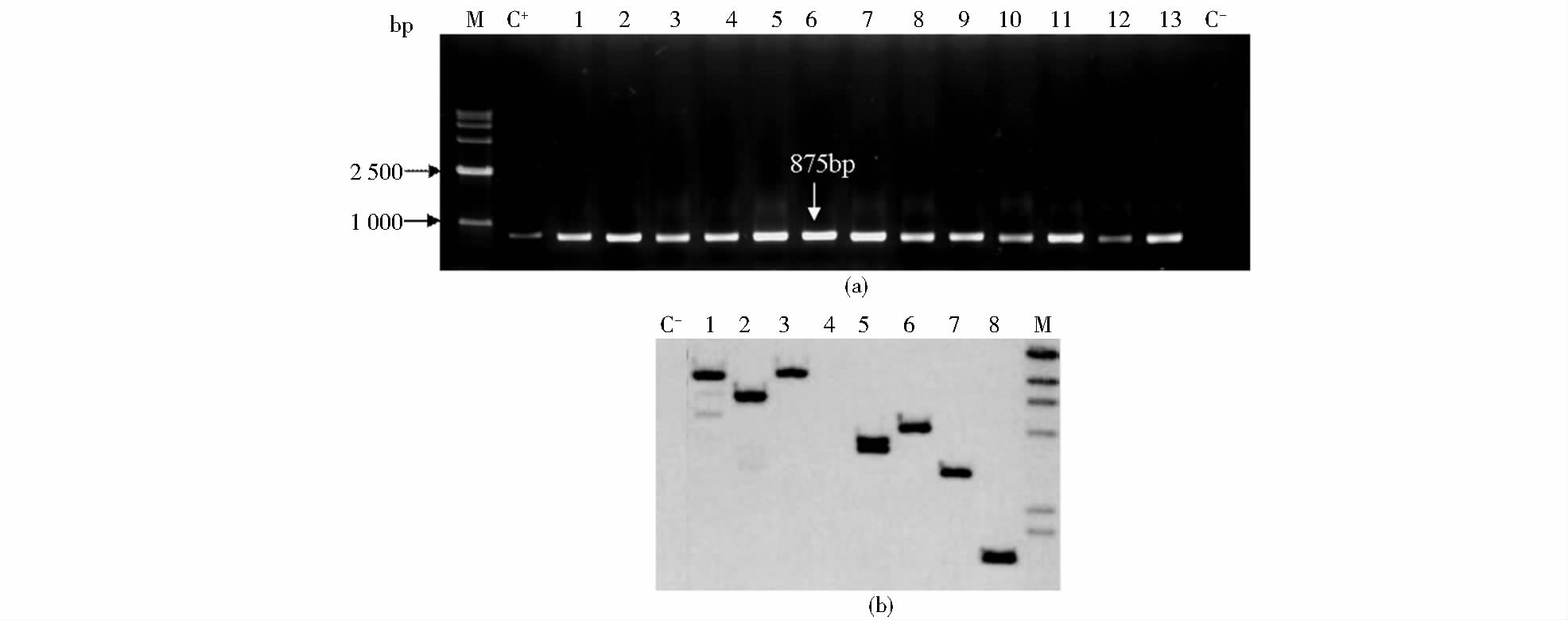
|
| 图 6 再生植株的PCR和Southern blot检测 Fig. 6 Detection of PCR and Southern blot of regenerated plants (a) Detection of regenerated plants by PCR (b) Southern blot M: 15kb DNA Marker; C+: Positive control (pCHF3-CDPK1); l~13: Regenerated plants; C-: Negative control ( non-transgenic potato genomic DNA) |
对部分PCR检测为阳性的转基因植株,提取其基因组DNA,同时选用未转化的受体植株作阴性对照,利用限制性内切核酸酶KpnI 对DNA进行酶切,并通过Southern blot方法检测AtCDPK1在马铃薯基因组中的整合情况,结果见图 6(b)。从图中可以看出,经杂交处理后,抗性植株中有7株出现较为明显的杂交信号,而阴性对照则无杂交信号产生。这表明目的基因AtCDPK1已经成功地与马铃薯基因组发生了整合,且每个株系都是单拷贝插入,插入的位点也不同。
2.6 转基因马铃薯AtCDPK1基因的表达及抗旱性分析为验证转基因马铃薯中AtCDPK1基因的转录水平,分别挑选7个35S 和Rd29A 启动子控制的T0代转基因株系,20% PEG胁迫8h,利用AtCDPK1的特异引物CDPK-RT-F/R,以马铃薯的看家基因StEF-1α作为内参基因,通过RT-PCR检测AtCDPK1在转基因马铃薯中的表达。从图 7(a)可以看出,在Rd29A启动子驱动AtCDPK1基因表达的转基因马铃薯植株中,在无胁迫条件下,植株中AtCDPK1基因基本不表达,而PEG处理后各个株系中AtCDPK1基因表达量明显增强。这表明Rd29A启动子驱动的转基因马铃薯在遇到胁迫时,转基因植株中AtCDPK1基因开始表达,而无任何胁迫时AtCDPK1基因基本不表达。
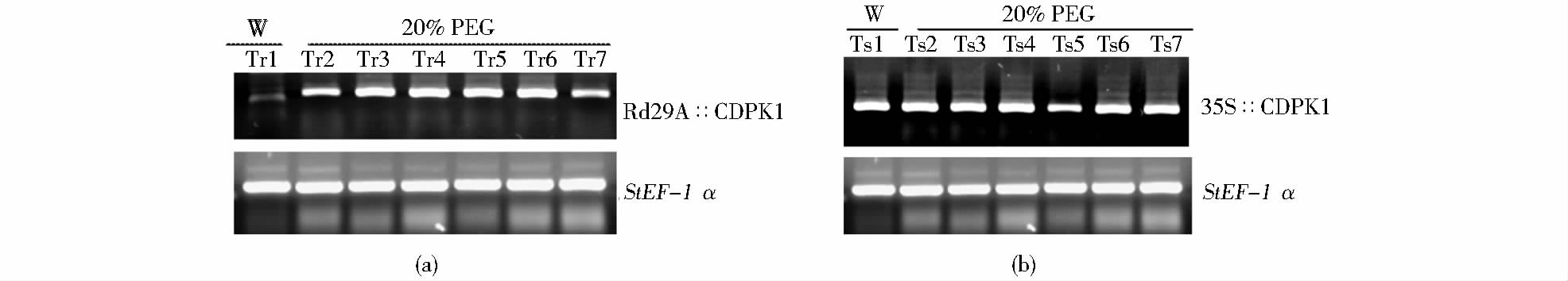
|
| 图 7 20% PEG胁迫转基因株系RT-PCR分析 Fig. 7 Analysis RT-PCR of transgenic plants stressed by 20%PEG (a) Transgenic potato drived by Rd29A promoter (b) Transgenic potato drived by 35S promoter W: Water treatment 8h; Tr1~Tr7:Transgenic potato drived by Rd29A promoter; Ts1~Ts7:Transgenic potato drived by 35S promoter; 20%PEG: 20%PEG treatment 8h |
为了定性检测不同启动子控制下的AtCDPK1表达量,以及胁迫条件对AtCDPK1基因转录的影响,对转基因马铃薯的 RNA 进行了RT-PCR半定量分析。结果表明,当用20% PEG 胁迫转基因马铃薯植株时,Rd29A 启动子驱动的AtCDPK1基因表达量较干旱胁迫前明显增强,而35S 控制的AtCDPK1在PEG 胁迫前后,基因转录未见明显差异[图 7(a)、(b)]。
另外,本研究对干旱胁迫转基因马铃薯植株的形态学观察表明,PEG胁迫前未转基因的对照和Rd29A 启动子驱动的转基因马铃薯生长势基本一致,而35S启动子驱动的转基因马铃薯较前者生长较弱,表现出植株较矮;在PEG胁迫下,转基因植株能正常生长,其长势优于未转基因的对照,且对照植株略有萎焉(图 8)。形态学观察还表明,转基因植株的株形正常,未发生畸形突变。

|
| 图 8 转基因马铃薯植株在30%PEG 胁迫下的形态学表现 Fig. 8 Morphological characteristics of transgenic plants after PEG stress |
全球面临水资源日益短缺的境况,由干旱造成的农作物减产并因此带来的经济损失逐渐加剧。与传统的抗逆育种工作相比,基因工程育种以其特有的优势,如不受种属间的限制、周期短、效率高等特点,正得到越来越广泛的关注。干旱等非生物胁迫严重影响植物的生长发育[17],而植物在生长过程中有很多基因参与了植物响应逆境胁迫的过程[18, 19]。前期研究[20]表明,AtCDPK1基因受干旱、高盐等逆境胁迫诱导表达,并在拟南芥抗非生物胁迫介导的信号转导中具有正向调节作用。因此,推测拟南芥对干旱等非生物胁迫的抗性与AtCDPK1的表达有一定的正相关性。所以,本研究克隆了拟南芥AtCDPK1基因,并将其转入耐旱性差的马铃薯品种中。作为基因表达调控的重要组成部分,启动子决定了基因表达的时间、空间和强度,也是农作物转基因研究中的重要工具[21]。虽然以前应用的35S启动子能够持续高效表达目的基因,提高了抗逆性,但往往阻碍植物生长发育[22]。在农作物的分子育种中,利用逆境诱导型启动子驱动抗逆基因在农作物中表达是改良作物耐逆性的有效方法。研究发现,许多逆境诱导的基因所具有的启动子调控元件包括ABRE(PyACGTGGC)、G2BOX(CACGTG)、DRE(TACCGACAT)、MYBRS (PyAACPy Pu )、MYCRS(CANNTG) 等[17, 22]。相关研究表明,在胁迫条件下,Rd29A启动子可以提高所驱动基因的转录和翻译水平,其启动子区域含有DRE核心序列和ABRE顺式作用元件[23]。我们利用生物信息学分析了拟南芥Rd29A基因上游序列,其也包括了ABA 和缺水应答的ABRE、DRE 等顺式作用元件,这与以前的研究结果是一致的。研究表明,Rd29A启动子序列各种作用元件有效的诱导作用位点大多集中在-1 000bp 范围内。所以,本研究克隆了Rd29A基因上游1 524bp序列作为目的基因的启动子,通过实验验证该序列完全具有诱导型启动子的功能。
在本研究以马铃薯为材料研究了Rd29A基因5′端ATG上游+83bp至-1 441bp共1 524bp的启动子序列调控AtCDPK1基因在转基因马铃薯中的诱导表达。结果表明,在转基因马铃薯中,Rd29A 启动子驱动的AtCDPK1基因能够被干旱条件诱导表达,该结果表明,在非胁迫条件下Rd29A启动子的活性很低,而在干旱等非生物胁迫处理条件下其活性明显增强,从而启动其下游基因AtCDPK1的表达。这说明在马铃薯中可能存在Rd29A 启动子诱导表达所需的相应的反式作用因子,但二者之间的关系如何还有待深入研究。对干旱胁迫后马铃薯植株表型观察可知,干旱胁迫前组成型和诱导型启动子驱动的转基因马铃薯的生长势有一定差别,这与他人的研究结果一致[24],进一步证实了Rd29A启动子在植物受到环境胁迫时,才诱导目的基因持续高效表达,而在无胁迫条件时,目的基因不表达。据此推测利用诱导型启动子控制目的基因可能是农作物抗逆基因工程育种的有效方法。
| [1] | 刘玲. 内蒙古马铃薯产业化问题研究. 呼和浩特:内蒙古农业大学,农学院,2003. Liu L. Study on Industrialization of Potato in Inner Mongolia Autonomous Region. Huhhot: Inner Mongolia Agricultural University, Agricultural College,2003. |
| [2] | 孙国凤,马鑫. 农业生物技术发展现状与展望. 农业展望,2010,(11):56-59. Sun G F, Ma X. Development status and prospect of agricultural biotechnology. Agricultural Outlook, 2010, (11): 56-59. |
| [3] | Yeo E T, Kwon H B, Han S E, et al. Genetic engineering of drought-resistant potato plants by introduction of the trehalose-6-phosphate synthase ( TPS1 ) gene from Saccharomyces cerevisiae. Molecular Cells, 2000, 10(3): 263-268. |
| [4] | 张宁. 应用甜菜碱醛脱氢酶基因工程提高马铃薯抗逆性的研究. 兰州:甘肃农业大学,农学院,2004. Zhang N. Studies on Increasing Stress Resistance of Potato by Genetic Engineering of Betaine Aldehyde Dehydrogenase. Lanzhou: Gansu Agricultural University, Agricultural College,2004. |
| [5] | Roberts D M, Harmon A C. Calcium-modulated proteins: targets of intracellular calcium signals in higher plants. Annual Review of Physiol Plant Molecular Biology, 1992, 43: 375-414. |
| [6] | Hrabak E M. Plant Protein Kinases: Calcium-dependent Protein Kinases and Their Relatives. In: Kreis M, Walker J C. Advances in Botanical Sciences. New York: Academic Press, 2000: 185-223. |
| [7] | Harmon A C, Gribskov M, Gubrum E, et al. The CDPK superfamily of protein kinases. New Phytologist, 2001, 151: 175-183. |
| [8] | Harper J F, Breton G, Harmon A C. Decoding Ca2+ signals through plant protein kinases. Annual Review of Plant Biology, 2004, 55: 263-288. |
| [9] | Hetherington A, Trewavas A. Calcium-dependent protein kinase in pea shoot membranes. FEBS Letters, 1982, 145(1): 67-71. |
| [10] | Sheen J. Ca2+-dependent protein kinases and stress signal transduction in plants. Science, 1996, 274(5294): 1900-1902. |
| [11] | 卢慧星. 拟南芥 AtCDPK1 参与非生物胁迫响应和ABA信号途径的证据. 呼和浩特: 内蒙古农业大学,生命科学院,2009. Lu H X. The Evidence of AtCDPK1 Involved in Abiotic Stresses and ABA Signaling Pathway. Huhhot: Inner Mongolia Agricultural University, College of Life Science,2009. |
| [12] | Zou J J, Wei F J, Wang C, et al. Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid and Ca2+-mediated stomatal regulation in response to drought stress. Plant Physiol, 2010, 154(3): 1232-1243. |
| [13] | 路静,赵华燕,何奕昆,等. 高等植物启动子及其应用研究进展. 自然科学进展,2004,14( 8):856-862. Lu J, Zhao H R, He Y K, et al. Research and application of promoter in higher plants . Progress of Natural Science, 2004, 14(8): 856-862. |
| [14] | Gittins J R1, Pellny T K, Hiles E R, et al. Transgene expression driven by heterologous ribulose-1, 5-bisphosphate carboxylase/oxygenase small-subunit gene promoters in the vegetative tissues of apple (Malus pumila Mill.) . Planta, 2000, 210(2): 232-240. |
| [15] | 纪巍,李杰,朱延明,等.不同启动子调控的 DREB1A 基因对黄瓜的遗传转化.东北农业大学学报,2005,36(4):442-447. Ji W, Li J, Zhu Y M,et al. DREB1A gene drived by different promoters transformation into Cucumissativus. Journal of Northeast Agricultural University, 2005, 36(4): 442-447. |
| [16] | 聂利珍,于肖夏,李国婧,等. 拟南芥 AtCDPK1 基因克隆与转化马铃薯的研究.西北植物学报,2015,35(3):447-453. Nie L Z, Yu X X, Li G J, et al. Cloning and Transformation into potato of AtCDPK1 gene from Arabidopsis thaliana. Acta Botanica Boreall-occidentalia Sinica, 2015, 35(3): 447-453. |
| [17] | Xiong L, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress. Plant Cell, 2002, 14: S165-S183. |
| [18] | ZHu J K, Hasengawa P M, Bressan R A, et al. Molecular aspects of osmotic stress in plants. Critical Reviews in Plant Sciences, 1997, 16(3): 253-277. |
| [19] | Hasegawa P M, Bressan R A, Zhu J K, et al. Plant cellular and molecular responses to high salinity. Annual Review of Plant Physiology and Plant Molecular Biology, 2000, 51: 463-499. |
| [20] | 聂利珍. 拟南芥 AtCDPK1 在响应丁香假单胞菌和非生物胁迫中的功能分析. 呼和浩特:内蒙古农业大学,生命科学院,2008. Nie L Z. Functional Analysis of AtCDPK1 in Arabidopsis Response to Pseudomonas syringae and Abiotic Stresses. Huhhot: Inner Mongolia Agricultural University, College of Life Science,2008. |
| [21] | Yamaguchi, Shinozaki K, Shinozaki K. Arabidopsis DNA encoding two desiccation responsive rd29A genes. Plant Physiol, 1993, 101: 1119-1120. |
| [22] | Shinozaki K, Yamaguchi, Shinozaki K. Gene expression and signal transduction in water stress response. Plant Physiol, 1997, 115: 327-334. |
| [23] | Lin Q, Li J,Zhang G Y, et al. Isolation of cDNAs encoding two distinct transcription factors binding to DRE cis-acting element involved in cold-and drought-induced expression of Arabidopsis rd29A Gene . Tsinghua Science and Technology. 1999, 4(3):256-260. |
| [24] | 刘强,赵南明,Yamaguch S K,等.DREB类转录因子在提高植物抗逆性中的作用.科学通报,2000,45(11):11-17. Liu Q, Zhao N M, Yamaguch S K, et al. The role of DREB transcription factors in improving plant resistance. Chinese Science Bulletin, 2000, 45(11): 11-17. |
 2015, Vol. 35
2015, Vol. 35




