文章信息
- 李婷, 孙静, 赵相哲, 连立强, 谢富强
- LI Ting, SUN Jing, ZHAO Xiang-zhe, LIAN Li-qiang, XIE Fu-qiang
- 骨形成蛋白2/珍珠层粉/壳聚糖支架制备及生物性能研究
- Preparation and Characterization Testing of Bone Morphogenetic Protein2/ Pearl Powder/Chitosan Porous Scaffolds
- 中国生物工程杂志, 2015, 35(11): 1-6
- China Biotechnology, 2015, 35(11): 1-6
- http://dx.doi.org/10.13523/j.cb.20151101
-
文章历史
- 收稿日期: 2015-05-26
- 修回日期: 2015-07-13
2. 兰州大学第二医院 兰州 730010
2. The Second Hospital of Lanzhou University, Lanzhou 730010, China
肿瘤(为面骨缺损的主因)、创伤、感染等因素可造成颌面部骨组织不同程度的缺损,骨组织工程在解决这一难题上极具前景。骨组织工程的核心问题是支架材料的选择,制备一种理想的骨诱导物以获得良好的临床成骨效果,一直是骨修复研究的目标。壳聚糖(chitosan ,CS)在自然界中来源广泛,是一种可自然降解的天然有机物,无免疫原性,刺激性较小,具有良好的生物相容性,且能促进伤口的愈合 ,并有内在的抑菌活性[1]。但其机械性能较差,不易保持形状,单独作为骨修复材料尚有局限性,由于自身可形成多孔结构,利于细胞在内部生长,将其与其他无机或有机组分结合为复合材料,可望应用于骨组织工程。珍珠层粉(nacre powder,NP)来源于软体动物贝壳最内层,文石型碳酸钙是其主要成分,占95%,蛋白质、糖蛋白、多糖等有机质约占5%,这种结构与哺乳动物骨组织的排列极具相似性[2]。有研究表明[3],在体内可发生明显的成骨反应,但其生物降解速率较慢。Berland等[4]将珍珠层粉植入山羊骨组织内9个月后方可观察到有限的向内溶解现象,珍珠层粉在体内的形貌及降解性能是决定成骨的关键因素。若将珍珠层粉与其他材料复合成为多孔结构可望提高降解性能,更好的体现珍珠层粉的成骨性。骨形态发生蛋白-2(bone morphogenetic protein 2,BMP-2)是第一个被证明在体内对骨和软骨的生长及再生具有重要促进作用的形态发生蛋白。但BMP-2体内半衰期较短,直接植入体内易被稀释和水解[5],不能满足骨修复时间的需要,因此需要一种支架材料使其缓释,更好的发挥成骨效果。
本实验旨在制备一种用于修复并能促进面部骨缺损愈合的复合支架材料。通过冷冻干燥法将壳聚糖溶液与珍珠层粉混合,并负载BMP-2,制成rhBMP-2/NP/CS复合多孔支架,用以克服单一材料骨缺损修复的不足。
1 材料与方法 1.1 主要试剂及设备壳聚糖(脱乙酰度>92%,青岛海汇生物有限公司),珍珠层粉(细度500目,青岛捷世康生物科技有限公司),rhBMP-2(重组人骨形成蛋白-2,Sigma,美国),β-甘油磷酸钠(Sigma,美国),冰乙酸(烟台市双双化工有限公司),DMEM培养基(Gibco,USA),胎牛血清(杭州四季青,上海生工生物试剂有限公司)。
冷冻干燥机(宁波新芝生物科技股份有限公司),扫描电子显微镜(美国Kevex公司JSM-5600LV/日立s3400N型),Instron 微力试验机(德国Instron 825 University Avenue)
1.2 实验动物实验动物采用清洁级6~8周龄Wistar大鼠,体重175~200g,由甘肃中医学院实验动物中心提供。
1.3 骨形成蛋白2/珍珠层粉/壳聚糖多孔支架的制备将56%的β-甘油磷酸钠(β-GP)溶液以1∶7比例滴加入2%的壳聚糖乙酸溶液中,于冰浴下混合搅拌4h后,按理论质量比珍珠层粉∶壳聚糖(1∶1)加入珍珠层粉继续冰浴下搅拌48h,将共混液注入模具放置于-20℃预冻12h成型,后置负压真空冷冻干燥机-20℃冷冻48h。用磷酸盐缓冲液配制浓度为10μg/ml的重组人骨形成蛋白2(rhBMP-2)溶液,将制备好的珍珠层粉/壳聚糖支架组及壳聚糖支架组修剪成直径5mm、高8mm的圆柱体,置于rhBMP-2溶液中浸泡,比例为每毫升rhBMP-2溶液置一个圆柱体[6, 7]。2h后取出,真空冷冻干燥5h,20kGy 60Co辐照灭菌,4℃保存备用。
1.4 用光学显微镜和扫描电子显微镜观察支架形貌及孔径大小将支架材料进行断面喷金处理,导电胶粘于载物台上,用扫描电子显微镜观察支架材料的表面形态。并于液氮中冷冻后将支架材料切割成厚度小于1mm的薄片,置于光学显微镜下观察支架孔隙分布与孔径大小。
1.5 孔隙率测定根据阿基米德原理,采用比重瓶法测rhBMP-2/NP/CS支架孔隙率[8]。先称得空比重瓶的质量(m0),向瓶内注满无水乙醇称得质量(m1),再倒出瓶内将液体吹干,加适量待测材料于瓶内称重(m2),再次注满无水乙醇,抽真空使气泡完全消失后称重(m3)。多次测试求平均值。每次称重前需在25℃水浴锅静置以保持前后称重时的温度恒定。孔隙率(ρs)可计算得出:
无水乙醇在25℃的密度为0.789g/ml。
1.6 热重分析将1mg样品剪碎,坩埚研磨至约100目,使用德国Linseis公司STA PT1600综合分析仪研究支架的质量变化与热量变化的关系,探讨材料的热稳定性。升温速率为10℃/min,温度为25~300℃。
1.7 力学性能测试用Instron 微力试验机按GB/T 1041—2008[9]标准,将高8mm、直径5mm的圆柱体试样置于载物台上,调试加载速率为2mm/min,测定试样的抗压强度,记录应力应变曲线图。
1.8 复合支架rhBMP-2缓释性检测将灭菌后的复合支架在无菌条件下切成小块,电子微量天平称量调节使各块质量均为20μg,将试样各块分别置于EP管中,每管加1ml无菌PBS液后放于37℃细胞孵育箱,分别于 8h、16h、1d、3d、5d、7d、14d、21d、28d、35d后取出样品3件,将取出的样品放于-80℃冰箱保存,待检测备用。35d后用酶联免疫分析法测定各试样液体中rhBMP-2的浓度。
1.9 细胞黏附实验将消毒好的rhBMP-2/NP/CS多孔支架材料在无菌超净台中切成直径为5mm、厚为1mm的薄片,用10%血清浓度的DMEM培养液浸泡1d后,放入48孔细胞培养板中,将传至第3代的兔骨髓间充质干细胞调整为细胞浓度5×105个/ml的细胞悬液,每块材料自表面滴加细胞悬液20μl,设4个复孔。在温度37℃、5% CO2条件下孵育3h后每孔补加培养液500μl继续培养至5d(2d换液一次),随机取出一份样本,PBS冲洗3次后3%戊二醛固定,脱水干燥,表面喷金,扫描电子显微镜观察细胞黏附情况[8]。
1.10 组织相容性实验甘肃省中医学院动物实验中心提供的9只雄性清洁级 Wistar大鼠,6~8 周龄,体重 175~200g,饲养温度(22±2)℃,光照12h/24h,自由饮水。实验前先静养1周。10%水合氯醛280~350mg/kg体重剂量经腹腔注射麻醉后固定于鼠板。大鼠背部两侧做切口钝性分离皮下组织放置试件。左侧置rhBMP/NP/CS组支架,右侧置单纯壳聚糖试件做为对照。术后青霉素钠4万IU/(只·d)肌肉注射。分别于10d、20d、30d后各随机处死3只取材,10%福尔马林固定48h后,做石蜡切片,苏木精-伊红染色,镜下观察炎性反应情况[8]。
1.11 统计学分析应用SPSS18.0软件对相关结果进行卡方检验,双因素方差分析,P<0.05时为结果具有统计学意义。
2 结 果 2.1 rhBMP-2/NP/CS复合支架形貌观察图 1为rhBMP-2/NP/CS复合支架的外观形貌及镜下显微图像,图 1(a)为呈乳白色固体,表面可见多孔样结构;图 1(b)、图 1(c)为光学显微镜及扫描电子显微镜镜下图像,可见支架材料内部呈三维网状结构,由图像分析软件Image-Pro Plus 6.0得知孔径大小为100~300μm,且各孔隙之间有30~50μm的小孔分布,使孔隙相互联通。用比重瓶法测得材料的孔隙率为91.64%。

|
| 图 1 rhBMP-2/NP/CS复合材料形貌观察 Fig. 1 Images of rhBMP/NP/CS scaffold (a) Ordinary digital photo (b) OM,×250 (c) SEM,×200 |
图 2为rhBMP-2/NP/CS复合支架的质量随温度变化的热重曲线图。有学者检测了珍珠层粉经热处理前后的角壳蛋白含量变化,发现珍珠层粉经250℃处理2h后成分结构基本没有变化[10]。且由rhBMP-2/NP/CS复合支架的热重曲线图可以得知支架在体温下失重率较小,结构较为稳定,珍珠层粉内部的有机大分子的活性得以保存。
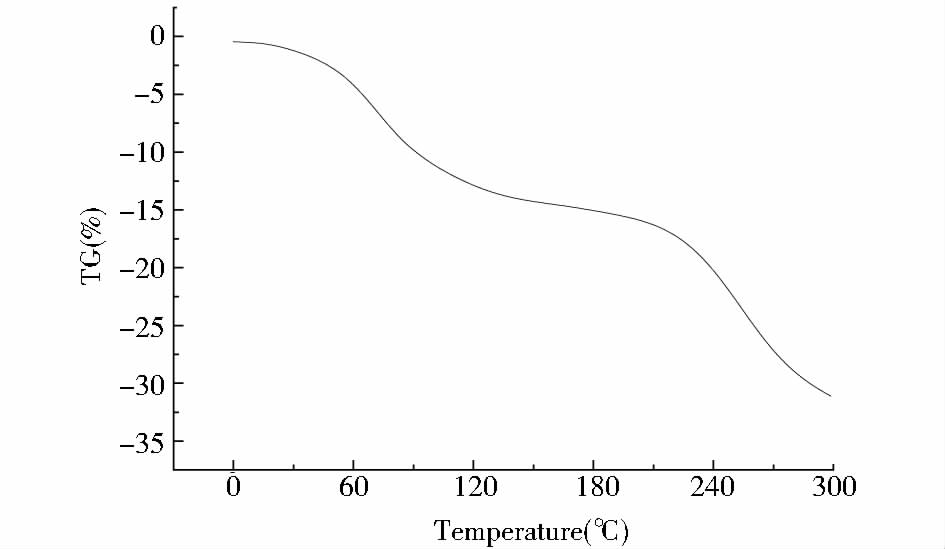
|
| 图 2 rhBMP-2/NP/CS热重曲线 Fig. 2 TG curves of rhBMP-2/NP/CS scaffold |
图 3为rhBMP-2/NP/CS复合支架压缩实验曲线图。结果显示,复合支架在压缩形变7mm时并无破坏,最大压缩应力为3.37MPa,接近人体松质骨组织工程的材料力学要求[11]。
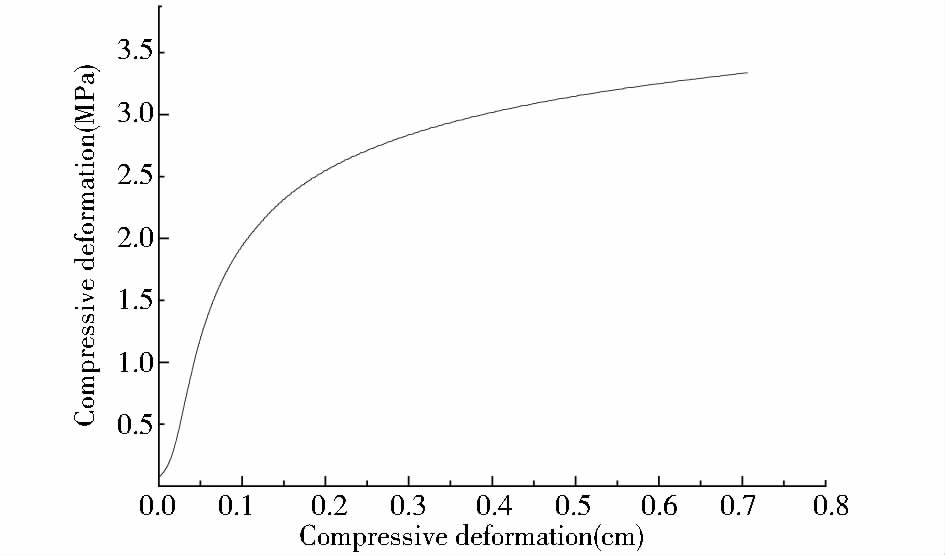
|
| 图 3 rhBMP-2/NP/CS支架力学性能曲线图 Fig. 3 Mechanical property of rhBMP-2/NP/CS scaffold |
图 4为rhBMP-2/NP/CS支架rhBMP-2缓释性能测定效果评价。曲线图显示初始时间段溶液中PBS浓度增速较快,可知复合支架中rhBMP-2在PBS液中1d、3d初始阶段有突释现象,在21d后,释放趋于平缓,复合支架可对rhBMP-2持续性缓释,如图 4所示,可望在体内持续发挥骨诱导作用。
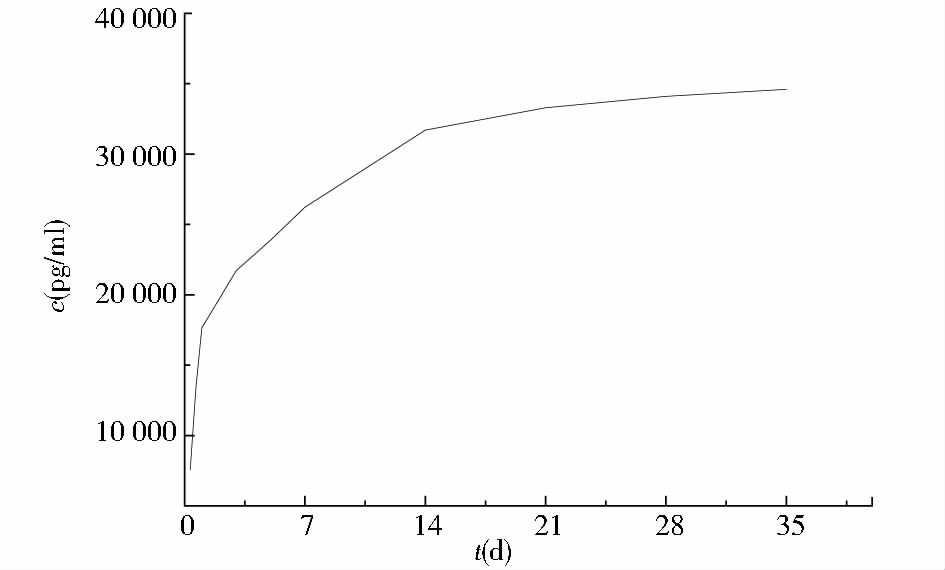
|
| 图 4 rhBMP-2/NP/CS支架rhBMP-2缓释性能测定 Fig. 4 Determination of controlled-release properties of rhBMP-2/NP/CS scaffold |
图 5为将rhBMP-2/NP/CS复合支架与兔骨髓间充质干细胞共培养5d后的扫描电子显微镜下影像。扫描电子显微镜下放大500倍时可见细胞首尾相接密集生长,镜下骨髓间充质干细胞呈长梭形,伸出伪足黏附在材料表面,生长状况良好,如图 5所示。
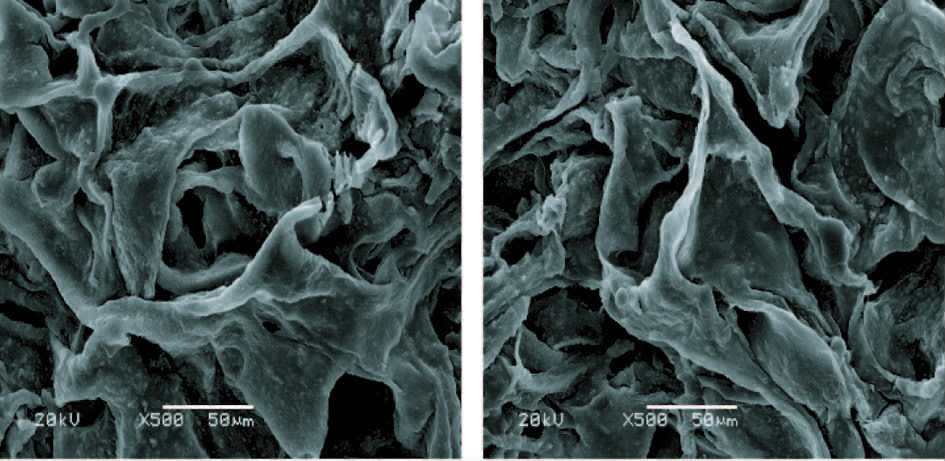
|
| 图 5 兔骨髓间充质干细胞黏附在材料表面 (扫描电子显微镜,×500) Fig. 5 MSCs adhered to the material surface (SEM,×500) |
复合材料植入大鼠体内术后10d、20d、30d后处死大鼠,取材可见壳聚糖对照侧与rhBMP/NP/CS实验侧均形成皮下结节,外被疏松纤维结缔组织包裹,直径大小随时间延长呈递减趋势,且实验侧结节小于对照侧。图 6所示为皮下埋置术后10d、20d、30d后的病理图片,组织学观察可见,10d时两侧试样周围均有纤维囊壁包绕,主要由成纤维细胞和胶原纤维构成,淋巴细胞浸润明显。20d时,囊壁厚度稳定,无继续增长现象,实验组较对照组囊壁较薄,炎性浸润较前缓解。30d时,实验侧及对照侧从结节外周向中心炎性细胞数目逐渐减少,试样周围可见小血管增生,逐渐形成疏松囊壁。
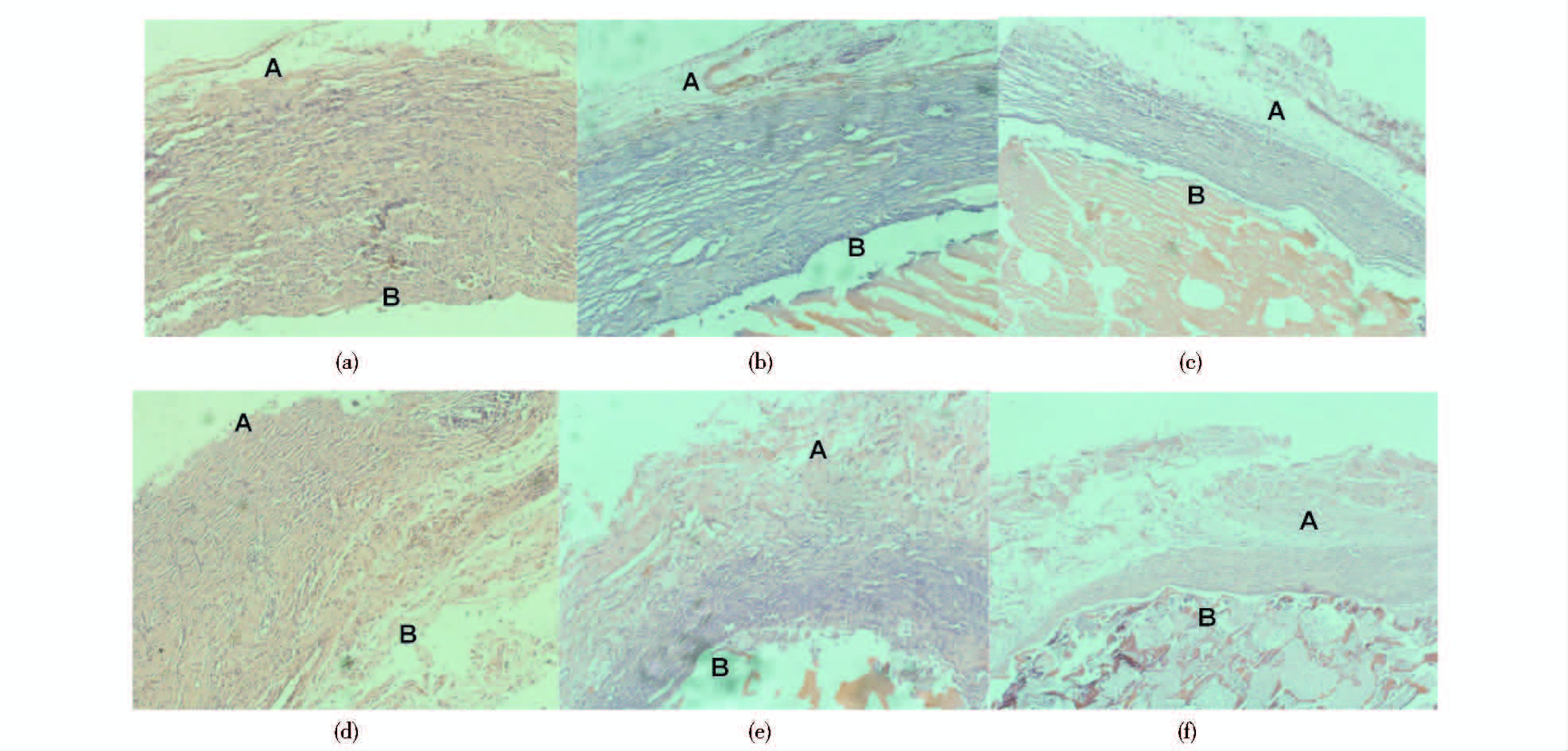
|
| 图 6 皮下埋置术后10d、20d、30d的病理图片(HE染色,×100) Fig. 6 10d,20d,30d later,pathologic observation in different groups (HE staining,×100)(a),(b),(c) Stand for control group of 10d,20d,30d (d),(e),(f) Stand for experimental group of 10d,20d,30d A: Tissue surface; B: Material surface |
对于颌面部骨组织缺损,目前临床上主要采取的治疗方式有自体骨移植、异体骨移植、骨替代材料,以及正处于探索阶段的组织工程技术,组织工程在修复颌面部组织缺损的研究中有很大发展前景,在一定程度上可以减轻其他传统术式的感染、排异反应、生物相容性差等风险。用冷冻干燥法合成复合支架,冻结温度密切影响孔径的大小,有研究证实[12]冻结温度越低时孔径越小,且冻结温度在-20℃时合成的材料孔径一般可达到100μm以上,所以本实验rhBMP-2/NP/CS复合支架的制备过程选择的冻结温度为-20℃,水作为天然的造孔剂,在冷冻干燥过后冰晶升华,所留下的腔隙即为支架的孔隙。有学者认为[13],骨组织工程支架材料的孔径应以100~500μm为宜,可为细胞在支架中生长提供充足的空间,保证支架内部细胞的营养输送和新陈代谢[14],孔径过小不利于骨细胞向内层渗透生长,而孔径过大则会影响支架的力学强度,且不易使细胞在支架表面黏附生长。rhBMP-2/NP/CS复合支架内部呈三维网状结构,孔隙无序分布,相互联通,孔径大小为100~300μm,孔隙率适宜,可作为支架材料诱导骨组织的形成。
rhBMP-2/NP/CS复合支架结构稳定,在体温下失重率较小,有良好的热稳定性,且力学性能较好,对rhBMP-2有持续性缓释作用。将兔骨髓间充质干细胞与复合支架直接接触培养,可见细胞在材料表面贴附生长,状态良好,增殖明显,并且在体内埋植实验中,实验组材料的周围炎性反应合格,说明rhBMP-2/NP/CS复合支架有良好的生物相容性和组织相容性,适宜作为组织工程支架材料。
珍珠层被认为是一种很有前途的骨诱导材料,含有一种或多种能够刺激骨形成的信号分子[15, 16],可调控羟基磷灰石在其表面快速沉积[17, 18, 19],羟基磷灰石是人体硬组织的主要无机成分,可进一步与固有组织产生化学结合,诱导骨组织的修复过程[20]。rhBMP-2/NP/CS复合支架制备时,将珍珠层粉加入到中性混合液中,最大程度的保存了珍珠层粉的结构完整,避免了珍珠层粉内部活性物质的破坏,并适量的加入骨诱导生长因子rhBMP-2,可望使复合支架的体内成骨效应更为显著。研究表明,珍珠层粉在一定程度上可促进rhBMP-2的表达,从而使细胞成骨性分化的诱导进程也得以促进[21, 22, 23]。且rhBMP-2/NP/CS复合支架中,珍珠层粉与壳聚糖的降解性可为rhBMP-2提供良好的缓释载体的作用,使支架性能更为优越。在后续实验中,我们将继续优化rhBMP-2/NP/CS复合支架的力学性能,并做动物体内实验,将rhBMP-2/NP/CS复合支架植入缺损部位观察成骨修复效果,以更好的应用于骨组织工程。
| [1] | Shahzad S, Yar M, Siddiqi S A, et al. Chitosan-based electrospun nanofibrous mats, hydrogels and cast films: novel anti-bacterial wound dressing matrices. Mater Sci Mater Med,2015,26(3):5462. |
| [2] | Kim H, Lee K, Ko C Y, et al. The role of nacreous factors in preventing osteoporotic bone loss through both osteoblast activation and osteoclast inactivation. Biomaterials, 2012,33(30):7489-7496. |
| [3] | Wang J J, Chen J T, Zhang X R. Nacre-induced osteogenesis in the femoral condyles of New Zealand rabbits. Journal of Southern Medical University, 2009, 29(2): 220-223. |
| [4] | Berland S, Delattre O, Borzeix S, et al. Nacre/bone interface changes in durable nacre endosseous implants in sheep. Biomaterials, 2005, 26(15): 2767-2773. |
| [5] | Lee E U, Lim H C, Hong J Y, et al. Bone regenerative efficacy of biphasic calcium phosphate collagen composite as a carrier of rhBMP-2. .http://www.ncbi.nlm.nih.gov/pubmed/25675639. |
| [6] | 孙晨,祝少博,禹志宏,等. 生物活性玻璃与壳聚糖复合骨修复材料的制备及细胞相容性的研究. 中华实验外科杂志, 2014, 31(2): 368-371. Sun C, Zhu S B, Yu Z H, et al. Preparation and cell compatibility of chitosan composite bioactive glass. Chinese Journal of Experimental Surgery,2014, 31(2): 368-371. |
| [7] | 刘学蔚,侯绪浩,陈怡憓,等. 正交优化白芨多糖复合支架材料的实验研究. 山东大学学报(医学版),2014, 52(3): 40-44. Liu X W, Hou X H, Chen Y H, et al. Experimental study of the bletilla striata glucomanan composited scaffolds by orthogonal experiment. Journal of Shandong University (Health Sciences), 2014, 52(3): 40-44. |
| [8] | 裴国献,魏宽海,金丹. 组织工程学实验技术. 北京:人民军医出版社, 2006:5. Pei G X, Wei K H, Jin D. Tissue Engineering Experimental Techniques. Beijing: People's Medical Publishing House, 2006:5. |
| [9] | 中华人民共和国国家标准.GB/T 1041-2008/ISO 604: 2002:塑料压缩性能的测定. 北京:中国标准出版社,2008. The National Standard of the People's Republic of China, GB/T 1041-2008/ISO 604:2002: Plastic Compression Performance Test. Beijing: China Standard Publishing House, 2008. |
| [10] | 夏静芬,钱国英,陈亮,等. 傅里叶变换红外光谱法对珍珠粉和贝壳粉的研究. 光谱实验室,2010,27(2): 524-527. Xia J F, Qian G Y, Chen L, et al. Study on the differentiation of pearl and conch powders by FTIR. Chinese Journal of Spectroscopy Laboratory, 2010,27(2): 524-527. |
| [11] | Hannink G, Arts J J. Bioresorbability, porosity and mechanical strength of bone substitutes: what is optimal for bone regeneration? Injury, 2011,42(2): 22-25. |
| [12] | 李容林, 李春阳, 张伟. 壳聚糖与I型胶原制备组织工程复合支架材料的扫描电镜研究. 中山大学学报(医学科学版), 2006,9(27): 557-561. Li R L, Li C Y, Zhang W. Micro-structure of composite tissue engineering scaffold of chitosan and typeⅠ collagen with scanning electron microscope. Journal of Sun Yat-Sen University(Medical Sciences), 2006, 9(27): 557-561. |
| [13] | Murphy C M, O'Brien F J. Understanding the effect of mean pore size on cell activity in collagen-glycosaminoglycan scaffolds. Cell Adh Migr,2010,4(3):377-381. |
| [14] | Karageorgiou V, Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials, 2005, 26(27): 5474-5491. |
| [15] | 陈亚保,黄甫,邓陈茂,等. 合浦珠母贝珍珠层粉微量化学成分的研究. 广东海洋大学学报,2007,27(4):93-95. Chen Y B, Huang F, Deng C M, et al. Research pearl oyster pearl powder trace chemical constituents. Journal of Guangdong Ocean University, 2007,27(4): 93-95. |
| [16] | Rousseau M, Boulzaguet H, Biagianti J, et al. Low molecular weight molecules of oyster nacre induce mineralization of the MC3T3-E1 cells. Biomed Mater Res,2008,85(2):487-497. |
| [17] | Shen Y, Zhu J, Zhang H, et al. In vitro osteogenetic activity of pearl.Biomaterials,2006,27(2):281-287. |
| [18] | Green D,Walsh D, Mann S, et al. The potential of biomimesis in bone tissue engineering: lessons from the design and synthesis of invertebrate skeletons. Bone,2002,30(6):810-815. |
| [19] | Ni M, Ratner B D. Nacre surface transformation to hydroxyapatite in a phosphate buffer solution.Biomaterials, 2003,24(23): 4323-4331. |
| [20] | Koutsopoulos S. Synthesis and characterization of hydroxyapatite crystals: A review study on the analytical methods. Journal of Biomedical Matericals Research, 2002,62(4):600-612. |
| [21] | Moutahir-Belqasmi F, Balmain N, Lieberrher M. Effect of water soluble extract of nacre (Pinctada maxima) on alkaline phosphatase activity and Bcl-2 expression in primary cultured osteoblasts from neonatal rat calvaria. Materials Science: Materials In Medicine, 2001,12(01):1-6. |
| [22] | Deckers M M, van Bezooijen R L, van der Horst G. Bone morphogenetic proteins stimulate angiogenesis through osteoblast-derived vascular endothelial growth factor A. Endocrinology Journal, 2002,143(04):1545-1553. |
| [23] | Green D W, Kwon H J, Jung H S. Osteogenic potency of nacre on human mesenchymal stem cells. Molecules and Cells,2015,38(3):267-272. |
 2015, Vol. 35
2015, Vol. 35




