文章信息
- 王蓉华, 孙秀娟, 李倩, 阎振鑫, Peter Proksch
- WANG Rong-hua, SUN Xiu-juan, LI Qian, YAN Zhen-xin, Peter Proksch
- 海洋功能分子间苯三酚的研究进展
- The Research Progress of Marine Functional Molecules Phloroglucinol
- 中国生物工程杂志, 2015, 35(10): 115-121
- China Biotechnology, 2015, 35(10): 115-121
- http://dx.doi.org/10.13523/j.cb.20151017
-
文章历史
- 收稿日期: 2015-04-02
- 修回日期: 2015-06-17
2. 威海市妇幼保健院 威海 264200
2. Weihai Municipal Maternal and Child Health Hospita Pharmacy Departmentl, Weihai 264200, China
间苯三酚,俗称根皮苷酚,英文名称为Phloroglucinol简称为phl。间苯三酚及其衍生物在自然界中广泛分布于陆生植物和海藻中,在海洋生物中主要是以聚合物的形式存在,形成具有生物活性和医药价值的褐藻多酚化合物,在褐藻门的许多科(绳藻科、萱藻科、墨角藻科、翅藻科、马尾藻科以及网地藻科等)中均有存在[1]。目前已经从褐藻中分离并鉴定出上百种褐藻多酚化合物[2, 3, 4, 5, 6, 7, 8]。例如,Glombitza等[8]在隶属4个目的23种褐藻中发现了间苯三酚的存在;Grombitza等[2]还从马尾藻Sargassum spinuligerum中分离出20种新的间苯三酚衍生物;Glombitza[5]从褐藻Cystophoratorulosa中分离出33种间苯三酚衍生物(1997);Sailler等[6]从褐藻Cystophora retroflexa中获得3种褐藻多酚,Glombitza等[7]从褐藻Carpophyllum angustifolium中分离得到4个间苯三酚衍生物(1999)。间苯三酚是一种重要的医药中间体,具有良好的抗病毒、抗肿瘤、抗菌、消炎、止血及收缩子宫等药理活性。另外,间苯三酚还可作为制备治疗心血管系统疾病、抗艾滋病[9, 10]及治疗急慢性肝炎药物的中间体。间苯三酚对多种挛性疼痛具有缓解作用[11];对怀孕期间子宫收缩具有辅助治疗作用[12]。与其它平滑肌解痉挛药相比,间苯三酚的副作用小、毒性极低,具有明显的市场优势。间苯三酚还可以作为染料偶合剂、轮胎增粘剂等用于精细化工行业,另外在重氮型复印、纺织品和皮革染色等行业也有应用[13]。除此之外,间苯三酚也可作为化学防腐剂应用于苹果防腐,其用途十分广泛。
据分析,间苯三酚在国内外的需求量正逐年上升,与此形成鲜明对比的是其生产技术落后,产量不足,产品质量跟不上医药产业的发展。目前,间苯三酚的生产主要是化学合成,虽然成本低,但产物复杂,环境污染严重;生物法制备间苯三酚有望解决化学合成存在的不足。因此,本文综述了目前生物制备间苯三酚的研究进展。
1 间苯三酚的化学合成法随着间苯三酚应用的不断开发,需求量日益增加,其合成方法也得到不断的发展和完善。 目前已用于工业化大生产的间苯三酚的合成方法主要有 4 种:(1)三硝基甲苯法,最早由Kastens等[14]开发出来,以2,4,6-三硝基甲苯(TNT)为原料,进行工业化生产间苯三酚。此法的优点是原料便宜、生产工艺成熟,存在的缺点是后处理较难、污染环境且原料存在安全隐患。(2)异丙苯法,简称TIP法,是由日本的Chiyoda等[15, 16, 17] 开发出来的以1,3,5-三异丙基苯(TIP)为原料的工艺合成路线,此方法优点在于污染小,成本低。尽管此法经过后期不断改进和工艺优化,但是因为原料获得困难的问题,限制了该方法的推广应用。(3)苯胺法,以苯胺为原料,先合成三溴苯酚 ,再生成间苯三酚[18],或者直接以三溴苯酚为原料合成,该法收率高,成本低,原料来源广泛,价格相对较低,是合成间苯三酚的一种新型方法。缺点是路线长,影响因素较多,生产稳定性不够,并且溴水对设备有一定的腐蚀。(4)六氯苯法,1981年美国专利[19]报道以六氯苯为原料合成间苯三酚。该方法反应条件温和,副产物少,成本较低,是合成间苯三酚的一种十分有效的方法。此路线的主要问题是酸分解,收率较低且废酸的处理困难,同时原料六氯苯毒性较大也是需解决的问题之一。目前,我国对间苯三酚的合成研究较少,主要集中在以TNT 或苯胺为原料的合成路线上。
2 间苯三酚的生物合成法 2.1 间苯三酚的生物合成机制 2.1.1 控制间苯三酚合成基因的发现目前,假单胞菌是报道最多的能够产生间苯三酚及其衍生物的野生菌株。20世纪80年代以来,许多国家将荧光假单胞菌应用于小麦全蚀病的防治,并取得了良好的成效。研究发现:荧光假单胞菌能够产生2,4-二乙酰基间苯三酚(2,4-DAPG)和乙酰基间苯三酚(2-MAPG)[20]。1996年,Bangera等[21]首次从荧光假单胞菌Q2-87中分离得到合成2,4-DAPG的基因簇,并于1999年提出2,4-DAPG的合成过程共有6个控制基因(phlFACBDE)[22]。随着基因测序技术的提高,2,4-DAPG的生物合成、管理、输出和降解等所有的基因全部定位为一个8.2kb的DNA 片段,称为间苯三酚基因簇(phl),并预测其共含有8个开放阅读框(ORFs):phlH,phlG,phlF,phlA,phlC,phlB,phlD 和phlE[23]。2005年Achkar等[24]在研究2,4-DAPG的合成机制时,发现荧光假单孢菌Pf-5的phlACBDE基因簇除了合成2,4-DAPG 和2-MAPG外,还可以合成间苯三酚。如果在荧光假单孢菌的phlD基因中插入一个转座子,使其功能丧失,便检测不到2,4-DAPG 和2-MAPG的产生;但是在其中加入2-MAPG,便可检测到2,4-DAPG的存在。由此表明phlD基因在2-MAPG的合成中起关键作用,而phlABC则在控制2-MAPG转化为2,4-DAPG的过程中起关键作用。进一步研究发现phlACB与前体碳酰辅酶A的合成有关,而phlD基因指导合成的phlD蛋白在碳酰辅酶A聚酮缩合成长链、长链环化、苯环乙酰化等一系列反应过程中起催化作用,是控制间苯三酚合成的关键基因[25]。同时Achkar等[24]还发现在大肠杆菌中仅克隆phlD基因便能够合成间苯三酚,其产量可达720mg/L,更加确定了phlD基因是间苯三酚合成的关键基因。
2.1.2 phlD蛋白催化合成间苯三酚的途径催化合成间苯三酚的关键酶phlD与Ⅲ型聚酮合酶(Ⅲ type polyketide synthase,PKSⅢ)之一查尔酮合酶(chalcone synthase,CHS)具有较高同源性,其结构和功能的相似性都很高[26]。间苯三酚本身可作为黄酮及类黄酮合成的中间体,其合成和代谢途径可能与CHS催化合成黄酮及类黄酮类物质的途径相似,因此我们可以推测phlD在间苯三酚合成途径中的作用。
以phlD基因在大肠杆菌中的异源表达为例,可推测其催化途径如图 1所示,葡萄糖进入EMP途径之后,产物丙酮酸经丙酮酸脱羧酶转化为乙酰辅酶A,乙酰辅酶A在乙酰辅酶A羧化酶的作用下生成丙二酸单酰辅酶A。3分子的丙二酸单酰辅酶A经过phlD催化聚酮缩合形成中间体3,5-庚二酮乙酯,再经过长链环化、侧链脱羧等一系列反应形成带有酚羟基对称结构的间苯三酚[27, 28]。
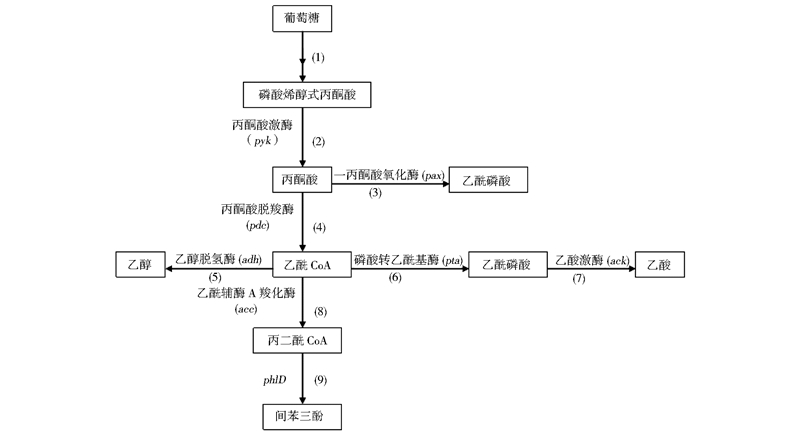
|
| 图 1 微生物中生物法合成间苯三酚化合物的途径 Fig. 1 The biosynthesis passway of phloroglucinol compounds in microorganisms |
生物合成法生产间苯三酚受到几个不同方面的限制,比如间苯三酚自身的理化性质,phlD催化过程中底物、关键酶等的限制,基因工程菌高密度发酵条件的影响等。针对以上限制因素,可以从以下几个方面采取措施来提高间苯三酚的表达量。
2.2.1 提高大肠杆菌对间苯三酚的耐受性间苯三酚是许多抗生素的前体,由于它自身的毒性,限制了其在发酵条件下产量的增加。参考文献[29]报道,间苯三酚浓度达到0.5 g/L时,将显著抑制大肠杆菌细胞生长。因此提高大肠杆菌对间苯三酚的耐受性是提高间苯三酚产量的关键。多重抗生素耐药基因(mar)是大肠杆菌中的一个普遍的抗性基因簇,研究显示其对多种抗生素、消毒剂和有机溶剂等具有耐药性[30]。因此,通过提高marA基因的表达可以提高大肠杆菌对间苯三酚的耐受性。
2.2.2 增强间苯三酚合成途径中的关键酶由于phlD 催化合成间苯三酚是以丙二酸单酰辅酶A 作为唯一底物,所以大肠杆菌中丙二酸单酰辅酶A 的浓度高低对间苯三酚的产量有很大的影响。研究发现,乙酰辅酶A 羧化酶(ACCase)是催化乙酰辅酶A合成丙二酰辅酶A的关键酶,因此提高大肠杆菌中ACCase的表达量,从而增加基因工程菌中丙二酸单酰辅酶A的含量,可能会提高间苯三酚的产量[31]。
2.2.3 降低间苯三酚合成途径中的竞争酶应用代谢工程技术对工程菌进行改良,敲除或者降低间苯三酚合成途径中的竞争酶,抑制非间苯三酚代谢产物的代谢途径,是提高间苯三酚表达量的重要途径。
乙酸是大肠杆菌的主要副产物之一,乙酸浓度过高会影响细胞的生长。当乙酸浓度超过1.0~ 1.5g/L时,重组外源基因的表达会大幅度降低[32]。阻断乙酸产生的主要途径可以采用Red重组法,得到△ackA-pta的变株[33],降低乙酸副产物的同时提高胞内乙酰CoA的水平。
2.3 提高生物制备间苯三酚产量的研究现状荧光假单胞菌是文献报道最多的能够产生间苯三酚及其衍生物的天然菌株,但是产量极低,其遗传背景和中心代谢过程尚未研究清楚。因此,很多研究通过将phlD基因转化到大肠杆菌体内异源表达,并利用大肠杆菌细胞内的生物酶体系和原料来合成间苯三酚。
2005年,研究者发现仅将phlD基因转入大肠杆菌JWF1(DE3)中异源表达,就能够产生间苯三酚,并且产量达到780mg/L[23]。2009年,Gao等[34]采用pET28载体克隆了荧光假单胞杆菌2P24菌株中的phlD基因。在震荡培养条件下经过36~48h,可检测到的间苯三酚的最高产量为166mg/L。2008年,Zha等[35]对phlD酶进行分子定向进化来提高其催化活性,从而提高间苯三酚产量。他们筛选到的两个突变株的间苯三酚产量比野生菌株分别提高了4.2倍和5.7倍。为了进一步提高间苯三酚的产量,2009年,Zha等[36]把磷酸转乙酰基酶-乙酸激酶A(图 1中途径6、7)和乙醇脱氢酶(图 1途径5)同时敲除,同时阻断了乙酸途径和乙醇途径,检测到间苯三酚的产量达到原来的3.7倍,产量达1280mg/L。与Achkar等[24]的研究相比,间苯三酚的产量随着培养时间的增长而增加。2011年,Cao等[29]将marA基因和大肠杆菌中的ACCase基因共表达,在间歇发酵培养条件下,目的菌株的间苯三酚积累量可高达3.8g/L。在Cao的另外一篇论文[37]中发现,使用源自fic基因的稳定期启动子及高拷贝质粒在大肠杆菌中表达phlD,在摇瓶条件下此工程菌株的间苯三酚产量可以达到0.28g/L,消耗的葡萄糖中有9.2%转化成了间苯三酚。对phlD基因进行定点突变也可以提高间苯三酚的产量。2010年,咸漠等[38]在其专利中定点突变phlD基因为phlD1基因,使间苯三酚的产量达到8g/L。2013年,Rao等[39]对phlD基因进行定向改造,提高了其热稳定性,使间苯三酚的产量达到3.65g/L。表 1 是提高生物法制备间苯三酚产量的研究现状总结。
间苯三酚作为一种精细化工产品,在工业和医药领域的广泛应用与其合成困难形成鲜明对比,尤其是间苯三酚在医药产业中的应用对其纯度有了更高的要求。生物法合成间苯三酚可以改善化学法的种种弊端,如原料来源困难、副产物多、分离提纯难等。基因工程菌发酵生产间苯三酚的原料简单易得,发酵周期短,产物的得率和纯度也有望提高。表 2是对间苯三酚的化学合成和生物合成法的比较。
| 化学合成法 | 生物合成法 | |
| 原料 | 主要以TNT和苯胺等化学原料为主,成本高 | 多糖类物质,成本低廉 |
| 合成原理 | 化合物之间的基团反应 | 基因工程菌中外源基因的表达合成 |
| 产物的分离纯化 | 氧化以及酸分解的过程中副产物较多,分离提纯困难 | 待研究 |
| 安全性 | 存在爆炸隐患,原料和中间体具有一定的毒性 | 安全,无爆炸隐患 |
| 环境污染 | 反应过程中产生大量的三废,环境污染比较严重 | 环境友好 |
间苯三酚作为一种重要的医药中间体,可以合成多种医药产品,由间苯三酚合成的Euglobals类似物能有效抑制EPsetin-Barr病毒,具有显著的抗癌作用。Medichem Research公司在1996年采用间苯三酚合成了抗HIV病毒的新药[40]。此外,间苯三酚作为制备黄酮、异黄酮等抗癌、抗心血管疾病类药物的中间体有着广阔的市场前景[41]。间苯三酚还能合成抗菌素2,4-DAPG,作为治疗心脑血管疾病药物如类黄酮药物的合成中间体,具有一定市场经济价值[42]。
间苯三酚在妇产科领域也具有广泛的应用价值,可以用于治疗妊娠时的剧烈呕吐[43];在分娩过程中,可以缩短分娩时间,提高正常分娩率[44];在人工流产术中,降低人工流产综合征的发生率,且镇痛效果好[45];对妇科痉挛性疼痛具有缓解作用,在治疗原发性痛经上具有显著疗效;还可用于怀孕期间子宫收缩的辅助治疗。
此外,间苯三酚本身也是一种优良的医药产品和性能优越的抗氧化剂,早已广泛用于抗菌、抑制脾脏酪氨酸激活酶以及苹果防腐等[46]。临床上应用间苯三酚治疗平滑肌痉挛性腹痛安全且有效,它直接作用于胃肠道和泌尿生殖道的平滑肌,与其他平滑肌解痉药相比,间苯三酚的解痉挛效果明显,作用迅速,不具有任何阿托品样副作用,不良反应极少,耐受性好[1],在泌尿科胃肠科妇产科等得到了广泛的临床应用,已成为治疗痉挛性疼痛的首选药物,用药安全有效,质量可控。目前还发现间苯三酚潜在的一个新功能,它可以调节内皮祖细胞的生物活性,甚至抑制肿瘤发生,因此,间苯三酚有潜力成为抗癌的生物安全药物[47]。
4.2 间苯三酚在农业方面的应用间苯三酚除了在医药领域具有应用价值,在农业方面也得到了广泛运用,主要体现在其衍生物的多重功能性上。间苯三酚的衍生物种类繁多(如DAPG和2,4-DAPG),具有抗微生物(真菌、抗细菌、抗病毒)、抗虫害(抗蠕虫,抗植物病原体)、抗逆性(抗变应性,抗氧化)等多种生物活性[48]。Weller等[49]早在1983年已发现荧光假单胞菌可以控制土壤植物病害的传播,后来证实是其产生的2,4-DAPG起主要作用[49]。它的作用特点是拮抗性强,抗菌谱广,是一种广谱抗生素,也是一种极有潜力的抗生素资源[50]。20世纪80年代以来,2,4-DAPG作为抗生素开始广泛用于生物防治,能够防治多种土传病原菌引起的根部病害和苗期病害,尤其是对小麦全蚀病的防治,并取得了良好的成效。
5 结语和展望间苯三酚作为一种高附加值产品在国际上的需求猛增。但其化学合成方法比较复杂,设备要求高,而且环境污染严重,成本优势不明显。采用生物法具有原料来源丰富,污染小,成本低等优点。本研究总结了间苯三酚的生物合成机制及提高其生物合成产量的研究现状。近期的研究虽然通过一系列方法提高了生物制备间苯三酚的产量,但仍然不能满足工业化生产的要求。因此,进一步提高生物制备间苯三酚的产量与质量,仍然是需要迫切解决的问题。
| [1] | Singh I P, Bharate S B. Phloroglucinol compounds of natural origin. Natural Product Reports, 2006, 23(4): 558-591. |
| [2] | Glombitza K W, Keusgen M. Fuhalols and deshydroxyfuhalols from the brown alga Sargassum spinuligerum. Phytochemistry, 1995, 38(4): 987-995. |
| [3] | Keusgen M, Glombitza K W. Phlorethols, fuhalols, and their derivatives from the brown alga Sargassum spinulligerum. Phytochemistry,1995,(04):975-998. |
| [4] | Keusgen M, Glombitza K W. Pseudofuhalols from the brown alga Sargassum spinuligerum. Phytochemistry, 1997, 46(8): 1403-1415. |
| [5] | Glombitza K W, Hauperich S. Phlorotannins from the brown alga Cystophora torulosa. Phytochemistry, 1997, 46(4): 735-740. |
| [6] | Sailler B, Glombitza K W. Phlorethols and fucophlorethols from the brown alga Cystophora retroflexa. Phytochemistry, 1999, 50(5): 869-881. |
| [7] | Glombitza K W, Schmidt A. Trihydroxyphlorethols from the brown alga Carpophyllum angustifolium. Phytochemistry, 1999, 51(8): 1095-1100. |
| [8] | Glombitza K W, Rösener H U, Vilter H, et al. Antibiotics from algae. 8. phloroglucinol from Phaeophyceae. Planta Medica, 1973, 24(4): 301-303. |
| [9] | Belekar V, Shah A, Garg P. High-throughput virtual screening of phloroglucinol derivatives against HIV-reverse transcriptase. Molecular Diversity, 2013, 17(1): 97-110. |
| [10] | Artan M, Li Y, Karadeniz F, et al. Anti-HIV-1 activity of phloroglucinol derivative, 6,6'-bieckol, from Ecklonia cava. Bioorganic & Medicinal Chemistry, 2008, 16(17): 7921-7926. |
| [11] | Jafri W, Yakoob J, Hussain S, et al. Phloroglucinol in irritable bowel syndrome. The Journal of the Pakistan Medical Association, 2006, 56(1): 5-8. |
| [12] | 汪艳红, 韩炜珍. 间苯三酚在产妇自然分娩中的临床应用. 中国医院药学杂志, 2004, 24(2): 96-99. Wang Y H, Han W Z. Clinical application of phloroglucinol in vaginal delivery. Chinese Journal of Hospital Pharmacy, 2004, 24(2): 96-99. |
| [13] | 诸爱士, 徐华新, 郑士辉. 间苯三酚的合成. 中国医药工业杂志, 2000, 31(2): 80-91. Zhu A S, Xu H X, Zheng S H. Synthesis of phloroglucinol. Chinese Journal of Pharmaceuticals, 2000, 31(2): 80-91. |
| [14] | Kastens M L, Kaplan J F. TNT into phloroglucinol. Industrial & Engineering Chemistry, 1950, 42(3): 402-413. |
| [15] | Chiyoda T, Hasegawa S, Nakamura M. Method for producing phloroglucin. U.S. Patent, 4,463,199, 1984-7-31. |
| [16] | Chiyoda T, Hasegawa S, Nakamura M. Process for producing phloroglucin. U.S. Patent, 4,469,899, 1984-9-4. |
| [17] | Chiyoda T, Hasegawa S, Nakamura M. Method for producing 1, 3, 5-triisopropylbenzene trihydroperoxides. U.S. Patent, 4,455,440, 1984-6-19. |
| [18] | 陈杨英, 赵德丰. 间苯三酚的合成研究. 染料工业, 2001, 38(4): 24-25. Chen Y Y, Zhao D F. Research of phloroglucinol synthesis. Dyeindustry, 2001, 38(4): 24-25. |
| [19] | Maegerlein H, Zielke R. Process for the preparation of phloroglucinol. U.S. Patent, 4,296,260, 1981-10-20. |
| [20] | Shanahan P, O'sullivan D J, Simpson P, et al. Isolation of 2,4-diacetylphloroglucinol from a Fluorescent pseudomonad and investigation of physiological parameters influencing its production. Appl Environ Microbiol, 1992, 58(1): 353-358. |
| [21] | Bangera M G, Thomashow L S. Characterization of a genomic locus required for synthesis of the antibiotic 2,4-diacetylphloroglucinol by the biological control agent Pseudomonas fluorescens Q2-87. Molecular Plant-microbe Interactions, 1996, 9(2): 83-90. |
| [22] | Bangera M G, Thomashow L S. Identification and characterization of a gene cluster for synthesis of the polyketide antibiotic 2,4-diacetylphloroglucinol from Pseudomonas fluorescens Q2-87. Journal of Bacteriology, 1999, 181(10): 3155-3163. |
| [23] | Moynihan J A, Morrissey J P, Coppoolse E R, et al. Evolutionary history of the phl gene cluster in the plant-associated bacterium Pseudomonas fluorescens. Appl Environ Microbiol, 2009, 75(7): 2122-2131. |
| [24] | Achkar J, Xian M, Zhao H, et al. Biosynthesis of phloroglucinol. Journal of the American Chemical Society, 2005, 127(15): 5332-5243. |
| [25] | Haas D, Keel C. Regulation of antibiotic production in root-colonizing Peudomonas spp. and relevance for biological control of plant disease. Annual Review of Phytopathology, 2003, 41(1):37-53. |
| [26] | Bender C, Rangaswamy V, Loper J. Polyketide production by plant-associated Pseudomonads. Annual Review of Phytopathology, 1999, 37(1):75-96. |
| [27] | Foo L Y, Lu Y, Howell A B, et al. The structure of cranberry proanthocyanidins which inhibit adherence of uropathogenic P-fimbriated Escherichia coli in vitro. Phytochemistry, 2000, 54(2): 173-181. |
| [28] | 朱峰, 乔建军. 聚酮合成酶底物专一性的研究进展. 中国抗生素杂志, 2006, 31(11): 641-650. Zhu F, Qiao J J. Progress in substrate specificity of polyketide synthase. Chin J Antibiot, 2006,31(11): 641-650. |
| [29] | Cao Y, Jiang X, Zhang R, et al. Improved phloroglucinol production by metabolically engineered Escherichia coli. Applied Microbiology and Biotechnology, 2011, 91(6): 1545-1559. |
| [30] | Randall L P, Woodward M J. The multiple antibiotic resistance (mar) locus and its significance. Research in Veterinary Science, 2002, 72(2): 87-93. |
| [31] | Davis M S, Solbiati J, Cronan J E. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli. The Journal of Biological Chemistry, 2000, 275(37): 28593-28604. |
| [32] | Atsumi S, Cann A F, Connor M R, et al. Metabolic engineering of Escherichia coli for 1-butanol production. Metabolic Engineering, 2008, 10(6): 305-311. |
| [33] | 高荣凯, 王芃, 王琰. 采用Red重组系统构建包装菌株DH-gIII. 微生物学杂志, 2008, 4(2): 87-91. Gao R K, Wang F, Wang Y. Adoption of Red recombination system to construct packing strain DH-gIII. Journal of Microbiology, 2008,4(2):87-91. |
| [34] | Gao Hai-Jun, Dan X, Yong-Zheng Y, et al. Cloning,expression and functioning of phlD genes from Pseudomonas fluorescens. Transactions of Beijing Institute of Technology, 2009, 29(5): 465-473. |
| [35] | Zha W, Rubin-Pitel S B, Zhao H. Exploiting genetic diversity by directed evolution: molecular breeding of type III polyketide synthases improves productivity. Molecular bioSystems, 2008, 4(3): 246-258. |
| [36] | Zha W, Rubin-Pitel S B, Shao Z, et al. Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering. Metabolic Engineering, 2009, 11(3): 192-178. |
| [37] | Cao Y, Xian M. Production of phloroglucinol by Escherichia coli using a stationary-phase promoter. Biotechnology Letters, 2011, 33(9): 1853-1858. |
| [38] | 咸漠, 杨建明, 李强, 等. 微生物催化合成间苯三酚技术. 中国, 2008102254011, 2012-08-15. Xian M, Yang J M, Li Q, et al. Microbial catalytic synthesis technology of phloroglucinol. China, 2008102254011, 2012-08-15. |
| [39] | Rao G, Lee J K, Zhao H. Directed evolution of phloroglucinol synthase PhlD with increased stability for phloroglucinol production. Applied Microbiology and Biotechnology, 2013, 97(13): 5861-5857. |
| [40] | Flavin M T, Rizzo J D, Khilevich A, et al. Synthesis, chromatographic resolution, and anti-human immunodeficiency virus activity of (±)-calanolide A and its enantiomers. Journal of Medicinal Chemistry, 1996, 39(6): 1303-1313. |
| [41] | Dinae F B, Sunzane H. Pharmacoloy and Therapeutics, 2001, 90(2), 157-177. |
| [42] | 高海军, 肖丹, 杨永政, 等. 荧光假单胞菌 phlD 基因的克隆, 表达及功能. 北京理工大学学报, 2009, 29(5): 465-470. Gao H J, Xiao D, Yang Y Z, et al. Cloning, expressing and functioning of phlD gene from Pseudomonads fluorescens. Journal of Beijing Institute of Technology,2009, 29(5): 465-470. |
| [43] | 白雅卉. 间苯三酚用于人工流产的临床观察. 吉林医学, 2010,31(15):2215. Bai Y H. Clinical of observation on abortion with phloroglucinol. Jilin Medical Journal, 2010,31(15):2215. |
| [44] | 刘桃. 斯帕丰(间苯三酚) 在产程中应用的对比观察. 医学理论与实践, 2009, 22(1):18. Liu T. A comparative observation of the effect of spasfon in labour progression. The Journal of Medical Theory and Practice, 2009, 22(1):18. |
| [45] | 吴爱雪,张雷.间苯三酚针治疗妊娠剧吐50例临床观察.现代医药卫生, 2013, 29(3): 424. Wu A X, Zhang L. Clinical observation of 50 cases of phloroglucinol injection in the treatment of hyperemesis gravidarum. Modern Medicine & Health, 2013, 29(3): 424. |
| [46] | 汪宝和, 杨念勇. 间苯三酚合成研究进展. 现代化工, 2003 (z1): 41-43. Wang B H, Yang N Y. Research progress of 1,3,5-Benzenetriol. Modern Chemical Industry, 2003 (z1): 41-43. |
| [47] | Kwon Y H, Jung S Y, Kim J W, et al. Phloroglucinol inhibits the bioactivities of endothelial progenitor cells and suppresses tumor angiogenesis in LLC-tumor-bearing mice. PloS One, 2012, 7(4): e33618. |
| [48] | Liliana M, Mwadham M. Model structures for the study of acylated phloroglucinols and omputational study of the caespitate molecule. Journal of Molecular Structure, 2006, 805: 39-52. |
| [49] | Weller M, Cook J. Suppression of take-all of wheat by seed treatments with Fluorescent pseudomonads. Phytopathology, 1983, 73: 463-469. |
| [50] | 王烨. 产抗生素2,4-diacetyl phloroglucinol(Phl)荧光假单胞菌的分离鉴定及Phl合成基因的克隆. 北京:中国农业大学博士学位论文. Wang Y. Isolation and detection of 2,4-diacelyl phlorogluciniol(Phl)-producing Fluorescent pseudomonads and cloning of phl gene.Beijing:China Agricultural University, 2001. |
 2015, Vol. 35
2015, Vol. 35




