文章信息
- 夏烨, 黄惟巍, 杨旭, 孙鹏艳, 姚月婷, 王世杰, 刘存宝, 孙文佳, 白红妹, 姚宇峰, 马雁冰
- XIA Ye, HUANG Wei-wei, YANG Xu, SUN Peng-yan, YAO Yue-ting, WANG Shi-jie, LIU Cun-bao, SUN Wen-jia, BAI Hong-mei, YAO Yu-feng, MA Yan-bing
- 利用不同碳源进行毕赤酵母高密度发酵及TEF-1启动子指导下的HPV16_L1蛋白表达
- The Effects of Carbon Source on High-density Fermentation of Pichia pastoris and HPV16_L1 Expression under the Control of Constitutive TEF-1 Promoter
- 中国生物工程杂志, 2015, 35(10): 39-43
- China Biotechnology, 2015, 35(10): 39-43
- http://dx.doi.org/10.13523/j.cb.20151006
-
文章历史
- 收稿日期: 2015-06-15
- 修回日期: 2015-06-30
2. 云南省重大传染病疫苗研发重点实验室 昆明 650118;
3. 云南省重大传染病疫苗工程技术研究中心 昆明 650118
2. Yunnan Key Laboratory of Research and Development on Severe Infection Disease, Kunming 650118, China;
3. Yunnan Engineering Research Center of Vaccine Research and Development on Severe Infectious Disease, Kunming 650118, China
人类乳头瘤病毒(HPV)的感染主要引起子宫颈癌,以及外阴癌、阴茎癌、口咽鳞状上皮细胞癌及头颈癌等[1]。研究显示超过 70%的子宫颈癌由 HPV16与18型引起[2]。针对以HPV16和18基因型为主的HPV疫苗的研发与应用对于控制HPV感染引起的疾病具有重要意义。目前,国外已有3个HPV预防性疫苗上市。但价格昂贵,对于发展中国家而言,需要进一步摸索简易、高效的疫苗制备技术,并研发自己的疫苗。Merck公司针对HPV16和HPV18的 二价疫苗Cervarix是利用杆状病毒-昆虫细胞表达系统制备的L1蛋白病毒样颗粒(VLPs)[3],而GSK生产的四价疫苗Gardasil [4]和九价疫苗Gardasil 9[5]利用酿酒酵母表达系统制备。国内目前处于临床试验阶段的二价HPV预防性疫苗则分别采用了大肠杆菌以及毕赤酵母表达系统[6]。
毕赤酵母是嗜甲醇酵母[7],可利用简单碳源如甲醇等进行生长,作为一个外源蛋白表达系统,具有容易操作、生长迅速、易于实现高密度发酵、生产成本低等优点,同时具有真核细胞的翻译后修饰加工功能[8, 9]。在毕赤酵母中进行外源基因表达多采用甲醇氧化酶1(AOX1)启动子[10],其基本上可以说是毕赤酵母中最强的启动子,应用AOX1启动子已经成功表达了数百种外源蛋白[11]。然而,甲醇易挥发、易燃、有毒,以及其高氧化性代谢产物对细胞生长的毒性,在一定程度上影响了它的应用。TEF-1主要负责将氨酰基tRNAs运输到核糖体,是细胞中最丰富的可溶性蛋白之一,其启动子的特点是组成型表达,具有强活性[12, 13]。TEF-1启动子在发酵过程中不需要甲醇诱导,目的蛋白即可持续表达,这一优点对于稳定的、非毒性的异源蛋白的表达制备,较之诱导性启动子而言具有潜在的巨大优势。
我们之前的报道显示,在摇瓶条件下,不同碳源对毕赤酵母细胞的生长以及HPV16_L1蛋白表达存在较大的影响[14]。因此,本研究拟在发酵罐条件下,进一步探索和研究甘油、甲醇、葡萄糖、山梨醇等不同碳源,对细胞高密度生长及TEF-1启动子表达HPV16_L1蛋白的影响,为HPV L1蛋白简易、经济的规模化制备提供基础。
1 材料与方法 1.1 材 料 1.1.1 菌株及质粒毕赤酵母菌株PichiaPink strain1与表达质粒pPink-HC 及pPink-LC 均购自美国Invitrogen公司;含有毕赤酵母TEF-1启动子,并表达HPV16_L1的重组质粒pPinkTEF-HPV16_L1以及重组菌株由本实验室构建并保存。
1.1.2 化学试剂山梨醇和生物素均购自美国BD 公司;无机盐、甘油、葡萄糖、甲醇等国产分析纯试剂均购自昆明酷升经贸有限公司;酵母膏、蛋白胨购自0xoid公司;消泡剂购自Sigma公司;HPV 16_L1单克隆抗体和HRP 标记的兔抗鼠IgG 购自美国Santa Crutz 公司;显色底物Pierce ECL 购自美国Thermo 公司。
1.1.3 培养基YPG培养基:1%酵母膏;2%蛋白胨;2%甘油。
发酵基础培养基(BSM):85% H3PO4 26.7 ml/L,CaSO4 0.93 g/L,K2SO4 18.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油/甲醇/葡萄糖/山梨醇40.0 g/L,PTM1 4ml/L,用25%氨水调至pH5.0。
微量元素(PTM1): CuSO4·5H2O 6.0 g/L,MgSO4·H2O 3.0 g/L,H3BO3 0.02 g/L,ZnCl2 20.0 g/L,Biotin 0.20 g/L,NaI 0.08 g/L,Na2MoO4 0.2 g/L,CoCl2 0.5 g/L,FeSO4·2H2O 65 g/L,H2SO4 5.0 ml/L。
补料生长培养基:50%甘油/甲醇/葡萄糖/山梨醇(含有12ml/L PTM1)。
1.1.4 仪器1.5L小型发酵罐为荷兰APPLIKON biotechnology公司产品;微量蛋白电泳仪及湿电转膜仪为Bio-Rad 公司产品;Eppendorf Biophotometer 分光光度计为德国Eppendorf 公司产品。
1.2 方 法 1.2.1 种子液制备使用保存在-80℃的TEF-HPV16_L1甘油菌划YPD平板,于30℃恒温培养箱培养60h,挑取单菌落接种于100ml YPG培养基中,260r/min、28℃培养48h后保存甘油菌。将甘油菌按1‰的比例接种入装有100ml YPG培养基的1L三角培养瓶中,280r/min、28℃培养48h,OD600达到8~10即可。
1.2.2 发酵罐高密度发酵配制发酵罐基础培养基500ml,加入1.5L发酵罐中121℃、15min高压灭菌待用。调节罐体温度至28℃,使用25%氨水和10%磷酸调节pH至5.0,加入2ml PTM1,并接种种子液50ml,启动发酵程序。使用甘油、甲醇、葡萄糖、山梨醇四种碳源在毕赤酵母中进行高密度发酵表达HPV16_L1蛋白,根据溶氧(DO)曲线变化来控制碳源的流加时间和流速。每隔12h取样一次,检测相应数值,包括OD600和菌体湿重。发酵过程中要始终保持温度在28℃,pH控制在5.0,溶氧控制在30%左右。发酵144h后收集发酵液备用。
1.2.3 OD600的检测将菌体稀释至OD600值在0.2~0.6之间,然后使用Eppendorf Biophotometer 分光光度计测定,并计算总的OD600值以反映菌体密度。
1.2.4 湿重检测称取1.5ml EP管重量,将样品各取1ml,13 000r/min离心5min,去掉上清,称重,计算出菌体湿重值。
1.2.5 Western blot检测HPV16_L1蛋白表达分别将培养0、12、24、36、48、60、72、84、96、108、120、132、144 h所取菌液的OD600值调整至2.0,各取200 μl,13 000g/min离心5 min,弃上清,沉淀用ddH2O 100μl重悬后,加入100μl 2×SDS loading buffer,沸水浴10 min,各取8μl蛋白,经12 % SDS-PAGE 分离后,以20V恒压45min半干转移至PVDF 膜上,以5 %脱脂奶粉封闭1 h;然后加入鼠抗HPV 16 L1单克隆抗体(1∶500 稀释),室温孵育1h;TBST 洗涤3 次,每次5 min,加入HRP 标记的兔抗鼠IgG(1∶8 000 稀释),室温孵育1 h;TBST 洗涤3 次,TBS洗涤2 次,每次5 min,加入ECL 底物显色液,室温孵育2 min,以X 光片曝光显色。应用Image Lab软件对目的条带进行密度分析,以条带密度值为纵坐标,培养时间为横坐标作图。
2 结 果 2.1 毕赤酵母利用不同碳源生长、增殖情况发酵结果如图 1所示。毕赤酵母利用甘油作为碳源时生长状态最好,呈S型曲线增长,在0~24h处于滞留期,24h~96h呈对数增长,而在96h后增殖缓慢,开始进入平台期,菌体湿重可达到510g/L。而甲醇和葡萄糖作为碳源能达到的菌体湿重较之甘油相对较低,为220g/L左右,但仍实现了超过150g/L的高密度发酵。山梨醇作为唯一碳源时则显示酵母菌未能在发酵罐中有效生长。
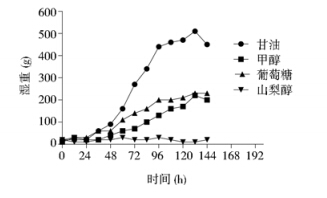
|
| 图 1 毕赤酵母在不同碳源环境中的增殖曲线 Fig. 1 Pichia pastoris proliferation curve in different carbon source |
将所取样品进行Western blot检测分析,结果如图 2所示。毕赤酵母细胞分别利用甘油、甲醇、葡萄糖三种碳源进行生长,都能实现TEF-1启动子指导下的HPV16_L1蛋白有效表达。通过光密度扫描对条带进行半定量分析,结果如图 3所示,随着发酵过程的进行,蛋白表达量在24h~36h之间达到最大的单位表达率。之后蛋白表达量开始下降。在甘油中HPV16_L1蛋白表达量在72h后快速下降,葡萄糖中蛋白表达量在60h后显著下降,而在甲醇中则维持了一个相对较高较稳定的蛋白表达水平。
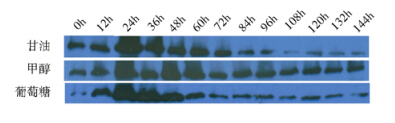
|
| 图 2 Western blot分析在毕赤酵母中不同碳源指导下HPV16_L1的表达 Fig. 2 The expression of HPV 16_L1 in different carbon source by Western blot |
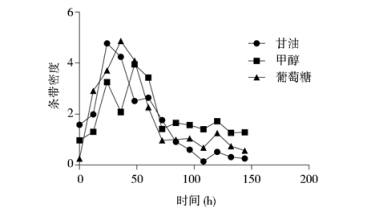
|
| 图 3 HPV16_L1 蛋白在不同碳源中表达的Western blot 相对定量分析 Fig. 3 The expression of HPV 16_L1 protein in different carbon source by Western blot relative quantification |
以条带密度代表单位体积的菌体中HPV16_L1蛋白表达量,乘以菌体湿重所代表的总生物量,得到一个数值以反映总的目的蛋白产量(图 4)。在48~96h期间,利用甘油为唯一碳源,可获得L1蛋白的高得率,并在60~72h达到最高。在以甲醇为碳源时,总体上L1蛋白总量持续获得增长,但最高水平仅达到甘油最高值的3/5左右。以葡萄糖作为碳源,L1总蛋白量在48h达到最高,与甲醇最高水平相当,此后在小范围内波动。
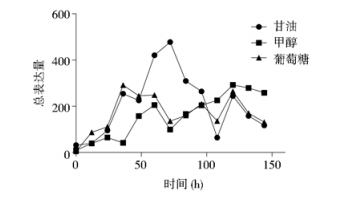
|
| 图 4 HPV16_L1蛋白在不同碳源中不同时间点表达总产量 Fig. 4 The total expression yield of HPV 16_L1 protein in different carbon source at different time points |
我们以前在摇瓶中使用不同碳源培养毕赤酵母,在TEF启动子指导下进行HPV16_L1蛋白表达。研究发现,在甘油和葡萄糖中,菌体生长较快,而在甲醇和山梨醇中则仅能达到甘油和葡萄糖一半的生长速率。显示了不同碳源利用,对菌体的生长产生了显著的影响。此外,不同碳源之间HPV16_L1蛋白的表达效率同样存在很大差异。菌体快速增殖的甘油和缓慢增殖的山梨醇能够持续获得单位菌体中HPV16 _L1蛋白的高表达率,而快速增殖的葡萄糖和缓慢增殖的甲醇中的表达却在12 h后迅速下降。我们分析,不同碳源由于代谢途径不同,导致菌体生长速度不同。有文献报道组成型启动子指导的基因表达与菌体生长状态有关[15]。然而,我们的结果显示,TEF-1启动子指导下的L1表达并不完全由菌体增长速率所决定。我们推测,TEF-1启动子为组成型启动子,应不被碳源的诱导所控制,然而,不同碳源代谢引起的反应及次级代谢产物可能对TEF启动子的转录活性或者蛋白产物稳定性产生影响。我们知道,高密度发酵情况下,菌体的生长代谢与摇瓶条件下显著不同,因此,本研究拟基于摇瓶研究结果,进一步探讨发酵罐高密度发酵情况,为L1蛋白的规模化组成型表达制备奠定基础。
本研究高密度发酵结果同样提示了不同碳源对菌体生长以及目的蛋白表达的显著影响。然而,与摇瓶培养有所不同。从发酵湿重增长曲线来看,甘油作为碳源时与摇瓶相似,获得了菌体的快速和高密度增长;而甲醇和葡萄糖作为碳源同样可获得高密发酵,但葡萄糖未能像在摇瓶中低密度条件下表达一样,获得与甘油相似的高速增殖。山梨醇作为唯一碳源,推测由于利用度低,不足以支持菌体快速生长,因此,在本研究中未获得在发酵罐中的明显增殖。分析L1表达率发现,除甲醇在整个过程中保持了一定的水平,其余碳源一定时间后都明显下降。发酵罐与摇瓶发酵中菌体增殖与目的蛋白表达情况不同,其原因可能是复杂的,推测在发酵罐中,由于菌体的高密度培养与高速增殖,其代谢速率、代谢途径、代谢产物类型与积累、目的蛋白表达速率、蛋白折叠效率、蛋白稳定性等都与摇瓶低密度培养条件下可能显著不同。对于生产制备目的蛋白而言,蛋白总产量是最重要的指标。研究结果提示,甘油作为碳源时尽管菌体在72h后仍然能快速增长,但单位表达率显著降低,造成总目的蛋白减少,因此,延长发酵时间,提高生物量已没有意义。同理,以葡萄糖为碳源,48h就应终止发酵,其后的生长延伸已不能带来更好的目的蛋白产量。而以甲醇作为碳源,尽管总产量在不断增加,但差别不大,考虑到时间等成本,尤其是与其它碳源比较,长时间的甲醇发酵并不经济。
本研究通过发酵罐中不同碳源利用的对比研究,为TEF-1启动子指导下的HPV16_L1蛋白在毕赤酵母高密度发酵中的表达提供了优化条件,也为将来几种碳源的联合应用以获取高密度发酵条件下生物量与表达率的优化整合,达到高目的蛋白产量提供了基础。概言之,本研究工作为实现毕赤酵母高密度生长与异源基因在TEF-1启动子指导下高效表达,为HPV疫苗降低成本和高效生产提供了可能的新思路和解决方案。
| [1] | Forman D, De Martel C, Lacey C J, et al. Global burden of human papillomavirus and related diseases. Vaccine, 2012, 30 Suppl 5:F12-23. |
| [2] | Crow J M. HPV: The global burden. Nature, 2012, 488(7413):2-3. |
| [3] | Keam S J, Harper D M. Human papillomavirus types 16 and 18 vaccine (recombinant, AS04 adjuvanted, adsorbed). Drugs, 2008, 68(3): 359-372. |
| [4] | Villa L L. Overview of the clinical development and results of a quadrivalent HPV (types 6, 11, 16, 18) vaccine. International Journal of Infectious Diseases, 2007, 11 Suppl 2:17-25. |
| [5] | Petrosky E, Bocchini J, Hariri S, et al. Use of 9-valent human papillomavirus (HPV) vaccine: updated HPV vaccination recommendations of the advisory committee on immunization practices. MMWR Morbidity and Mortality Weekly Report, 2015, 64(11): 300-304. |
| [6] | Zhu F C, Chen W, Hu Y M, et al. Efficacy, immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese women aged 18-25 years: results from a randomized controlled trial. International Journal of Cancer Journal International du Cancer, 2014, 135(11): 2612-2622. |
| [7] | Byrne B. Pichia pastoris as an expression host for membrane protein structural biology. Curr Opin Struct Biol, 2015, 32C:9-17. |
| [8] | Liang S, Wang B, Pan L, et al. Comprehensive structural annotation of Pichia pastoris transcriptome and the response to various carbon sources using deep paired-end RNA sequencing. BMC Genomics, 2012, 13:738. |
| [9] | Jiang Z, Tong G, Cai B, et al. Purification and immunogenicity study of human papillomavirus 58 virus-like particles expressed in Pichia pastoris. Protein Expression and Purification, 2011, 80(2): 203-210. |
| [10] | Barrigon J M, Valero F, Montesinos J L. A macrokinetic model-based comparative meta-analysis of recombinant protein production by Pichia pastoris under AOX1 promoter. Biotechnology and Bioengineering, 2015, 112(6): 1132-1145. |
| [11] | Macauley-Patrick S, Fazenda M L, Mcneil B, et al. Heterologous protein production using the Pichia pastoris expression system. Yeast, 2005, 22(4): 249-270. |
| [12] | Vogl T, Glieder A. Regulation of Pichia pastoris promoters and its consequences for protein production. New Biotechnology, 2013, 30(4): 385-404. |
| [13] | Ahn J, Hong J, Lee H, et al. Translation elongation factor 1-alpha gene from Pichia pastoris: molecular cloning, sequence, and use of its promoter. Applied Microbiology and Biotechnology, 2007, 74(3): 601-608. |
| [14] | 金晓媚,姚宇峰,黄惟巍,等. 利用翻译延伸因子1-α 启动子在毕赤酵母中表达人乳头瘤病毒16 L1 蛋白,中国生物制品学杂志,2014,2(4):338-453.Jin X M, Yao Y F, Huang V V, et al.Expression of human papilloma virus 16 L1 protein in Pichia pastoris using translation elongation factor 1-α promoter.2014,2(4):338-453. |
| [15] | Bollok M, Resina D, Valero F, et al. Recent patents on the Pichia pastoris expression system: expanding the toolbox for recombinant protein production. Recent Patents on Biotechnology, 2009, 3(3): 192-201. |
 2015, Vol. 35
2015, Vol. 35




