文章信息
- 汤俊明, 赵彦平, 刘奇, 盛青松, 吴黎明, 乔国洪
- TANG Jun-ming, ZHAO Yan-ping, LIU Qi, SHENG Qing-song, WU Li-ming, QIAO Guo-hong
- 构建皮肤组织中特异表达HPV16-E6基因的小鼠模型
- Modeling of Transgenic Mice Specifically Expressed HPV16-E6 in Skin
- 中国生物工程杂志, 2015, 35(10): 27-31
- China Biotechnology, 2015, 35(10): 27-31
- http://dx.doi.org/10.13523/j.cb.20151004
-
文章历史
- 收稿日期: 2015-04-03
- 修回日期: 2015-04-24
2. 无锡市申瑞生物制品有限公司 无锡 214200
2. WuxiShenRui Biological Products Company, Wuxi 214200, China
HPV(human papillpmavrius)是孔多空病毒科乳头瘤病毒属中的一种DNA病毒。自1976年Hausen等首次从宫颈癌组织中分离出HPV16、HPV18以来,至今已发现的HPV有100多种类型[1]。大量分子流行病学研究资料表明,人乳头瘤病毒16型(HPV16)与生殖道肿瘤密切相关,在宫颈癌活检组织中,HPV16的阳性检出率显著高于正常宫颈组织[2]。动物致癌实验发现,HPV16及其E6E7基因可明显诱导小鼠宫颈癌的发生[3]。故普遍认为HPV16是宫颈癌发生的“高危”型人乳头瘤病毒。HPV16既可以其基因片段又可以整个DNA形式整合到宿主细胞基因组中[4]。HPV16的基因组至少有10个开放阅读框,而其早期的E1~E7基因主要是维持病毒复制、编码病毒蛋白和维持细胞内病毒高拷贝数。
许多研究表明,HPV16及其基因组的致癌(肿瘤)性或细胞恶性转化作用是由于HPV16的有关基因通过影响宿主细胞抑癌基因表达产物生物活性来实现的。Dyson等[5]和Werness等[6]分别于1989年、1990年在Science杂志上发表论文,提出HPV16产生的两个病毒蛋白,即E6、E7蛋白可能分别捆绑并抑制宿主细胞内的两个关键性的抗癌蛋白P53和Rb。在正常细胞内,P53和Rb调控细胞周期与凋亡,P53与Rb表达产物的失活可导致宿主细胞永生化。E6蛋白可能与P53表达产物结合而导致P53降解失活,继之使含HPV16的宿主细胞生长失控。
人外皮蛋白(human involucrin,hINV)是角质细胞角质化包膜的前体,特异在分层的鳞状细胞上基层表达。根据前人的研究,我们选择hINV上游调控序列的-2 473~-1区域为皮肤特异表达启动子。该启动子有两个重要的调节区,即远端的启动子(distal regulatory region,DRR)和近端的调控元件(proximal regulatory region,PRR)能在体外特异启动目的基因的表达[7, 8]。其DRR(-2 474bp/-1 953bp)主要调控其下游基因在表层角朊细胞表达,PRR(-986bp/-41bp)主要调控其下游基因在内层角朊细胞表达,而-1 953bp/-986bp主要与其下游基因的表达分化模式有关[9]。
本文用分子生物学技术方法构建了pINV-HPV16-E6的真核表达载体,并制备了其转基因小鼠模型。不仅在mRNA和蛋白质水平研究了外源基因HPV16-E6的表达,同时利用pINV特异启动子引导外源基因在转基因小鼠的皮肤特异表达,以更真实地模拟宫颈癌的发生,并在此基础上为深入探讨HPV16-E6对癌症发生及发展的作用机制奠定基础。
1 材料与方法 1.1 材 料宫颈癌组织(江苏省宜兴市人民医院采样);大肠杆菌Top10(天根,北京);pcDNA3.1(-)载体、Trizol试剂(Invitrogen,美国);氨苄(Sigma,美国);Oligo(d)T、M-MLV反转录酶、RNase抑制剂、dNTP、DNA聚合酶(promega,美国);T4 DNA连接酶、T4 Polymerase、NruI、NheI、XbaI、XhoI、BamHI(TaKaRa,日本);CIP去磷酸化酶(NEB,美国);昆明白小鼠(中国科学院);质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒(Biomiga,美国);小鼠抗E6单克隆抗体(ab70,abcam,英国);辣根过氧化物酶标记的兔抗鼠抗体(麦约尔公司,上海)。
1.2 载体构建 1.2.1 PCR扩增目的片段设计pINV基因启动子引物(上游引物: 5′-TGTCTAGAAAGCTTCTCCATGTGTCATGT-3′;下游引物:5′-TACTCGAGGAGCTGAGCAGGAGTCAGG-3′),上游引物5′端设计加入了XbaI酶切位点,下游引物5′端设计加入了XhoI酶切位点,扩增获得的片段理论长度为2 491bp。设计HPV16-E6基因引物序列(上游引物:5′-TGCTCGAGATGCACCAAAAGAGAACTG-3′;下游引物:5′-ATGGATCCTTACAGCTGGGTTTCTCTA-3′),上游引物5′端设计加入了XhoI酶切位点,下游引物5′端设计加入了BamHI酶切位点,扩增获得的片段理论长度为491bp。PCR获得的片段电泳图见图 1。

|
| 图 1 PCR扩增pINV启动子和HPV16-E6基因片段 Fig. 1 PCR amplification of pINV promoter and HPV16-E6 gene fragment M: DNA marker;1: Pinv promoter;2:HPV16-E6 |
首先用NruI和NheI酶切pcDNA3.1(-)质粒去掉CMV启动子,获得去CMV的中间载体dpcDNA3.1(-)(4 764bp);XbaI和XhoI酶切dpcDNA3.1(-)载体,去磷酸化;用同样的酶切扩增的启动子片段,胶回收两片段,连接两片段获得dpcDNA3.1(-)-PINV载体(7 237bp);用XhoI和BamHI酶切dpcDNA3.1(-)-PINV载体,去磷酸化;用同样的酶切扩增的HPV16-E6片段,连接两片段,挑克隆鉴定获得dpcDNA3.1(-)-PINV-E6载体(7 714bp),测序结果显示正确接入。
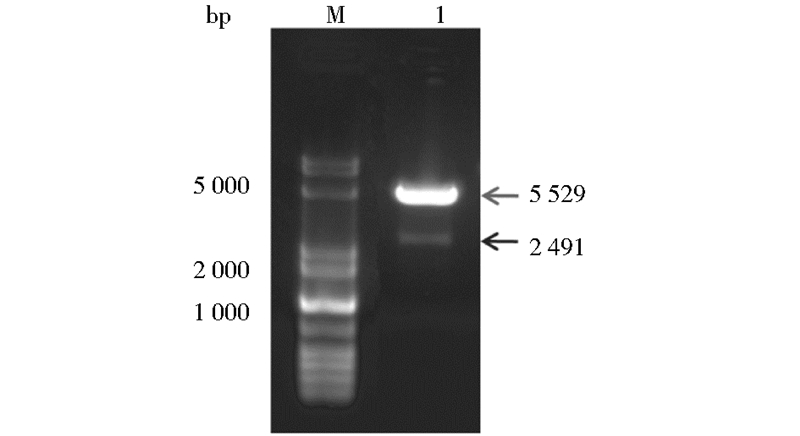
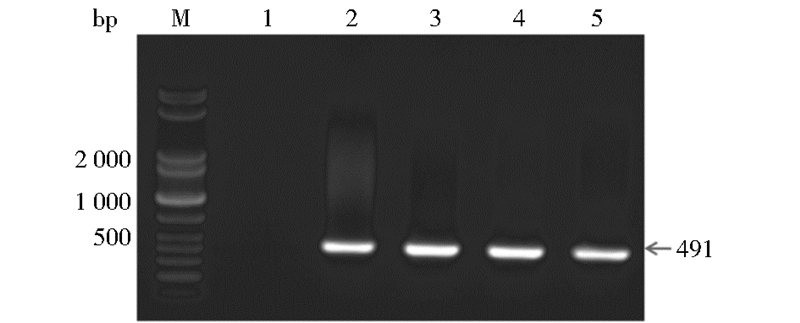
1.3 转基因小鼠的制备及鉴定准备昆明白小鼠10只,其中7只母鼠(5只处理后作假孕母鼠,2只用于超排卵)、3只公鼠。将获得的dpcDNA3.1(-)-PINV-E6载体扩量、纯化。用限制性内切核酸酶SalI酶切纯化的质粒切除载体多余片段,理论酶切片段长度分别为2 185bp和5 529bp,酶切鉴定图见图 2。胶回收含E6目的基因的片段(5 529bp),之后再纯化一遍。稀释至4.0ng/μl,显微注射受精卵,然后将注射了外源基因的受精卵移入假孕母鼠,待其分娩获得后代。取鼠尾DNA 用扩增E6基因的引物进行PCR鉴定是否整合了外源基因。获得的原代阳性小鼠与野生型小鼠交配,鉴定后代以获得F1代小鼠,鉴定结果见图 3。
|
| 图 2 SalI酶切dpcDNA3.1(-)-PINV-E6质粒 Fig. 2 The detection of dpcDNA3.1(-)-PINV-E6 plasmid digested by SalI M: DNA marker;1: Products of dpcDNA3.1(-)-PINV-E6 plasmid digested by SalI |
|
| 图 3 PCR鉴定转基因小鼠 Fig. 3 PCR identification of transgenic mice M: DNA maker; 1: Wild type mouse as control; 2: F0-7; 3: F0-11小鼠; 4: F1-7-2; 5:F1-7-5 |
取阳性转基因小鼠和野生型小鼠,麻醉后用生理盐水灌流,取心、肝、脾、肺、肾、脑、皮肤组织,以Trizol法提取各脏器组织的总RNA。以反转录合成的cDNA为PCR的模板。检测E6的特异性引物(上游引物:5′-GCGACCCAGAAAGTTACCAC-3′;下游引物:5′-GACACAGTGGCTTTTGACAGT-3′),使用30个循环(95℃,15s;59℃,30s),扩增产物的大小为314bp。小鼠的内参基因为GAPDH,其扩增引物为:上游引物5′-TGGCCTTCCGTGTTCCTAC-3′、下游引物5′-GAGTTGCTGTTGAAGTCGCA-3′,其片段大小为178bp。以上所有实验均至少重复3次。
1.5 Western blot检测转基因小鼠体内E6蛋白的表达取转基因小鼠3只及野生型小鼠1只,麻醉、灌流,取少量心、肝、脾、肺、肾、脑、皮肤组织,蛋白质裂解液处理,抽提蛋白质,SDS缓冲液95℃煮沸处理样品5min。SDS电泳,转膜,用3%BSA封闭,4℃过夜,小鼠抗E6抗体(1∶1 000)室温孵育2h,HRP标记的兔抗鼠二抗(1∶4 000)室温孵育1.5h,ECL试剂盒显色,成像仪间隔拍取照片。以上所有实验均至少重复3次。
1.6 免疫组化检测转基因小鼠体内E6蛋白的表达取转基因小鼠及野生小鼠的新鲜皮肤组织,石蜡包埋、切片,脱蜡复水后,加山羊血清封闭,清洗后加小鼠抗E6抗体(1∶1 000)室温孵育1h或4℃过夜,HRP标记的兔抗鼠二抗(1∶4 000)37℃ 1h,DAB试剂盒显色,显微镜下拍照保存。
2 结 果 2.1 转基因小鼠的鉴定将最后获得的dpcDNA3.1(-)-PINV-E6载体,扩量、纯化后用限制性内切核酸酶SalI酶切质粒切除载体多余片段,获得带有pINV启动子和E6基因的片段5 529bp,酶切后其大小与预期相符(图 2)。经三柱纯化、显微注射、体外培养和植入假孕鼠内,最终成功孕育的母鼠有4只,分娩获得31只小鼠后代,其中有2只小鼠携带外源基因,将其与野生型小鼠交配获得F1代中又有2只阳性小鼠,其家系见表 1。本实验鼠用PCR方法鉴定是否携带外源基因,PCR结果显示转基因阳性小鼠的基因组DNA内已包含有E6基因(图 3)。
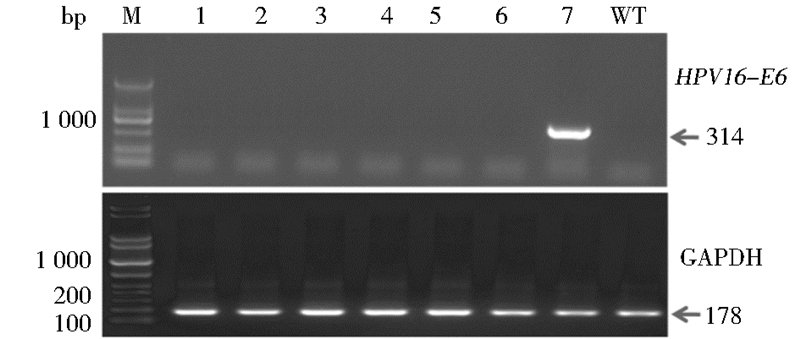
在本实验中,取转基因小鼠和野生型小鼠的各个脏器组织,以Trizol法提取培养细胞的总RNA,反转录为cDNA后,以HPV16-E6基因的特异引物做RT-PCR,小鼠GNPDN基因用作内参。HPV16-E6基因的PCR产物长度为314bp,作为内参的GNPDN基因的PCR产物长度为178bp。RT-PCR结果显示,在转基因小鼠的各个脏器中除皮肤外几乎无E6的表达,表明插入转基因小鼠体内的外源基因E6能够转录,并特异在皮肤组织中表达,显示了pINV启动子的特异性,以野生型小鼠皮肤组织作为对照(图 4)。野生型小鼠均未检测到HPV16-E6的表达。
|
| 图 4 RT-PCR法鉴定转基因小鼠各个脏器内E6的转录 Fig. 4 RT-PCR identification of the transcript of E6 in transgenic mice viscera M: DNA maker; 1: Heart; 2: Liver; 3: Spleen; 4: Lung; 5: Kidney; 6: Brain; 7: Skin; WT: Skin of wild type as control |
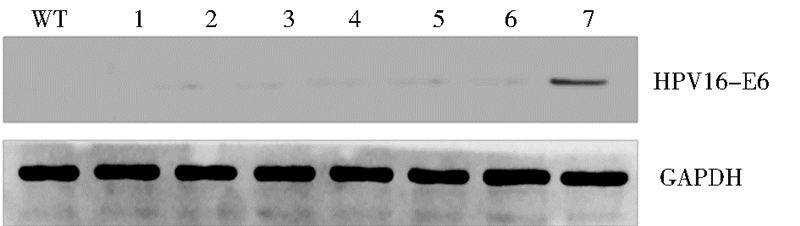
在本实验中,取转基因小鼠和野生型小鼠的各个脏器组织,抽提蛋白质后做Western blot检测HPV16-E6基因的蛋白质表达,以小鼠GNPDH基因为内参。检测结果显示,转基因小鼠的表皮组织中可见E6有明显表达,其显示的条带大小与预期相符(18kDa),其他各个脏器中均有极少量或几乎无E6的表达,表明插入转基因小鼠体内的外源基因E6能够翻译为蛋白质,并相对特异在皮肤组织中表达,显示了pINV启动子的皮肤特异性,以野生型小鼠皮肤组织作对照(图 5)。
|
| 图 5 Western blot法鉴定转基因小鼠各个脏器内E6的蛋白质表达 Fig. 5 Western blot analysis of E6 protein in various viscera of transgenic mice WT: Skin of wild type as control; 1: Heart; 2: Liver; 3: Spleen; 4: Lung; 5: Kidney; 6: Brain; 7: Skin |
为了更直观地显示HPV16-E6蛋白的表达,以及初步观察皮肤病变情况,在本研究中分别取了转基因小鼠和野生型小鼠的皮肤组织进行免疫组化实验。结果显示转基因小鼠的皮肤组织中有咖啡色着色处为E6蛋白的分布,而野生型小鼠无表达;同时可见F0-7号转基因小鼠的皮肤组织对比野生型小鼠有极轻微不典型增生(图 6)。进一步证实了HPV16-E6转基因小鼠模型的成功构建,以及外源基因E6在启动子pINV的作用下能在模型小鼠的皮肤组织中转录和表达。

|
| 图 6 免疫组化鉴定转基因小鼠皮肤内E6的蛋白质表达 Fig. 6 Immunochemistry analysis of the expression of E6 protein in the skin of transgenic mice (a) Skin of wild type (b) Skin of transgenic mice (magnification: 400×) Arrows indicate the epithelial basement (hyperplastic) layer and positive expression |
高危型的HPV(HPV16)是宫颈癌及大部分肛门、生殖器和口咽癌的致病物[10, 11, 12]。HPV16编码两种病毒的致癌基因[13],它们是细胞转型的主要因素。它们参与了从HPV感染、细胞转化到癌变的多个过程。为了更深入地研究HPV16与宫颈癌及其他HPV相关肿瘤的相互作用,模型小鼠是必不可少的实验工具。HPV16的基因组至少有10个开放阅读框,其不同的基因所属功能各异,本研究着重开展了在癌症形成过程中与抑癌基因p53相互作用的E6基因研究。
在本研究中,我们构建了pINV-HPV16-E6皮肤特异启动真核表达载体,并在细胞水平验证了载体的有效性(结果待发表)。原核注射法制备获得了pINV-HPV16-E6的转基因模型小鼠,并且获得了稳定传代的转基因小鼠后代,并在mRNA及蛋白质水平均检测到E6的表达,证实了该表达载体的有效性。另外在上述实验基础上,分别检测转基因小鼠的心、肝、脾、肺、肾、脑及皮肤组织,结果发现在皮肤组织中均有E6的表达,免疫组化结果能更直观地反应外源蛋白的分布及表达;而在其他组织中几乎完全没有表达,证实了pINV启动子的皮肤表达特异性。外源基因插入小鼠体内后,若全身表达,则会影响小鼠正常的生长、发育、生殖等其他行为,而本研究中获得的转基因小鼠因利用pINV启动子使其特异在皮肤表达,因此减少了外源基因在转基因小鼠体内不规律表达可能导致的不良影响,更有利于该转基因小鼠的稳定传代及表达。
目前研究显示,HPV16-E6除了能抑制p53的作用,使细胞周期异常,转化为永生细胞之外[14, 15];Vonetta等[16]发现HPV16-E6还与引起细胞的氧化损伤有关[16],他们实验发现E6的表达会降低II型过氧化物歧化酶的表达量,而活性氧(ROS)的增加可能会减少细胞的抗氧化能力。这表明E6在病毒诱发的氧化应激和DNA损伤的变异过程中发挥重要作用。本研究完成了pINV-HPV16-E6转基因小鼠模型的构建,HPV16-E6基因在小鼠皮肤中特异表达为后续E6蛋白对细胞的影响以及致癌的深入机制研究奠定了良好的基础,并提供了良好的工具和材料。
| [1] | Chan S H,Bernard H U,Ratterree M,et al. Genomic diversity and evolution of papillomavituses in rhesus monkeys. J Virol,1997,71(7):4938-4943. |
| [2] | 蔡红,姚堃,陈伟丽,等. 多聚酶链反应检测宫颈癌HPV感染及分型的研究. 中国病毒学,1994,9(4):291-296. Cai H,Yao K,Chen W L,et al. The research for infection and classification of cervical HPV using polymers polymerase chain reaction. Virologica Sinica,1994,9(4):291-296. |
| [3] | 钟才高,Donald D A. HPV16及其基因诱导小鼠宫颈癌的毒理学研究. 实用预防医学,1999,6(6):401-404. Zhong C G,Donald D A. Toxicology research of cervical cancer induced by HPV16 gene in mice. Practical Preventive Medicine,1999,6(6):401-404. |
| [4] | Lazo P A. The molecular genetics of cervical carcinoma.Br J Cancer,1999,80(12):2008-2018. |
| [5] | Dyson N,Howley P M,Munger K,et al. The human papillomavirus 16 E7 oncoprotein is able to bind the retinoblastoma gene product. Science,1989,243(4893):934-936. |
| [6] | Werness B A, Levine A J, Howley P M. Association of human papillomavirus type 16 and 18 E6 proteins with p53. Science,1990,248(4951):76-79. |
| [7] | Welter J F,Crish J F,Agarwal C,et al. Fos-related antigen (Fra-1), junB, and junD activate human involucrin promoter transcription by binding to proximal and distal AP1 sites to mediate phorbol ester effects on promoter activity. J Biol Chem,1995,270(21):12614-12622. |
| [8] | Banks E B,Crish J F,Welter J F,et al. Characterization of human involucrin promoter distal regulatory region transcriptional activator elements——a role for Sp1 and AP1 binding sites. Biochem J, 1998,331(Pt1):61-68. |
| [9] | James F C,Tarif M Z,Richard L E. The distal regulatory region of the human involucrin promoter is required for expression in epidermis. The Journal of Biological Chemistry,1998,273(46): 30460-30465. |
| [10] | Parkin D M,Bray F. Chapter 2: the burden of HPV-related cancers. Vaccine,2006,24(S3):11-25. |
| [11] | Gargano J W,Wilkinson E J,Unger E R,et al. Prevalence of human papillomavirus types in invasive vulvar cancers and vulvar intraepithelial neoplasia 3 in the United States before vaccine introduction. J Low Genit Tract Dis,2012,16(4):471-479. |
| [12] | Steinau M,Unger E R,Hernandez B Y,et al. Human papillomavirus prevalence in invasive anal cancers in the United States before vaccine introduction. J Low Genit Tract Dis,2013,17(4):397-403. |
| [13] | Munger K,Baldwin A,Edwards K M,et al. Mechanisms of human papillomavirus-induced oncogenesis. J Virol,2004,78(21):11451-11460. |
| [14] | Pim D,Banks L. HPV-18 E6*I protein modulates the E6-directed degradation of p53 by binding to full-length HPV-18 E6. Oncogene,1999,18(52):7403-7408. |
| [15] | Pim D,Massimi P,Banks L. Alternatively spliced HPV-18 E6* protein inhibits E6 mediated degradation of p53 and suppresses transformed cell growth. Oncogene,1997,15(3):257-264. |
| [16] | Vonetta M W,Maria F,Valery F,et al. Human papillomavirus type 16 E6* induces oxidative stress and DNA damage. Journal of Virology,2014,88(12):6751-6761. |
 2015, Vol. 35
2015, Vol. 35




