文章信息
- 冯巧灵, 王玉凤, 刘晓骅, 吉彩霞, 罗进勇
- FENG Qiao-ling, WANG Yu-feng, LIU Xiao-hua, JI Cai-xia, LUO Jin-yong
- SATB2促进BMP9诱导C2C12细胞的成骨分化
- SATB2 Promotes Bone Morphogenetic Protein 9-induced Osteogenic Differentiation of Mesenchymal Stem Cells
- 中国生物工程杂志, 2015, 35(10): 20-26
- China Biotechnology, 2015, 35(10): 20-26
- http://dx.doi.org/10.13523/j.cb.20151003
-
文章历史
- 收稿日期:2015-05-24
- 修回日期:2015-06-11
间充质干细胞(mesenchymal stem cells,MSCs)系一种具有多向分化能力的成体干细胞[1],它在体外可以分化为成骨、软骨脂肪细胞[2, 3],且因其易分离和培养等特点,现已作为“种子细胞”广泛应用于组织工程、器官移植及基因治疗等多个领域。骨形态发生蛋白(bone morphogenetic protein,BMP)是转化因子TGF-β(transforming growth factor-β,TGF-β)中的一员,它作为一种分泌性蛋白在细胞分化以及骨形成中起着重要的作用。研究证实,在目前分离的20余种BMP中,BMP2、BMP4、BMP6及BMP7能够诱导MSCs向成骨分化[4, 5],其中BMP2已经应用于骨骼疾病的临床治疗病[6]。近年来,通过本课题组的研究发现,BMP9同样具有诱导成骨分化的能力,且作用明显强于BMP家族的其他成员[7],有望代替BMP2成为有效的成骨诱导因子,为骨疾病的研究和临床治疗提供广阔的应用前景。研究表明,BMP9诱导MSCs向成骨细胞分化的过程受到很多转录因子的调节,目前已经证实的有Runx2,Osterix等[8, 9],但是否还有一些未知的转录因子参与其中还有待研究。
SATB2是特异AT序列结合蛋白(special AT-rich sequence-binding protein,SATB)家族中的一员,它是一种能与核基质区结合的蛋白质,参与调控基因的转录和染色质的重组[10, 11],它不仅在神经系统的发育和肿瘤的发生发展中起着重要作用,而且也参与成骨分化和骨基质的形成。在MSCs向成骨分化的过程中,SATB2是重要的转录因子。研究表明,BMP2/4/7可以通过多种途径诱导SATB2的表达;而SATB2能正向调节成骨标志物骨涎蛋白、骨钙蛋白以及胚胎干细胞基因如Nanog和Sox2的表达,另外,SATB2可具有显著促进胚胎干细胞多向分化的潜能[12, 13, 14]。但SATB2在BMP9诱导成骨分化过程中的作用尚不明确,本研究主要探讨SATB2在强力成骨诱导因子BMP9诱导MSCs成骨分化中的作用。
1 材料与方法 1.1 质粒、菌种、腺病毒及细胞SATB2基因模板、大肠埃希菌DH5α、AdEasy-1细菌(含有缺失E1和E3区的野生型腺病毒骨架质粒pAdEasy-1的BJ5183感受态大肠埃希菌)、腺病毒穿梭质粒pAdTrace-TO4(mRFP、卡纳抗性)、腺病毒AdRFP及AdBMP9、人胚肾细胞HEK293、人结肠癌细胞HCT116、间充质干细胞C2C12(本实验室保存)。
1.2 试 剂PCR引物和高保真酶PrimerSTAR(TaKaRa公司);Trizol、普通PCR及逆转录PCR试剂盒(TaKaRa公司);质粒抽提试剂盒(Omega公司);限制性内切酶SalI、XbaI、PmeI、Pac I(New England Biolab公司); DNA连接试剂盒和脂质体转染试剂盒Lipofectamine 2000(Invitrogen公司);高糖型DMEM培养基(HyClone公司);胎牛血清(Gibico公司);鼠SATB2一抗(Abcam公司)和β-Actin一抗(Santa Cruz公司);二抗为辣根过氧化物酶标记的羊抗兔/鼠IgG(中杉金桥);ALP染色试剂;0.05%戊二醛;0.4%茜素红S、维生素C和β-磷酸甘油(Sigma公司);其他试剂均为进口分装。
1.3 质粒构建和细胞实验 1.3.1 穿梭质粒pAdTrace-TO4-SATB2的构建根据合成的引物用PCR扩增SATB2的编码序列(PCR反应体系50 μl :Primer STAR buffer10μl、PrimerSTAR 0.5μl、2.5mol/L dNTP 4μl、SATB2目的片段上下游引物各1 μl、SATB2基因模板1.0 μl、ddH2O 32.5μl×4;PCR反应条件:95 ℃预变性3 min,92 ℃变性30s,55 ℃退火30s,72 ℃延伸120s,循环35次,72℃再延伸5min;纯化后用SalI、XbaI、双酶切后备用,同时用SalI、XbaId酶切pAd-Trace-TO4载体,用T4连接酶把载体和目的片段连接起来,载体含有卡纳霉素抗性基因,将重组质粒导入大肠杆菌DH5α感受态细菌中筛选阳性克隆,取适量涂于卡那霉素(100mg/L)的LB琼脂板上培养,选取不同单菌落,进行菌落PCR验证(PCR反应体系10 μl∶10 μmol/L的SATB2和TO4筛选primer各1 μl、10×PCR Buffer 1.0 μl、2.5mol/L dNTP 3.0 μl、Traq酶0.2 μl、DMSO 0.6μl、ddH2O 3.2μl;PCR反应条件:95 ℃预变性3 min,92 ℃变性30s,55 ℃退火30s,72 ℃延伸30s,循环28次,72℃再延伸5min);将PCR 产物经1%琼脂糖凝胶电泳进行分析验证(阳性克隆经PCR后电泳分析可观察到约500bp的条带),挑选2~3个阳性克隆接种于10ml含有卡那霉素的培养基中培养过夜,收集菌液并提取质粒,再次进行质粒PCR(体系和菌落PCR一样)及电泳分析验证。将阳性重组质粒送TaKaRa公司进行测序鉴定,验证序列准确性。 1.3.2 重组质粒的构建以及腺病毒的包装把构建好的穿梭pAdTrace-TO4-SATB2质粒经Pme I酶切使其线性化,乙醇沉淀后电转至含有pAdEasy-1的BJ5183感受态中,与pAdEasy-1进行同源重组,并于含100mg /L卡那霉素的LB平板上进行筛选,挑取单克隆摇菌,抽提质粒,进行Pac I酶切鉴定,并将序列正确的重组质粒命名为重组pAdTrace-TO4-SATB2;用Pac I酶切重组pAdTrace-TO4-SATB2,用脂质体Lipofectamine 2000介导转染入人胚肾HEK293细胞。在37℃、5%CO2、饱和湿度培养箱中培养,在第3天和第7天观察报告基因RFP荧光表达量,当90%以上细胞变圆、10%的细胞脱落漂浮后收获病毒,并进行逐轮扩增,直到病毒滴度变高[15]。
1.3.3 条件培养基的制备接种HCT116 细胞于直径60mm的培养皿中,待细胞融合至70%~80%时,加入Ad-BMP9病毒,控制感染率为80%,在4 h后换成无血清无抗生素的培养基(去除polybrene和没有进入的腺病毒),分别在24 h 和48 h后收集培养基,离心取上清备用,上清内含有一定浓度的BMP9蛋白。
1.3.4 细胞培养在37℃、5% CO2的培养条件下,HEK293、HCT116以及C2C12细胞用含10%胎牛血清以及100U/ml青霉素和100g/ml的链霉素的DMEM高糖培养基培养。
1.3.5 RT-PCRC2C12细胞加入处理因素24 h后,提取细胞RNA,逆转录为cDNA,RT-PCR检测相关基因的表达(引物见表1),PCR扩增产物经1%的琼脂糖凝胶电泳,紫外下成像后保存图像,所有样本以GAPDH为内参进行相对定量分析。
| Primer | Sequence | |
| GAPDH | Forward primer | GGCTGCCCAGAACATCAT |
| Reverse primer | CGGACACATTGGGGGTAG | |
| SATB2 | Forward primer | GCAGTTAAGCCAGAGCCAAC |
| Reverse primer | GCAGGTTGAGGAAGTTCTGC | |
| SATB2 clone | Forward primer | cgcGTCGACACCATGGAGCGGCGGAGCGAGAG |
| Reverse primer | tgcTCTAGATTATCTCTGGTCAATTTCGGCAG | |
| SATB2 screening | Forward primer | GCTGTTTAGTGAACCGTCAGATCG |
| Reverse primer | CCACCTTCCCAGCTTGATTA |
C2C12细胞感染Ad-BMP9后48h,收集细胞,用蛋白裂解液裂解细胞,然后提取总蛋白,经SDS-PAGE(10%分离胶)分离后,湿转法转移至硝酸纤维素膜上,37℃封闭1 h,4℃过夜(SATB2抗体为1∶1 000 稀释,β-actin抗体为1∶1 000 稀释),常温洗膜3次,加入辣根过氧化物酶标记二抗(1∶5 000),37℃反应1 h,再常温洗膜3次,最后按ECL 试剂盒说明书进行化学发光检测并存取图像。
1.3.7 碱性磷酸酶活性和染色将细胞接种24孔板中,待细胞融合至30%左右时,加入Ad-RFP或Ad-SATB2感染36 h,然后加入BMP9条件培养基,培养5 d后进行ALP活性定量分析和细胞化学染色(操作方法按照试剂盒说明书)。
1.3.8 钙盐沉积实验将细胞接种于24孔板中,细胞密度约为30%时,加入Ad-RFP或Ad-SATB2感染36h,然后加入BMP9条件培养基和成骨诱导培养基,连续培养14 d后,用茜素红S进行染色:弃去培养基,PBS洗3次,加入250μl/孔0.05%戊二醛固定10min,然后用去离子水洗3次,加入200μl/孔0.04%茜素红S染液,观察有红色物质堆积时弃去染液,用去离子水终止染色后,在显微镜下成像。
1.4 统计学分析计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,统计学分析用 SSPS17.0软件包处理。
2 结 果 2.1 BMP9促进间充质干细胞C2C12细胞中SATB2的表达用Ad-GFP 和Ad-BMP9分别感染C2C12细胞24 h后,通过 RT-PCR检测结果显示BMP9可促进SATB2基因的表达(图1a、图b);用 Ad-GFP 和Ad-BMP9 分别感染C2C12细胞48 h后,Western blot检测SATB2蛋白水平,结果显示BMP9可促进SATB2蛋白的表达(图1c、图1d)。
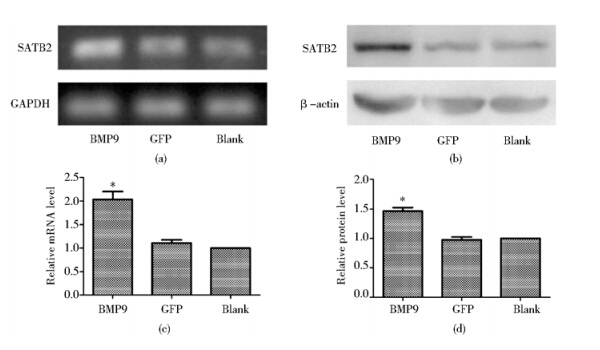
|
| 图 1 C2C12细胞中Ad-BMP9对内源性 SATB2表达的影响 Fig. 1 Expression of SATB2 at mRNA and protein level in Ad-BMP9 infected C2C12 cells (a) and (b) The endogenous SATB2 were expressed after exogenous Ad-BMP9 infection for 24 h; (c) and (d) The endogenous SATB2 were expressed after exogenous Ad-BMP9 infection for 48 h; GAPDH and β-actin were used as loading control,separately. Data present mean ± SD (n = 3). * P<0.05 |
PCR方法扩增SATB2基因编码序列(2 202bp),电泳检测结果显示2 000bp左右有目的条带(图2a);连接酶切后的pAdTrace-TO4载体和胶回收目的片段后,转入到大肠埃希菌DH5α后菌落PCR筛选结果(图2b);再把阳性菌落扩增后提取质粒,质粒PCR验证(图2c),把构建好的质粒送到TaKaRa公司进行测序,测序结果完全正确。

|
| 图 2 SATB2重组腺病毒穿梭质粒的构建 Fig. 2 Construction of recombinant plasmid of adenovirus-mediated SATB2 (a) PCR product SATB2 M: DNA Marker (b) Bacterial liquid PCR 2:Positive clone (c)Plasmid PCR |
构建好的穿梭质粒线性化并导入BJ5183中,与pAdEasy- 1同源重组,重组后的质粒(1,2,3,4,)比AdEasy质粒大(图3a),重组后的质粒经PacⅠ酶切后可以释放出1个约30kb的大片段和1个4.5kb的小片段(图3b);重组好的质粒酶切后用lipo2000导入HER293细胞中,第3天(图3c)和第7天(图3d)时荧光检测显示:荧光数量不断增多,证明腺病毒包装成功。

|
| 图 3 Ad-SATB2穿梭质粒和骨架质粒AdEasy-1的重组和病毒的包装 Fig. 3 PCR identification of recombinant plasmid and packaging of Ad-SATB2 (a) DNA Marker:λHindIII; 0:Adeasy;1~4:Recombinant plasmid (b) M:DNAMarker(λHindIII); 0:Adeasy; 1:Recombinant plasmid; 2:Recombinant plasmid Adtrace-TO4-SATB2 enzyme digestion (c) and (d) Fluorescence imaging of targeted cells infected by recombinant plasmid after day 3 and day 7,respectively |
用Ad-RFP和Ad-SATB2分别感染C2C12细胞24 h后,通过Western blot检测SATB2总蛋白水平,证实Ad-SATB2腺病毒处理后的组别SATB2蛋白明显高表达(图4a、图4b)。

|
| 图 4 SATB2重组腺病毒的验证 Fig. 4 The over-expressed validation of the Ad-SATB2 (a) and (b) The endogenous SATB2 were significantly over-expressed in C2C12 cells after adenovirus infection which load SATB2 for 48 h than that of the controls.β-actin were used as loading control,Data present mean ± SD ( n = 3) (4B). **P < 0.01 |
用Ad-SATB2处理BMP9诱导的C2C12细胞,5d后检测ALP活性和染色。结果显示,与blank组和RFP组相比,单独的SATB2可以促进C2C12细胞ALP活性,与BMP9 + RFP和BMP9组相比,SATB2组能显著增加BMP9诱导的ALP活性(图5a、图5b),表明单独SATB2可以促进C2C12细胞的成骨早期分化,且SATB2可促进BMP9诱导的C2C12细胞的成骨分化。

|
| 图 5 SATB2对BMP9诱导的C2C12细胞早期成骨指标ALP的影响 Fig. 5Effect of Ad-SATB2 on BMP9-induced C2C12 cells in early osteogenic differentiation (a)and (b): C2C12 cells were infected with Ad-SATB2 or Ad-RFP and treated with BMP9-conditioned medium; after 36 h infection ,ALP activities were detected by ALP quantitative assay and staining assay at day 5. Data present mean ± SD (n =3). *** P<0.001 |
用Ad-SATB2处理BMP9诱导的C2C12细胞,14 d后用茜素红S进行染色。结果显示,与blank和RFP组相比,单独SATB2组钙盐结节少量增加,与BMP9和RFP + BMP9组相比,SATB2 + BMP9组红色钙盐结节明显增加(图6)。表明SATB2可以促进C2C12细胞的成骨晚期分化,且SATB2可以协同BMP9促进C2C12细胞晚期成骨分化。
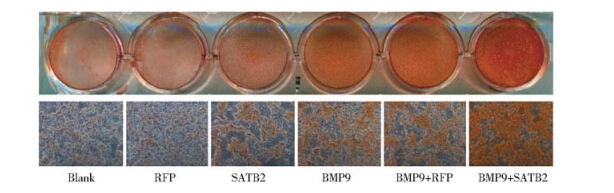
|
| 图 6 SATB2对BMP9诱导的C2C12细胞晚期成骨指标钙盐沉积的影响 Fig. 6 Effect of Ad-SATB2 on BMP9-induced C2C12 cells in late osteogenic differentiation C2C12 cells were infected with Ad- SATB2 or Ad-RFP and treated with BMP9-conditioned medium after 36 h infection,calcium deposition was determined by Alizarin red S staining assay at day 14 |
间充质干细胞(MSCs)作为一种具有多向分化能力的成体干细胞存在于人体的许多种组织中,异源的MSCs和同种异源的MSCs移植到宿主体内不会产生免疫反应[16],因此,在骨的再生和修复研究中,MSCs作为一种比较理想的种子细胞参与骨的再生和修复[17]。本课题组在前期研究发现,BMP9是诱导成骨分化的最强的生长因子[12],其主要通过经典的BMP-Smad和非经典的MAPK信号通路调节骨的形成[9, 18]。有研究报道,SATB2可能在成骨分化的过程中起着重要的作用,但具体作用机制尚不清楚[11, 12]。因此,本实验主要研究SATB2是否可影响BMP9诱导的MSCs成骨分化。
最新的研究表明,SATB2不仅在调控成骨基因表达模式和成骨细胞定向分化中具有调节作用,而且在MSCs的多向分化潜能、自噬以及抗衰老等方面具有重要的调节作用[19]。本课题首先探讨了BMP9对C2C12细胞中SATB2内源性表达的影响,本研究应用Ad-BMP9处理C2C12细胞,不论是mRNA水平还是在蛋白水平,BMP9均明显上调了C2C12细胞内源性SATB2的表达,说明SATB2可能直接参与BMP9诱导的成骨分化过程。
Gong等[20]率先应用慢病毒介导SATB2转染小鼠骨髓基质干细胞,研究表明转染的外源性SATB2在体外和体内均可显著促进成骨分化以及上调成骨基因如Runx2,Sp7,Atf4以及Bsp等表达。但SATB2在BMP9诱导的成骨分化过程中的作用以及作用机制目前尚不明确[11, 13, 21],本研究构建了带红色荧光蛋白的SATB2穿梭质粒,采用Ad-easy系统2包装腺病毒Ad-SATB2,经Western blot验证成功后感染C2C12细胞,观察BMP9和SATB2共同作用对成骨指标的影响。通过对成骨分化的早期指标和晚期指标的检测,表明SATB2可以促进BMP9诱导的成骨分化,可为开展骨再生医学的分子机制提供新的研究视野和方法[17, 19, 22]。
综上所述,本研究采用的腺病毒Ad-easy系统利用原核生物AdEasier细菌完成了腺病毒穿梭质粒和质粒的同源重组,快速构建过表达腺病毒,该方法简单高效,为实验的顺利进行提供了保证。本研究首次证实,SATB2与BMP9在调控骨间质细胞的成骨分化和形成过程具有明显的协同增强效应。下一步将会探讨SATB2和BMP9共同处理后成骨下游靶基因的变化,以及确认SATB2是否通过影响经典的BMP-Smad信号和非经典的MAPK信号通路来影响C2C12细胞的成骨分化,进一步探讨SATB2增强BMP9诱导的C2C12细胞成骨分化的机制。本研究采用独创的Ad-easy系统优化BMP9 诱导的骨间质干细胞在组织工程人工骨中的成骨效应,有助于为骨再生医学的基础研究和临床研究开拓新的视野。
| [1] | Pittenger M F, Mackay A M, Beck S C, et al. Multilineage potential of adult human mesenchymal stem cells. Science, 1999, 284(5411):143-147 |
| [2] | Horwitz E M, Prockop D J, Fitzpatrick L A, et al. Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta. Nat Med, 1999, 5(3):309-313. |
| [3] | Jiang Y, Jahagirdar B N, Reinhardt R L, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature, 2002, 418(6893):41-49. |
| [4] | Tseng Y H, Kokkotou E, Schulz T J, et al. New role of bone morphogenetic protein 7 in brown adipogenesis and energy expenditure. Nature, 2008, 454(7207):1000-1004. |
| [5] | Cheng H, Jiang W, Phillips F M, et al. Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs). J Bone Joint Surg Am, 2003, 85-A(8):1544-1552. |
| [6] | Govender S, Csimma C, Genant H K, et al. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients. J Bone Joint Surg Am, 2002, 84-A(12):2123-2134. |
| [7] | Luo J, Tang M, Huang J, et al. TGFbeta/BMP type I receptors ALK1 and ALK2 are essential for BMP9-induced osteogenic signaling in mesenchymal stem cells. J Biol Chem, 2010, 285(38):29588-29598. |
| [8] | Sinha K M, Zhou X. Genetic and molecular control of osterix in skeletal formation. J Cell Biochem, 2013, 114(5):975-984. |
| [9] | Lee K S, Kim H J, Li Q L, et al. Runx2 is a common target of transforming growth factor beta1 and bone morphogenetic protein 2, and cooperation between Runx2 and Smad5 induces osteoblast-specific gene expression in the pluripotent mesenchymal precursor cell line C2C12. Mol Cell Biol, 2000, 20(23):8783-8792. |
| [10] | Dobreva G, Chahrour M, Dautzenberg M, et al. SATB2 is a multifunctional determinant of craniofacial patterning and osteoblast differentiation. Cell, 2006, 125(5):971-986. |
| [11] | Zhang P, Men J, Fu Y, et . Contribution of SATB2 to the stronger osteogenic potential of bone marrow stromal cells from craniofacial bones. Cell Tissue Res, 2012, 350(3):425-437. |
| [12] | Savarese F, Davila A, Nechanitzky R, et al. Satb1 and Satb2 regulate embryonic stem cell differentiation and Nanog expression. Genes Dev, 2009, 23(22):2625-2638. |
| [13] | Asanoma K, Kubota K, Chakraborty D, et al. SATB homeobox proteins regulate trophoblast stem cell renewal and differentiation. J Biol Chem, 2012, 287(3):2257-2268. |
| [14] | Tu Q, Valverde P, Li S, et al. Osterix overexpression in mesenchymal stem cells stimulates healing of critical-sized defects in murine calvarial bone. Tissue Eng, 2007, 13(10):2431-2440. |
| [15] | He T C, Zhou S, Da C L, et al. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A, 1998, 95(5): 2509-2514. |
| [16] | Mendez-Ferrer S, Michurina T V, Ferraro F, et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature, 2010, 466(7308):829-834. |
| [17] | Chambers I, Colby D, Robertson M, et al. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells. Cell, 2003, 113(5):643-655. |
| [18] | Chang H Y. Anatomic demarcation of cells: Genes to patterns. Science, 2009, 326(5957):1206-1207. |
| [19] | Dong W, Zhang P, Fu Y, et al. Roles of SATB2 in site-specific stemness, autophagy and senescence of bone marrow mesenchymal stem cells. J Cell Physiol, 2015, 230(3):680-690. |
| [20] | Gong Y, Qian Y, Yang F, et al. Lentiviral-mediated expression of SATB2 promotes osteogenic differentiation of bone marrow stromal cells in vitro and in vivo. Eur J Oral Sci, 2014, 122(3):190-197. |
| [21] | Asanoma K, Kubota K, Chakraborty D, et al. SATB homeobox proteins regulate trophoblast stem cell renewal and differentiation. J Biol Chem, 2012, 287(3):2257-2268. |
| [22] | Chang H Y, Chi J T, Dudoit S, et al. Diversity, topographic differentiation, and positional memory in human fibroblasts. Proc Natl Acad Sci USA, 2002, 99(5):12877-12882. |
 2015, Vol. 35
2015, Vol. 35




