文章信息
- 赵央, 田海山, 李校堃, 姜潮
- ZHAO Yang, TIAN Hai-shan, LI Xiao-kun, JIANG Chao
- 成纤维细胞生长因子20研究进展
- The Research Progress of Fibroblast Growth Factor 20
- 中国生物工程杂志, 2015, 35(8): 103-108
- China Biotechnology, 2015, 35(8): 103-108
- http://dx.doi.org/10.13523/j.cb.20150815
-
文章历史
- 收稿日期:2015-03-19
- 修回日期:2015-04-22
2. 吉林农业大学生物反应器与药物开发教育部工程研究中心 长春 130118
2. Bioreactor with the Drug Development Project of the Ministry of Education Research Center, Jilin Agricultural University, Changchun 130118, China
成纤维细胞生长因子FGF20(fibroblast growth factor 20)属于成纤维细胞生长因子超家族(fibroblast growth factor superfamily,FGFs),迄今为止发现的FGF家族有23个成员,分子量从17kDa到34kDa不等,它们之间保持有13%~72%氨基酸序列的同源性。大多数FGFs(除FGF11~FGF14)[1]都能特异性结合几种酪氨酸激酶受体(fibroblast growth factor recepter,FGFR),从而启动FGFR的信号转导途径,发挥相关生物学功能。作为FGF家族成员之一,FGF20与其他FGFs成员一样,对于形态发生,组织修复,血管生成和肿瘤发生[2, 3, 4, 5, 6, 7]等都有重要关联。研究者对FGF20进行表达鉴定时发现其在人体正常组织中,仅在脑组织中有表达,而在其他组织中表达量非常的低甚至是不表达。特别是近阶段研究发现,FGF20是一种黑质致密部的多巴胺能神经元的内源性神经营养因子,能增强中脑多巴胺能神经元的存活,在退行性神经系统疾病如帕金森病的治疗中有重要的临床应用价值,已成为FGFs领域的研发热点。
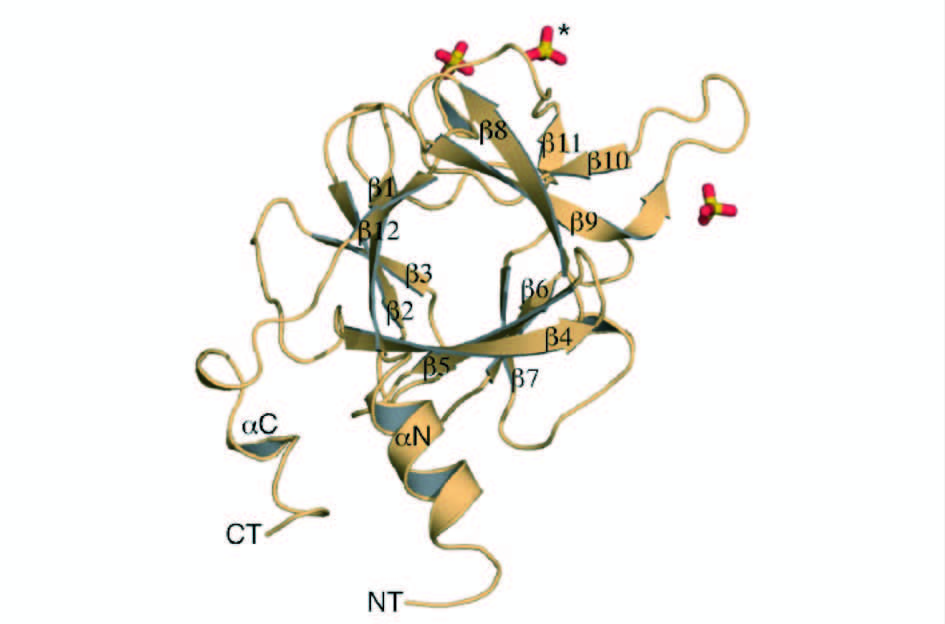
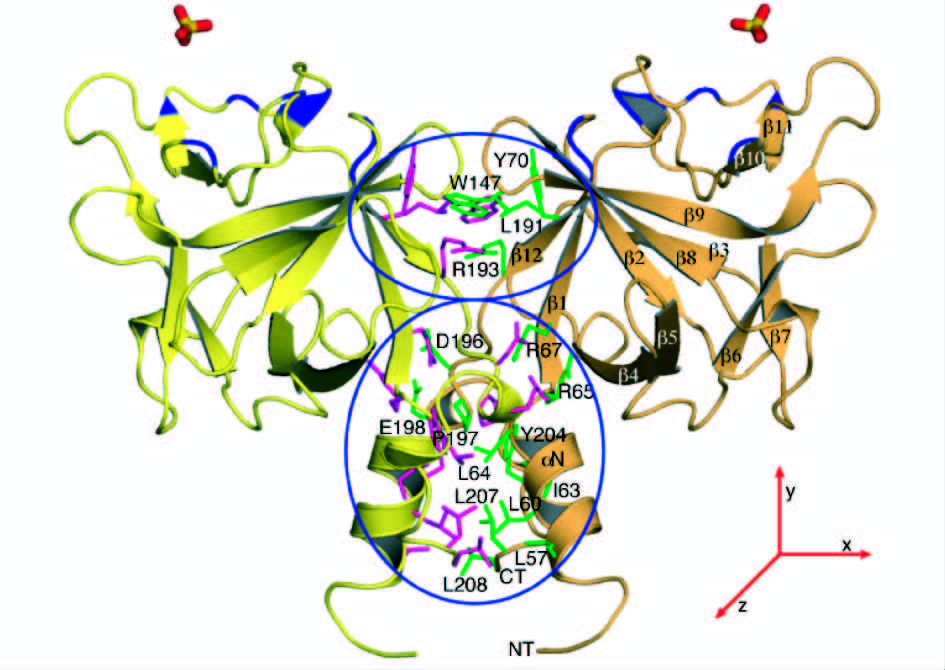
1 FGF20的分子结构Kirikoshi等[8]在2000年最先克隆了人类FGF20基因,它是由3个外显子和2个内含子组成,编码一个含有211个氨基酸残基组成的多肽,单体质量约为23 kDa。在起始密码子甲硫氨酸上游117 bp处有一终止密码。FGF20定位于人类染色体8p21.3- p22区域,是第一个定位于8号染色体的FGFs家族成员。FGF20和FGF9(70%)和FGF16(64%)具有高度的序列同源性[9],三者共同组成FGFs家族中的一个亚家族。研究者已经确定了FGF9的晶体结构[10],它具有FGF家族中的β-三叶草折叠的核心结构,Fan等[11]对FGF20的结构及其活性的稳定性进行了研究,发现FGF20的二级结构主要是由β-折叠构成的,并且FGF20的远紫外圆二色谱表现出典型的含有β-三叶草结构的蛋白质的特征(图 1)。FGF20通过β-三叶草核心结构外的N-末端和C-末端区域的相互作用形成二聚体形式(图 2)。另外,他们发现,类似其它FGF家族成员一样,FGF20在酸性pH下并不稳定,故推测FGF20可能是以二聚体形式存在于细胞内。
|
| 图 1 FGF20的晶体结构示意图 Fig. 1 Crystal Structure of FGF20 |
|
| 图 2 FGF20的二聚体结构示意图 Fig. 2 Dimer Structure of FGF20 |
FGF20和其他FGFs家族成员类似,都是通过与FGFR结合后进行细胞信号转导[12]。FGF20与不同的受体结合会产生不同的功能(表 1)。以前,Ohmachi等[5]就发现FGF受体FGFR-1c在多巴胺能神经元中有大量表达。另外,他们还发现SU5402(FGFR-lc的抑制因子)和PD98059(MAPK通路的抑制因子)均能有效抑制FGF20对MAPK信号通路的激活。
之后,研究者针对FGF20在肿瘤发生中的作用做了大量相关性研究,发现FGF20的作用机制很可能是通过其与FGFRs发生特异性结合,后通过其他信号通路途径,如Wnt,MAPK和BMP4等途径影响细胞内DNA合成以及细胞增殖,从而导致肿瘤发生[7, 13, 14]。
现有资料已经明确,Wnt信号通路与许多人类肿瘤的发生密切相关[15]。大量研究表明β-catenin在肿瘤组织中异常高表达,如结直肠癌、肝癌、乳腺癌等[16, 17, 18, 19, 20, 21]。为了进一步研究FGF20对肿瘤细胞的具体作用机制,Chamorro等[22]将不能被降解的β-catenin转入到肝癌细胞中,结果发现FGF20的转录水平上调,进一步证实与许多人类恶性肿瘤发生密切相关的Wnt/β-catenin信号通路调节着FGF20的转录水平,表明FGF20是β-catenin的直接下游靶基因,其表达与肿瘤形成有非常密切的关系。作为经典Wnt信号通路靶基因之一的FGF20,在人类结直肠癌中也有非常关键的作用。刘萍等[23]利用免疫组化的方法检测45例结直肠癌和20例结直肠正常组织中FGF20表达情况,结果表明FGF20 在结直肠癌组织中的过度表达,与结直肠癌的浸润、转移、临床病理分期密切相关。
帕金森病(PD)又称“震颤麻痹”,多在60岁以后发病。主要表现为患者动作缓慢,手脚或身体其它部分的震颤,身体失去柔软性和姿势不稳的主要运动症状。在帕金森病中,主要是由于在黑质致密部(SNpc)里的多巴胺能神经元的退化。多巴胺(DA)和乙酰胆碱(Ach)作为纹状体两种重要神经递质,功能相互拮抗,对脑退行性神经系统疾病有非常重要的意义。目前,在疾病早期主要治疗药物有拟多巴胺类药物,如左旋多巴(L-dope)、多巴胺增效剂,卡比多巴和中枢性抗胆碱药,苯海索等。虽然这些药物能改善部分帕金森病症状,但这些药物会导致很多副作用,如L-dope诱发的运动障碍和“开关作用”。
最近研究发现,FGF20与脑退行性神经系统疾病,如帕金森病有很大的联系。FGF20作为大鼠中脑多巴胺能神经元的神经营养因子,可能是通过体内增加其表达可引起α-突触核蛋白表达增加,该蛋白参与调节多巴胺的生物合成,目前已广泛应用在帕金森病治疗作用的研究中。作为成纤维生长因子家族的一员,研究者发现FGF20在大脑中优先表达,而在其它主要器官内很少表达或不表达。Ohmachi 等[5]发现,FGF20在小鼠脑组织中有比较高的表达,他们利用原位杂交技术发现,小鼠脑组织的黑质致密部位存在FGF20 mRNA,他们利用整合了鼠FGF20 cDNA的杆状病毒感染昆虫细胞以此获得重组鼠FGF20蛋白,结果发现小鼠中脑多巴胺能神经元的存活率显著提高,表明FGF20是在小鼠大脑黑质致密部选择性表达的一种新型神经营养因子。鉴于多巴胺能神经元营养因子在临床上对很多脑退行性疾病有重大的应用价值,Ohmachi等[6]继续研究了FGF20对提高多巴胺能神经元存活率的特异性作用,发现FGF20对中脑所有神经元的存活率仅有轻微提高,表明FGF20只能选择性地提高多巴胺能神经元的存活率,明确显示了FGF20与多巴胺能神经元相关的疾病联系非常关键。Ohmachi等进一步利用原位杂交技术检测发现FGF受体FGFR-lc mRNA在黑质致密部的大多数神经元内大量表达,黑质致密部的大多数神经元经证明是多巴胺能神经元。相反,在中脑的其他神经元中则表达量较少,提示FGF20可能通过FGFR-1c发挥其营养活性。Takagi 等[24]给猴子注射外源FGF20后,发现其干细胞分化为多巴胺能的神经元,将FGF20移植到一个帕金森病模型中后,也能缓解一些帕金森症状。
总之,在黑质致密部的多巴胺能神经元内优先表达FGF20可以看出其对多巴胺能神经元有优先的神经营养活性。而实验也验证了FGF20的优先活性是通过FGFR-1c活化的MAPK途径介导的。在黑质致密部的多巴胺能神经元内,FGF20的优先表达表明了FGF20在黑质里的多巴胺能神经元的存活中起着重要作用。初步研究显示,FGF20与脑退行性疾病有非常重大的联系[25, 26, 27],有望研发成为治疗帕金森病疾病的一种重要重组蛋白新药。
3.2 FGF20与毛发生长毛发疾病是现代社会比较困扰人们的疾病之一,它不仅给患者带来生理上的困扰,还有心理的压力也远远大于疾病的本身。对于大多数哺乳动物而言,表皮毛囊的生长受到间充质和上皮细胞相互作用的调节,使其经历生长期、退化期和终期的循环[28, 29, 30]。在循环中最主要的动力是毛囊的间充质,尤其是真皮乳突细胞。基底角质细胞重组形成基板,然后间充质细胞在皮肤聚集形成胶原真皮,毛囊的形态基于此开始形成。很多研究已经证实,上皮细胞Wnt/β-Catenin信号通路的调节发生在毛囊形成形态的初期[31]。随后Eda/Edar信号通路协同Wnt/β-Catenin信号通路的激活完成最初的毛发基板的形成[32, 33]。
近来研究发现,许多生长因子如角质细胞生长因子(KGF)、表皮生长因子(EGF)、血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)等对毛发生长有明显的调节作用。早前就有研究发现FGF信号通路在毛发形成的多个阶段都有参与。Huh等[34]利用原位杂交技术发现,敲除FGF20的突变鼠中,基板和真皮凝集都有部分缺失,他们又进一步证实FGF20作为Eda/Edar和Wnt/β-Catenin的下游基因,对真皮凝集的形成和毛囊形成都有很大的关联。这些结果进一步验证了FGF20对于真皮凝集起到重要作用。然而,目前此方面的研究较少,对其准确的生理活性和作用机制尚无明确报道。
3.3 FGF20与组织修复FGF20作为FGFs家族成员,能与一系列FGFR 特异性结合,在组织损伤修复过程中发挥作用[35]。炎症性肠病(inflammatory bowel disease,IBD)是一类原因不明的,以慢性炎症为特征的肠道炎性损坏的消化道疾病,目前尚无药物能完全促进肠粘膜修复,因此对此类疾病的研究是非常重要且紧迫的。先前有部分研究者曾经报道其他两个FGFs家族成员FGF-7和FGF-10对粘膜的修复作用[36, 37],但是很快发现与之对应的特异性结合的受体比较少,它们只能促进一些上皮细胞增生,对成纤维细胞没有明显的影响,因此修复粘膜的作用不显著。为了寻找更加有利的对粘膜修复有作用的成纤维生长因子,Jeffers等[3]针对FGF20进行了两种炎症性肠炎动物模型的建造,一种是用右旋糖苷硫酸酯钠DSS诱导的溃疡性结肠炎模型,另一种是利用消炎痛诱导的克隆氏病模型。研究发现,在DSS诱导的溃疡性结肠炎模型中,仅预防剂量的FGF20就能有效地减轻黏膜损害的严重程度,而且能减少黏膜损伤的范围,进一步加大剂量后发现FGF20能使小鼠的生存率显著提高。而在另一种模型中,与安慰剂对照组相比,FGF20可产生比较明显的保护性效果,如肠坏死较对照组明显减少、相对炎症也有减少、血液中性粒细胞增加数目也较对照组有减少。另外,发现FGF20对口腔黏膜炎也有比较好的效果。Alvarez 等[38]研究发现,针对仓鼠在接受化疗和放疗双重治疗后出现的口腔黏膜炎病症,FGF20有明显的治疗作用,能减轻口腔黏膜炎的严重程度。美国食品与药物监督管理局(FDA)已批准FGF20(CG53135)进入I期临床试验,对接受化疗和放疗的肿瘤病人的口腔黏膜炎进行治疗,并已完成I期临床试验。但该研究在II期临床试验过程中,因治疗的靶点不明确而在2007年10月停止试验[39]。
3.4 FGF20与肿瘤发生Jeffers等[7]通过实时定量PCR技术检测了人类FGF20 mRNA的表达定位,检测发现在人体一般正常组织中,脑组织特别是小脑组织中FGF20表达量最高,而在其它正常组织中表达量很低甚至是不表达。而在50余种人肿瘤细胞株中进行检测,发现绝大多数肿瘤细胞株均异常表达FGF20,其中在肺癌LX-1、结肠癌SW480和胃癌细胞NCI-N87中FGF20的表达量很高,表明FGF20与这些肿瘤的发生发展有重大关联。为了更加明确FGF20是否与肿瘤细胞的形态发生有关,Jeffers等利用NIH 3T3细胞转染到无胸腺裸鼠的皮下组织,2周后发现裸鼠出现肿瘤,他们进而将带有FGF20的表达载体以及一个空白载体转入NIH 3T3细胞,结果发现转染了带有FGF20的表达载体的裸鼠肿瘤体积明显增加,而且出现肿瘤的时间与对照组相比约提前1周,而转染了空白载体的裸鼠相对的肿瘤体积没有很大的变化。进一步表明FGF20蛋白对细胞的增殖和肿瘤的发生有很重要的联系。进一步研究发现,FGF20对细胞的增殖作用是通过与受体FGFR-2α(IIIb)、FGFR-2α(IIIc),FGFR-2β(IIIb),FGFR-3α(IIIc)特异性结合实现的,这些受体可与FGF20蛋白结合而促进细胞增殖的活性。研究结果提示FGF20与这些酪氨酸激酶型受体发生特异性结合,通过引起细胞DNA合成以及细胞增殖的变化,从而可能导致肿瘤发生。
总之,FGF20在肿瘤细胞中异常高表达,证实FGF20参与了肿瘤浸润、转移和病理过程,具有非常重要的研究价值。随着研究的深入,FGF20可作为肿瘤诊断和治疗的靶分子具有良好的研发前景。
3.5 FGF20的其他生物活性FGF20作为细胞增殖因子、血管形成因子、神经营养因子、形态发生因子等与生物体的多个生物活性有重要的关联。Maclachlan等[40]发现,对致死剂量电离辐射照射后小鼠注射FGF20后观察,发现小鼠的总体生存率提高,表明FGF20对辐射有比较明显的的预防作用。Hajihosseini等[2]发现,FGF20对动物肢体发育和颅骨闭合也有很重要的作用,并发挥了分化、增殖的作用,是肢体发育形成和颅骨骨缝闭合的关键调节物质。也有研究者发现FGF20基因敲除小鼠出现了天生的耳聋现象,表明FGF20可能也是影响内耳正常发育的关键蛋白[41]。
4 结 语FGF20 作为成纤维细胞生长因子家族中的一员,具有多种生物学功能。在退行性神经系统疾病、组织修复、肿瘤诊断和治疗的靶分子等[42, 43, 44, 45]方面具有潜在的临床应用价值。此外,FGF20作为一种新颖的细胞保护剂,具有抗辐射的潜力[46]。但是,迄今为止,FGF20针对各种疾病的信号通路的研究仍处于起始阶段,进一步阐明其在不同组织中所发挥的作用及疾病过程中的基因调控机制已成为今后关注的重要方向之一。
| [1] | Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy. Nature Reviews Drug Discovery, 2009, 8(3): 235-253. |
| [2] | Hajihosseini M K, Heath J K. Expression patterns of fibroblast growth factors-18 and-20 in mouse embryos is suggestive of novel roles in calvarial and limb development. Mechanisms of Development, 2002, 113(1): 79-83. |
| [3] | Jeffers M, McDonald W F, Chillakuru R A, et al. A novel human fibroblast growth factor treats experimental intestinal inflammation. Gastroenterology, 2002, 123(4): 1151-1162. |
| [4] | Maclachlan T, Narayanan B, Gerlach V L, et al. Human fibroblast growth factor 20 (FGF-20; CG53135-05): a novel cytoprotectant with radioprotective potential. International Journal of Radiation Biology, 2005, 81(8): 567-579. |
| [5] | Ohmachi S, Watanabe Y, Mikami T, et al. FGF-20, a novel neurotrophic factor, preferentially expressed in the substantia nigra pars compacta of rat brain. Biochemical and Biophysical Research Communications, 2000, 277(2): 355-360. |
| [6] | Ohmachi S, Mikami T, Konishi M, et al. Preferential neurotrophic activity of fibroblast growth factor-20 for dopaminergic neurons through fibroblast growth factor receptor-1c. Journal of Neuroscience Research, 2003, 72(4): 436-443. |
| [7] | Jeffers M, Shimkets R, Prayaga S, et al. Identification of a novel human fibroblast growth factor and characterization of its role in oncogenesis. Cancer Research, 2001, 61(7): 3131-3138. |
| [8] | Kirikoshi H, Sagara N, Saitoh T, et al. Molecular cloning and characterization of human FGF-20 on chromosome 8p21. 3-p22. Biochemical and Biophysical Research Communications, 2000, 274(2): 337-343. |
| [9] | Plotnikov A N, Eliseenkova A V, Ibrahimi O A, et al. Crystal structure of fibroblast growth factor 9 reveals regions implicated in dimerization and autoinhibition. Journal of Biological Chemistry, 2001, 276(6): 4322-4329. |
| [10] | Kalinina J, Byron S A, Makarenkova H P, et al. Homodimerization controls the fibroblast growth factor 9 subfamily’s receptor binding and heparan sulfate-dependent diffusion in the extracellular matrix. Molecular and Cellular Biology, 2009, 29(17): 4663-4678. |
| [11] | Fan H, Vitharana S N, Chen T, et al. Effects of pH and polyanions on the thermal stability of fibroblast growth factor 20. Molecular Pharmaceutics, 2007, 4(2): 232-240. |
| [12] | 时小燕, 郭靓. 成纤维细胞生长因子家族: 生物学特性, 病理生理学作用及相关治疗方法. 国际药学研究杂志, 2009, 36(5): 376-379.Shi X Y, Guo L. Fibroblast growth factor family: biological characteristics, pathophysiological role and related treatment methods. Journal of International Pharmaceutical Research, 2009, 36 (5): 376-379. |
| [13] | Thisse B, Thisse C. Functions and regulations of fibroblast growth factor signaling during embryonic development. Developmental Biology, 2005, 287(2): 390-402. |
| [14] | de Mena L, Cardo L F, Coto E, et al. FGF20 rs12720208 SNP and microRNA-433 variation: no association with Parkinson’s disease in Spanish patients. Neuroscience Letters, 2010, 479(1): 22-25. |
| [15] | Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nature Reviews Drug Discovery, 2006, 5(12): 997-1014. |
| [16] | Bienz M, Clevers H. Linking colorectal cancer to Wnt signaling. Cell, 2000, 103(2): 311-320. |
| [17] | Huang H, Ushijima T, Nagao M, et al. β-Catenin mutations in liver tumors induced by 2-amino-3, 4-dimethylimidazo [4, 5-f] quinoline in CDF 1 mice. Cancer Letters, 2003, 198(1): 29-35. |
| [18] | Cui J, Zhou X, Liu Y, et al. Alterations of beta-catenin and Tcf-4 instead of GSK-3beta contribute to activation of Wnt pathway in hepatocellular carcinoma. Chinese Medical Journal, 2003, 116(12): 1885-1892. |
| [19] | Park J Y, Park W S, Nam S W, et al. Mutations of β-catenin and AXIN I genes are a late event in human hepatocellular carcinogenesis. Liver International, 2005, 25(1): 70-76. |
| [20] | Chung G G, Zerkowski M P, Ocal I T, et al. β-Catenin and p53 analyses of a breast carcinoma tissue microarray. Cancer, 2004, 100(10): 2084-2092. |
| [21] | Rowlands T M, Pechenkina I V, Hatsell S, et al. b-Catenin and Cyclin D1: Connecting development to breast cancer. Cell Cycle, 2004, 3(2): 143-146. |
| [22] | Chamorro M N, Schwartz D R, Vonica A, et al. FGF-20 and DKK1 are transcriptional targets of β-catenin and FGF-20 is implicated in cancer and development. The EMBO Journal, 2005, 24(1): 73-84. |
| [23] | 刘萍, 李云峰, 张捷, 等. FGF-20 在结直肠癌中的表达及临床意义. 实用癌症杂志, 2009, 24(4): 358-359.Liu P, Li Y F, Zhang J,et al. The expression of FGF-20 and its clinical significance in the tissues from colorectal cancer. The Practical Journal of Cancer, 2009, 24 (4): 358-359. |
| [24] | Takagi Y, Takahashi J, Saiki H, et al. Dopaminergic neurons generated from monkey embryonic stem cells function in a Parkinson primate model. Journal of Clinical Investigation, 2005, 115(1): 102-109. |
| [25] | van der Walt J M, Noureddine M A, Kittappa R, et al. Fibroblast growth factor 20 polymorphisms and haplotypes strongly influence risk of Parkinson disease. The American Journal of Human Genetics, 2004, 74(6): 1121-1127. |
| [26] | Fuchs E. Scratching the surface of skin development. Nature, 2007, 445(7130): 834-842. |
| [27] | Mikkola M L, Millar S E. The mammary bud as a skin appendage: unique and shared aspects of development. Journal of Mammary Gland Biology and Neoplasia, 2006,11(3-4): 187-203. |
| [28] | Schmidt-Ullrich R, Paus R. Molecular principles of hair follicle induction and morphogenesis. Bioessays, 2005, 27(3): 247-261. |
| [29] | Lim X, Nusse R. Wnt signaling in skin development, homeostasis, and disease. Cold Spring Harbor Perspectives in Biology, 2013,5(2):a008029. |
| [30] | Mou C, Jackson B, Schneider P, et al. Generation of the primary hair follicle pattern. Proceedings of the National Academy of Sciences, 2006, 103(24): 9075-9080. |
| [31] | Fliniaux I, Mikkola M L, Lefebvre S, et al. Identification of dkk4 as a target of Eda-A1/Edar pathway reveals an unexpected role of ectodysplasin as inhibitor of Wnt signalling in ectodermal placodes. Developmental Biology, 2008, 320(1): 60-71. |
| [32] | Huh S H, Nrhi K, Lindfors PH, et al. Fgf20 governs formation of primary and secondary dermal condensations in developing hair follicles. Genes & Development, 2013, 27(4): 450-458. |
| [33] | Wang G, van der Walt J M, Mayhew G, et al. Variation in the miRNA-433 binding site of FGF20 confers risk for Parkinson disease by overexpression of α-synuclein. The American Journal of Human Genetics, 2008, 82(2): 283-289. |
| [34] | Huh S H, Jones J, Warchol M E, et al. Differentiation of the lateral compartment of the cochlea requires a temporally restricted FGF20 signal. PLoS Biology, 2012, 10(1): e1001231. |
| [35] | Miller R H, Fyffe-Maricich S L. Restoring the balance between disease and repair in multiple sclerosis: insights from mouse models. Disease Models & Mechanisms, 2010, 3(9-10): 535-539. |
| [36] | Han D S, Li F, Holt L, et al. Keratinocyte growth factor-2 (FGF-10) promotes healing of experimental small intestinal ulceration in rats. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2000, 279(5): 1011-1022. |
| [37] | Zhao C, Wang X, Wang J, et al. Effect of moxibustion on the expressions of protein KGF-1, KGF-2 and IL-6 in colon of rats with ulcerative colitis. Journal of Acupuncture and Tuina Science, 2012, 10(3): 138-145. |
| [38] | Alvarez E, Fey E G, Valax P, et al. Preclinical characterization of CG53135 (FGF-20) in radiation and concomitant chemotherapy/radiation-induced oral mucositis. Clinical Cancer Research, 2003, 9(9): 3454-3461. |
| [39] | Schuster M W, Shore T B, Harpel J G, et al. Safety and tolerability of velafermin (CG53135-05) in patients receiving high-dose chemotherapy and autologous peripheral blood stem cell transplant. Supportive Care in Cancer, 2008, 16(5): 477-483. |
| [40] | Maclachlan T, Narayanan B, Gerlach V L, et al. Human fibroblast growth factor 20 (FGF-20; CG53135-05): a novel cytoprotectant with radioprotective potential. International Journal of Radiation Biology, 2005, 81(8): 567-579. |
| [41] | Hayashi T, Ray C A, Bermingham-McDonogh O. Fgf20 is required for sensory epithelial specification in the developing cochlea. The Journal of Neuroscience, 2008, 28(23): 5991-5999. |
| [42] | Sleeman I J, Boshoff E L, Duty S. Fibroblast growth factor-20 protects against dopamine neuron loss in vitro and provides functional protection in the 6-hydroxydopamine-lesioned rat model of Parkinson’s disease. Neuropharmacology, 2012, 63(7): 1268-1277. |
| [43] | Shimada H, Yoshimura N, Tsuji A, et al. Differentiation of dopaminergic neurons from human embryonic stem cells: modulation of differentiation by FGF-20. Journal of Bioscience and Bioengineering, 2009, 107(4): 447-454. |
| [44] | Häärä O, Harjunmaa E, Lindfors P H, et al. Ectodysplasin regulates activator-inhibitor balance in murine tooth development through Fgf20 signaling. Development, 2012, 139(17): 3189-3199. |
| [45] | Kaya F, Mannioui A, Chesneau A, et al. Live imaging of targeted cell ablation in Xenopus: a new model to study demyelination and repair. The Journal of Neuroscience, 2012, 32(37): 12885-12895. |
| [46] | Katoh M, Katoh M, Katoh Y. Comparative genomics on FGF20 orthologs. Oncology Reports, 2005, 14(1): 287-290. |
 2015, Vol. 35
2015, Vol. 35




