文章信息
- 郭玮婷, 张慧, 查东风, 黄汉峰, 黄静, 高红亮, 常忠义, 金明飞, 鲁伟
- GUO Wei-ting, ZHANG Hui, ZHA Dong-feng, HUANG Han-feng, HUANG Jing, GAO Hong-liang, CHANG Zhong-yi, JIN Ming-fei, LU Wei
- 产耐高温谷氨酰胺转胺酶菌株的快速筛选方法
- A Rapid Method of Screening for Thermostable Transglutaminase from Streptomyces mobaraensis
- 中国生物工程杂志, 2015, 35(8): 83-89
- China Biotechnology, 2015, 35(8): 83-89
- http://dx.doi.org/10.13523/j.cb.20150812
-
文章历史
- 收稿日期:2015-04-29
- 修回日期:2015-05-11
2. 河南省商丘市农业局经作中心 商丘 476000;
3. 泰兴市东圣食品科技有限公司 泰兴 225411
2. Economic Crops Center Henan Shangqiu Agriculture Bureau, Shangqiu 476000, China;
3. Taixing Dongsheng Food and Technology Limited Company, Taixing 225411, China
谷氨酰胺转胺酶(EC 2.3.2 .13 ,Transglutaminase,TGase)能够催化蛋白质以及氨基酸分子之间形成 ε-(γ -谷氨酰)赖氨酸异肽键以及催化谷氨酰胺使其脱氨生成谷氨酸残基[1]。来源于茂原链霉菌的谷氨酰胺转胺酶(microbial transglutaminase,MTG)具有非Ca2+依赖性[1]、纯化工艺简单以及相对于动植物来源提取成本低廉等优势,现已广泛应用于食品[2],医药[3],纺织[4]等行业。
然而,由于蛋白质的稳定性易受理化因素影响,MTG在贮存、运输以及食品加工应用中受温度影响较明显,如在酸奶发酵前的巴氏消毒[5]过程中,火腿的高温蒸煮、肉鱼丸的切割、斩拌等过程中会产生热量,使得MTG活性损失、交联效果大打折扣,影响了酶本身和蛋白质产品的品质[6]。因此,MTG的热稳定性问题成为其在高温食品加工领域应用的瓶颈。据报道,一些稳定添加剂(糖类、醇类、氨基酸及其衍生物、无机盐)会增加MTG的Tm值[7],所以目前商业化MTG产品采用冷冻干燥、低温运输和大量添加麦芽糊精作为保护剂来增加MTG的稳定性[8]。但是这些方法具有各种局限性且效果甚微,无法从本质上解决问题。Marx等[9]利用基因工程技术在大肠杆菌中表达获得了MTG半衰期提高了270%的突变菌株,但是以大肠杆菌为宿主的基因工程菌的安全性有待考察,使其无法应用于食品领域。
目前,提高MTG热稳定性的手段主要为添加保护剂和对MTG结构域中部分氨基酸进行定点突变、组合突变以及饱和突变等分子改造,如Buettner等[10]利用饱和突变的手段,获得的突变体K294L在 50℃的半衰期提高了4.5 倍。利用传统诱变技术改良菌株,以获得所产MTG热稳定性得到改善的菌株是改善MTG热稳定性的重要手段之一。本文首次探讨了将NTG诱变技术与96孔板高通量筛选技术相结合获得产耐高温MTG菌株的可行性,并考察了筛选得到的突变株所产MTG的热稳定性,旨在建立一种产耐高温MTG菌株的高效筛选方法。
1 材料与方法 1.1 材 料 1.1.1 菌株与培养基茂原链霉菌由华东师范大学微生物实验室保种。参照本实验室所用高氏一号培养基、种子培养基和发酵培养基[11 ,12]。
1.1.2 试剂与仪器Nα-CBZ-Gln-Gly(上海多肽公司),还原型谷胱甘肽(上海生工生物工程公司);其他药品均为分析纯级产品(国药集团化学试剂有限公司)。恒温水浴锅(上海精宏实验设备有限公司),恒温调速回旋式摇床DKY-Ⅱ(上海杜科自动化设备有限公司),Synergy HT多功能酶标仪(BioTek),721可见分光光度计(上海元析仪器有限公司),Labofuge 400R水平离心机(Thermo Scientific)。
1.2 产耐高温MTG菌株筛选方法的建立 1.2.1 MTG活性测定采用恒温空气浴法。参照氧肟酸比色法[13],根据恒温水浴法改良。96孔板中加入10μl发酵上清液、100μl底物溶液(0.1mol/L盐酸羟胺,0.01mol/L还原型谷胱甘肽,0.03mol/L Nα-CBZ-Gln-Gly,0.2mol/L Tris-HCl,pH 6.0),于37℃恒温空气浴10min后,加入100μl终止液[1mol/L HCl,4%(w/v)三氯乙酸,1.6%(w/v) FeCl3·6H2O]终止反应,测定525nm处吸光值。一个MTG活性单位:37℃下,每分钟催化盐酸羟胺、Nα-CBZ-Gln-Gly生成1μmolL-谷氨酸-γ-单羟氧肟酸所需的酶量。变异系数(CV)=标准差/平均值×100%。
1.2.2 筛选温度和时间的确定将单菌落接种于96孔板(装液量:150μl发酵培养基/孔),30℃、200r/min培养3d[14]后,取10μl发酵上清液于新的96孔板、密封,分别在60℃、70℃和80℃水浴0min、2min、5min、10min、20min后,迅速冰浴冷却,参照1.2.1 方法测定MTG活性。残留活性为发酵上清液不同温度水浴一段时间后的MTG活性。
1.3 NTG诱变[15]TM缓冲液pH为8.0,NTG终浓度分别为0.1 mg/ml、0.5 mg/ml、1 mg/ml、2 mg/ml、3mg/ml,反应时间1h。
残留活性提高(%)=[(突变株残留活性-出发株残留活性)/ 出发株残留活性] ×100
致死率(%)=[(未诱变平板菌落数-诱变后平板菌落数)/未诱变平板菌落数] ×100
正突变率(%)=(残留活性发生正突变的菌株数/总突变菌株数)×100
1.4 高通量筛选产耐高温MTG的菌株 1.4.1 初筛将装有10μl发酵上清液的96孔板密封,70℃水浴7.5min后迅速冰浴冷却,参照1.2.1 方法测定MTG活性。挑选出残留活性相对出发菌株高30%的突变株。
1.4.2 复筛将初筛得到的突变株,重新进行96孔板发酵,分别测定70℃水浴7.5min前、后的活性,挑选出酶活残留率相对出发菌株高30%的突变株进行热稳定性分析。酶活残留率=发酵上清液70℃保温7.5min后的MTG活性/保温前的MTG活性。
1.5 耐高温MTG的热稳定性分析将30℃、200r/min培养24h的种子液以8%(v/v)的接种量接种至装有30ml发酵培养基的摇瓶中,相同条件培养40h[14]。摇瓶发酵后分别取各突变株的发酵上清液,用Tris-HCl、pH6.0缓冲液进行稀释,使得各突变株的MTG活性相同,然后分别取1ml于50℃水浴20min、40 min、60 min、80 min、100 min,于70℃和80℃水浴0 min、0.5 min、1 min、1.5 min、2min,参照1.2.1 方法测定MTG活性,每组3个重复。
1.6 数据处理和分析用graphpad prism 5和Microsoft Excel进行数据处理与分析,用Origin8.0进行作图。
2 结果与分析 2.1 产耐高温MTG菌株的筛选方法建立 2.1.1 高通量测定MTG活性方法的建立MTG活性的测定方法采用氧肟酸比色法[13],比较了空气浴和水浴两种反应条件对酶活测定结果的影响。图 1中(a)和(b)分别表示37℃水浴和空气浴反应10min条件下,MTG活性的测定结果。数据表明,水浴法和空气浴法测定MTG活性的变异系数分别为8.44%和8.24%,两种测定方法的变异系数相近且均在合理范围内[16];水浴法和空气浴法测得MTG的平均活性也相近,分别为35.81mAbs/min和34.08mAbs/min。总之,两种方法都可用于MTG活性的测定,但是水浴会污染96孔板底部,给活性测定带来不便,同时严重限制了一次性筛选数量。因此,为提高高通量筛选效率,本研究采用37℃空气浴10min的条件测定MTG的活性。

|
| 图 1 恒温水浴和空气浴对测定MTG活性的影响 Fig. 1 The influence of water bath and air bath on theMTG activity (a)Water bath (b)Air bath on 10min at 37℃ The coefficient of variation(a)is 8.44%;(b)is 8.24% |
不同热处理温度和时间下,MTG的残留活性差别很大,确定最佳失活温度和时间可以有效地增加筛选效率。图 2(a)表示出发株所产MTG在60℃、70℃和80℃下,分别保温2min、5min、10min、20min后的残留活性。由图可知,60℃水浴20min,仍残留有较高的MTG活性,而80℃水浴5min,MTG几乎完全丧失活性。70℃水浴5min时MTG活性损失较少,水浴10min时活性完全丧失。60℃所需热处理时间过长,严重影响一次性筛选数量;80℃热处理时间太短,受热不均一、操作误差较大。在这三种温度下测定MTG残留活性的变异系数如表 1所示,60℃和80℃的变异系数总体略高于70℃。因此,选择70℃作为最佳筛选温度,并对70℃水浴时间进行进一步细化。由图 2(b)可知,70℃水浴7.5min的MTG残留活性较低,显色较浅,筛选过程中正突变的反应颜色与出发株和负突变的反应颜色区分明显[图 2(c)],可以快速、准确挑选出MTG残留活性较高的突变株,且该条件下变异系数仅为10.4%,所以最终确定筛选温度和时间为:70℃、7.5min。

|
| 图 2 筛选温度和时间的确定 Fig. 2 Evaluation of temperature and time for the method of screening for the variants producing thermostable MTG in 96-well microtiter (a)I-III: pre-incubation in water at 60,70 and 80℃ at 0,2,5,10,20min (a~e) respectively (b)IVa-IVc: pre-incubation in water at 70℃ at 5,7.5,10min respectively (c)Initial rate of MTG of well 1~4: 7.21,50.47,101.43,133.17mAbs/min respectively |
| Incubation time(min) | Coefficient of variation(%) | ||
| 60℃ | 70℃ | 80℃ | |
| 0 | 25.85 | 13.52 | 14.16 |
| 2 | 24.79 | 16.41 | 10.83 |
| 5 | 29.49 | 15.26 | 24.61 |
| 10 | 22.33 | 23.90 | 24.27 |
| 20 | 24.73 | 20.75 | 25.07 |
获得产耐高温MTG菌株的关键是构建正突变率高、残留活性提高幅度大的高效筛选突变库。参照1.3方法,对NTG诱变浓度进行优化,所得致死率、正突变率和残留活性提高幅度如表 2所示。由该表可知,随着NTG浓度的增加,致死率逐渐增加;正突变率以及MTG残留活性提高30%以上的比例先增加后减少。当NTG浓度为2mg/ml时,正突变率、残留活性提高30%以上的比例均为最大值,分别为42.01%和8.51%。该浓度下得到正突变株的概率最大,残留活性明显提高的突变株最多,同时致死率适中,便于一次性获得大量突变株。因此,最佳诱变条件确定为2mg/ml NTG、pH8.0、反应60min。
| Concentration of NTG (mg/ml) | Initial rate of MTG increased more than 30%(%) | Fatality rate(%) | Positive mutation(%) | Sample size(strain) |
| 0.1 | 6.60 | 15.66 | 23.26 | 400 |
| 0.5 | 7.22 | 43.98 | 30.56 | 400 |
| 1 | 7.99 | 65.06 | 37.15 | 400 |
| 2 | 8.51 | 82.18 | 42.01 | 400 |
| 3 | 4.40 | 96.99 | 36.81 | 400 |
使用2.2结果中最佳NTG浓度进行诱变,构建了样本量为5 200株的菌株突变库。按照1.4.1 方法进行高通量初筛,MTG残留活性的测定结果如图 3(a)所示。由图可知突变株残留活性的平均值为23.44 mAbs/min,经过初筛挑选出残留活性较高的142株突变株进行高通量复筛,筛选通量为2.7%。
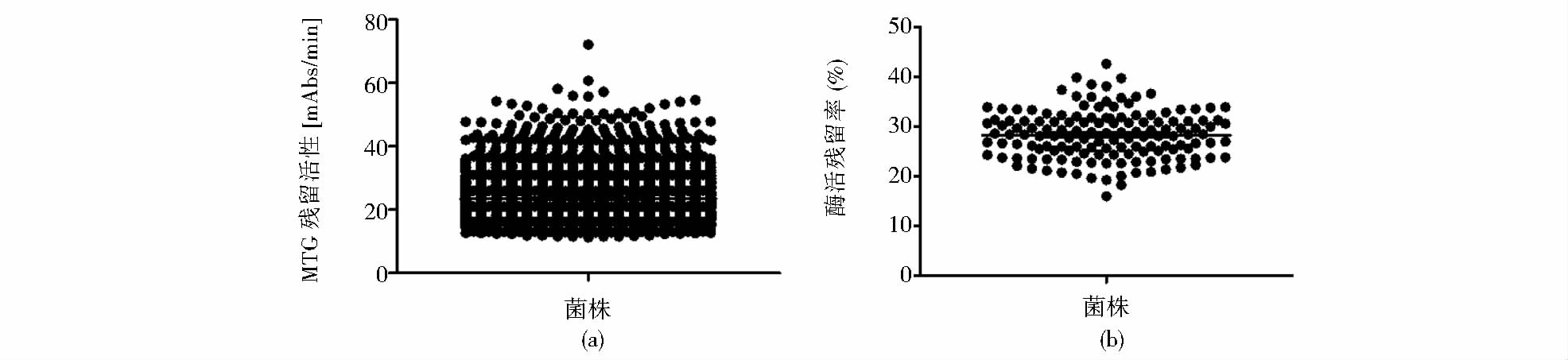
|
| 图 3 高通量筛选产耐高温MTG的菌株 Fig. 3 The result of high-throughput screening for variants producing thermostable MTG (a)Preliminary screening (b) Repeated screening |
参照1.4.2方法进行高通量复筛,复筛结果如图 3(b)所示。突变株中,酶活残留率最低值为18.2%,80%的突变株酶活残留率在20%~30%之间。有5株突变株所产MTG 的热稳定性明显提高,酶活残留率均在40%左右,从中挑选出酶活残留率最高的突变株12-82进行热稳定性分析。
2.4 耐高温MTG的热稳定性分析突变株12-82的发酵上清液在50℃、70℃和80℃水浴不同时间的酶活残留率如图 4所示。在50℃、70℃和80℃检测的所有时间点中,该菌株所产MTG的酶活残留率均高于出发株。50℃的热稳定性优势最为明显: 酶活残留率提高范围在10%~20%;保温60min时,仍保留58.7%的活性,比出发株高出近20%;保温100min时,酶活残留率为26%。
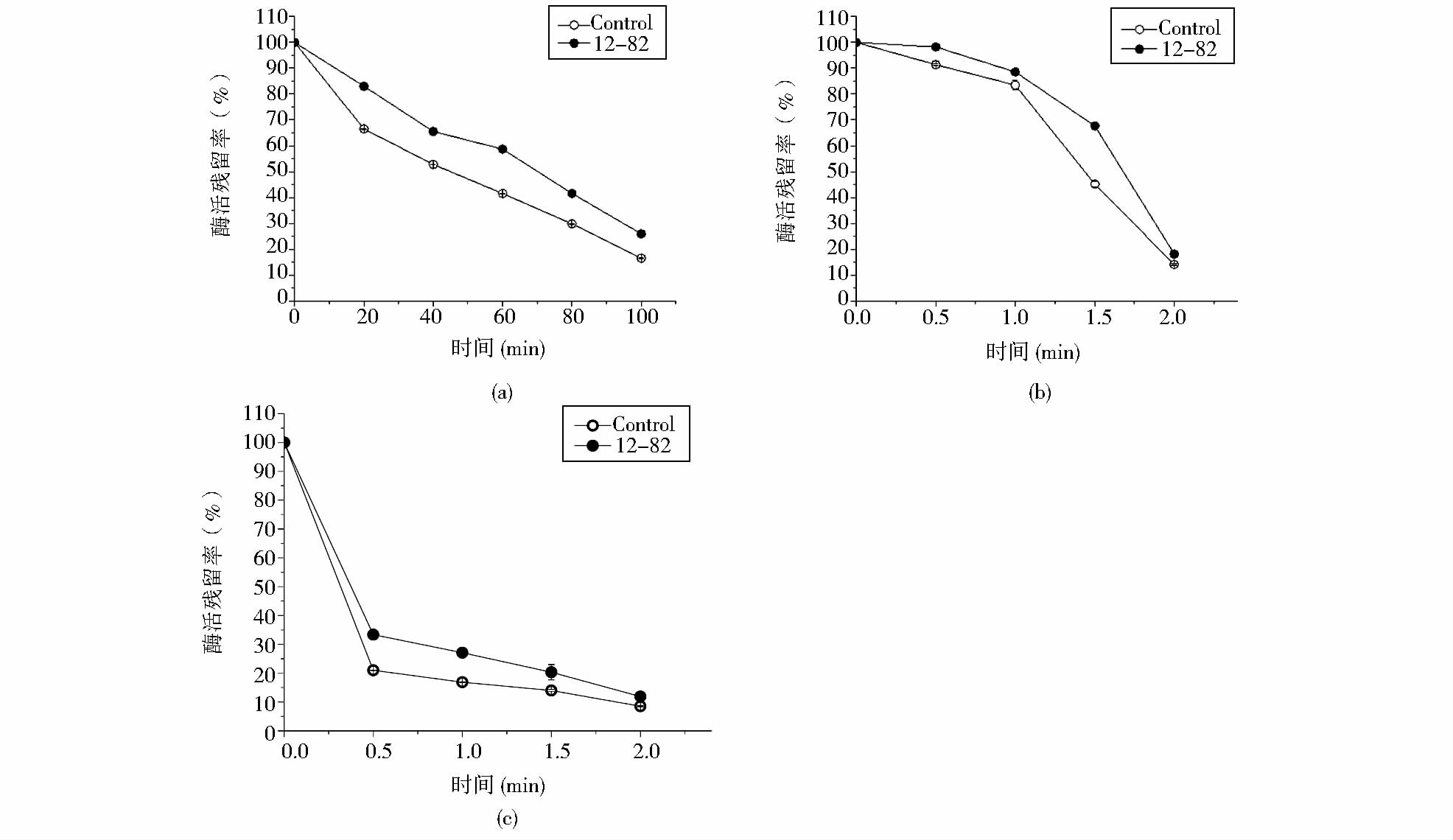
|
| 图 4 耐高温MTG的热稳定性 Fig. 4 Thermostability of MTG from the variant 12-82 a)0,20,40,60,80 and 100 min incubation at 50℃(b)0,0.5,1.0,1.5 and 2.0 min incubation at 70℃(c) 0,0.5,1.0,1.5 and 2.0 min incubation at 80℃ |
MTG活性在70℃和80℃急剧下降,但突变株12-82仍显示出较好的热稳定性。70℃保温1.5min时,酶活残留率为62.7%,比出发株高出近20%。80℃保温0.5min和1min时,酶活残留率分别为33.4%和27.1%,比出发株高出12.3%和10.2%,且保温2min时,仍有11.9%的酶活残留率。
3 讨 论作为21世纪超级粘合剂的MTG在未来的应用范围不可估量,但是作为蛋白质本身,由于其自身的不稳定性,极大地影响了其商业化应用。特别是在热稳定方面,MTG在工业生产、运输和贮存中普遍存在耐热性差等问题,严重制约了其应用范围。
通过对蛋白质特定位点的氨基酸进行定点突变可以显著提高其热稳定性[17],但是工程菌的安全性有待考察,改良的菌株无法直接应用于食品领域。因此,本研究采用NTG诱变,使出发株中某个或某些氨基酸产生随机突变,并结合96孔板高通量筛选技术建立了产耐高温MTG菌株的高效筛选方法,具有以下特点:优化了高通量测定MTG活性的方法,最终选择了37℃空气浴反应10min的条件(图 1)以提高筛选效率;确定筛选温度和时间为70℃水浴7.5min(图 2);并且优化了NTG诱变浓度,最终选择2mg/ml(表 2)的浓度构建随机突变库;使用方便高效的96孔板高通量筛选方法,从而可以在一个月内完成5 200株突变株的初筛,本实验室以前通过摇瓶发酵进行初筛,一个月最多只能完成450株菌株的筛选,本筛选方法与之比较,效率大大提高。
经过高通量初筛、复筛,最终挑选出5株热稳定性明显改善的菌株,其中突变株12-82每毫升发酵上清液中MTG的活性约为117.86mAbs/min,其所产MTG在50℃、70℃和80℃的酶活残留率均有10%~20%的提高,在50℃保温60min以及70℃保温1.5min时的酶活残留率比出发株高出近20%。Menéndez等[18]研究中来源于S. mobaraense的MTG在80℃水浴2min后已经完全失去活性,而突变株12-82所产MTG在80℃水浴2min仍有11.9%(图 4)的酶活残留率。遗传稳定性实验结果表明,突变株12-82具有良好的遗传稳定性,第一代与第七代平均酶活残留率无显著性差异(P>0.05)。
本筛选方法得到的突变株所产的耐高温MTG在50℃、70℃和80℃所有的检测时间点中,酶活残留率均有一定提高,因此可采用本筛选方法逐轮筛选、不断积累正突变,有望在短时间内获得所产MTG的热稳定性大幅度提高的突变株,为解决MTG在高温食品加工领域热稳定性差的问题提供了有力的技术保障。
| [1] | Ando H, Adachi M, Umeda K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms. Agricultural and Biological Chemistry, 1989, 53(10): 2613-2617. |
| [2] | Matheis G, Whitaker J R. A review: Enzymatic cross-linking of proteins applicable to foods. Journal of Food Biochemistry, 1987, 11(4): 309-327. |
| [3] | Garcia Y, Wilkins B, Collighan R J, et al. Towards development of a dermal rudiment for enhanced wound healing response. Biomaterials, 2008, 29(7): 857-868. |
| [4] | Cortez J, Bonner P L, Griffin M. Application of transglutaminases in the modification of wool textiles. Enzyme and Microbial Technology, 2004, 34(1): 64-72. |
| [5] | O'Sullivan M M, Kelly A L, Fox P F. Effect of transglutaminase on the heat stability of milk: a possible mechanism. Journal of Dairy Science, 2002, 85(1): 1-7. |
| [6] | Ahhmed A M, Kuroda R, Kawahara S, et al. Dependence of microbial transglutaminase on meat type in myofibrillar proteins cross-linking. Food Chemistry, 2009, 112(2): 354-361. |
| [7] | 常忠义,柏俊华,高红亮,等. 海藻糖对微生物谷氨酰氨转胺酶热稳定性研究. 中国生物工程杂志, 2005, 25(4): 291-294. Chang Z Y, Bai J H, Gao H L, et al. Study on stabilization of microbial transglutaminase by trehalose. China Biotechnology, 2005, 25(4): 291-294. |
| [8] | 李洪波,张兰威,崔艳华,等. 微生物源谷氨酰胺转氨酶基因工程菌株的研究进展. 食品工业科技, 2013, 34(17): 389-394. Li H B, Zhang L W, Cui Y H, et al. Research progress in genetically engineered strains of microbial transglutaminase. Science and Technology of Food Industry, 2013, 34(17): 389-394. |
| [9] | Marx C K, Hertel T C, Pietzsch M. Random mutagenesis of a recombinant microbial transglutaminase for the generation of thermostable and heat-sensitive variants. Journal of Biotechnology, 2008, 136(3): 156-162. |
| [10] | Buettner K, Hertel T C, Pietzsch M. Increased thermostability of microbial transglutaminase by combination of several hot spots evolved by random and saturation mutagenesis. Amino Acids, 2012, 42(2-3): 987-996. |
| [11] | 常忠义,江波,王璋. 培养基组成对轮枝链霉菌合成谷氨酰胺转胺酶的影响. 无锡轻工大学学报, 2001, 20(1): 51-54. Chang Z Y, Jiang B, Wang Z. Effect of culture medium composition on the production of transglutaminase by Streptoverticillium. Journal of Wuxi University of Light Industry, 2001, 20(1): 51-54. |
| [12] | 宋敏,曹娟,张颖颖,等. 不同菌落形态的链霉菌对产谷氨酰胺转胺酶的影响. 广西农业生物科学, 2008, 27(4):435-438. Song M, Cao J, Zhang Y Y, et al. Effect of different colonial morphologies on transglutaminase production of Streptomyces. Journal of Guangxi Agric and Biol Science, 2008, 27(4):435-438. |
| [13] | Grossowicz N, Wainfan E, Borek E, et al. The enzymatic formation of hydroxamic acids from glutamine and asparagine. Journal of Biological Chemistry, 1950, 187(1): 111-125. |
| [14] | 刘颖,田沛霖,陈佳,等. 产谷氨酰胺转胺酶菌株的高通量筛选. 西北农林科技大学学报(自然科学版), 2013, 41(06): 167-172. Liu Y, Tian P L, Chen J, et al. Novel high-throughput screening of Streptoverticillium mobaraense with high microbial transglutaminase yield. Journal of Northwest A&F University, 2013, 41(06): 167-172. |
| [15] | Kieser T, Bibb M J, Buttner M J, et al. Practical Streptomyces Genetics. 2nd ed. Norwich United Kingdom The John Innes Foundation, 2000. 103-104. |
| [16] | Salazar O, Sun L. Evaluating a screen and analysis of mutant libraries. In: Frances H A, George G. Directed Enzyme Evolution. New Jersey: Humana Press, 2003. 85-97. |
| [17] | Heinzelman P, Snow C D, Smith M A, et al. SCHEMA recombination of a fungal cellulase uncovers a single mutation that contributes markedly to stability. Journal of Biological Chemistry, 2009, 284(39): 26229-26233. |
| [18] | Menéndez O, Rawel H, Schwarzenbolz U, et al. Structural changes of microbial transglutaminase during thermal and high-pressure treatment. Journal of Agricultural and Food Chemistry, 2006, 54(5): 1716-1721. |
 2015, Vol. 35
2015, Vol. 35




