文章信息
- 常玉梅, 侯占铭
- CHANG Yu-mei, HOU Zhan-ming
- 禾谷镰刀菌中FgPDE1基因的敲除及其功能的研究
- Research on Gene Knockout and Function of FgPDE1 in Fusarium graminearum
- 中国生物工程杂志, 2015, 35(8): 59-67
- China Biotechnology, 2015, 35(8): 59-67
- http://dx.doi.org/10.13523/j.cb.20150809
-
文章历史
- 收稿日期:2015-03-10
- 修回日期:2015-04-01
小麦赤霉病[Gibberella zeae (Schw.) Petch]是我国气候温暖潮湿麦区的重要病害,其中禾谷镰刀菌(Fusarium graminearum)为致病优势种[1]。禾谷镰刀菌的有性世代为玉蜀黍赤霉(Gibberella zeae),无性世代属于半知菌亚门的镰孢属(Fusarium)[2]。禾谷镰刀菌是单核细胞,染色体也为单倍体,无性世代产生分生孢子,有性世代产生子囊孢子[3]。禾谷镰刀菌中的主要真菌毒素是脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和玉米赤霉烯酮(zearalenone,ZEA)[4]。真菌毒素是一类由丝状真菌在适宜条件下产生的有毒的次生代谢物[5],对人类和动物都造成了一定的威胁。一种名为多菌灵的苯并咪唑杀菌剂一度用于赤霉病的防治,然而使用时间过长就会使赤霉菌产生抗药性,于是更为先进、稳定的降低禾谷镰刀菌致病力的方法尚待研究。随着生物技术、基因工程、遗传分子生物学等学科的发展,通过敲除禾谷镰刀菌中的某些致病基因,而使它的侵染力减弱,从遗传角度上彻底防治赤霉病,已成为一种理想的方式[6, 7, 8, 9, 10]。禾谷镰刀菌全基因组序列测定的成功为研究它的基因组功能及致病机理提供了遗传基础[11]。自1995年首次成功克隆禾谷镰刀菌的致病基因以来,已有多个致病相关的基因被克隆和鉴定出来了。如Tri5与毒素的合成有关[12],MGV1在菌体的异核体的形成、雌性繁殖以及侵染寄主等过程中都起着重要作用[13],脂酶基因FGL1的缺失会使致病力减弱,毒性下降[14],基因PKS4参与合成玉米赤霉烯酮[15],XYR1影响细胞壁完整性[16],FgEnd1基因与内吞机制有关[17],FgFlbD调节有性和无性繁殖的菌丝分化[18],ELP3参与禾谷镰刀菌的繁殖、毒力和氧化应激反应[19]等等。
在酿酒酵母中,腺苷调节养分感应,假菌丝分化,细胞周期进程和应激信号。在裂殖酵母中,交配,孢子形成和糖异生都是通过cAMP途径控制的。在致病真菌中,如白色念珠菌和隐球菌,cAMP信号影响性分化,抗逆性和毒力的几个重要方面[20]。酿酒酵母细胞内cAMP水平分别受到低亲和性磷酸二酯酶PDE1和高亲和性磷酸二酯酶PDE2的活性影响,PDE2调节基础cAMP水平,PDE1却对基础cAMP水平的影响不显著。然而,PDE1在葡萄糖存在的诱导下调节cAMP水平,而且PDE1对 cAMP的分解活性受到PKA催化亚基的正调控。从新生隐球菌报告的PDE1和PDE2的特性表明,PDE2对于调节细胞内cAMP水平没有明显的作用,此基因的缺失只能导致细微的表型变化。然而,PDE1显然是依赖于cAMP的信号传导途径,调节毒力属性的一部分。PDE1由PKA1激活,它是PKA活化负反馈环路控制这个致病真菌胞内cAMP水平的一个重要部分[21]。以上研究表明,研究PDE1基因对深入研究cAMP的信号级联途径非常必要。并且,在禾谷镰刀菌中,此基因并没有被研究过。本次实验采用基因敲除技术敲除目的基因FgPDE1,应用Split Marker重组技术构建敲除载体,以PCR为基础,经过两轮PCR扩增构建敲除载体导入受体细胞,用PCR方法确认敲除突变体,再根据对突变体的观察以及致病力的检测做初步的判断,为进一步研究此基因的功能做铺垫。
1 材料与方法 1.1 材 料 1.1.1 实验菌株、质粒本实验所用的实验菌株、质粒见表 1。
| Strains and plasmids | Characterization | Resource |
| Strains | ||
| Fusarium graminearum wilde type | Purdue University | |
| E.coli DH5α | Vector-host | Biomad |
| Plasmids | ||
| pCB1003 | Containing Hygromycin | Purdue University |
| pKY37 | Containing Hygromycin | Purdue University |
在小麦赤霉菌数据库(Fusarium Comparative Database)中找到同源基因FGSG_06914.3基因序列,下载FGSG_06914.3基因及上下游1 000 bp序列,根据Split Maker原理,利用下载的FGSG_06914.3基因序列(>F. graminearum PH-1 supercont 3.4 of Gibberella zeae PH-1[DNA] 1653715-1658514 +)和潮霉素磷酸转移酶基因(hph)序列设计引物,本实验所用引物由上海生工技术服务有限公司合成,引物序列见表 2。
| Primers | sequence | Resource |
| Pde5F | CCTTCACATCATCACCCTGACACC | upstream sequence |
| Pde6R | TTGACCTCCACTAGCTCCAGCCAAGCCTGTACCAAGATGAGGCGATTTACC | of FgPDE1 |
| Pde3F | ATAGAGTAGATGCCGACCGCGGGTTCTAACGGTGCAGTTGTGAAACTGGC | downstream sequence |
| Pde4R | GGATGATGCACTATGGAAGGCTCG | of FgPDE1 |
| PdeN1F | GCAGCTAAGGAGCAATCAAC | Internal sequence |
| PdeN2R | CTGACACTTCTTATCACCGC | of FgPDE1 |
| HYG/F | GGCTTGGCTGGAGCTAGTGGAGGTCAA | upstream sequence |
| HY/R | TTCGGACCGCAAGGAATCGGTCAATAC | of Hygromycin |
| YG/F | GATGTAGGAGGGCGTGGATATGTCCT | upstream sequence |
| HYG/R | ATAGAGTAGATGCCGACCGCGGGTTC | of Hygromycin |
| H850R | AACAATGTCCTGACGGACAA | Internal sequence of Hygromycin |
Chitinase(几丁质酶)、Driselase(崩溃酶)、Lysing enzyme(溶菌酶)、Carboxymethyl cellulose、Yeast Extract、MgSO4·7H2O、Dextrose、Casamino Acids、KCl、Tlis碱、抗生素潮霉素(Hygromycin B)(50mg/ml)均购自Sigma公司 ;PEG8000、Ampcilin(氨苄青霉素)购自Amresco公司:2×Taq Mix购于南京博尔迪公司;LMTagar(低熔点琼脂)购于上海生工技术服务有限公司;普通质粒小提试剂盒(离心柱型,TIANGEN);真菌基因组DNA提取试剂盒,BioFlux;Sucrose(Biosharp);CaCl2.2H2O (Scientific Research Special);Agarose(Biowest);Peptone、D-glucose、RNase(Solarbio);miracloth(Calbiochem),其它常规药品均为国内采购。
1.1.4 培养基及主要试剂LB液体培养基、LB固体培养基、0.5mol/L EDTA(pH 8.0)、10×TBE电泳缓冲液、CMC培养基(梭甲基纤维素酯培养基Carboxymethyl CelIulose)、YEPD液体培养基、0.5mol/L Tris-Cl(pH 8.0)、STC buffer、PTC buffer、1.2mol/L KCl溶液、原生质体(protoplast)Buffer、TB3液体培养基、LMTagar TB3固体培养基、TCC培养基都可在相关文献中查到[22]。
1.2 方 法 1.2.1 禾谷镰刀菌野生型菌株基因组DNA的提取接种PH-1的菌丝于YEPD培养基中(含Amp),25℃,175r/min摇床培养4~5d。双层miracloth滤布过滤菌丝,吸干水分,用锡纸包好,-80℃冰箱中保存过夜,取出后在液氮中迅速研磨菌丝至粉末状。称取小于50mg的粉末到1.5ml的离心管中。后面的步骤按照真菌基因组DNA提取试剂盒,BioFlux的说明严格进行,其后得到PH-1基因组DNA,琼脂糖凝胶电泳检测。
1.2.2 pCB1003/pKY37质粒DNA的提取接种pCB1003/pKY37单菌落于3ml LB液体培养基中,37℃,250r/min摇床中培养12h~15h。将3ml的菌液转移至1.5ml离心管中,12 000r/min离心1min,吸干上清液,保留沉淀。后面将按照普通质粒小提试剂盒(离心柱型,TIANGEN)的步骤严格进行,并得到pCB1003/pKY37的质粒DNA,琼脂糖凝胶电泳检测。
1.2.3 Split Marker法-FgPDE1 基因敲除盒的构建PH-1 DNA作模板,Pde5F/6R、Pde3F/4R为引物对FgPDE1上(下)游序列进行PCR扩增。pCB1003/pKY37质粒DNA作模板,HYG/F-HY/R和YG/F-HYG/R为引物对Hygromycin(hph)上(下)游序列进行PCR扩增。重叠PCR扩增分别以FgPDE1基因上游PCR产物和hph基因上游PCR产物为模板,Pde5F-HY/R为引物进行PCR扩增;FgPDE1基因下游PCR产物和hph基因下游PCR产物为模板,YG/F-Pde4R为引物进行PCR扩增,琼脂糖凝胶电泳检测。
1.2.4 FgPDE1基因敲除与转化子的筛选鉴定(1)原生质体的制备 CMC培养基中培养PH-1菌丝,25℃、175r/min摇床培养4d。双层miracloth过滤孢子到50ml离心管中,25℃、5 000r/min,离心5min。倒净上清液,将沉淀转移到YEPD 液体培养基中,25℃、175r/min,摇床培养12h。12h后miracloth过滤收集菌丝,1.2mol/L KCl冲洗3次后将适量菌丝刮进50ml离心管中。在装有菌丝的50ml离心管中,对配制好的原生质体Buffer进行过滤除菌,30℃、80r/min,摇床培养1.5~2h左右。miracloth过滤释放好的原生质体放于三角瓶中,1.2mol/L KCl冲洗至100ml,25℃,4 000 r/min,离心5min。倒净上清液,加少许 STC buffer悬浮沉淀,加STC buffer至50ml,充分混匀,25℃,4 000 r/min,离心5min。倒净上清液,加600μl STC buffer轻轻悬浮。将此原生质体保存在冰上,待用。
(2)原生质体转化 15ml离心管中加入FgPDE1基因重叠上下游序列各10μl和300μl的原生质体,轻轻混匀后室温静置20min。然后加1.25ml 40% PTC buffer,用力甩,混匀,室温静置20min。再加5ml TB3液体培养基(含50μg/ml Ampencilin),25℃,80r/min,摇床过夜培养。
(3)转化子的筛选与鉴定 ①转化子的初步筛选 过夜培养的混合液4000r/min,离心5min,倒净上清液,加入10ml LMTagar TB3固体培养基(含有终浓度250μg/ml潮霉素和50μg/ml Ampencilin),混合均匀后倒入90mm灭菌培养皿内,过夜培养;在过夜的培养皿中加入10ml LMTagar TB3固体培养基(含有终浓度250μg/ml潮霉素和50μg/ml Ampencilin)覆盖一层,继续培养;2~3d后长出转化子,挑取转化子到含有150μg/ml潮霉素和50μg/ml Ampencilin的TCC固体培养基上继续筛选;选取与PH-1表型有差异的转化子提取DNA(参照1.2.1 )。②转化子的PCR筛选转化子DNA作模板,PdeN1F/N2R为引物进行负筛;HYG/F-HYG/R与Pde5F/H850R为引物进行正筛,琼脂糖凝胶电泳。
1.2.5 FgPDE1敲除突变体表型观察和致病力检测将PH-1菌株、FgPDE1敲除突变体(△FgPDE1)分别接到60mm和90mm装有TCC培养基的培养皿上(含Amp),25℃培养,观察60mm培养皿中菌株形态区别,记录90mm培养皿中菌落生长速度。接种菌株于CMC培养基中,25℃,175r/min,摇床培养4~5d,每种菌株做三个重复。制切片,观察几种孢子形态之间的区别,并照相。滤布过滤后的滤液使用血球计数板计数。将蕃茄用70%酒精消毒后缓慢注入10μl PH-1孢子和△FgPDE1孢子,注入深度为1cm左右,标记。25℃静置培养,5~6d后对比PH-1和△FgPDE1对蕃茄的侵染情况,拍照。
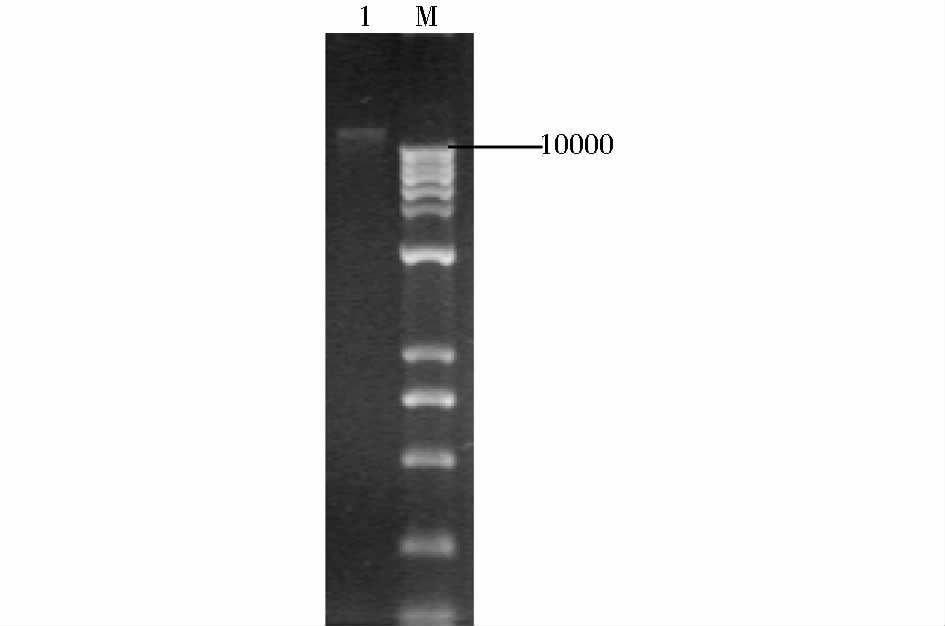
2 结 果 2.1 Split Marker法-FgPDE1基因敲除盒构建结果 2.1.1 野生型禾谷镰刀菌PH-1 DNA实验中使用真菌基因组DNA提取试剂盒,BioFlux提取出PH-1 DNA,取2μl进行0.7%的琼脂糖凝胶电泳检测,1kb plus DNA Ladder作为Marker,推断条带大小(图 1)。
|
| 图 1 禾谷镰刀菌基因组DNA Fig. 1 Genomic DNA of Fusarium graminearum M:1kb Plus DNA Marker;1:Genomic DNA of wild type |
实验应用TIANGEN质粒小提试剂盒提取质粒DNA,取2μl进行1%的琼脂糖凝胶电泳检测,1kb plus DNA Ladder为Marker,pCB1003质粒DNA片段大小为5 000bp左右,pKY37质粒DNA片段大小为3000~4000bp之间,符合预期条带大小,结果如图 2。

|
| 图 2 PCR扩增的潮霉素上下游序列 Fig. 2 PCR products of upstream and downstream sequences of hygromycin M:1kb plus DNA Ladder(Real-Times); 1,2: pCB1003 plasmid DNA as template; 3,4: pKY37 plasmid DNA as template; 5,6: pCB1003 plasmid DNA; 7,8: pKY37 plasmid DNA; 1,3: pCB1003 and pKY37 plasmid DNA as templates,HYG/F and HY/R as upstream primers out of hygromycin upstream sequence; 2,4: pCB1003 and pKY37 plasmid DNA as templates,YG/F and HYG/R as downstream primers out of hygromycin downstream sequence; Anneling temperature:60 degrees; Extension time:1min |
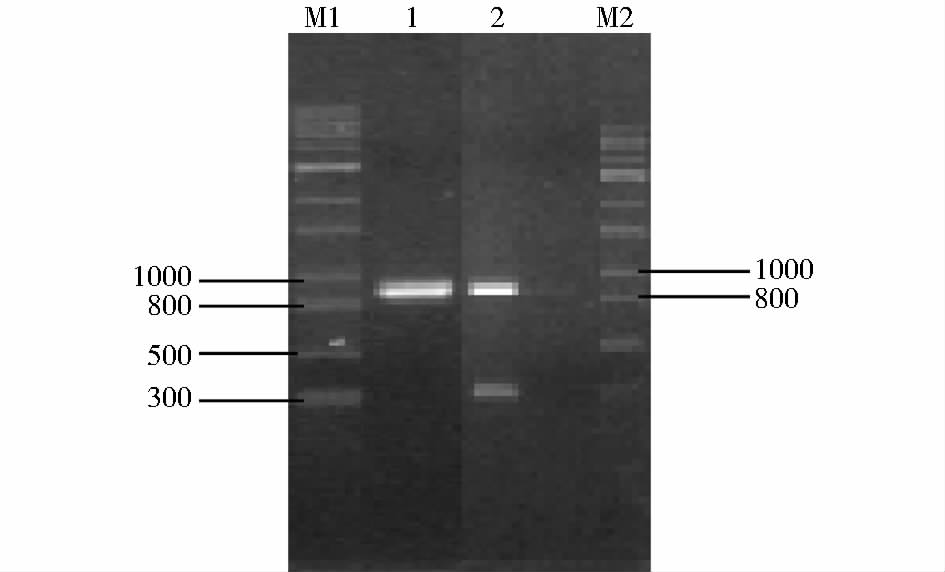
在Split Marker法为基本的敲除盒构建第一步中,pCB1003/pKY37质粒DNA作模板,HYG/F-HY/R和YG/F-HYG/R为引物进行PCR扩增。取4μl进行1%的琼脂糖凝胶电泳检测,1kb plus DNA Ladder作为Marker。上游片段大小约为764bp,下游片段约为931bp,符合预期条带大小,结果如图 2。
2.1.4 FgPDE1基因上下游序列在基因敲除盒构建第一步中,PH-1 DNA作模板,Pde5F/6R、3F/4R为引物进行PCR扩增。取4μl进行1%的琼脂糖凝胶电泳检测,1kb plus DNA Ladder作为Marker。上游片段大小约为868bp,下游片段约为861bp,符合预期条带大小,结果如图 3。
|
| 图 3 FgPDE1基因上下游序列产物 Fig. 3 FgPDE1 gene products of upstream and downstream sequence M1,M2:1kb plus DNA Ladder(Real-Times); 1:PH-1DNA as template,Pde5F/Pde6R as upstream primers out of PDE1 gene upstream sequence; 2:PH-1DNA as template,Pde3F/Pde4R as downstream primers out of PDE1 gene downstream sequence; 1:Annealing temperature:60 degrees; 2:Annealing temperature:56 degrees; Extension time:1min(Both) |
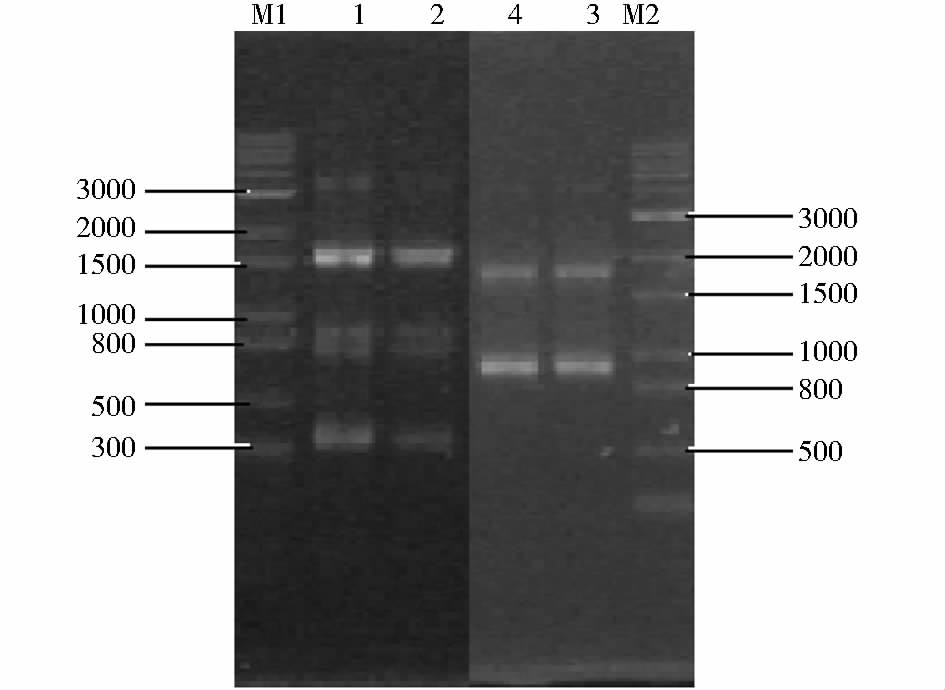
在基因敲除盒构建第二步中,分别以FgPDE1基因上游PCR产物和hph基因上游PCR产物为模板,Pde5F-HY/R为引物进行扩增,预期片段为1 632bp;FgPDE1基因下游PCR产物和hph基因下游PCR产物为模板,YG/F-Pde4R为引物进行PCR扩增,预期片段为1 792bp。取4μl进行1%的琼脂糖凝胶电泳检测,1kb plus DNA Ladder作为Marker,符合预期条带大小,结果如图 4。
|
| 图 4 FgPDE1 Split Marker 重叠PCR产物 Fig. 4 Overlapping PCR products for FgPDE1 Split-marker recombination M1,M2:1kb Plus DNA Ladder(Real-Times); 1:Pde(5F/6R) PCR products with pCB1003(HYG/F HY/R) products as templates; 2:Pde(5F/6R) PCR products with pKY37(HYG/F HY/R) PCR products as templates; 3:Pde(3F/4R) PCR products with pCB1003(YG/F HYG/R) PCR products as templates; 4:Pde(3F/4R) PCR products with pKY37(YG/F HYG/R) PCR products as templates; 1.2:PDE1 upstream of the gene 3′ end primer Pde5F and hph (hygromycin) upstream of the 5′ end primer HY/R; 3,4:PDE1 gene downstream of the 5′ end of the primer Pde4R and hph(hygromycin) downstream of the 3′ end of the primer YG/F; Annealing temperature:60 degrees(both); Extension of time:2min(both) |
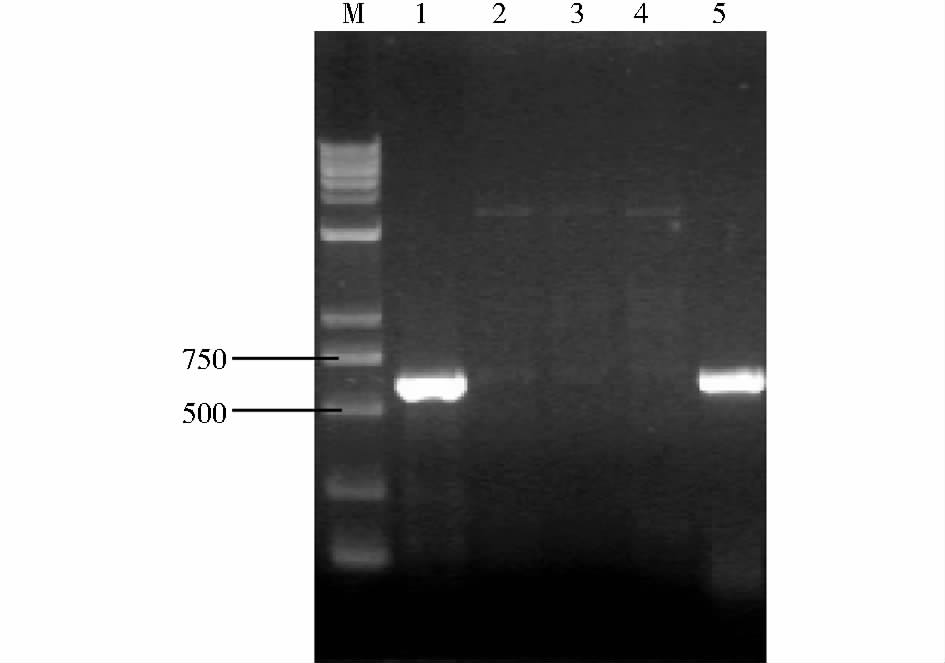
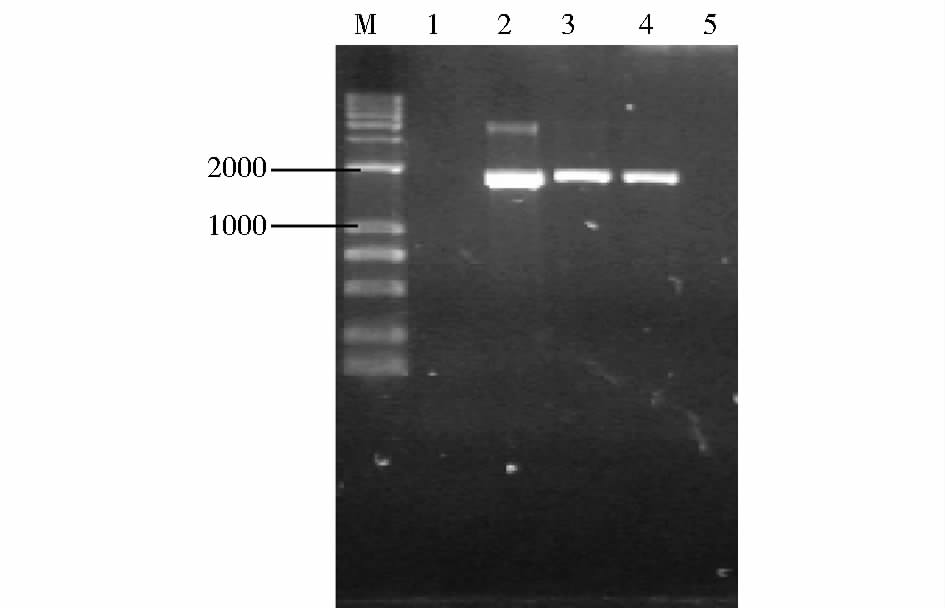
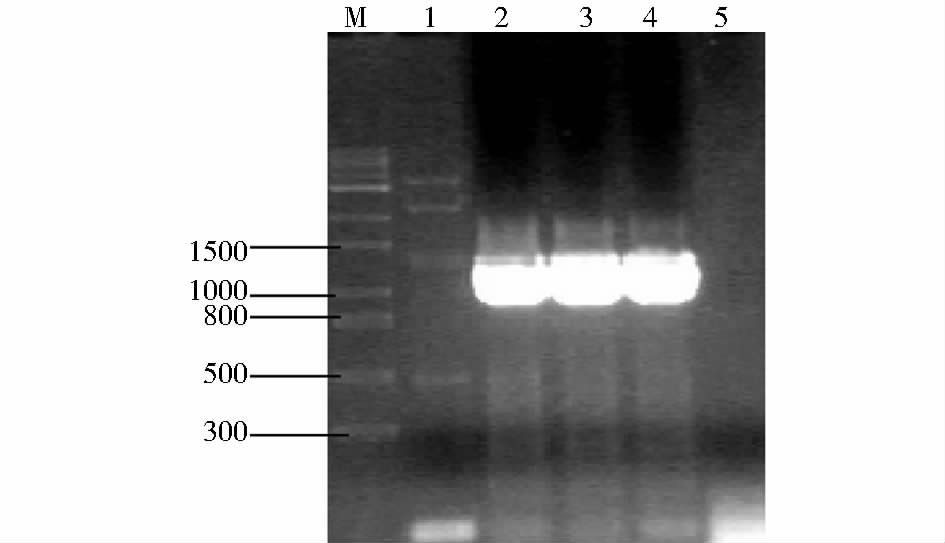
PdeN1F和PdeN2R两个引物设计于FgPDE1基因内部,扩增产物长度619bp。成功敲除FgPDE1基因的转化子DNA中不再含有该基因,而在PH-1中含有FgPDE1基因。通过PCR扩增,敲除转化子不会扩增出PdeN1F和PdeN2R两个引物之间的片段,电泳结果应没有预期条带显示,即负筛选;而对照组以PH-1 DNA为模板,电泳结果应有条带。引物Pde5F和H850R与另一对引物HYG/F和HYG/R用于正筛查,引物Pde5F和H850R扩增产物长度为1 823bp,引物HYG/F和HYG/R扩增产物长度为1 380bp,由于敲除突变体中FgPDE1基因已经被hph基因取代,因此只有敲除转化子能够扩增出预期条带。以敲除转化子DNA为模板进行PCR反应扩增,电泳结果有预期条带显示,即正筛选。对照组不能扩增出片段,电泳结果无条带。结果如图 5,图 6,图 7。
|
| 图 5 FgPDE1敲除突变体负筛选 Fig. 5 Negative screening for knock-out mutants of FgPDE1 M:1kb Plus DNA Marker(Biomed);1:Genomic DNA of PDE3 as template; 2:Genomic DNA of PDE1-3 as template; 3:Genomic DNA of PDE1-4 as template; 4:Genomic DNA of PDE2-2 as template; 5:Genomic DNA of PH-1 as template; 1~5:PdeN1F/PdeN2R as negative primer; Annealing temperature:60 degrees; Extension of time:1min |
|
| 图 6 敲除突变体正筛选1 Fig. 6 Positive screening for knockout mutants 1 M:1kb Plus DNA Marker(Biomed); 1:Genomic DNA of PDE3; 2:Genomic DNA of PDE1-3; 3:Genomic DNA of PDE1-4; 4:Genomic DNA of PDE2-2; 5:Genomic DNA of wild type; 1~5:Pde5F/H850R as primer; Annealing temperature:60 degrees; Extension of time:2min |
|
| 图 7 敲除突变体正筛选 2 Fig. 7 Positive screening for knockout mutants 2 M:1kb Plus DNA Marker(Biomed); 1:Genomic DNA of PDE3; 2:Genomic DNA of PDE1-3; 3:Genomic DNA of PDE1-4; 4:Genomic DNA of PDE2-2; 5:Genomic DNA of wild type; 1~5:HYG/F and HYG/R as positive primer; Annealing temperature:64 degrees; Extensiion of time:90s |
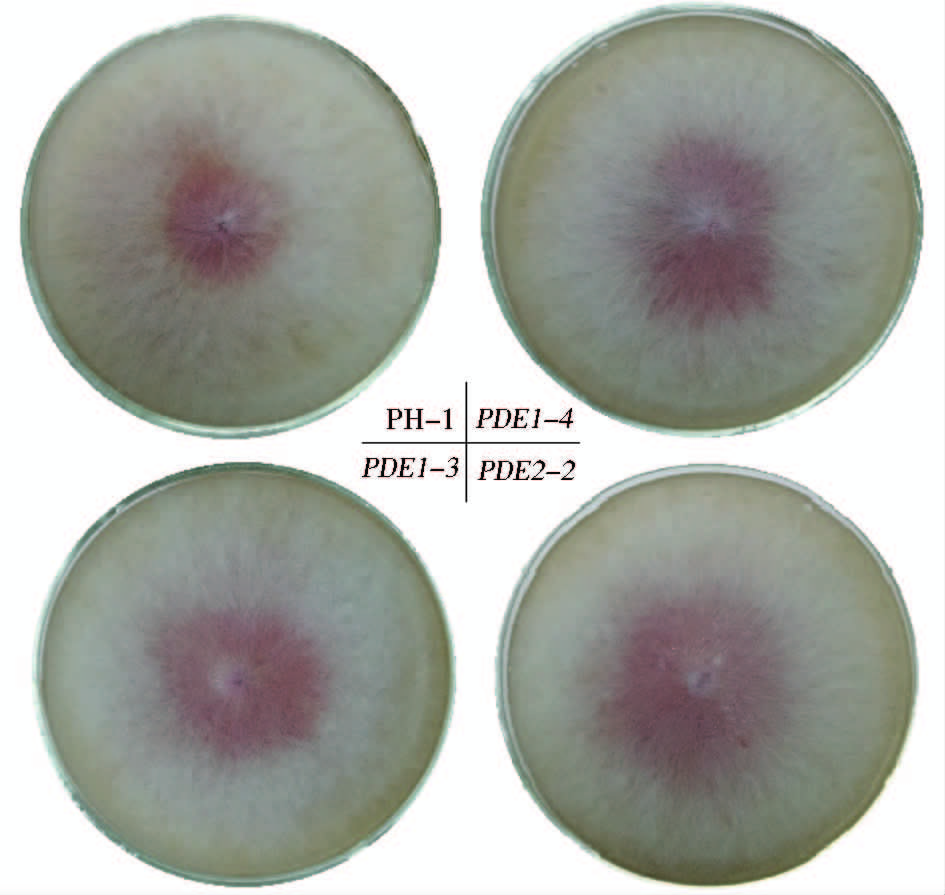
对比PH-1和△FgPDE1的菌落生长情况,没有明显的区别,拍照对比结果如图 8。
|
| 图 8 菌株PH-1,△FgPDE1敲除突变体 PDE1-3、PDE1-4、PDE2-2在TCC 培养基上的菌落形态 Fig. 8 Colony morphology of PH-1,PDE1-3, PDE1-4,PDE2-2 cultured on TCC plate |
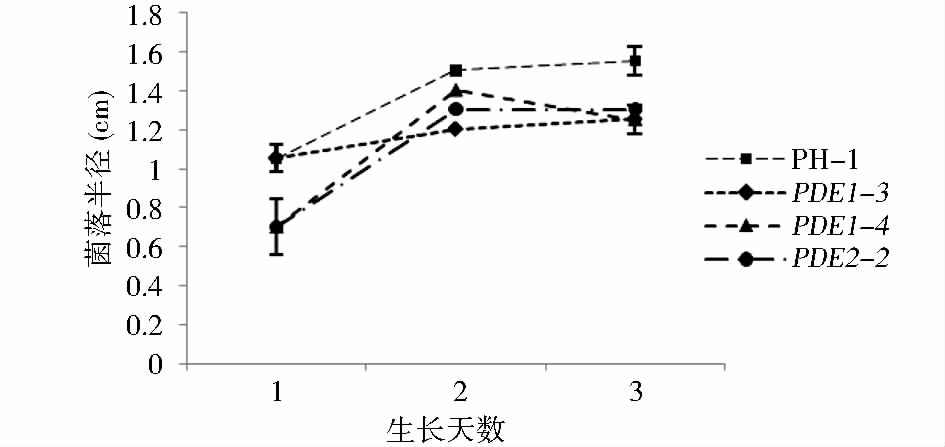
通过标记与测量,△FgPDE1菌丝在生长过程中稍微滞后PH-1,2个重复,得出生长速率的平均值,绘制生长曲线,结果如图 9。
|
| 图 9 野生型菌株PH-1与突变体PDE1-3、PDE1-4、PDE2-2生长速度比较 Fig. 9 The mycelium growth rate of PH-1,PDE1-3,PDE1-4 and PDE2-2 |
对比在CMC培养基中PH-1和△FgPDE1孢子生长量,吸取同量液体中△FgPDE1孢子的数量明显减少。95%置信区间中PH-1孢子数为7.4×105 ~1.46×106个/ml;敲除突变体PDE1-3孢子数为1.16×105 ~ 2.44×105个/ml;敲除突变体PDE1-4孢子数为3.0×103 ~ 5.7×104个/ml;敲除突变体PDE2-2孢子数为5.0×104 ~ 1.3×105个/ml。
2.2.4 分生孢子的形态观察PH-1与△FgPDE1孢子形态在大小、形状、横膈膜数量等方面无差别。显微镜拍照对比后结果如图 10。

|
| 图 10 野生型菌株PH-1、△FgPDE1分生孢子形态 Fig. 10 Conidia morphology of wild type PH-1、deletion mutant △FgPDE1 A: Conidia morphology of wild type PH-1 B: Conidia morphology of PDE1-3 C: Conidia morphology of PDE1-4 D: Conidia morphology of PDE2-2 |
新鲜番茄注入分生孢子后,PH-1与△FgPDE1的孢子注入部位长出许多白色菌丝,有较大的腐烂区域,两个重复,拍照对比,结果如图 11。

|
| 图 11 野生型PH-1,敲除突变体PDE1-3,PDE1-4以及对照CMC培养基侵染番茄 Fig. 11 Infection assays of wild type PH-1, deletion mutant PDE1-3,PDE1-4, CMC medium as contrast on tomato |
利用构建好的基因敲除盒,对PH-1的原生质体进行转化,目的是用Hygromycin基因取代FgPDE1基因。根据同源重组原理,预期转化子中含有hph基因,FgPDE1基因被取代。第一轮中通过潮霉素药物抗性的筛选,在培养基上可以存活并生长的均为转化子。为了进一步确定,单独培养每一个转化子,提取DNA进行PCR检测,应用3组引物筛选。通过三次筛选的转化子确认为突变体△FgPDE1。由于禾谷镰刀菌营养体是单倍体,敲除突变体的表型不涉及显隐性关系可以直接表达。一般情况下,敲除突变体应表现出与被敲除基因功能相关的形态、有性过程或生理生化以及对寄主的侵染性等方面的表型改变。△FgPDE1菌落形态比PH-1稍微小一点,没有显著变化。这与新型隐球菌中此基因的缺失表型较为相似,只有轻度的表型缺陷[20]。△FgPDE1生长速度稍微滞后PH-1。通过孢子侵染西红柿实验结果表明,△FgPDE1与PH-1侵染西红柿的面积接近,而有些文章表明PDE1是调节的毒力属性的一部分[21],但是△FgPDE1对于西红柿的致病力并没有减弱。然而,稻瘟病菌实验则表明:此基因敲除突变体同时侵染大麦和水稻,对水稻的毒性减弱而不是大麦,这表明PDE1基因敲除突变体在不同的宿主所表现的致病力也许是大不相同的,所以西红柿侵染实验并不能完全用来判断敲除突变体的致病力。孢子的形态与PH-1比较也没有明显的区别。与PH-1比较,△FgPDE1的产孢子量以10倍的速度在下降。在裂殖酵母中,交配,孢子形成和糖异生都是通过cAMP途径控制的[23],经过推测,禾谷镰刀菌中孢子的形成也是通过cAMP途径控制的,进而FgPDE1基因的缺失影响了孢子的形成。此次研究为进一步研究此基因的功能做出了铺垫。
4 结 论通过药物抗性筛选,PCR正负筛选,最终得到3个△FgPDE1基因突变型菌株。对PH-1和△FgPDE1菌株在表型以及致病力方面的比较发现,△FgPDE1与PH-1菌株的菌落形态没有明显区别,菌丝生长速度稍微滞后,对寄主西红柿的致病能力没有下降,但是分生孢子产量下降显著。因此FgPDE1基因可能与禾谷镰刀菌分生孢子的生长能力有关,而FgPDE1基因的功能则尚未完全确定。
| [1] | 王裕中,米勒.中国小麦赤霉病菌优势种—禾谷镰刀菌产毒素能力的研究.真菌学, 1994,13(3):229-234. Wang Y Z, Miller J D. Toxin producing potential of Fusarium graminearum from China. Acta Mycologica Sinica, 1994, 13(3):229-234. |
| [2] | Gale L R, Chen L F, Hernick C A, et al. Population analysis of Fusarium graminearum from wheat fields in eastern China. Ecology and Population Biology, 2002, 92(12): 1315-1322. |
| [3] | 袁婷露,曹秀云. 禾谷镰刀菌致病力和致病基因的研究进展. 安徽农业科学, 2008, 36(14): 5915- 5916, 5916,5934. Yuan T L, Cao X Y. Research progress of virulence and pathogenicity genes of Fusarium graminearum. Journal of Anhui Agricultural Sciences, 2008, 36(14): 5915-5916,5934. |
| [4] | 张大军,邱德文,蒋伶活.禾谷镰刀菌基因组学研究进展.安徽农业科学,2009, 37(17): 7892- 7894. Zhang D J, Qu D W, Jang L H. Research progress on the genomics of Fusarium graminearum. Journal of Anhui Agricultural Sciences, 2009, 37(17): 7892- 7894. |
| [5] | 王琢,闫培生.真菌毒素产生菌的分子鉴定研究进展.中国农业科技导报,2010,12(5):42-50. Wang Z,Yan P S. Research progress on molecular identification of mycotoxin-producing fungi. Journal of Agicultural Science and Technology, 2010, 12(5):42-50. |
| [6] | 戴大凯,贾晓静,武东霞,等.小麦赤霉病菌多菌灵抗性群体的扩散路径分析—基于致病菌种类及所产毒素化学型鉴定和抗药性检出的时序性.农药学学报, 2013,15(3):279-285. Dai D K, Jia X J, Wu D X, et al. Analysis of diffusion path of carbendazim-resistance population of Fusarium head bligh-based on Fusarium species, mycotoxin chemotype and resistance timing. Chinese Journal of Pesticide Science, 2013,15(3):279-285. |
| [7] | McMullen M P, Jones R, Gallenberg D. Scab of wheat and barley: a re-emerging disease of devastating impact. Plant Disease, 1997, 81(12):1340-1348. |
| [8] | Windels C E. Economic and social impacts of Fusarium head blight:changing farms and rural communities in the northern Great Plains. Phytopathology, 2000, 90:17-21. |
| [9] | 张雁南,樊坪升.禾谷镰刀菌对多菌灵抗性的监测及其演变规律.农药,2009,48(8):603-613. Zhang Y N, Fan P S. Monitoring and evolvement of resistance to carbendazim of Fusarium graminearum. Agrochemicals, 2009, 48(8):603-613. |
| [10] | 陆维忠,程顺和.细胞工程在小麦抗赤霉病育种中的利用.江苏农业学报,1998,14(1): 9-14. Lu W Z, Cheng S H. Study on utilization of cell engineering in breeding wheat for scab-resistance. JiangSu Academy of Agricultural Sciences, 1998,14(1):9-14. |
| [11] | Brown D W, Robert A E. Proctor Fusarium genomic resources: Tools to limit crop diseases and mycotoxin contamination. My-copathologia, 2006, 162: 191-199. |
| [12] | Jurgenson J E, BowdenR L,Zeller K A,et al. A genetic map of Gibberella zeae (Fusarium graminearum).Genetics, 2002, 160(4):1451-1460. |
| [13] | Hou Z M, Xue C Y, Peng Y L, et al. A mitogen-activated protein kinase gene (MGV1)in Fusarium graminearum is required for female fertility, heterokaryon formation and plant infection. Mol Plant Microbe Interact, 2002, 15(11): 1119-1127. |
| [14] | Christian A V, Wilhelm S. A secret lipase of Fusarium graminearum is a virulence factor required for infection of cereals. Plant Journal, 2005, 42: 364-375. |
| [15] | Lysoe E, Klemsdal S S, Bone K R, et al. The PKS4 gene of Fusarium graminearum is essential for zearalenone production. Applied and Environmental Micorobiology, 2006, 72(6): 3924 -3932. |
| [16] | Brunner K, Lichtenauer A M, Kratochwill K, et al. Xyr1 regulates xylanase but not cellulase formation in the head blight fungus Fusarium graminearum. Current Genetics, 2007, 52(5-6): 213-220. |
| [17] | Kim J H, Kim H W, Heo D H, et al. FgEnd1 is a putative component of the endocytic machinery and mediates ferrichrome uptake in F. graminearum. Current Genetics, 2009, 55(6):593-600. |
| [18] | Son H, Kim M G, Chae S K, et al. FgFlbD regulates hyphal differentiation required for sexual and asexual reproduction in the ascomycete fungus Fusarium graminearum. Journal of Microbiology, 2014, 52(11):930-939. |
| [19] | Lee Y, Min K, Son H, et al. ELP3 is involved in sexual and asexual development, virulence, and the oxidative stress response in Fusarium graminearum. Molecular Plant-Microbe Interactions, 2014, 27(12):1344-1355. |
| [20] | Ramanujam R, Naqvi N I, Howlett B J. PdeH, a high-affinity cAMP phosphodiesterase, is a Key regulator of asexual and pathogenic differentiation in Magnaporthe oryzae. PLoS Pathog, 2010, 6(5): e1000897. |
| [21] | Hicks J K, Bahn Y S, Heitman J. Pde1 phosphodiesterase modulates cyclic AMP levels through a protein kinase A-mediated negative feedback loop in Cryptococcus neoformans. Eukaryot Cell, 2005, 4(12): 1971-1981. |
| [22] | 吴彬.小麦赤霉菌 FGAC1 基因敲除及功能研究.呼和浩特:内蒙古师范大学,2011. Wu B. Characterization of FGAC1 Gene of Fusarium graminearum. Hohhot:Inner Mongolia Normal University, 2011. |
| [23] | Balhadère P V, Talbot N J. PDE1 encodes aP-type ATPase involved in Appressorium-mediated plant infection by the rice blast fungus Magnaporthe grisea. Plant Cell, 2001, 13(9): 1987-2004. |
 2015, Vol. 35
2015, Vol. 35




