文章信息
- 高飞, 周婧, 刘晓彤, 李成磊, 姚慧鹏, 赵海霞, 吴琦
- GAO Fei, ZHOU Jing, LIU Xiao-tong, LI Cheng-lei, YAO Hui-peng, ZHAO Hai-xia, WU Qi
- 苦荞锌指蛋白基因FtLOL1的克隆及其对非生物胁迫的应答
- Cloning and Expression Analysis One Zinc Finger Protein Gene FtLOL1 in Fagopyrum tataricum: Effect of Abiotic Stress
- 中国生物工程杂志, 2015, 35(8): 44-50
- China Biotechnology, 2015, 35(8): 44-50
- http://dx.doi.org/10.13523/j.cb.20150807
-
文章历史
- 收稿日期:2015-03-11
锌指蛋白是植物中最为丰富的一类转录因子之一,对植物的生长发育、抗病及抗非生物胁迫具有重要的调控作用[1, 2]。根据锌指蛋白结构域半胱氨酸(C)和组氨酸(H)残基的数目和位置,可将含锌指结构域的转录因子分为C2H2,C2C2,C3H,C3HC4(IUNG finger)和C3HC5(LIM finger)5个亚类。其中,C2C2型锌指蛋白的4个半胱氨酸残基与Zn+以配位键相结合,形成稳定的锌指结构,参与 DNA、RNA 和蛋白质的识别、调控基因转录,并参与蛋白质之间的相互作用[3]。
类LSD1基因编码一类特殊的C2C2型锌指蛋白,含有3个特殊的锌指结构域:CxxCxRxxLMYxxGAxSVxCxxC,又称为zf-LSD结构域[4]。1997年,Dietrich采用图位法克隆得到该家族首条基因拟南芥AtLSD1。功能研究表明,该基因通过应答水杨酸(salicylic acid,SA)信号分子,上调铜锌超氧化物歧化酶(Cu-ZnSOD)来清除由病原菌或者其它非生物胁迫造成的过量积累的活性氧(reactive oxygen species,ROS),减轻氧迸发的二次伤害[5]。Epple等在拟南芥基因组上鉴定出2个类LSD1基因AtLOL1和AtLOL2,研究结果表明AtLSD1和AtLOL1通过拮抗作用调节Cu-ZnSOD的积累来决定细胞的命运。随后在水稻、小麦、玉米等植物中发现并克隆出更多含有 zf-LSD1 结构域的基因[6, 7]。功能研究表明,这类 LSD1 型锌指蛋白在细胞过敏性死亡、植物广谱抗病性以及植物对低温、长日照等非生物环境胁迫具有调控功能[8]。
苦荞是一种药食两用的小杂粮作物,富含黄酮类化合物,对人类多种疾病具有预防治疗作用,被开发成苦荞茶、苦荞酒和苦荞芽菜等多种具有保健功能的食品,具有良好的经济开发前景[9, 10]。苦荞具有很强的抗逆及抗氧化能力,能够适应高寒、高海拔、强紫外及干旱等恶劣环境[11]。目前,关于荞麦抗逆及抗氧化的研究主要集中于黄酮类化合物和SOD酶类对ROS的清除方面[12 ,13],而其中分子调控机制的研究尚未见报道。本实验根据获得的苦荞花期转录组数据,采用RT-PCR技术克隆苦荞抗逆相关的锌指蛋白FtLOL1基因序列,并采用UV-B、2mmol/L水杨酸和4℃冷胁迫处理二叶期苦荞,探究FtLOL1基因的表达量与外界非生物胁迫的相关性,为深入探究苦荞抗逆和抗氧化提供参考。
1 材料与方法 1.1 材料及试剂 1.1.1 植物材料苦荞(‘西荞二号’)购自西昌学院,种植于四川农业大学生命科学院实验室培养箱,培养条件为光照16h,黑暗8h,温度(22 ± 2)℃,相对湿度60%,培养至二叶期供试备用。
1.1.2 试 剂植物RNAout(Trizol法)试剂盒、胶回收试剂盒购自天泽基因工程有限公司; PrimeScript RT reagent Kit With gDNA Eraser (Perfect Real Time)、DNA Ligation Kit、pMD19-T Simple Vector、Taq DNA聚合酶、PrimeSTAR Max DNA Polymerase、SYBR Premix Ex TaqTM II (Tli RNaseH Plus)购自TaKaRa公司;水杨酸购自西亚试剂公司;引物由上海英骏生物工程公司合成,其他试剂均为进口或国产分析纯试剂。
1.2 方 法 1.2.1 苦荞总DNA的提取及FtLOL1 DNA序列的克隆采用改良的SDS法[14]提取苦荞叶片总DNA,根据本实验室获得的苦荞花期转录组数据,设计一对特异引物 FtLOL1f和FtLOL1r(表 1),PCR扩增FtLOL1 DNA序列,PCR产物纯化后送上海英骏生物公司测序。
1.2.2 苦荞RNA提取及FtLOL1 cDNA序列的克隆采用植物RNAout试剂盒提取苦荞新鲜叶片总RNA,并以其为模板使用PrimeScript RT reagent Kit With gDNA Eraser (Perfect Real Time)试剂盒反转录制备cDNA第一条链。使用特异引物FtLOL1f和FtLOL1r。PCR扩增FtLOL1 cDNA序列,PCR产物回收纯化后连接至pMD19-T Simple Vector,阳性克隆送上海英骏生物工程公司测序。
1.2.3 序列分析使用NCBI在线工具Blast进行FtLOL1核苷酸序列及其编码的蛋白质氨基酸序列同源性分析;使用DNAMAN进行多序列比对;利用 MEGA5.0将对比结果采用邻接法(neighbor-joining,NJ)构建系统进化树。
1.2.4 二叶期苦荞的处理UV-B处理:使用10W UV-B(308nm) LED灯照射二叶期苦荞,光照距离30cm。水杨酸处理:使用2mmol/L浓度水杨酸,叶面喷施二叶期苦荞,以叶面滴水为度,以上处理均于处理前0h、处理后2、4、6、8、10和12h分别取供试样品叶片,液氮冷冻后置于-80℃备用。4℃冷处理:将二叶期苦荞转移至培养条件为光照16h,黑暗8h,温度4℃,相对湿度60%的光照培养箱,于处理前0h、处理后12、24、36、48、60和72h取供试样品叶片,液氮冷冻后置于-80℃备用。
1.2.5 苦荞FtLSD1基因表达量的检测采用植物RNAout试剂盒提1.2.4 供试样品总RNA,并以其为模板使用PrimeScript RT reagent Kit With gDNA Eraser (Perfect Real Time)试剂盒反转录制备cDNA第一条链。设计一对实时定量PCR特异引物FtLOL1qf和FtLOL1qr,以苦荞组蛋白H3基因[15]为内参基因,引物为H3qf和H3qr(表 1),采用SYBR GreenⅠ染料法检测苦荞FtLOL1基因表达量,数据采用2-△△CT方法[16]分析,采用IBM SPSS Statistics 20 统计软件对水杨酸处理、UV-B处理和冷条件下苦荞FtLOL1基因的表达量进行数据分析。
| 引物名称 | 引物序列 | 引物用途 |
| FtLOL1f | 5′- AAGAAGGCTTTGCTGCTGAAGATTA -3′ | gene cloning |
| FtLOL1r | 5′- GTATAGAGTTGTGTTTTTCGCCTTTG-3′ | gene cloning |
| FtLOL1qf | 5′- GTAATGCTGTAACTGCTGTTCCTCCTC-3′ | qPCR |
| FtLOL1qr | 5′- GTGCCACTTGATTCGCTTCTAACG-3′ | qPCR |
| H3qf | 5′- GAAATTCGCAAGTACCAGAAGAG-3′ | qPCR |
| H3qr | 5′- CCAACAAGGTATGCCTCAGC-3′ | qPCR |
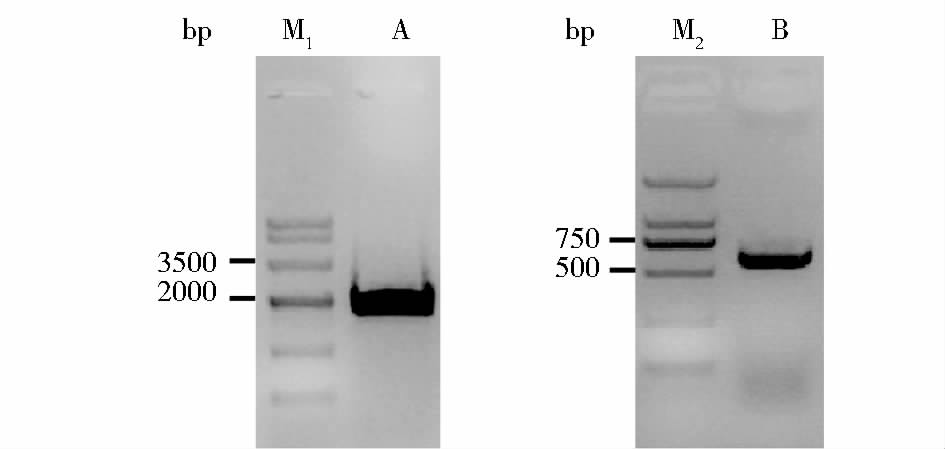
采用特异引物FtLOL1f和FtLOL1r,以苦荞DNA为模板,PCR扩增得到2 000bp左右条带(图 1A),测序结果表明该片段长1 821bp;采用特异引物FtLOL1f和FtLOL1r,以苦荞cDNA为模板,PCR扩增得到600bp左右条带,测序结果表明该片段长629bp(图 1B)。
|
| 图 1 苦荞FtLOL1 DNA(A)和cDNA(B)扩增 Fig. 1 FtLOL1 DNA(A)and cDNA(B) amplification of Fagopyrum tataricum M1: Marker Ⅳ;M2: Marker DL2000 |
通过Blast 比对苦荞FtLOL1 cDNA和DNA序列,确定其全长DNA序列为1 720bp,包含5个外显子和4个内含子(图 2),符合标准的GT-AG内含子剪切原则。此外,苦荞FtLOL1 cDNA序列包含一个444bp的开放阅读框(open reading frame,ORF),NCBI Blast序列比对结果表明,该cDNA序列与可可(Theobroma cacao)TcLOL1、苜蓿(Medicago truncatula)MtLSD1和拟南芥(Arabidopsis thaliana)AtLOL1的相似性分别为79%、79%和74%。克隆得到的基因属于类LSD1基因家族。

|
| 图 2 FtLOL1基因结构示意 Fig. 2 FtLOL1 gene structure diagram |
DNAman分析表明,FtLOL1基因编码147个氨基酸,等电点为pI 7.89,相对分子质量为15.28 kDa,无信号肽。SOPMA预测表明,该序列由19.05% α-螺旋(alpha helix)、22.45%延伸链(extended strand)、9.52% β-转角(beta turn)和48.98%无规则卷曲(Random coil)组成。NCBI Blast 结果表明,苦荞FtLOL1与苦荞FtLSD1相似性为58%,而与拟南芥(Arabidopsis thaliana)LOL1、可可(Theobroma cacao)LOL1和棉花(Gossypium arboreum)LOL1相似性分别为87%、90%和88%。将FtLOL1氨基酸序列与其它物种LSD1氨基酸序列进行多序列比对,结果如图 3所示,苦荞LOL1与拟南芥等植物的LSD1都具有3个共同的保守肽基序,结构为CxxCxRxxLMYxxGAxSVxCxxC,是锌指蛋白的典型的保守序列,而其它区域相似性较低。

|
| 图 3 FtLOL1与其它LSD1的氨基酸序列的比对 Fig. 3 Alignments of FtLOL1 with other LSD1 proteins The amino acid sequence in the maps which from the top to the bottom represent: Fagopyrum tataricum,Gossypium arboretum,Arabidopsis thaliana,Theobroma cacao,Oryza sativa,Bambusa oldhamii,Zea mays,Fagopyrum tataricum,Brassica oleracea,Brassica oleracea,Arabidopsis thaliana. The zf-LSD1 zinc finger protein domains are bracketed |
采用MEGA 5.0软件,采用邻接法构建基于FtLOL1氨基酸序列的系统发育进化树(图 4)。结果表明,LSD1主要分为2个大分支,在第一个大分支中,双子叶的苦荞FtLOL1与同为双子叶的棉花GaLOL1、拟南芥AtLOL1和可可TcLOL1 共聚于ClusterⅠ,而单子叶的玉米ZmLOL1、水稻OsLSD1和竹子BohLOL1共聚于ClusterⅡ,符合植物学分类系统。而另一个大分支中,苦荞FtLSD1、拟南芥AtLSD1与甘蓝BoLSD1共聚于Cluster Ⅲ。进一步分析表明第一大分支与第二大支LSD1之间氨基酸序列间差异较大,推测其具有不同的进化模式,可能具有不同的功能。研究表明,属于同一物种的拟南芥AtLSD1和AtLOL1具有相反的功能,AtLSD1参与负调控ROS介导的信号通路,而AtLOL1参与正调控,推测苦荞FtLOL1与AtLLOL1具有相似的功能[17]。

|
| 图 4 苦荞LOL1与其他植物LOL氨基酸序列的系统发育树 Fig. 4 Phylogenetic tree based on amino acid sequences of FtLOL1 and other plants |
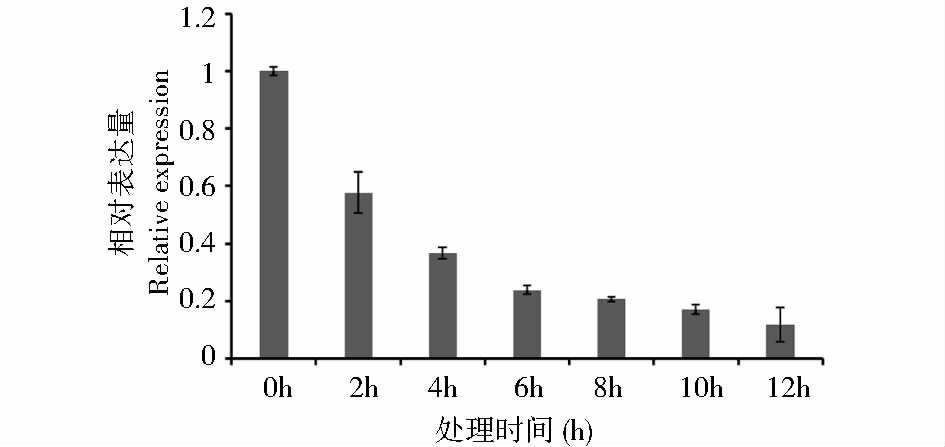
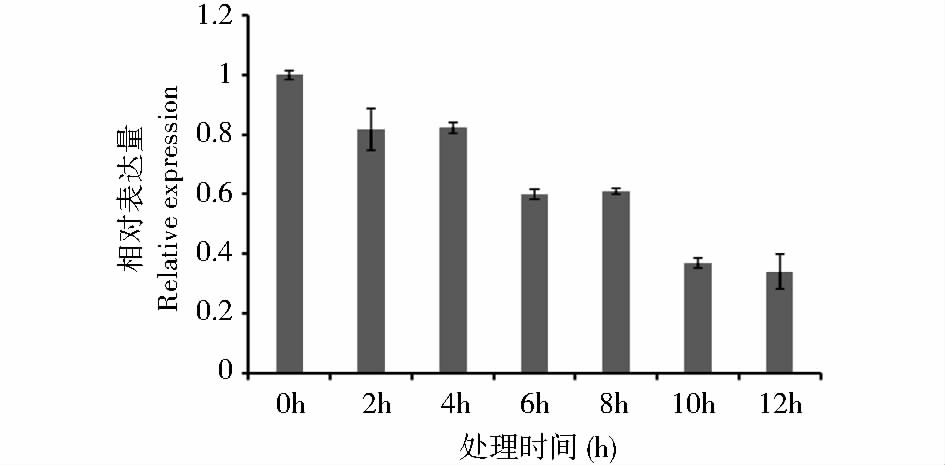
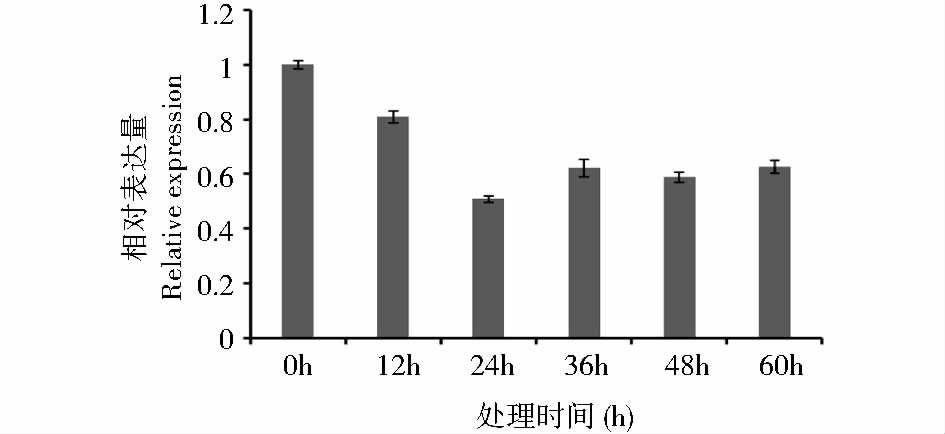
使用荧光定量PCR分析FtLOL1在水杨酸、UV-B和4℃冷处理下各个时间段的转录水平。以苦荞组蛋白H3为内参基因,0h为对照组,使用2-△△Ct法计算FtLOL1基因表达量变化的倍数关系。2mmol/L水杨酸处理结果(图 5)表明,FtLOL1基因表达量从2h开始下降,每隔2h均呈下降趋势,12h达到最小值,为对照组(0h)的11.9%。UV-B处理结果(图 6)表明,FtLOL1基因表达量从处理2h开始下降,每隔4h呈现明显的下降趋势,12h达到最小值,为对照组(0h)的33.8%。4℃冷处理结果(图 7)表明,FtLOL1表达量从12h开始下降,至24h达到最小值,为0h对照的50.7%,36h后表达量有所回升,稳定在对照组(0h)的60%左右。
|
| 图 5 水杨酸处理条件下FtLOL1表达量 Fig. 5 FtLSD1 expression levels under SA treatment conditions |
|
| 图 6 UV-B处理条件下FtLOL1表达量 Fig. 6 FtLSD1 expression levels under UV-B cold treatment conditions |
|
| 图 7 4℃冷处理条件下FtLOL1表达量 Fig. 7 FtLSD1 expression levels under 4 ℃ cold treatment conditions |
目前根据转录组数据,克隆基因已经成为一种成熟的技术广泛应用于目的基因的克隆,与RACE等其它技术相比,具有简便、高效、节省经费等特点。本研究根据实验室前期获得的苦荞转录组数据,筛选克隆得到一条锌指蛋白基因FtLOL1(FtLSD-one-like 1),获得该基因的cDNA和DNA序列。核苷酸序列和氨基酸序列经NCBI Blast比对结果表明,FtLOL1与已经克隆的苦荞锌指蛋白基因FtLSD1(数据未发表)同属于类LSD1家族。
Liu等[18]将植物LSDl型锌指结构家族分为三类分别为:含有3个zf-LSD1蛋白、含有2个zf-LSDl蛋白以及含有1个zf-LSDl蛋白,同时发现具有调控细胞死亡、植物抗病性以及植物对非生物胁迫抗逆性功能的锌指蛋白多属于3个zf-LSD1蛋白的亚家族。本研究获得的FtLOL1含有3个zf-LSD1锌指结构域,与拟南芥AtLOL1、水稻OsLSD1、玉米ZmLOL1和竹子BohLOL1等LSDl型锌指结构蛋白高度同源;而与拟南芥AtLSD1、甘蓝BoLSD1和苦荞FtLSD1的氨基酸序列对比显示,仅在锌指结构zf-LSD1(CxxCxRxxLMYxxGAxSVxCxxC)处保守,而在3个zf-LSD1间隔区域保守性较低,这也决定了该类蛋白调控功能的多样化。系统进化树分析表明,苦荞FtLOL1与FtLSD1分属于不同的进化树簇,推测苦荞FtLOL1与FtLSD1进化模式上存在差异,属于旁系同源基因,通常能够表现出不同的功能[19]。
FtLOL1基因在UV-B、2mmol/L水杨酸和4℃冷胁迫处理下,表现出下调表达趋势,而先前研究表明,苦荞FtLSD1在UV-B、2mmol/L水杨酸处理条件下呈显著上调表达趋势,在4℃冷胁迫下基本保持稳定。苦荞中,同为LSD1型锌指蛋白的FtLOL1 和FtLSD1,对UV-B、2mmol/L水杨酸和4℃冷胁迫表现出不同的应答模式,说明两条基因可能在苦荞抗逆及抗氧化反应中存在着不同的功能。其它物种中,拟南芥AtLSD1基因功能是通过应答水杨酸(salicylic acid,SA)信号分子,上调铜锌超氧化物歧化酶(Cu-ZnSOD)来清除由病原菌或者其它非生物胁迫造成的过量积累的活性氧(reactive oxygen species,ROS),减轻氧迸发的二次伤害[20],而AtLOL1功能则相反,与AtLSD1通过拮抗作用调节Cu-ZnSOD的积累来决定细胞的命运。类LSD1型锌指蛋白作为一种转录因子,可以从正向或者反向调控同一生理过程,其中机制尚待进一步研究[21]。
苦荞主要分布在我国西南山区,该地区干旱、昼夜温差大、紫外线强,而苦荞具有良好的适应性,表现出良好的抗逆性能。本实验克隆得到苦荞抗逆相关的锌指蛋白基因FtLOL1,分析其在UV-B、水杨酸和冷等非生物学胁迫下的响应,并且发现苦荞FtLOL1与苦荞FtLSD1对非生物胁迫存在着不同的应答模式,为研究苦荞的抗逆机制提供了新的思路。
| [1] | 宋冰, 洪洋, 王丕武, 等. 植物 C2H2 型锌指蛋白的研究进展. 基因组学与应用微生物学, 2010, 29(5): 1133-1141. Song B, Hong Y, Wang P W, et al. Advances on plant C2H2-type zinc finger protein. Genome ApplBiol, 2010, 29(5): 1133-1141. |
| [2] | 向建华, 李灵之, 陈信波. 植物非生物逆境相关锌指蛋白基因的研究进展. 核农学报, 2012,26(4): 666-672. Xiang J H, Li L Z, Chen X B. Progress in the study of abiotic stress-related zinc finger protein genes in plants. J Nuclear Agri Sci, 2012, 26(4): 666-672. |
| [3] | Brown R S. Zinc finger proteins: getting a grip on RNA. Curr Opin Struct Biol, 2005, 15(1): 94-98. |
| [4] | Dietrich R A, Richberg M H, Schmidt R, et al. A novel zinc finger protein is encoded by the Arabidopsis LSD1 gene and functions as a negative regulator of plant cell death. Cell, 1997, 88(5): 685-694. |
| [5] | Torres M A, Jones J D, Dang J L, et al. Pathogen-induced, NADPH oxidase-derived reactive oxygen intermediates suppress spread of cell death in Arabidopsis thaliana. Nature Genetics, 2005, 37(10): 1130-1134. |
| [6] | 王丽娟, 田颖川, 何朝族, 等. 新基因水稻OsLSD1的克隆及拟南芥和水稻类 LSD1基因家族的生物信息学分析. 生物化学与生物物理进展, 2005, 32(3): 268-274. Wang L J, Tian Y C, He C Z, et al. Cloning of a novel rice gene OsLSD1 and bioinformatic analysis of LSD1 -like gene family from Arabidopsis and Rice. Progress in Biochemistry and Biophysics, 2005, 32(3): 268-274. |
| [7] | 黄新杰, 郭军, 屈志朋, 等. 小麦TaLSD1锌指蛋白基因的电子克隆及序列分析.西北植物学报, 2007, 27(11): 2147-2152. Huang X J, Guo J, Qu Z P, et al. In silico cloning and sequence analysis of a TaLSD1 zinc finger protein gene from wheat infected by stripe rust fungus. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(11): 2147-2152. |
| [8] | Sheng-Hsiung Yeh, Choun-Sea Lin, Fu-Hui Wu, et al. Analysis of the expression of BohLOL1, which encodes an LSD1-like zinc finger protein in Bambusa oldhamii. Planta, 2011, 234:1179-1189. |
| [9] | Calabrò M L, Tommasini S, Donato P, et al. The rutin/bcyclodextrin interactions infully aqueous solution:Spectroscopicstudies andbiological assays. J Pharm Biomed Anal, 2005, 36(5):1019-1027. |
| [10] | Zwirtes O I, Fernandes S C, Vieira I C. Development of abiosensor basedongilo peroxidase immobilized on chitosan chemically crosslinked with epichlorohydrin for determination of rutin. J Pharm Biomed Anal, 2006, 41(2):366-372. |
| [11] | Kitabayashi H, Ujihara A, Hirose T, et al. On the genotypic differences for rutin content in tatary buckwheat, Fagopyrum tataricum Gaertn. Breeding Sci, 1995, 45(2): 189-194. |
| [12] | Suzuki T, Honda Y, Mukasa Y J. Effects of UV-B radiation, cold and desiccation stress on rutin concentration and rutin glucosidase activity in tartary buckwheat (Fagopyrum tataricum) leaves. Plant Science, 2005, 168: 1303-1307. |
| [13] | 董新纯, 赵世杰, 郭珊珊, 等. 增强UV-B条件下类黄酮与苦荞逆境伤害和抗氧化酶的关系. 山东农业大学学报, 2006, 37(2): 157-162. Dong X C, Zhao S J, Guo S S, et al. Role of flavonoids on stress injury and antioxydative enzymes in Fagopyrum tataricun seedings under enhanced UV-B radiation. Journal of Shangdong Agricultural University, 2006, 37(2): 157-162. |
| [14] | 李成磊, 冯争艳, 白悦辰, 等. 金荞麦苯丙氨酸解氨酶基因FdPAL的克隆及原核表达.中国中药杂志, 2011,36(23): 3238-3243. Li C L, Feng Z Y, Bai Y C, et al. Molecular cloning and prokaryotic expression of phenylalanine ammonialyase gene FDPAL from Fagopyrum dibotrys. China Journal of Chinese Materia Medica, 2011, 36(23): 3238-3243. |
| [15] | Bai Y C, Li C L, Zhang J W, et al. Characterization of two tartary buckwheat R2R3-MYB transcription factors and their regulation of proanthocyandin biosynthesis. Physiologia Plantarum, 2014, 152(3): 431-440. |
| [16] | Thomas D S, Kenneth J L. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 2008, 3 (6): 1101-1108. |
| [17] | Epple P, Mack A A, morrisV R, et al. Antagonistic control of oxidative stress-induced cell death in Arabidopsis by two related, plant-specific zinc finger proteins. Proc Natl Acad Sci U S A, 2003, 100(11):6831-6836. |
| [18] | Liu Q P,Xue Q Z.Molecular phylogeny, evolution, and functional divergence of the LSD1-like gene family: inference from the rice genome. Journal of Molecular Evolution,2007,64(3);354-363. |
| [19] | Tatusov R L, Koonin E V, Lipman D J. A genomic perpective on protein families. Science, 1997, 278(5338):631-637. |
| [20] | Danie H A, Christine R A, Ben F H, et al. Runaway cell death, but not basal disease resistance, in lsd1 is SA- andNIM1/NPR1-dependent. The Plant Journal, 2002, 29(3): 381-391. |
| [21] | Kaminaka H, Nakc C, Epple P, et al. bZIP10-LSD1 antagonism modulates basal defense and cell death in Arabidopsis following infection. EMBO J, 2006, 25(18):4400-4411. |
 2015, Vol. 35
2015, Vol. 35




