文章信息
- 王青, 徐彦召, 魏晓晓, 王秋霞, 杭柏林, 孙亚伟, 王飞飞, 胡建和
- WANG Qing, XU Yan-zhao, WEI Xiao-xiao, WANG Qiu-xia, HANG Bo-lin, SUN Ya-wei, WANG Fei-fei, HU Jian-he
- 猪繁殖与呼吸综合征病毒GP5a多克隆抗血清的制备
- Preparation of Polyclonal Antiserums of GP5a Protein of Porcine Reproductive and Respiratory Syndrome Virus
- 中国生物工程杂志, 2015, 35(8): 38-43
- China Biotechnology, 2015, 35(8): 38-43
- http://dx.doi.org/10.13523/j.cb.20150806
-
文章历史
- 收稿日期:2015-03-06
- 修回日期:2015-04-27
猪繁殖与呼吸综合征 (porcine reproductive and respiratory syndrome,PRRS) 是由猪繁殖与呼吸综合征病毒 (PRRS virus,PRRSV) 所引起的一种传染病,其临床主要表现为母猪繁殖障碍和仔猪呼吸道疾病。1987年该病在美国首先爆发,我国于1996年由郭宝清等[1]首次报道此病并分离到病毒,由此该病在我国猪群中持续存在[2]。2006年,从我国南方猪群以及相邻的东南亚国家最先爆发了以发病急、传播速度快、高发病率和高死亡率等为典型特征的高致病性PRRSV (highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV),HP-PRRSV XX2012株是本实验室在2012年从河南新乡某猪场分离得到的病毒株。目前HP-PRRSV在我国猪群中广泛存在,给我国养猪业造成巨大损失[3, 4]。因此,2008年12月我国新修订的《一、二、三类动物疫病病种名录》就将HP-PRRS列为一类动物疫病。目前,对该病毒的研究成为动物病毒病研究的一个热点。
PRRSV 属动脉炎病毒科,为单股正链RNA 病毒,基因组结构与同属的其它动脉炎病毒类似,依次为5′-(cap)UTR-ORF1a-ORF1b-ORF2-7-UTR- poly(A)- 3′[5 ,6]。目前PRRSV基因组中已经证实有10个开放阅读框(open reading frame,ORF),分别是ORF1a和ORF1b (编码非结构蛋白),ORF2、ORF2a、ORF3~ORF5、ORF5a、ORF6和ORF7(分别编码GP2、GP2a、GP3~GP5、GP5a、M蛋白和N蛋白8个结构蛋白)[7]。其中,GP2a蛋白是位于ORF2内部的一个小的开放编码框[8]; GP5a位于ORF4和ORF5之间,最早在2011年由Firth 等[9]和Johnson等[10]证实其存在,但其作用和功能还不清楚。因此,本研究应用分子生物学手段,克隆得到了HP-PRRSV XX2012株的GP5a蛋白基因,并将该基因在PCAGGS真核表达载体中进行表达,最后通过基因免疫小鼠的方法获得GP5a蛋白的多克隆抗血清。本试验采用真核表达系统表达GP5a蛋白,并制备出了该蛋白的多克隆抗血清,为进一步研究GP5a的作用和功能提供必要的前期试验材料。
1 材料与方法 1.1 载体、菌 (毒) 种和试剂XX2012株HP-PRRSV(XX2012株HP-PRRSV是本实验室在2012年从河南新乡某猪场分离得到的病毒株,其序列特征具备HP-PRRSV的特征)、真核表达载体pCAGGS、大肠埃希菌感受态细胞 (DH5α) 由河南科技学院动物科技学院实验室保存;AMV反转录酶、rTaq酶、T4 DNA 连接酶、DL 2000 DNA Marker(TaKaRa公司);EcoR Ⅰ和Bgl Ⅱ限制性内切酶(Ferments公司); RNA提取试剂盒[天根生化科技(北京)有限公司];质粒DNA小量提取试剂盒和胶回收试剂盒(OMEGA公司);胎牛血清和高糖DMEM培养基(Gibco公司);lipofiterTM真核转染试剂[汉恒生物科技(上海)有限公司];Cy3标记兔抗猪lgG和兔抗鼠lgG(北京博奥森生物技术有限公司);PRRSV阳性血清(来源于使用HuN4株HP-PRRSV致弱后的疫苗毒株免疫猪30d后分离的血清);其他试剂均为国产分析纯。
1.2 方 法 1.2.1 XX2012株HP-PRRSV GP5a蛋白基因引物的设计与合成根据HP-PRRSV XX2012株GP5a蛋白基因序列设计引物,上游引物(5a-UP):5′-CGCGAATTCATGTCTTCCGTATTTGATGAGT-3′,其5′端设计有EcoR Ⅰ酶切位点(下划标示的序列); 下游引物(5a-DP): 5′-GGCAGATCTTCACATAACGTTAAGTTA T-3′,其5′端设计有Bgl Ⅱ酶切位点(下划标示的序列)。PCR预期的扩增片段大小为156 base pair(bp)。引物由上海生工生物工程技术服务有限公司合成并纯化,引物以灭菌去离子水稀释至终浓度10 μmol/L,存放于-20℃冰箱中保存备用。
1.2.2 XX2012株HP-PRRSV GP5a蛋白的克隆扩增按照RNA提取试剂盒的说明书提取XX2012株HP-PRRSV感染细胞后的总RNA。参照AMV产品使用说明书,以下游引物5a-DP作为反转录引物,合成第一链cDNA。第一步反转录反应体系:总RNA 21 μl,5a-DP引物2μl(50mmol/L),dNTP(10mmol/L each) 4μl,RNase inhibitor 1μl(20U),AMV 2μl(10U),加5× AMV Buffer 4μl,灭菌去离子水,6μl,共40μl。反应条件为:42℃ 反应1h。第二步PCR扩增的反应体系为:逆转录产物 10 μl,上、下游引物 (10 μmol/L)各1 μl;dNTP(2.5 mmol/L) 4 μl;10×Buffer 5 μl;rTaq酶 (2 U/μl) 1 μl;灭菌去离子水28μl,共50μl。PCR过程的反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环30次; 72 ℃ 再延伸 5 min,4 ℃ 保存。PCR结束以后取10μl PCR产物于1.0%琼脂糖凝胶中进行电泳分析鉴定,观察PCR结束以后产物的大小以及特异性。电泳结束后参照胶回收试剂盒说明书纯化回收目的基因用于后续试验[11]。
1.2.3 含有XX2012株HP-PRRSV GP5a蛋白基因真核表达载体的构建将回收得到的目的基因产物和真核表达载体pCAGGS分别用EcoR Ⅰ和Bgl Ⅱ进行双酶切操作,酶切后的两种产物分别采用胶回收试剂盒进行纯化回收得到目的片段。将酶切好的目的基因与线性化真核载体pCAGGS按5∶1的体积比混合,参照T4 DNA 连接酶的说明书,在16℃连接过夜,最后再将连接产物转化DH5α大肠杆菌感受态细胞,在含有氨苄青霉素的LB平板上培养过夜。挑取单个菌落进行培养后提取质粒,分别对质粒采用PCR法、双酶切法 (EcoR Ⅰ和Bgl Ⅱ) 进行鉴定,并将鉴定为阳性的菌液送测序公司鉴定。将最终鉴定为阳性的重组质粒命名为pCAGGS-GP5a。
1.2.4 重组质粒在MARC-145细胞中的表达将MARC-145细胞培养于含10 %胎牛血清的高糖DMEM培养液中,转染前1 d 均匀铺于6孔板。分别对pCAGGS-GP5a和pCAGGS空载体(对照)进行纯化。细胞接种24 h 后(铺满皿底约80%),按照lipofiterTM试剂盒说明书,分别将上述重组阳性的质粒DNA(约2μg)和脂质体加入无血清的高糖DMEM培养液中混匀,静置15min。然后将两溶液混匀(将质粒溶液加入到脂质体溶液中),室温静置30min。用无血清的高糖DMEM培养液清洗靶细胞2次,加入800 μl 高糖DMEM培养液。将分散好的脂质体/DNA混悬液逐滴加入到细胞培养板中,轻轻晃动培养板混匀,置于体积分数为5 % CO2培养箱中、37 ℃培养6 h,置换新鲜的DMEM 培养液(含有10%胎牛血清)继续培养。表达48 h后用间接免疫荧光法检测GP5a蛋白的表达情况,具体步骤如下:弃掉细胞培养液,用1×PBS 洗涤细胞1次,加入预冷的80%乙醇溶液4℃ 固定60min,用1×PBS 洗涤细胞后加入PRRSV阳性血清,37℃作用1 h。用预冷的1×PBS 洗3遍,加入荧光素标记的兔抗猪二抗(1∶1 000 稀释),37℃作用1 h。同样用预冷的1×PBS 洗3遍后,于荧光显微镜下观察。
1.2.5 XX2012株HP-PRRSV GP5a蛋白多克隆抗血清的制备选取6~8周龄健康雌性BALB/c小鼠12只,随机分成2组。将重组质粒PCAGGS-GP5a、和对照空载体pCAGGS 分别以100 μg/只/次多点注射后腿肌肉或脊柱两侧。每组免疫3 次,间隔2周。在第3次免疫后7天采血,分离血清用于检测抗体。
1.2.6 GP5a蛋白多克隆抗血清的特异性检测采用间接免疫荧光的方法检测GP5a蛋白多克隆抗血清的特异性。具体的方法为:将XX2012株HP-PRRSV按照一定的稀释度感染MARC-145 24 h 后弃去培养液,进行间接免疫荧光实验操作。首先,用预冷的80%(体积比)乙醇固定感染XX-2012株HP-PRRSV后的MARC-145细胞,置于4℃条件下反应 60 min,再用l % BSA室温封闭30 min;其次,分别将不同稀释倍数(1 000倍、2 000倍)的GP5a蛋白的抗血清室温孵育2 h,最后,再加入FITC 标记兔抗鼠二抗,室温孵育1 h,PBS 洗3遍后,在荧光显微镜下观察结果,同时设免疫PCAGGS空载体的小鼠血清做对照。
2 结果与分析 2.1 HP-PRRSV GP5a蛋白基因的克隆提取XX2012株HP-PRRSV的总RNA,以5a-DP为反转录引物获得XX2012株HP-PRRSV的cDNA。以合成的第一链cDNA为模板,上、下游引物(5a-UP、5a-DP)为起点,通过PCR方法成功克隆到HP-PRRSVXX2012株的GP5a蛋白全长基因(图 1),基因长度为156 bp。
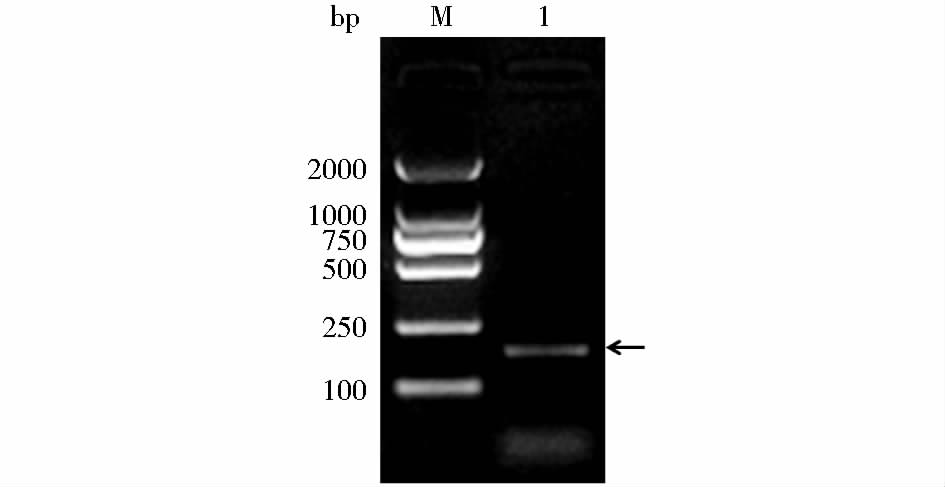
|
| 图 1 GP5a蛋白基因的RT-PCR扩增结果 Fig. 1 Amplification of GP5a gene by RT-PCR M: DNA marker DL2000; 1: Products of GP5a gene by RT-PCR |
将回收到的两端含有特异性酶切位点序列的GP5a蛋白基因和pCAGGS真核表达载体进行双酶切(EcoR Ⅰ和Bgl Ⅱ),分别回收获得目的片段,使用T4 DNA连接酶将两个线性片段连接起来,并转化E. coli DH5α感受态细胞。经PCR、双酶切(EcoR Ⅰ和Bgl Ⅱ)鉴定 (图 2)重组阳性质粒,同时将上述鉴定为阳性的重组质粒送测序公司鉴定分析,将鉴定出的阳性重组质粒命名为pCAGGS-GP5a。
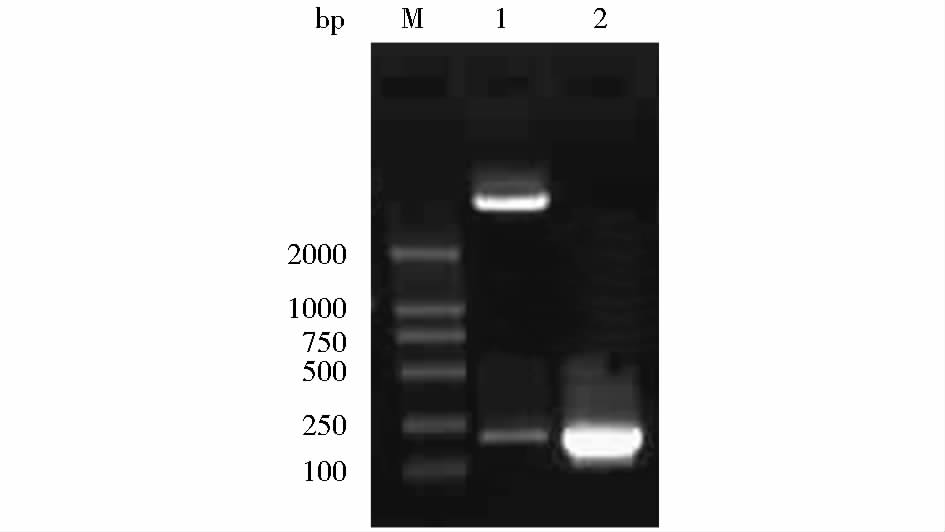
|
| 图 2 重组质粒pCAGGS-GP5a的鉴定 Fig. 2 Identification of recombinant plasmid pCAGGS-GP5a M: DNA marker DL2000; 1: Identification of recombinant plasmid pCAGGS-GP5a by double enzyme digestion; 2. Identification of recombinant plasmid pCAGGS-GP5a by PCR |
将构建好的含有GP5a蛋白基因的重组质粒转染MARC-145细胞,使用HP-PRRSV阳性血清按照间接免疫荧光的方法检测GP5a蛋白的表达情况,结果表明,转染重组质粒的细胞能与阳性血清发生特异性结合,在荧光显微镜下显示出红色荧光,而空载体对照和被转染的细胞均无特异性荧光出现,表明GP5a蛋白被成功表达出来,且具有良好的反应原性(图 3)。

|
| 图 3 GP5a蛋白在MARC-145细胞中的IFA检测 Fig. 3 IFA detection of GP5a protein in MARC-145 cells (a) IFA detection of GP5a protein in MARC-145 cells with transfection of pCAGGS-GP5a vector (b) IFA detection of GP5a protein in MARC-145 cells with transfection of pCAGGS vector (c) IFA detection of GP5a protein in MARC-145 cells |
通过对感染XX2012株HP-PRRSV的MARC-145细胞进行IFA检测来验证制备出的GP5a蛋白抗血清的特异性,结果显示,制备出的多克隆抗血清能与感染病毒的细胞发生特异性结合(见图 4a和图 4b),而与免疫PCAGGS空载体和未免疫小鼠的血清不发生反应(图 4c和图 4d)。同时,采用该方法测得制备出的多克隆抗血清的效价为1∶2 000。
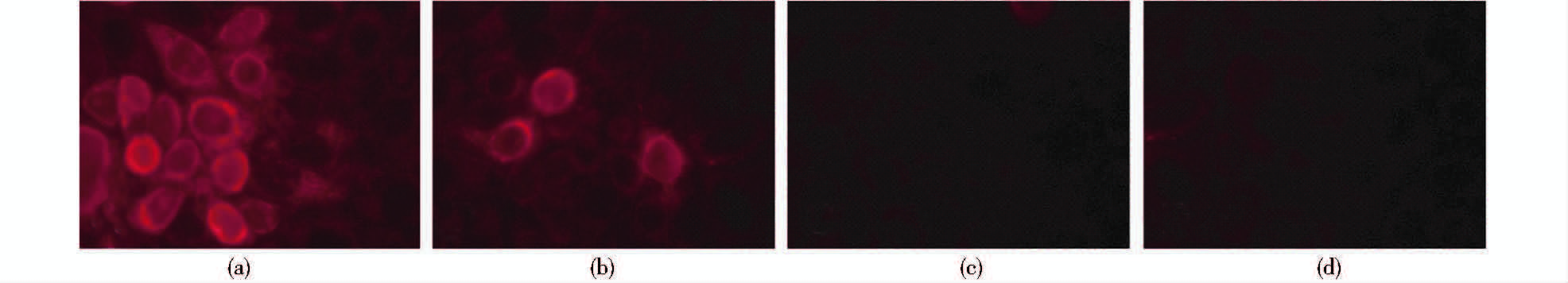
|
| 图 4 IFA检测GP5a蛋白多克隆抗血清的特异性 Fig. 4 Specificity detection of polyclonal antiserum of GP5a protein by IFA assay (a) IFA detection of 1:1 000 dilution of polyclonal antiserum of GP5a protein (b) IFA detection of 1:2 000 dilution of polyclonal aniserum of GP5a protein (c) IFA detection of serum with immune PCAGGS vector (d) IFA detection of negative serum |
2011年研究者通过序列比较和软件预测分析的方法最先发现在PRRSV基因组中存在 ORF5a 基因,随后Johnson等[9, 10]通过生化等相关试验确认在病毒中存在GP5a小蛋白,且该蛋白存在于成熟的PRRSV病毒粒子中,同时在猪感染PRRSV后可以其血清中检测到GP5a蛋白的抗体。该蛋白由46或51个氨基酸组成。目前,PRRSV GP5a的结构和功能尚未见报道,它在病毒复制周期中的作用也不明确。研究者通过对GP5a蛋白的序列进行分析,GP5a蛋白含有跨膜区序列。同比GP5a蛋白在马动脉炎病毒属中的马动脉炎病毒中的作用,我们推测GP5a可能对PRRSV形成感染性粒子以及在病毒的复制过程中起到重要的作用,但更多的GP5a的信息还有待研究者去发现。因此,制备出要进行GP5a蛋白的抗体成为揭开GP5a功能的一项重要材料。
本实验构建了pCAGGS-GP5a重组真核表达质粒,应用真核转染的手段成功地在MARC-145细胞中获得该蛋白的真核表达产物,且该表达产物能和PRRSV阳性血清发生特异性结合,提示我们获得的GP5a表达产物具有良好的反应原性。
制备一种蛋白质的多克隆抗血清经典的方法是通过原核表达的方法获得这种蛋白质,再将该蛋白与佐剂混合到一起免疫小鼠即可以获得较高水平的多克隆抗血清[12]。经过分子生物学分析GP5a蛋白是一个膜蛋白,采用原核表达的方式获得的重组GP5a蛋白主要是包涵体形式的表达产物。包涵体是一种不溶于水的、无法形成正确次级键的表达产物,因此采用包涵体蛋白制备出的抗体不能很好地获得目标蛋白质中空间表位的抗体。DNA免疫系指将靶抗原编码基因序列置于真核表达调控元件的调控下,将该外源DNA直接或者与一定的载体连接起来进行动物体内接种,机体细胞以与自然感染类似的方式加工、呈递抗原,诱生集体产生特异性体液和细胞免疫应答的技术。通过基因免疫的方式,我们可以获得该蛋白质所有表位的抗体,可以克服经典制备多克隆抗体的不足,因此,本实验选择具有真核细胞强启动子和调控序列的PCAGGS载体,构建基因疫苗免疫小鼠制备多克隆抗体[13, 14]。结果显示,通过这种方法制备的多克隆抗血清能够很好地识别被病毒感染的MRRC-145细胞,为进一步研究GP5a蛋白的亚细胞定位以及进一步开展GP5a蛋白的结构和功能的研究提供必要的试验材料。
| [1] | 郭宝清, 陈章水, 刘文兴, 等. 从疑似PRRS流产胎儿分离PRRSV的研究. 中国畜禽传染病, 1996, (02):3-7. Guo B Q, Chen Z S, Liu W X, et al. Isolation and identification of porcine reproductory and respiratory syndrome (PRRS) virus from aborted fetuses suspected of PRRS. Chinese Journal of Preventive Medicine, 1996, (02):3-7. |
| [2] | 杨汉春, 管山红, 尹晓敏, 等. 猪繁殖与呼吸综合征病毒的分离与初步鉴定. 中国兽医杂志, 1997, 23 (10):9-10. Yang H C, Guan S H, Yin X M, et al. Isolation and identification of porcine reproductory and respiratory syndrome (PRRS) virus. Chinese Journal of Veterinary Medicine, 1997, 23 (10):9-10. |
| [3] | 杨汉春. 目前我国主要猪病现状、问题及科学防控策略. 中国猪业, 2013, (S2):21-24. Yang H C. Present situation, problems, and scientific prevention and control strategies of our country main swine disease. Chinese Swine Industry, 2013, (S2):21-24. |
| [4] | 杨汉春. 2013年猪病流行情况与2014年流行趋势及防控对策. 猪业科学, 2014, (02):42-43. Yang H C. Swine disease epidemic situation in 2013 and the epidemic trend, prevention and control countermeasures in 2014. Swine Industry Science, 2014, (02):42-43. |
| [5] | Collins J E, Benfield D A, Christianson W T, et al. Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2332) in North America and experimental reproduction of the disease in gnotobiotic pigs. J Vet Diagn Invest, 1992, 4 (2):117-126. |
| [6] | Wensvoort G, de Kluyver E P, Pol J M, et al. Lelystad virus, the cause of porcine epidemic abortion and respiratory syndrome: a review of mystery swine disease research at Lelystad. Vet Microbiol, 1992, 33 (1-4):185-193. |
| [7] | 徐彦召. 高致病性猪繁殖与呼吸综合征病毒致弱毒株NSP2复制非必需区的鉴定及其表达外源基因的研究. 北京: 中国农业科学院, 2012. Xu Y Z. Identification of nonessential sequences in NSP2 region of an attenuated porcine reproductive and respiratory syndrome virus and expression of foreign genes in the nonessential regions. Beijing: Chinese Acdamy of Agriculture Science, 2012. |
| [8] | Wu W H, Fang Y, Rowland R R, et al. The 2b protein as a minor structural component of PRRSV. Virus Res, 2005, 114 (1-2):177-181. |
| [9] | Firth A E, Zevenhoven-Dobbe J C, Wills N M, et al. Discovery of a small arterivirus gene that overlaps the GP5 coding sequence and is important for virus production. J Gen Virol, 2011, 92 (Pt 5):1097-1106. |
| [10] | Johnson C R, Griggs T F, Gnanandarajah J, et al. Novel structural protein in porcine reproductive and respiratory syndrome virus encoded by an alternative ORF5 present in all arteriviruses. J Gen Virol, 2011, 92 (Pt 5):1107-1116. |
| [11] | 徐彦召, 王青, 杭柏林, 等. 新城疫病毒核衣壳蛋白基因在大肠埃希菌中的表达、纯化及其活性分析. 中国畜牧兽医, 2013, (02):18-22. Xu Y Z, Wang Q, Hang B L, et al. Prokaryotic expression, purification of NDV NP protein gene in Escherichia coli and its activity analysis. Chinese Animal Husbandry and Veterinary Medicine, 2013, (02):18-22. |
| [12] | 蒋伟, 王喜军, 帅磊, 等. 狂犬病病毒囊膜糖蛋白基因DNA免疫研究. 中国预防兽医学报, 2013, (09):752-755. Jiang W, Wang X J, Shuai L, et al. Immunogenicity of a codon optimized DNA vaccine expressing rabies virus G protein. Chinese Journal of Preventive Medicine, 2013, (09):752-755. |
| [13] | 崔保亮. DNA免疫制备抗牛IFN-γ单克隆抗体及其特性研究. 北京: 中国农业科学院, 2014. Cui B L. Preparation and characterization of monoclonal antibodies against bovine IFN-γ by DNA immunization. Beijing: Chinese Acdamy of Agriculture Science, 2014. |
| [14] | 陈雅君, 程慧芳, 徐卫松, 等. 猪传染性胃肠炎病毒HN-2012分离株S基因的遗传变异分析及其真核表达. 中国兽医科学, 2015, (01):32-36. Cheng Y J, Cheng H F, Xu W S, et al. Genetic variation analysis and eukaryotic expression of S gene of Porcine transmissible gastroenteritis virus HN2012 strain. Chinese Veterinary Science, 2015, (01):32-36. |
 2015, Vol. 35
2015, Vol. 35




