文章信息
- 夏文跃, 王晶, 赵冰心, 潘小霞, 文喻玲, 陈元鼎
- XIA Wen-yue, WANG Jing, ZHAO Bing-xin, PAN Xiao-xia, WEN Yu-ling, CHEN Yuan-ding
- 轮状病毒VP4抗原表位在VP6载体蛋白同一位点表达比较研究
- Comparative Analysis of Two Rotavirus VP4 Epitopes Inserted on the Same Site of VP6 Vector Protein
- 中国生物工程杂志, 2015, 35(8): 9-15
- China Biotechnology, 2015, 35(8): 9-15
- http://dx.doi.org/10.13523/j.cb.20150802
-
文章历史
- 收稿日期:2015-04-15
- 修回日期:2015-05-10
2. 云南民族大学化学与生物技术学院 民族药资源化学国家民委-教育部重点实验室 昆明 650118
2. Key Laboratory of Chemistry in Ethnic Medicinal Resources, State Ethnic Affairs Commission and Ministry of Education, Yunnan Minzu University, Kunming 650500, China
轮状病毒(RV)是无包膜的双链RNA病毒,RV基因组由11个节段的双链RNA组成,分别编码6个结构蛋白(VP1,VP2,VP3,VP4,VP6,VP7)和6个非结构蛋白(NSP1,NSP2,NSP3,NSP4,NSP5/NSP6)[1]。VP4蛋白和VP7蛋白组成了轮状病毒的最外层结构,且含有病毒中和性抗原表位。根据VP7和VP4编码基因核苷酸序列差异,可将RV分成不同的基因型——G型和P型,共有27个G型和37个P型[2]。VP6蛋白是RV含量最丰富的蛋白,也是RV的组特异性蛋白。根据VP6基因同源性差异可将RV分成A-E8个组[3],其中A组RV是引起婴幼儿严重病毒性腹泻的主要病原。VP6蛋白有高度保守性,并具有较强的免疫原性[4]。
目前,上市使用的RV疫苗主要有三种,英国葛兰素史克公司生产的Rotarix,美国默克公司生产的Rotateq和我国兰州生物制品研究所生产的LLR,三种疫苗均为减毒活疫苗。Rotarix是由分离自临床病人体内血清型为G1P[8]的RV毒株制备的单价疫苗;Rotateq为五价疫苗,是人/牛(WC3株)重配株,五个重配株中包括4个表达人RV VP7(G1-G4型)的重配株和1个表达人RV VP4 P[8] 型的重配株[5];LLR为分离自羔羊体内血清型为G10P[15]的轮状病毒株制备的单价减毒活疫苗[6]。在临床试验中,前两种RV疫苗针对严重腹泻的保护率不低于85%[7, 8]。而在发展中国家,这两种疫苗针对RV引起的腹泻的保护率总体上只有51%~66%[9]。 LLR尚缺乏长期临床免疫保护试验资料,较难对其大范围内使用有效保护性进行评价。作为减毒活疫苗,Rotarix,Rotateq和LLR存在毒力回升及在使用过程中出现不同病毒株之间基因重组的情况[10, 11]。
因此,开发具有更高保护效率和更安全的疫苗具有重要的价值。重组蛋白疫苗能够在一定程度上弥补传统疫苗的不足:(1)因其不含有病毒基因,不会发生病毒株之间的基因重组,较之减毒活疫苗具有更好的安全性;(2)如果将病毒保守的抗原蛋白或抗原表位在重组蛋白上表达,重组蛋白可拥有更广泛的免疫保护作用。本研究采用基因工程技术,将RV病毒VP4蛋白上的两个抗原表位分别插入到VP6载体蛋白上,成功表达出两个重组嵌合蛋白,分析比较其免疫学性质,评价VP6蛋白载体在研发重组蛋白/抗原表位疫苗中的价值。研究结果为RV重组蛋白新型疫苗的开发设计奠定了较好的基础。
1 材料与方法 1.1 材 料 1.1.1 质粒、菌毒株及细胞表达质粒 pETL经本实验室由质粒pET-3a改建而成,克隆和扩增质粒大肠杆菌DH5α由本实验室保存,感受态大肠杆菌BL21(DE3)由本实验室制备;人RV Wa株和MA104细胞由本实验室保存。
1.1.2 试剂限制性内切酶Sac I、Xho I、Nde I、Sac II、BamH I和 DNA连接酶等工具酶购自宝生物工程(大连)有限公司;辣根过氧化物酶(HRP)标记的羊抗豚鼠IgG购自Proteintech公司;ECL显色液为美国Thermo公司产品。
1.1.3 实验动物豚鼠,2月龄,体重250g~300g左右,由中国医学科学院医学生物学研究所实验动物中心提供。
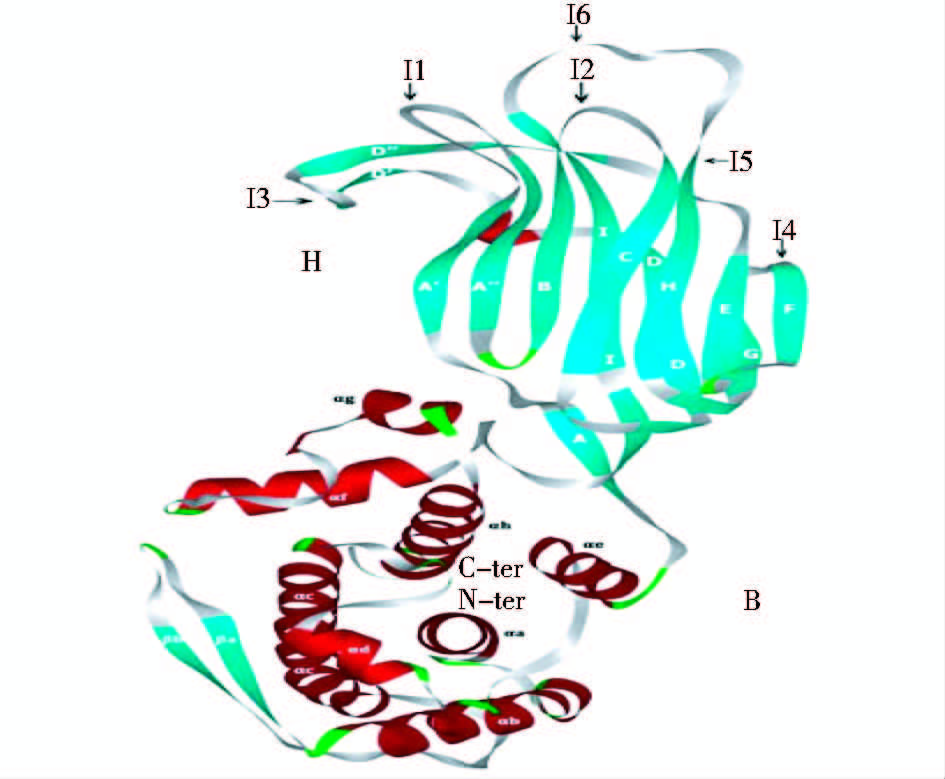
1.2 方 法 1.2.1 载体蛋白表达质粒的构建运用分子克隆和基因重组技术[12],构建重组嵌合蛋白表达载体质粒pETP6F[13]。从人RV株TB-Chen克隆得到编码VP6蛋白的cDNA,在6个不同位点处分别插入6个内切酶位点Sac I,BspT104 I,Kpn I,Bln I,Sac II及Xho I,形成有6个插入位点I1、I2、 I3、 I4、 I5、 I6的重组载体蛋白VP6F编码基因。将重组载体蛋白VP6F编码基因插入到pETL质粒的Nde I/BamH I克隆位点,构建携带载体蛋白VP6F编码基因的重组表达质粒pETP6F。重组表达的载体蛋白VP6F的分子结构如图 1所示[13]。酶切鉴定重组质粒,并对酶切正确的重组质粒进行DNA测序鉴定。
|
| 图 1 VP6F 载体蛋白的三维分子结构图 VP6F载体蛋白表面有6个抗原表位插入位点: I1、I2、I3、I4、I5、I6,本研究选取I5作为外源抗原表位插入位点 Fig. 1 Three-dimensional molecular structure of VP6F vector protein |
分析选取来源于轮状病毒VP4蛋白的两个抗原表位298S/P[8]/296和298S/P[8]/381,所对应的氨基酸序列分别为aa296-313(KAANY QYNYL RDGEQ VTA)和aa381-399(GGSYD FRLPV GEWPI MNGG)。合成所对应的两对寡核苷酸序列298S/P[8]/296-313f(5′-GGGGTGGGAG TTATGATTTT AGATTACCTG TAGGTG AATG GCCTATTATG AATGGCGGTC CGC-3′)与298S/P[8]/296-313r(5′-GGACCGCCAT TCATAATAGG CCATTCACCT ACAGGTAATC TAAAATCATA ACTCCCA CCC CGC-3′)和298S/P[8]/381-399f(5′-GGAAGGCAG C AAATTATCAA TATAATTACT TACGTGACGG TGAAC AAGTA ACCGCACCGC-3′)与298S/P[8]/381-399r(5′-GGTGCGGTTA CTTGTTCACC GTCACGTAAG TAATTAT ATT GATAATTTGC TGCCTTCCGC-3′),并分别将其插入到VP6F载体蛋白上的Sac II酶切位点I5。抗原表位嵌合蛋白编码基因重组连接到pETL质粒的Nde I/BamH I克隆位点上,构建成pETP6F298S/P[8]/296和pETP6F298S/P[8]/381重组嵌合蛋白表达质粒。重组表达质粒经双酶切鉴定连接成功后,再进行DNA测序测定,确定插入目的基因完整正确,以进一步进行蛋白表达研究。
1.2.3 重组嵌合蛋白的表达和纯化重组质粒pETP6F,pETP6F298S/P[8]/296和pETP6F298S/P[8]/381在大肠杆菌中的表达。重组质粒pETP6F,pETP6F298S/P[8]/296和pETP6F298S/P[8]/381经酶切鉴定及核苷酸序列测定确定无误后,分别转化到E.coli BL21(DE3)感受态细胞。转化细胞涂布于Amp+ LB培养基上,37℃过夜培养。挑选阳性菌落接种于3ml含氨苄青霉素(Amp,200μg /ml)的LB培养液中,37℃,120r/min摇床培养7h,取50μl菌液转入300ml LB 培养基中,37℃,120r/min条件下扩大培养16h。 4000r/min离心8min,收集菌体。菌体悬浮于超声裂解缓冲液[150mmol/L NaCl,50mmol/L Tris(pH 7.5),5% 甘油,1% Triton X-100,2mmol/L EDTA(pH8.0),0.2%-巯基乙醇],超声破碎细胞。裂解液于12 000r/min,4℃下离心30min,收集白色沉淀(主要为包涵体蛋白),超声洗涤液(10mmol/L Tris,5mmol/L EDTA,0.1% Triton X-100)漂洗,12 000r/min,5min离心洗涤沉淀。将包涵体蛋白溶于8mol/L尿素溶解,分装并于-20℃保存并进行SDS-PAGE检测蛋白表达情况。表达蛋白经SDS-PAGE切胶纯化。溶解于8mol/L尿素中的包涵体蛋白用SDS-PAGE电泳分离,在150mmol/L的KCl中显色,将重组蛋白目的条带切下,放入到12%SDS-PAGE的凝胶柱中电泳(20mA,4℃,15h),富集到与凝胶柱相连的盛有无SDS电泳液的回收杯中。收集蛋白回收液,分装,-20℃保存。蛋白浓度采用Bradford法进行测定。
1.2.4 动物免疫实验豚鼠分成实验组和阴性对照组,共免疫3次。初次免疫前,随机对两只实验豚鼠采血,检测抗RV血清抗体,排除前期RV感染。实验组设有A,B,C三个小组,每组5只,采用大腿皮下注射的方式进行免疫。A组用纯化载体蛋白VP6F免疫,B组用嵌合蛋白6F/P[8]296免疫,C组用嵌合蛋白6F/P[8]381免疫。根据蛋白浓度用适量TNMC缓冲液(15 mmol/L Tris,150 mmol/L NaCl,pH 7.0)稀释,免疫剂量为120μg/100μl/只蛋白量;D组用人轮状病毒株Wa免疫,每只豚鼠按1×108 TCID50的病毒量(TNMC缓冲液稀释)进行免疫,100μl/只。阴性对照组(E组)共3只,注射TNMC缓冲液,100μl/只。
初次免疫后2周进行第1次加强免疫,免疫剂量和免疫方式同初次免疫;免疫后1周进行第2次加强免疫,免疫剂量和免疫方式同第1次加强免疫。第2次加强免疫后1周采血,制备血清。对每只实验豚鼠进行心脏采血,全血在37℃静置30min,再在4℃下静置2h;10 000r/min,4℃,离心30min,吸取上部血清。分装,-20℃保存。
1.2.5 免疫动物血清中和抗体测定用微量中和试验测定血清中和抗体效价[13]。待测豚鼠血清作1∶10稀释,再进行2倍系列稀释;Wa株病毒用终浓度为10μg/ml的乙酰化胰酶在37℃水浴1h,用MEM维持液稀释成病毒含量为200×TCID50/100μl的稀释液。等量血清和病毒液混合,37℃中和作用1h;期间每15min摇晃一次。已长成单层的96孔板中的细胞先用PBS洗2次,再用MEM维持液洗1次。把中和后的血清与病毒混合液加入到96孔板中,100μl/孔;分别加入100μl /孔的病毒液及100μl/孔的MEM维持液作为阳性对照孔和阴性对照孔。细胞放培养箱中,37℃,5%CO2培养48h,判定细胞病变(CPE)。
1.2.6 Western blot 分析蛋白经SDS-PAGE电泳分离后,用湿转的方法(恒压45V,1.5h)转移至PVDF膜上。PVDF膜用含5%脱脂奶粉(TBS稀释)4℃封闭过夜。封闭后加入一抗(1∶500稀释的免疫豚鼠血清)37℃反应1.5h;二抗为HRP标记的羊抗豚鼠IgG,1∶2000稀释,37℃反应1.5h;ECL底物曝光显色。
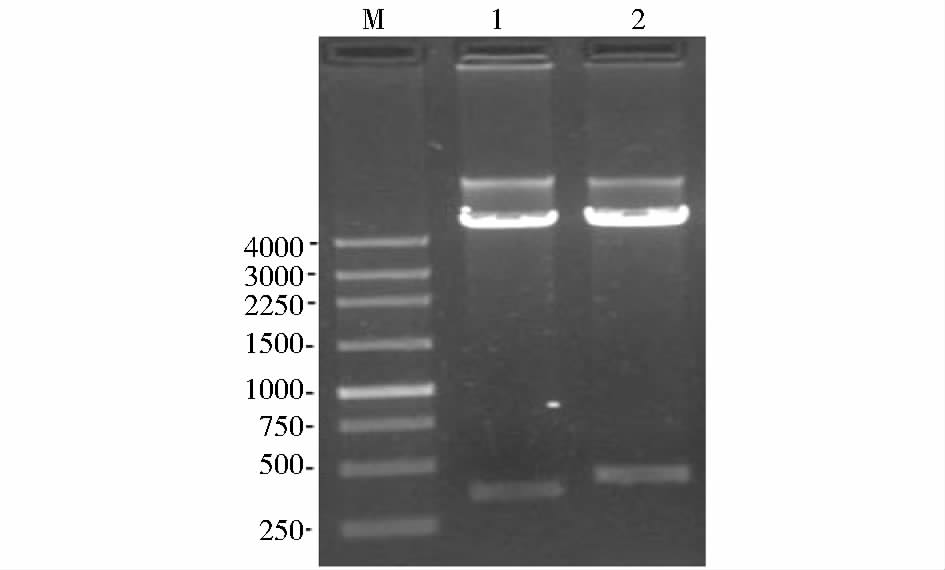
2 结 果 2.1 重组嵌合蛋白表达载体质粒的构建运用分子克隆手段构建载体蛋白VP6F表达质粒pETP6F及嵌合蛋白表达质粒pETP6F298S/P[8]/296和pETP6F298S/P[8]/381。重组载体蛋白质粒pETP6F和嵌合pETP6F298S/P[8]/296 DNA经Sac I/Xho I双酶切鉴定,分别在相应的位置处可见一条约373bp和410bp的条带(图 2),与预期相符;结果表明嵌合蛋白pETP6F298S/P[8]/296中成功插入了298S/P[8]/296抗原表位基因(图 2)。此外,在约4 600bp位置处显示的条带,为载体质粒pETL的核苷酸长度。pETP6F298S/P[8]/381质粒酶切与pETP6F298S/P[8]/296酶切结果相同(文中未显示)。经DNA测序,结果确认这3个质粒核苷酸序列完整正确(文中未显示)。
|
| 图 2 重组表达质Sac I/Xho I双酶切鉴定 Fig. 2 Analysis of recombinant plasmids by Sac I/Xho I digestion M: DNA marker; 1: pETP6F; 2: pET6F298S/P[8]296 |
重组质粒在大肠杆菌BL21(DE3)细胞转化和表达。重组表达的载体蛋白VP6F,嵌合蛋白6F/P[8]296和6F P[8]381分别为380aa,400aa,401aa,分子量分别为43.2kDa,45.5kDa和45.5kDa。经SDS-PAGE电泳,考马斯亮蓝染色的方法检测,结果与预期相符(图 3,目的蛋白为箭头所示条带)。表达的重组蛋白均存在于包涵体中,细胞培养上清和超声裂解上清中未检测到目的蛋白(材料未显示)。
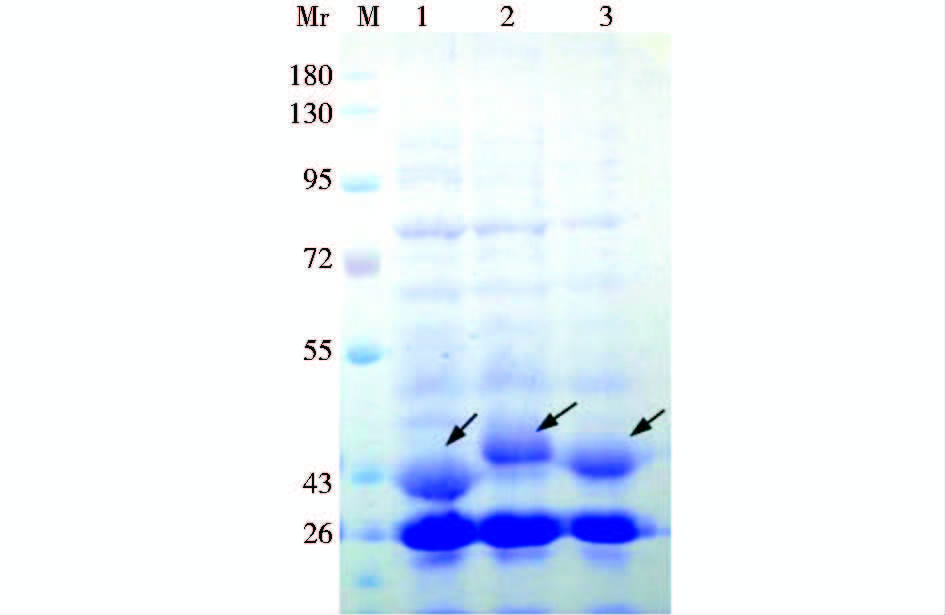
|
| 图 3 在E. coli BL21(DE3)细胞中表达的重组嵌合蛋白SDS-PAGE(10%)结果 Fig. 3 SDS-PAGE (10%) of the recombinant chimeric proteins expressed in E. coli BL21(DE3) cell M: Protein marker; 1: Vector protein VP6F; 2: Chimeric protein 6F/P[8]296; 3: Chimeric protein 6F/P[8]381 |
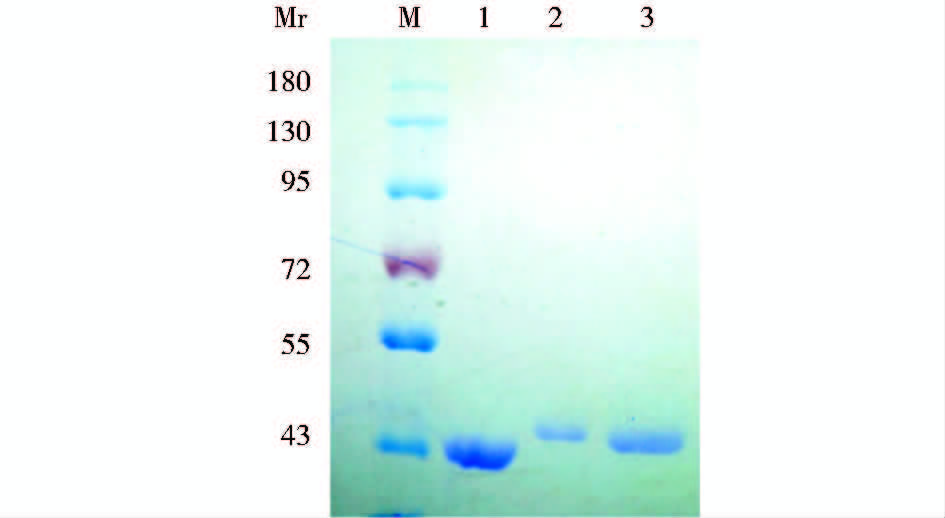
表达蛋白经纯化(图 4),用于动物免疫和其他检测。
|
| 图 4 纯化重组嵌合蛋白SDS-PAGE(10%)结果 Fig. 4 SDS-PAGE (10%) of the purified recombinant chimeric proteins M: Protein marker; 1: Vector protein VP6F; 2: Chimeric protein 6F/P[8]296; 3: Chimeric protein 6F/P[8]381 |
微量血清中和试验检测豚鼠血清中和抗体滴度,检测所用毒株为Wa株RV。结果显示,VP6F蛋白免疫豚鼠 的血清中和抗体滴度为1∶320,嵌合蛋白免疫豚鼠血清中和抗体滴度均为1∶1 280;TNMC缓冲液注射的阴性对照组血清中和抗体滴度低于1∶10(表 1)。结果表明,嵌合蛋白血清中和抗体滴度高于VP6F蛋白血清抗体,VP4抗原表位可显著增强载体蛋白的免疫原性。
| Virus | Neutralization titer of antibodies | ||||
| Negative control | VP6F | 6F/P[8]/296 | 6F/P[8]/381 | Wa | |
| Wa | ﹤10 | 320 | 1280 | 1280 | 10240 |
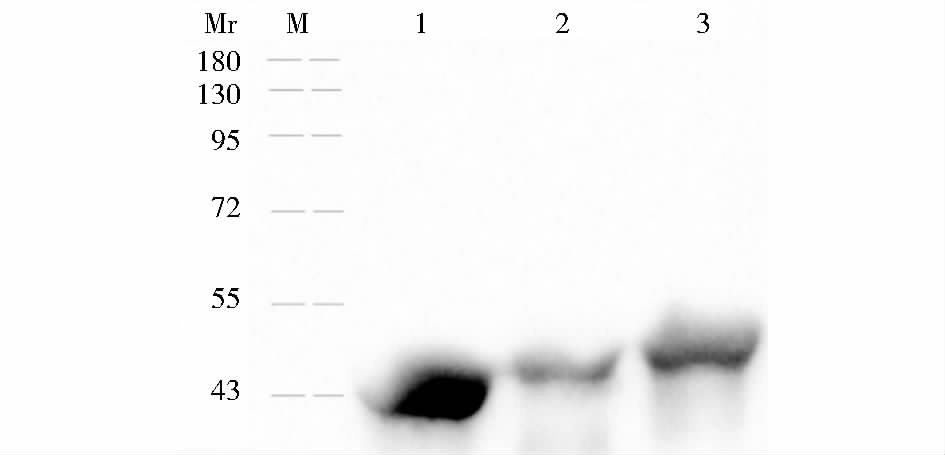
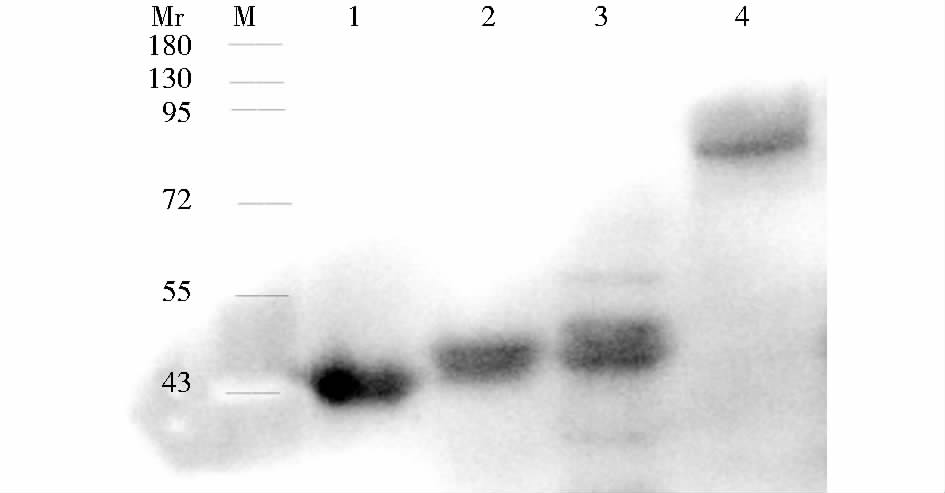
Western blot结果表明,重组蛋白免疫豚鼠血清抗体可与相应抗原特异性反应。载体蛋白VP6F免疫豚鼠血清抗体能特异性识别载体蛋白VP6F及嵌合蛋白6F/P[8]296,6F/P[8]381(图 5);嵌合蛋白6F/P[8]296免疫豚鼠血清抗体及抗6F/P[8]381豚鼠血清抗体(资料未显示)可特异性识别重组蛋白VP6F,嵌合蛋白6F/P[8]296,6F/P[8]381和重组VP4蛋白[14](图 6,VP4蛋白分子量约88kDa);以及VP4蛋白和RV Wa株病毒(图 7)。
|
| 图 5 抗VP6F蛋白豚鼠免疫血清抗体检测重组蛋白Western blot Fig. 5 Western blot of chimeric proteins with antibodies in serum collected from vector VP6 inoculated guinea pigs M: Protein marker; 1: Vector protein VP6F; 2: Chimeric protein 6F/P[8]381; 3: Chimeric protein 6F/P[8]296 |
|
| 图 6 抗嵌合蛋白豚鼠免疫血清抗体检测重组蛋白Western blot Fig. 6 Western blot of recombinant proteins with antibodies in serum collected from cheimeric protein inoculated guinea pig M: Protein marker; 1: Vector protein VP6F; 2: Chimeric protein 6F/P[8]296; 3: Chimeric protein 6F/P[8]381; 4:Recombinant protein VP4 |

|
| 图 7 抗嵌合蛋白豚鼠血清抗体检测嵌合蛋白及轮状病毒Western blot Fig. 7 Western blot of recombinant chimeric proteins and rotavirus VP4 with antibodies in serum collected from cheimeric protein inoculated guinea pig M: Protein marker; 1: Vector protein VP6F; 2: Chimeric protein 6F/P[8]296; 3: Chimeric protein 6F/P[8]381;4: RV Wa |
VP6蛋白是RV中含量最高的蛋白,约占病毒蛋白总重量的39%;也是RV最主要的抗原蛋白,并具有高度保守性,哺乳动物RV VP6蛋白氨基酸序列同源性高达87%~99%[15]。因此,采用RV VP6蛋白制备疫苗,会有较强的免疫原性和潜在交叉保护性。用VP6蛋白作为外源抗原表位载体,在VP6蛋白上插入外源抗原表位,构建携带外源抗原表位的嵌合蛋白,可获得具有载体VP6蛋白以及外源抗原表位免疫原性的保护性疫苗[13]。
本研究运用从VP6改建的VP6F为载体蛋白(图 1)[13],选取2个不同的RV VP4 抗原表位,插入载体蛋白的同一位置,在大肠杆菌原核表达系统中重组表达,进行抗原反应性和免疫原性研究。
Western blot结果显示,嵌合蛋白6F/P[8]296和6F/P[8]381可与抗VP6F抗体反应,也可诱导豚鼠产生抗VP6F,抗6F/P[8]296和抗6F/P[8]381血清抗体。可识别RV重组VP4蛋白以及RV的VP6和VP4蛋白,并具有中和Wa株病毒感染能力。嵌合蛋白免疫血清的体外中和抗体滴度明显高于抗载体蛋白VP6F血清的体外中和抗体滴度。结果表明,嵌合蛋白6F/P[8]296和6F/P[8]381具有较好抗原反应性和免疫原性;嵌合蛋白6F/P[8]296和6F/P[8]381上携带的抗原表位P[8]296和P[8]381可增强载体蛋白VP6F的免疫原性。
本研究中VP6载体蛋白插入外源表位后,载体蛋白原有的分子骨架和蛋白分子构象保持不变,从而保证了VP6蛋白分子的相对稳定性。氨基酸位点aa32-64,aa155-167,aa208-274,308-397是RVVP6蛋白的组特异性抗原表位[16],在VP6F载体蛋白的构建过程中仍保留了这些抗原表位,其相关活性不会受到影响。VP4蛋白为RV的主要中和抗原蛋白,所选取的VP4抗原表位P[8]/296和P[8]/381氨基酸位点分别为aa296-313和aa381-401,这两个抗原表位高度保守[17, 18],将其作为重组嵌合蛋白疫苗组成成分,具有潜在的交叉保护性。
研究结果显示,插入VP4抗原表位后VP6F蛋白的免疫原性得到加强。Andrea等[19]也报道了在VP6蛋白的不同位点插入了长度为14个氨基酸的轮状病毒VP5抗原表位,重组蛋白能够引起较强的免疫反应。此外,本研究所构建的两个嵌合蛋白均能诱导免疫豚鼠产生较高滴度的中和抗体,两者的滴度较为接近,表明抗原表位298S/P[8]/296和298S/P[8]/381均可作为为制备新型RV重组蛋白疫苗的主要候选抗原表位。本研究结果以及之前的研究结果均显示,在VP6F载体蛋白的不同位点插入不同的VP4抗原表位,构建的重组嵌合蛋白也都具有较强的免疫反应性[4],提示VP6蛋白是较好的外源抗原表位载体蛋白。本研究结果为研制RV新型疫苗和疫苗载体提供了新的参考。
| [1] | Lin C L, Chen S C, Liu S Y, et al. Disease caused by rotavirus infection. The Open Virology Journal, 2014, 8:14-19. |
| [2] | Ulrich D. Rotaviruses. Virus Research, 2014, 190(10):75-96. |
| [3] | Jelle M, Peter H O, Max C, et al. VP6-sequence-based cut off values as a criterion for rotavirus species demarcation. Archives of Virology, 2012, 157(6):1177-1182. |
| [4] | Svensson L, Sheshberadaran H, Vene S, et al. Serum antibody responses to individual viral polypeptides in human rotavirus infections. Journal of General Virology, 1987, 68(3):643-651. |
| [5] | Yen C, Tate J E, Patel M M, et al. Rotavirus vaccines: update on global impact and future priorities. Human Vaccines, 2011, 7(12):1282-1290. |
| [6] | 李丹地,徐子乾,谢广成,等.确认我国轮状病毒疫苗株LLR基因型为G10P[15].病毒学报,2015,31(2):170-173.Li D D, Xu Z Q, Xie G C, et al. Genotype of rotavirus vaccine strain LLR in China is G10P[15]. Chinese Journal of Virology, 2015, 31(20): 170-173. |
| [7] | Ruiz-Palacios G M, Perez-Schael I, Velazquez F R, et al. Human rotavirus vaccine study group. Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis. The New England Journal of Medicine, 2006, 354(1):11-22. |
| [8] | Vesikari T, Matson D O, Dennehy P, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine. The New England Journal of Medicine, 2006, 354(1):23-33. |
| [9] | Jiang V, Jiang B, Tate J, et al. Performance of rotavirus vaccines in developed and developing countries. Human Vaccines, 2010, 6(7):532-542. |
| [10] | Hemming M, Vesikari T. Genetic diversity of G1P[8] rotavirus VP7 and VP8* antigens in Finland over a 20-year period: No evidence for selection pressure by universal mass vaccination with RotaTeq® vaccine. Infection Genetics and Evolution, 2013, 19(10):51-58. |
| [11] | Hemming M, Vesikari T. Detection of rotateq vaccine-derived, double-reassortant rotavirus in a 7-year-old child with acute gastroenteritis. The Pediatric Infectious Disease Journal, 2014, 33(6): 655-656. |
| [12] | Chen Y, Xiong X, Liu X, et al. Immunoreactivity of HCV/HBV epitopes displayed in an epitope-presenting system. Molecular Immunology, 2006, 43(5):436-442. |
| [13] | Teng Y, Zhao B, Pan X, et al. A new rotavirus VP6-based foreign epitope presenting vector and immunoreactivity of VP4 epitope chimeric proteins. Viral Immunology, 2014, 27(3):96-104. |
| [14] | Zhang Y, Wen Y L, Wei H T, et al. Expression of VP5* and VP8* of group A rotavirus and immunological characteristics. China Biotechnology, 2010, 30(2):32-38. |
| [15] | Lepault J, Petitpas I, Erk I, et al. Structural polymorphism of the major capsid protein of rotavirus. EMBO Journal, 2001, 20(7):1498-1507. |
| [16] | Studer E, Bertoni G, Candrian U. Detection and characterization of pestivirus contaminations in human live viral vaccines. Biologicals, 2002, 30(4):289-296. |
| [17] | Komoto S, Kugita M, Sasaki J, et al. Generation of recombinant rotavirus with an antigenic mosaic of cross-reactive neutralization epitopes on VP4. Journal of Virology, 2008, 82 (13):6753-6757. |
| [18] | Taniguchi K, Maloy W L, Nishikawa K, et al. Identification of cross-reactive and serotype 2-specific neutralization epitopes on VP3 of human rotavirus. Journal of Virology, 1988, 62(7):2421-2426. |
| [19] | Andrea P, Paula M, Oscar T. Chimeric recombinant rotavirus-like particles as a vehicle for the display of heterologous epitopes. Virology Journal, 2009, 6(1):192. |
 2015, Vol. 35
2015, Vol. 35




