文章信息
- 李洪昌, 袁林, 张令强
- LI Hong-chang, YUAN Lin, ZHANG Ling-qiang
- 抑癌基因PTEN转基因小鼠的构建及表型初步分析
- Construction of Transgenic Mice and Phenotypic Analysis of Tumor Suppressor PTEN
- 中国生物工程杂志, 2015, 35(8): 1-8
- China Biotechnology, 2015, 35(8): 1-8
- http://dx.doi.org/10.13523/j.cb.20150801
-
文章历史
- 收稿日期:2015-03-24
- 修回日期:2015-04-23
PTEN (phosphatase and tensin homolog deleted on chromosome ten) 是1997年克隆发现的肿瘤抑制基因[1],是近二十年来研究最多的抑癌基因之一。PTEN蛋白具有蛋白磷酸酶和脂质磷酸酶双重活性,由403个氨基酸组成,相对分子量55kDa,由N端的磷酸酶结构域、中部的C2结构域及C端的尾部结构域组成。
PTEN作为一个重要的抑癌蛋白,在细胞信号通路中参与PTEN/PI3K/AKT[2, 3]、FAK/MAPK[4]等多条信号途径的调控,这些信号途径在协调细胞周期进程、抑制癌细胞增殖和转移、控制细胞黏附及细胞凋亡等方面发挥着重要作用,其表达异常与多种人类系统型疾病以及多种恶性肿瘤的发生、发展相关。已有的研究表明PTEN基因在包括子宫内膜癌、脑胶质瘤、前列腺癌、乳腺癌、肺癌等[5, 6, 7, 8, 9]在内的多种肿瘤中具有很高的缺失或突变率。PTEN的遗传性突变也同样常见,并能导致Cowden和Bannayan-Zonana等综合症[10, 11, 12]。2007年,当PTEN在细胞核内的重要功能被发现后,PTEN又被称为“a new guardian of the genome”,与p53同列为体内的两大重要的抑癌基因。
PTEN的研究一直都是分子生物学与细胞生物学研究的重点。前期在基因敲除动物模型上已经发现Pten基因纯合缺失小鼠胚胎致死,杂合缺失小鼠自发形成多种肿瘤[13, 14, 15]。2012年,Garcia等[16]对PTEN转基因小鼠的研究发现PTEN在细胞代谢调节中发挥重要作用。
转基因动物模型是研究基因生理功能的一种重要手段,鉴于目前国内尚无PTEN转基因小鼠模型,本研究构建了PTEN转基因小鼠并进行了鉴定、检测与初步的表型分析,为深入研究PTEN基因的生理功能及调控机制提供了重要的动物模型。
1 材料与方法 1.1 材 料C57BL/6J小鼠及打靶载体购自广州赛业公司,小鼠基因型鉴定引物(PTEN-Primer F、PTEN-Primer R)由上海生物工程技术服务有限公司合成(表 1)。DNA marker、2×Taq mix均购自TaKaRa公司;dNTP购自 Sigma公司;蛋白marker、Western印迹发光试剂盒购自Thermo公司;胶片购自柯达公司;PTEN抗体(ab32199)购自Abcam公司,β-actin购自中杉金桥公司。DMEM高糖培养基、胎牛血清、胰酶以及双抗(终浓度:青霉素100 U/ml;链霉素 100 μg/ml)购自Hyclone公司。
| Primer | Sequence |
| PTEN-Primer F | GGCCGCTAATACGACTCAC |
| PTEN-Primer R | ATAAAATGACTTGCCATTGGGT |
| Control F | AGGTCGGTGTGAACGGATTTG |
| Control R | TGTAGACCATGTAGTTGAGGTCA |
PTEN转基因小鼠的背景鼠是C57BL/6,构建原理是利用细菌人工染色体(BAC)载体系统携带大量完整的Pten基因拷贝片段,并将线性化的载体通过显微注射入小鼠受精卵雄性原核中,使其整合进小鼠染色体。随后将受精卵移植到假孕受体鼠的输卵管中,产出 F0代转基因小鼠。PTEN转基因小鼠通过以载体系统上特定序列设计的引物做PCR鉴定。转基因小鼠饲养于SPF的环境中,室温22~28℃,相对湿度50%~70%,自动光控。转基因小鼠繁殖时将每个F0代小鼠视为一个独立的转基因表达系,与野生型的C57BL/6小鼠交配繁殖。
1.2.2 小鼠鼠尾基因组DNA提取及基因型鉴定酒精消毒鼠尾及器械后,剪约1 mm尾尖(3周龄转基因小鼠)置于高压灭菌后的1.5ml离心管底。取100μl鼠尾裂解液A液(25 mmol/L NaOH,20 μmol/L EDTA)加入离心管,95℃水浴40min,加入100μl鼠尾裂解液B液(40 mmol/L Tris-Cl),震荡20次,3 000r/min离心10min,取70 μl上清作为DNA模板,用于PCR鉴定,同时选取野生型C57BL/6小鼠基因组DNA作为阴性对照。反应条件:94℃预变性3 min;94℃变性30s,56℃退火30s,72℃延伸30s,35个循环,最后 72℃延伸10 min。PCR产物用1.5% 琼脂糖凝胶电泳检测。PTEN、control的扩增片段大小分别为446 bp、192 bp。
1.2.3 胚胎成纤维细胞的分离与培养取妊娠期12天的孕鼠为实验材料,颈椎脱臼法处死孕鼠,放于盛有75%酒精的烧杯中消毒,拿到超净工作台上解剖。取出子宫,置于装有PBS的培养皿中洗去表面血迹,随后取出胎鼠,在PBS中洗涤数次。去除头、尾、内脏和四肢,仅留躯干部(尾与四肢用于提取基因组DNA进行基因型鉴定),在PBS中充分漂洗,去除红细胞。在新的培养皿中加入少量PBS,放入躯干,用眼科剪刀剪成1mm3以下的组织块碎片。加入5ml 0.25%胰蛋白酶,培养箱中消化15min,消化结束后加入等体积的MEF Medium[10% 胎牛血清,双抗(青霉素/链霉素),2 mmol/L L-glutamine,1% NEAA]终止消化反应,轻轻吹打,使细胞分散。将收集的细胞悬液离心,1000r/min,4min,弃上清,加入红细胞裂解液(5倍体积的细胞体积),轻轻吹打1min,离心除上清。重悬细胞,过滤(200目筛网)并收集滤液,再次离心,去上清。用MEF Medium洗涤沉淀,离心除上清,重悬细胞,铺板。置于37℃ 5% CO2饱和湿度培养箱中培养。第二天换液,随后每2天换液一次。培养2~4d后,当MEF接近汇合,即可按1∶3的比例传代培养。
1.2.4 克隆形成实验取对数生长期的TG与WT MEF细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的DMEM培养液中备用。每组细胞均以每孔1000个细胞的浓度分别接种于含37℃预温培养液的12孔板中。轻轻转动,使细胞分散均匀。置37℃,5% CO2及饱和湿度的细胞培养箱中培养。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞15min。然后去固定液,加500μl的0.1%结晶紫染色液,静置20min,然后用流水缓慢洗去染色液,空气干燥。
1.2.5 Western blotting检测PTEN在转基因小鼠中的表达分别取转基因小鼠的胚胎成纤维细胞和成年转基因小鼠的大脑、心、肺、肝、脾肾组织,提取蛋白后用12% SDS-PAGE电泳分离,通过湿法电转将PAGE胶上的蛋白转至NC膜上,裁下含有PTEN与β-actin的NC膜,室温下封闭1h。加入相应的PTEN抗体(1∶1000)与β-actin抗体(1∶1000)于4℃条件下孵育过夜。回收一抗,用TBST洗膜3次,每次10 min,加入辣根过氧化物酶标记的二抗,室温孵育1h,TBST洗膜3次,每次10 min;ECL发光试剂A、B液等体积混合后加入到无残余TBST的膜上,反应约3 min,吸去发光试剂,于暗室中用X光片曝光,经显影和定量后观察结果。
1.2.6 统计学分析采用双尾T检验,比较PTEN转基因小鼠与野生型小鼠的体重差异。
2 结 果 2.1 PTEN转基因小鼠的制备及鉴定繁殖PTEN转基因小鼠模型的打靶载体采用pBACe3.6载体系统(图 1a),pBACe3.6载体系统能够保护插入的Pten基因片段不与小鼠基因组内的其他片段发生位置效应,并使插入的多拷贝基因在小鼠体内高表达。通过显微注射打靶,一共获得63只F0代小鼠,PCR 鉴定后得到5只转基因阳性首建鼠(图 1b)。对首建鼠分别单独建系,顺利维持下2个转基因系。对这两个转基因系生出的F1代小鼠进行统计后发现,F1代共出生小鼠58只,其中阳性小鼠30只,阳性率为51.7% (表 2)。说明PTEN转基因小鼠能正常传代繁殖。
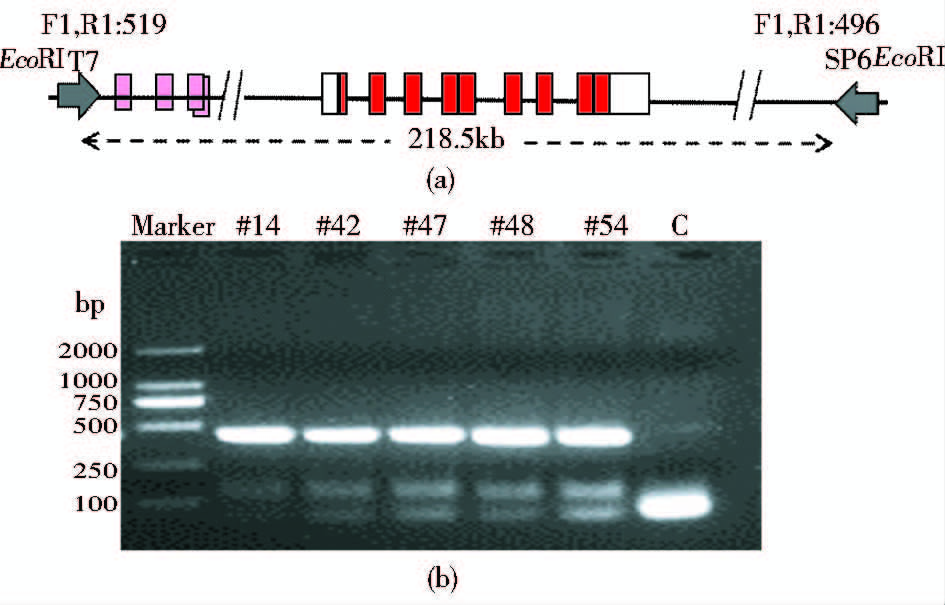
|
| 图 1 PTEN转基因小鼠的构建策略及鉴定 Fig. 1 Construction strategy and identification of PTEN transgenic mice (a) Design for BAC targeting carrier (b) Genotype identification of PTEN transgenic mice C: Blank control |
| 雄 | 雌 | 总量 | |
| F1代阳性小鼠数量(只) | 17 | 13 | 30 |
| F1代小鼠总量(只) | 31 | 27 | 58 |
| F1代小鼠阳性率 | 54.8% | 41.8% | 51.7% |
为检测转基因小鼠体内PTEN的表达水平,分别分离2个转基因系小鼠的胚胎成纤维细胞,通过Western blotting技术检测PTEN蛋白表达水平。结果显示,来源于PTEN转基因小鼠的MEF细胞中PTEN的蛋白水平显著高于野生型小鼠 (图 2a)。对转基因系小鼠的PTEN表达水平检测结果进行灰度扫描定量后,显示较高水平转基因系的PTEN蛋白水平约为野生型小鼠的3倍(图 2b)。同时,收集转基因成年小鼠及其同窝野生型小鼠的大脑、心、肺、肝、脾、肾组织,匀浆处理后裂解提取组织蛋白,通过Western blotting检测PTEN蛋白表达水平,结果如图 2c所示,在PTEN转基因成年小鼠的主要脏器中,PTEN蛋白水平都显著高于野生型小鼠。同时,将分离出的MEF细胞进行克隆形成实验,结果显示PTEN转基因小鼠的MEF细胞的克隆形成能力显著低于野生型小鼠的MEF细胞(图 2d)。

|
| 图 2 转基因小鼠PTEN蛋白表达水平 Fig. 2 Protein expression levels of PTEN transgenic mice (a) PTEN protein levels for transgenic mice and wild-type MEFs of two transgenic lines (b) Quantitatively analysis the expression of PTEN in Fig. 2a by gray scanning,the height of the columns relatively represents the multiples of transgenic mice’s PTEN levels compared with wild type mice (c) PTEN expression in adult transgenic mice tissues(high expression line) (d) The result for colony-formation assay of PTEN transgenic MEF (high expression line) and wile type MEF |
综上所述,通过细菌人工染色体(BAC)载体打靶的方式顺利获得了体内稳定过表达PTEN的转基因小鼠,同时分离得到了稳定过表达PTEN的转基因细胞系。
2.3 PTEN转基因小鼠体型小于野生型小鼠已有的研究表明,PTEN转基因小鼠在体型上显著小于野生型小鼠[16]。为在整体上验证PTEN转基因小鼠模型是否构建成功,在高表达PTEN蛋白的转基因系小鼠出生3周后,每周称量并记录PTEN转基因小鼠的体重并作体重增长曲线分析直至12周。统计显示,构建的PTEN转基因小鼠在体型上显著小于野生型小鼠(图 3)。
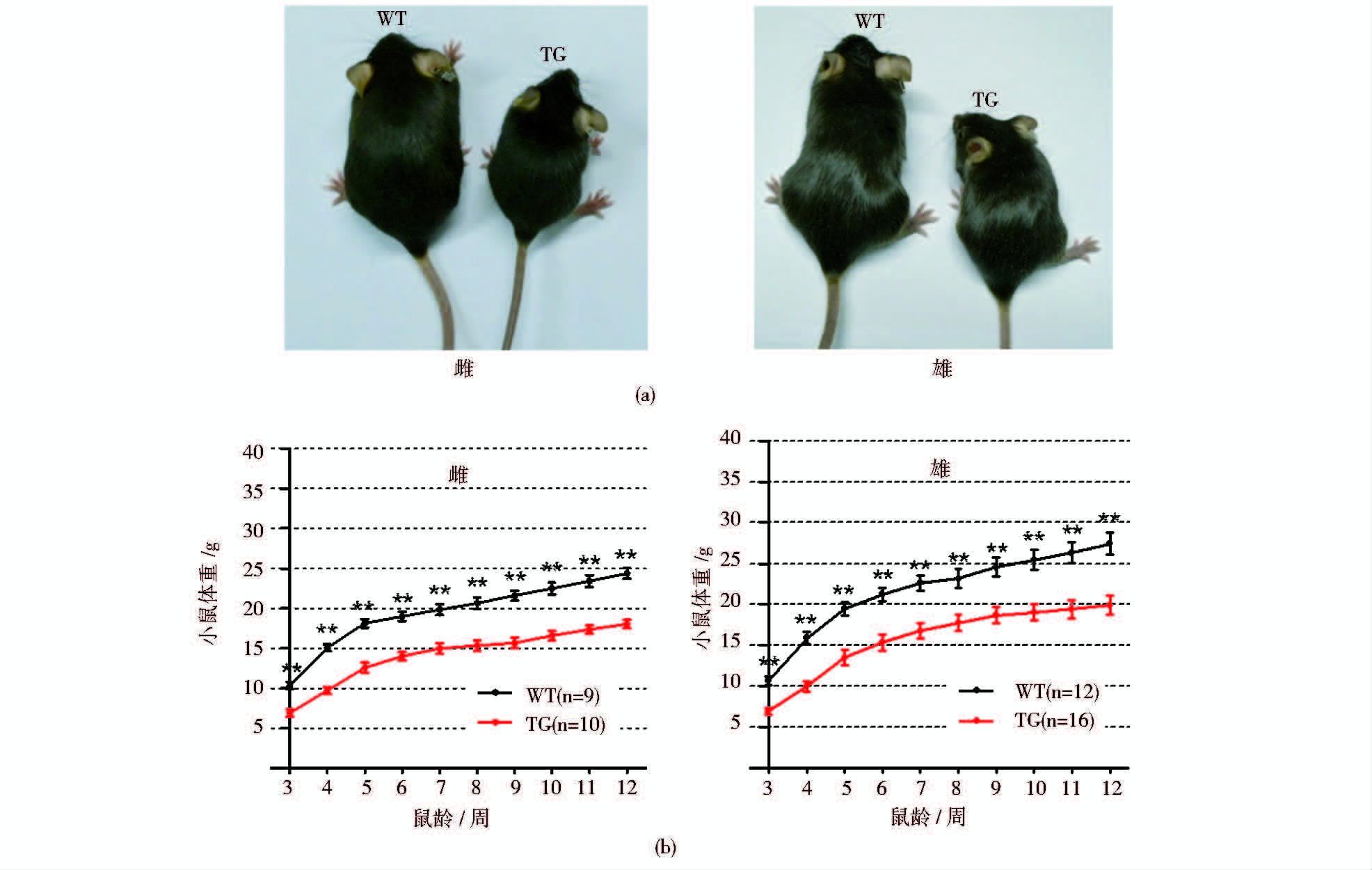
|
| 图 3 PTEN转基因小鼠的整体表型(高表达系) Fig. 3 The overall phenotype of PTEN transgenic mice (high expression line) (a) Body sizes of PTEN transgenic mice and wild type mice (6 weeks) (b) Growth curves for PTEN transgenic mice and wild type mice |
虽然统计发现PTEN转基因小鼠的体型显著小于野生型小鼠,然而,在组织水平上是否也出现同样的表型仍需进一步确证。将小鼠解剖观察后发现,PTEN转基因小鼠的主要组织器官均明显小于野生型小鼠。而对肺、肝和脾脏进行切片与HE染色,结果显示PTEN转基因小鼠与野生型小鼠的肺、肝和脾脏内的细胞大小并无明显差异,说明PTEN转基因小鼠组织器官变小的原因并不是细胞体积减小,而是器官内的细胞数量减少所致(图 4)。
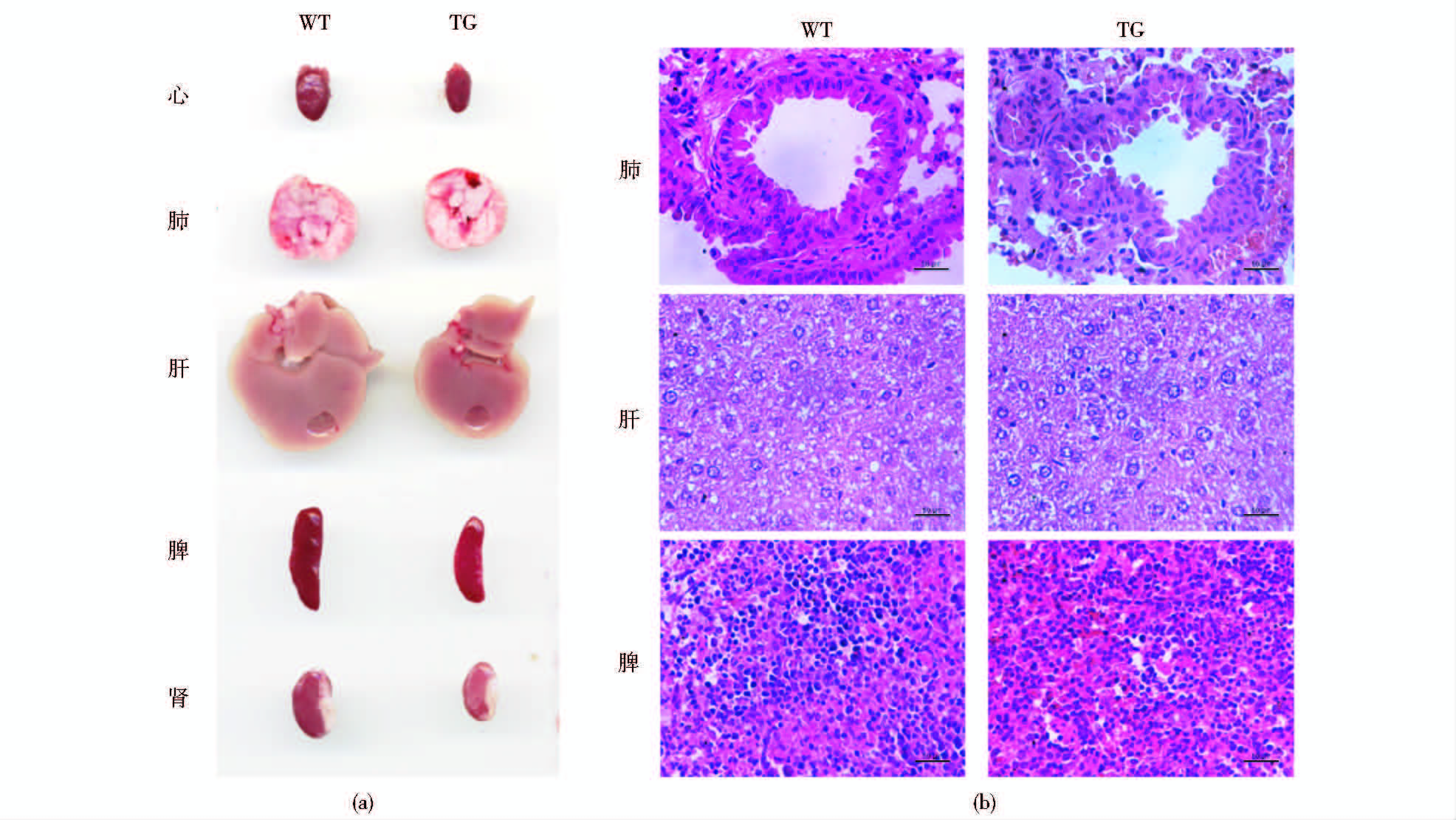
|
| 图 4 PTEN体内过表达后不改变组织器官的细胞大小 Fig. 4 PTEN over-expressing in vivo does not change the cell size in tissues and organs (a) The main organs of PTEN transgenic mice and wild type mice (b) The HE staining for lung,liver and spleen of PTEN transgenic mice and wild type mice |
对PTEN转基因小鼠的体型观察发现转基因小鼠全身性的组织与器官均小于野生型小鼠。研究显示PTEN在体内可参与代谢调节,通过增强线粒体的氧化磷酸化加速能量代谢[16]。因此,我们将同窝的PTEN转基因小鼠与野生型小鼠(9月龄)解剖后取出腹腔内的脂肪组织块,发现PTEN转基因小鼠腹腔的脂肪组织明显少于野生型小鼠。将脂肪取出称重,结果显示PTEN转基因小鼠的腹腔脂肪占体重的比例远低于野生型小鼠(图 5)。
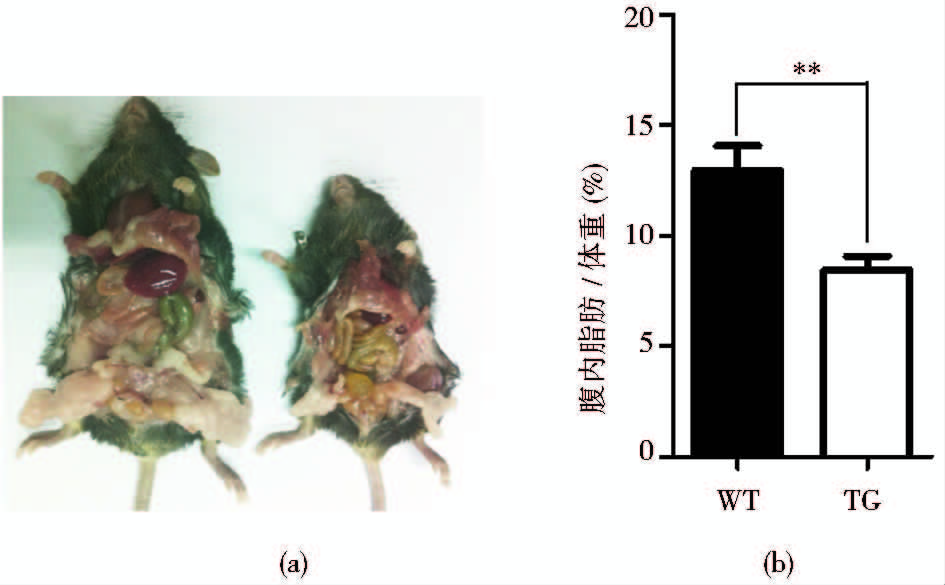
|
| 图 5 PTEN转基因小鼠的腹腔脂肪含量低于野生型小鼠(高表达系) Fig. 5 The abdominal fat content of PTEN transgenic mice is lower than that of wild type mice (high expression line) (a) Representative image of abdominal fat of PTEN transgenic mice and wile type mice (9 months) (b) Percentage of abdominal fat in PTEN transgenic mice and wile type mice (WT,n = 3; TG,n = 3) |
Pandolfi 实验室对PTEN转基因小鼠的研究是国际上第一次将PTEN在哺乳动物体内过表达后的研究。这一研究将PTEN的研究领域拓展到了代谢调节,PTEN转基因小鼠在体型上虽然比野生型小鼠小,但却表现出更健康的代谢状态,包括细胞内葡萄糖与谷氨酰胺减少,体内氧化磷酸化的能量代谢流增强,对致癌性转化的抵抗能力增强等[16]。PTEN转基因小鼠体型小于野生型小鼠的原因可能在于转基因小鼠体内的高水平PTEN抑制了PI3K-Akt通路,从而下调细胞内c-Myc的水平[16]。虽然在果蝇中dmyc基因(c-Myc的同源基因)同时调控组织中细胞的大小与数量[17],但现有的研究发现在哺乳动物的组织中却主要调控细胞的数量,对细胞的大小并不产生影响[18]。因此,PTEN转基因小鼠体内低水平的c-Myc使小鼠各器官中的细胞数量少于正常的野生型小鼠,但细胞的大小却不变[16]。PTEN转基因小鼠在代谢上的变化主要有三方面的原因,其一是高水平的PTEN通过抑制PI3K-Akt通路促进了PGC-1α的合成,进而促进了细胞内的线粒体合成及氧化磷酸化反应;其二是PTEN表达水平上升后通过APC/Cdh1复合物降解能够促进谷氨酰胺代谢的关键酶GLS以及能够促进糖酵解的关键调节因子PFKFB3;其三是高水平的PTEN通过抑制PI3K-Akt通路下调能够增强糖酵解支路的关键酶PKM2[16]。由于肿瘤细胞需要改变细胞的代谢状态以适应其快速的增殖[19, 20, 21],而PTEN水平上升后在多方面抑制了细胞的糖酵解和谷氨酰胺代谢,因此,PTEN在体内过表达后,通过调节细胞的能量代谢途径使小鼠处于抑癌能力增强的更健康的状态[16]。本PTEN转基因小鼠与国外的PTEN转基因小鼠在制备策略上是一致的。在小鼠表型上也与报道的相似。
PTEN对癌症的抑制作用具有明显的剂量效应,生物体内PTEN蛋白水平的微量的丢失就对肿瘤的发生与发展有重要影响[22, 23, 24]。相应的,PTEN的生理功能在转基因小鼠上也同样表现出剂量效应,随着PTEN过表达水平的升高而增强。PTEN虽然一直是癌症领域研究的热点,但是用于研究、验证其生理功能的动物模型却不多,很多研究专注于分子与细胞水平上的功能,缺少生理条件下动物整体水平的研究。本研究构建的PTEN转基因小鼠不仅为探究PTEN新的生理功能打下了基础,也为PTEN在非生理条件下的机制研究提供了后期验证的便利。
利用细菌人工染色体系统构建的PTEN转基因小鼠模型不仅能够在整体上用于细胞与分子研究后功能的验证,还能在小鼠生长发育的各个时期分离体细胞用于PTEN的细胞功能研究(Western实验证明转基因小鼠中PTEN在胚胎时期已经有很好的高表达)。由于转基因小鼠模型还可以通过Western 检测目标分子在小鼠体内的表达水平,因此,不同表达水平的转基因小鼠分离出的内源细胞是一系列天然生理条件下的内源过表达细胞系。综上所述,本研究所构建的PTEN转基因小鼠是一个验证与研究PTEN生理功能的很好的动物模型。
| [1] | Maehama T, Dixon J E. The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate. J Biol Chem, 1998, 273(22):13375-13378. |
| [2] | Hamada K, Sasaki T, Koni P A, et al. The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis. Genes Dev,2005,19(17): 2054-2065. |
| [3] | Hartmann W, Digon-Sntgerath B, Koch A, et al. Phosphatidylinositol 3-kinase/AKT signaling is activated in medulloblastoma cell prolifer action and is associated with reduced expression of PTEN. Clin Cancer Res,2006,12(10):3019-3027. |
| [4] | Shen Y H, Zhang L, Gan Y, et al. Up-regulation of PTEN (phosphatase and tensin homolog deleted on chromosome ten) mediates p38 MAPK stress signal-induced inhibition of insulin signaling. A cross-talk between stress signaling and insulin signaling in resistin-treated human endothelial cells. J Biol Chem, 2006, 24; 281(12):7727-7736. |
| [5] | Cairns P, Okami K, Halachmi S, et al. Frequent inactivation of PTEN/MMAC1 in primary prostate cancer. Cancer Res,1997,57(22):4997-5000. |
| [6] | Feilotter H E, Nagai M A, Boag A H, et al. Analysis of PTEN and the 10q23 region in primary prostate carcinomas. Oncogene,1998,16(13):1743-1748. |
| [7] | Li J, Yen C, Liaw D, et al. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science,1997,275(5308):1943-1947. |
| [8] | Risinger J I, Hayes A K, Berchuck A, et al. PTEN/MMAC1 mutations in endometrial cancers. Cancer Res,1997,57(21):4736-4738. |
| [9] | Steck PA, Pershouse M A, Jasser S A, et al. Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers. Nat Genet,1997,15(4):356-362. |
| [10] | Yamada K M, Araki M. Tumor suppressor PTEN: Modulator of cell signaling, growth, migration and apoptosis. J Cell Sci,2001,114(Pt13):2375-2382. |
| [11] | Liaw D, Marsh D J, Li J, et al. Germline mutations of the PTEN gene in Cowden disease, an inherited breast and thyroid cancer syndrome.Nat Genet,1997,16(1):64-67. |
| [12] | Marsh D J, Dahia P L, Zheng Z, et al. Germline mutations in PTEN are present in Bannayan-Zonana syndrome. Nat Genet,1997,16(4):333-334. |
| [13] | Di Cristofano A, Pesce B, Cordon-Cardo C, et al. Pten is essential for embryonic development and tumour suppression. Nat Genet,1998,19(4):348-355. |
| [14] | Suzuki A, Pompa J L, Stambolic V, et al. High cancer susceptibility and embryonic lethality associated with mutation of the PTEN tumor suppressor gene in mice. Curr. Biol,1998,8(21):1169-1178. |
| [15] | Podsypanina K I, Ellenson L H, Nemes A, et al. Mutation of Pten/Mmac1 in mice causes neoplasia in multiple organ systems. Proc Natl Acad Sci USA,1999,96(4):1563-1568. |
| [16] | Garcia-Cao I, Song M S, Hobbs R M, et al. Systemic elevation of PTEN induces a tumor-suppressive metabolic state.Cell,2012,149(1):49-62. |
| [17] | Johnston L A, Prober D A, Edgar B A, et al. Drosophila myc regulates cellular growth during development.Cell,1999,98(6):779-790. |
| [18] | Trumpp A, Refaeli Y, Oskarsson T, et al. c-Myc regulates mammalian body size by controlling cell number but not cell size.Nature,2001,414(6865):768-773. |
| [19] | Deberardinis R J, Lum J J, Thompson C B. Phosphatidylinositol 3-kinase-dependent modulation of carnitine palmitoyltransferase 1A expression regulates lipid metabolism during hematopoietic cell growth.J Biol Chem,2006,281(49):37372-37380. |
| [20] | King A, Gottlieb E. Glucose metabolism and programmed cell death: an evolutionary and mechanistic perspective. Curr Opin Cell Biol, 2009,21(6):885-893. |
| [21] | Tennant D A, Duran R V, Boulahbel H, et al. Metabolic transformation in cancer. Carcinogenesis,2009,30(8):1269-1280. |
| [22] | Alimonti A, Carracedo A, Clohessy J G, et al. Subtle variations in Pten dose determine cancer susceptibility.Nat Genet,2010,42(5):454-458. |
| [23] | Carracedo A, Alimonti A, Pandolfi P P. PTEN level in tumor suppression: how much is too little.Cancer Res,2011,71(3):629-633. |
| [24] | Trotman L C, Niki M, Dotan Z A, et al. Pten dose dictates cancer progression in the prostate.PLoS Biol,2003,1(3):385-396. |
 2015, Vol. 35
2015, Vol. 35




