文章信息
- 黄健,黄美容,朱杰华,骆诗露,闵迅
- HUANG Jian,HUANG Mei-rong,ZHU Jie-hua,LUO Shi-lu,MIN Xun
- 肺炎链球菌SP0306蛋白的表达纯化及结晶研究
- Expression,Purification,Crystallization of SP0306 Protein from Streptococcus pneumoniae
- 中国生物工程杂志,2015,35(6): 21-25
- China Biotechnology,2015,35(6): 21-25
- http://dx.doi.org/10.13523/j.cb.20150604
-
文章历史
- 收稿日期:2015-03-05
- 修回日期:2015-03-18
2. 遵义医学院附属医院输血科 遵义 563003
2. Affiliated Hospital of Zunyi Medical College,Department of Blood Transfusion,Zunyi 563003,China
肺炎链球菌(Streptococcus pneumoniae,S.pn)是引起细菌性肺炎、中耳炎、脑膜炎等疾病的一种常见致病菌。其在婴幼儿及老年人中具有较高的发病率与死亡率,全世界每年约有160万人死于与S.pn感染相关的疾病[1]。毒力因子在肺炎链球菌致病过程中扮演着较为重要的作用,其重要的毒力因子包括荚膜多糖和许多毒力蛋白,如肺炎链球菌表面蛋白PspA、PspC,PavA等在肺炎链球菌粘附、侵袭等致病环节中发挥着重要作用[2]。针对不同感染进程的需要,肺炎链球菌会调控许多毒力基因的表达,以利于其建立感染及适应宿主局部微环境。其中,转录因子在毒力基因表达调控过程中起着非常重要的作用[3]。因此,研究肺炎链球菌毒力基因的转录调控机制,对于预防与控制肺炎链球菌感染有重要意义。SP0306蛋白是肺炎链球菌中的一种功能未知的转录因子,为研究其生物学功能,本研究拟对SP0306蛋白进行原核表达、纯化及晶体生长,并对挑选其蛋白晶体进行X射线衍射,为最终解析出蛋白三维结构及下一步的功能研究奠定了基础。
1 材料与方法 1.1 菌株与质粒肺炎链球菌TIGR4菌株、大肠杆菌DH5α菌株、BL21(DE3)菌株、PET28a质粒均为本室保存。
1.2 试 剂细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;Primer star 高保真DNA聚合酶,限制性内切酶BamH I、Xho I,T4 DNA连接酶购自大连宝生物工程有限公司;His Bind Column (Ni-NTA) 树脂、DEAE阴离子交换柱购自美国GE公司;蛋白晶体筛选试剂盒Crystal Screen Kit I & II及PEG screen I & II购自美国Hampton Research公司。
1.3 生物信息学分析本研究采用NCBI保守结构域在线分析软件(Conserved Domain Search Service),分析SP0306蛋白结构域以预测其可能的生物学功能。
1.4 SP0306蛋白原核表达载体构建以肺炎链球菌TIGR4菌株基因组DNA为模板,以上游引物:5′-CGCGGATCCGTGTTAAACATTAAAGAG-3′(下划线为BamH I酶切位点),下游引物:5′-CCGCTCGAGTTATTTTATCTTCTCAAAT-3′(下划线为Xho I酶切位点)扩增sp0306基因。扩增产物和PET28a质粒经BamH I,Xho I双酶切后再连接构建PET28a-sp0306重组表达质粒,转化入大肠杆菌DH5α菌株,在含卡那霉素(50 mg/L)的LB平板上筛选阳性克隆,提取质粒行双酶切鉴定后,送南京金斯瑞生物科技有限公司进行测序鉴定。
1.5 SP0306蛋白表达及纯化将鉴定正确的PET28a-sp0306表达质粒转入大肠杆菌BL21(DE3)表达菌中,接种于LB培养液(含50 mg/L卡那霉素)中,37℃培养至光密度A600=0.5~0.6时,加入0.2 mmol/L的IPTG,20℃诱导9h,12 000×g离心10min收集菌体,超声破菌后SDS-PAGE鉴定蛋白表达形式。破菌液经12 000×g离心10min收集上清液,用His Bind Column(Ni-NTA)对蛋白进行亲和层析纯化,并进一步利用DEAE阴离子交换柱对蛋白进行纯化,再行SDS-PAGE电泳鉴定蛋白纯度,纯化的蛋白经脱盐、超滤浓缩后分装,-80℃保存备用。
1.6 SP0306蛋白的晶体生长及X衍射数据收集以5mmol/L Tris-HCl缓冲液(含50mmol/L NaCl,pH 8.0)稀释蛋白浓度为20mg/ml,用Crystal screen Ⅰ和Ⅱ、PEGⅠ和Ⅱ试剂盒以悬滴气相扩散法行晶体初筛,池液200μl,将1μl母液与1μl SP0306蛋白混合后加样于硅化处理的玻片上,用凡士林封板,在20℃恒温条件下进行晶体生长。蛋白结晶形成后,挑选晶体送至上海同步辐射光源中心,进行X射线衍射并收集衍射数据。
2 结 果 2.1 生物信息学分析保守结构域分析显示该蛋白拥有2个磷酸转移酶系统(phosphotransferase system,PTS)结构域和2个PTS调控结构域(PTS regulation domain,PRD)。
2.2 目的基因的扩增及表达载体构建挑选阳性克隆经菌液PCR鉴定正确后,提取重组质粒经双酶切鉴定,能够获得1 970bp大小的酶切产物(图 1),经测序鉴定插入序列与GenBank中肺炎链球菌TIGR4菌株的sp0306基因序列完全相同 (图 2)。
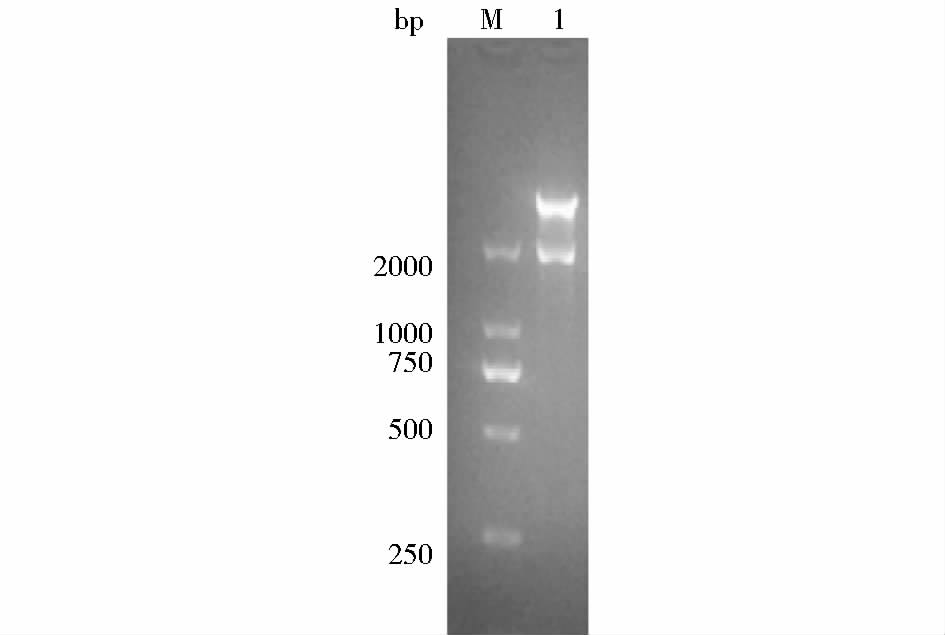
|
| 图 1 PET28a-sp0306重组表达质粒双酶切鉴定 Fig. 1 Identification of the recombinant plasmid PET28a-sp0306 M:Marker; 1: Recombinant plasmid PET28a-sp0306 digested by BamHⅠand XhoⅠ |

|
| 图 2 PET28a-sp0306原核表达质粒测序图 Fig. 2 DNA Sequencing for the expression plasmid of PET28a-sp0306 |
含PET28a-sp0306重组表达质粒的大肠杆菌BL21(DE3)表达菌,经IPTG诱导后破菌分析,可见主要以可溶形式表达SP0306重组蛋白,分子量约为76kDa,与预期结果相符,经Ni-NTA亲和纯化后,获得了纯度较高的目的蛋白(图 3)。

|
| 图 3 重组蛋白SP0306的SDS-PAGE电泳图 Fig. 3 SDS-PAGE analysis of SP0306 recombined protein M:Maker;1:Whole cell lysates of E.coli BL21-PET28a-sp0306 induced by IPTG;2:Supernatant of E.coli BL21-PET28a-sp0306 after ultrasonication;3:Sediment of E.coli BL21-PET28a-sp0306 after ultrasonication;4:Flow through from Ni-NTA column;5:Elution fraction using imidazole 20mmol/L;6:Elution fraction using imidazole 50mmol/L;7:Elution fraction using imidazole 300mmol/L |
以DEAE离子交换层析进一步对SP0306蛋白进行纯化,从层析图谱上可见一个低洗脱峰(图 4a),收集该洗脱峰处的蛋白行SDS-PAGE分析,SP0306蛋白纯度达到了预期要求(图 4b),可用于后续晶体生长。

|
| 图 4 阴离子交换层析图及SP0306蛋白SDS-PAGE电泳图 Fig. 4 DEAE chromatography purification for SP0306 protein (a) DEAE Chromatography picture of SP0306 recombined protein (b)SDS-PAGE analysis of SP0306 recombined protein after DEAE Chromatography M:Marker;1~8:Purified SP0306 protein eluted with NaCl of different concentration |
SP0306蛋白在20℃条件下生长后,在多种条件中出现了大小不一的方形晶体,其中在0.1mol/L MES pH6.5,20%PEG3350条件下获得了质量较好的长棒状晶体,挑取晶体行SDS-PAGE电泳,结果显示其分子量大小与SP0306蛋白相符,提示生长的晶体为SP0306蛋白结晶而成(图 5)。筛选合格SP0306蛋白晶体行X射线衍射实验,晶体衍射能力达到了3.5Å(图 6)。

|
| 图 5 SP0306蛋白晶体及SDS-PAGE分析 Fig. 5 Crystal picture and SDS-PAGE anlysis of SP0306 crystal (a)Crystal picture of SP0306 protein (b)SDS-PAGE anlysis of SP0306 crystal M:Protein molecular weight marker;1:Crystals of SP0306 |

|
| 图 6 SP0306 蛋白晶体X射线衍射图 Fig. 6 The X-ray diffractogram of SP0306 protein crystal |
在许多细菌生长和致病过程中,自身会激活许多转录因子,以调控下游基因的表达,从而利于细菌适应宿主局部微环境及致病过程。如霍乱弧菌可通过转录因子ToxR和ToxT调控部分毒力基因的高表达以对宿主建立感染[4]。在肺炎链球菌中,转录因子SP0927 敲除后能够显著减弱肺炎链球菌毒力,主要是由于sp0927基因敲除后会下调许多毒力因子的表达[3]。此外,肺炎链球菌在感染过程中会根据感染部位局部微环境的需要,通过转录因子的调控使细菌呈现透明型和不透明型细菌形态的转换,其中透明型菌株表达更多的磷壁酸、胆碱结合蛋白A、lytA,而荚膜多糖、pspA表达量减少,从而让细菌更容易在鼻咽部位定植;但当细菌侵袭进入宿主体内后,细菌形态则会转变为荚膜多糖表达量多的不透明型菌株,其具有更强的抗吞噬能力,因而在系统感染中表现出更强的毒力[5, 6]。由此可见,转录因子在肺炎链球菌感染致病过程中发挥着重要作用。但目前许多转录因子在肺炎链球菌生长、致病过程中的具体调控机制尚不明了,其中主要的原因可能是转录因子表达时间短,表达水平较低,给研究带来了一定的困难。
本文所研究的肺炎链球菌sp0306基因是一种假想的转录因子,其编码产物SPD0306蛋白由657个氨基酸组成,生物信息学分析显示该蛋白拥有2个保守的PTS结构域和2个PRD结构域。该家族蛋白主要调控细菌碳水化合物代谢相关基因的表达,如大肠杆菌BglG蛋白和精细芽孢杆菌LicT蛋白,它们调控糖转运和代谢相关基因的表达,在细菌生长、致病过程中发挥着重要作用[7, 8]。虽然BglG蛋白与LicT蛋白间序列和功能相似,但转录调控的方式确有明显差别。BglG必须通过PRD2结构域去磷酸化才能形成有活性的二聚体,而LicT发挥功能则需要PRD1结构域去磷酸化而PRD2结构域磷酸化[9]。目前,关于SP0306蛋白的具体转录调控机制尚不清楚。由于蛋白质的三维结构分析有助于预测蛋白的功能,因此,本研究拟对SP0306蛋白进行原核表达、纯化及晶体生长,以便解析出其三维结构。通过原核表达系统,获得了表达量较大的SP0306蛋白。但在纯化过程中发现该蛋白极不稳定,很容易沉淀。通过系列条件摸索,发现将缓冲液的pH提高至8.0后,SP0306蛋白的稳定性会得到显著提高。通过Ni柱亲和纯化以及DEAE纯化后,得到了纯度较高的目的蛋白用于晶体培养,并成功培养出来质量较好的蛋白晶体。X射线衍射数据显示SP0306蛋白晶体衍射能力达到3.5Å,但由于该序列结构同源性极低,无法通过分子置换获得相位来建立结构模型,因此,我们拟下一步进行SP0306蛋白硒代晶体的培养,以最终解析出其蛋白三维结构。
| [1] | Isaacman D J, McIntosh E D, Reinert R R. Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines.Int J Infect Dis, 2010, 14(3): e197-209. |
| [2] | Kadioglu A,Weiser J N,Paton J C,et al.The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease. Nat Rev Microbiol 2008, 6 (4):288-301. |
| [3] | Mahdi L K,Ebrahimie E,Adelson D L,et al.A transcription factor contributes to pathogenesis and virulence in Streptococcus pneumoniae.PLoS One,2013, 8(8):e70862. |
| [4] | Abuaita B H, Withey J H.Termination of Vibrio cholerae virulence gene expression is mediated by proteolysis of the major virulence activator, ToxT. Mol Microbiol. 2011,81(6):1640-1653. |
| [5] | Kim J O, Weiser J N.Association of intrastrain phase variation in quantity of capsular polysaccharide and teichoic acid with the virulence of Streptococcus pneumoniae.J Infect Dis,1998,177(2):368-377. |
| [6] | Ogunniyi A D,Giammarinaro P,Paton J C.The genes encoding virulence-associated proteins and the capsule of Streptococcus pneumoniae are upregulated and differentially expressed in vivo.Microbiology,2002,148(Pt 7):2045-2053. |
| [7] | Rothe F M,Bahr T,Stülke J,et al.Activation of Escherichia coli antiterminator BglG requires its phosphorylation.Proc Natl Acad Sci U S A,2012,109(39):15906-15911. |
| [8] | Rothe F M,Wrede C,Lehnik-Habrink M,et al.Dynamic localization of a transcription factor in Bacillus subtilis: the LicT antiterminator relocalizes in response to inducer availability.J Bacteriol,2013,195(10):2146-2154. |
| [9] | Ben-Zeev E,Fux L,Amster-Choder O,et al.Experimental and computational characterization of the dimerization of the PTS-regulation domains of BglG from Escherichia coli. J Mol Biol,2005,347(4):693-706. |
 2015,Vol. 35
2015,Vol. 35




