文章信息
- 罗婉月, 李天明, 于莹, 许湄雪, 仪宏
- LUO Wan-yue, LI Tian-ming, YU Ying, XU Mei-xue, YI Hong
- Ketogulonigenium vulgare四环素诱导表达穿梭质粒的构建
- Construction of an Inducible Expression Shuttle Vector for Ketogulonigenium vulgare Allowing Tightly Regulable Gene Expression
- 中国生物工程杂志, 2015, 35(5): 81-86
- China Biotechnology, 2015, 35(5): 81-86
- http://dx.doi.org/10.13523/j.cb.20150512
-
文章历史
- 收稿日期:2015-01-16
- 修回日期:2015-03-03
生酮古龙酸杆菌(Ketogulonigenium vulgare,简称X菌)是两步发酵法生产维生素C过程中的关键菌株,在与其伴生菌芽孢杆菌共培养条件下,可将L-山梨糖转化为Vc前体2-酮基-L-古龙酸(2-Keto-L-gulonic acid,2-KGA)[1],是一类重要的工业菌,对其进行菌种改造,获得可产业化显示的遗传资源具有重要意义。2011年Ketogulonicigenium vulgare Y25[2]和Ketogulonicigenium vulgare WSH-001[3]的基因组相继测序完成,为进行该菌的系统生物学的研究提供了可能。但是由于其遗传背景资料相对缺乏、广泛的抗性谱、不能独立生长等因素,给遗传操作带来很大的难度。且国内外有关Ketogulonigenium vulgare的遗传操作体系以及对其基因组DNA进行修饰改造的技术手段等方面的研究,国内外不多,遗传操作工具的高效性仍是目前Ketogulonigenium vulgare菌外源基因表达及其改造的一个制约因素。
四环素(tet)诱导表达系统是在大肠杆菌Tn10转座子中特异的tet抗性操纵子的基础上建立起来的一种诱导基因表达的调控系统,阻遏蛋白TetR调节四环素家族抗性基因的表达[4]。其调控原理为:tetA编码四环素的泵出蛋白,在四环素不存在的情况下TetR与操纵子TetO紧密结合,并且抑制tetA的转录。四环素能够通过细胞膜进行扩散,使这些诱导物能够进入大多数细菌细胞进行调控。一旦四环素进入细胞与TetR结合,就会诱导构象发生改变,结果导致TetR从操纵子TetO上分离下来,从而诱导受TetO调控的基因表达。有效的四环素诱导表达系统在革兰氏阳性菌、革兰氏阴性菌中的应用已经比较成熟,并且在小鼠转染中能够调节细胞基因表达[5, 6, 7, 8, 9, 10, 11]。
本研究为了探讨四环素诱导表达系统在Ketogulonigenium vulgar中应用的可行性,采用重叠延伸PCR技术合成了阻遏蛋白的编码基因tetr和插入了操纵基因teto的Ketogulonigenium vulgare菌山梨酮脱氢酶启动子psndh的基因序列,借助宽宿主质粒pBBR1MCS-5,构建了四环素诱导表达的穿梭质粒,转化至X菌中,添加诱导剂四环素后,使四环素能够与穿梭质粒表达的阻遏蛋白TetR结合,释放出操纵子TetO,从而使启动子psndh表达卡那霉素抗性基因,实现了四环素诱导表达系统在X菌种应用。为进一步丰富和完善X菌遗传操作系统,为快速、高效、方便、稳定地进行基因的修饰改造奠定基础。 1 材料与方法 1.1 材 料 1.1.1 菌种与质粒
所用菌株、质粒分别如表 1所示。
| Strains and plasmid | Descriptions | Source |
| E.coli DH5α | F-φ80 lac ZΔM15 Δ(lacZYA-arg F) U169 endA1 recA1 hsdR17(rk-,mk+) supE44λ- thi -1 gyrA96 relA1 phoA | TransGen Biotech |
| Ketogulonigenium vulgare | Wild strain | Stored in lab. |
| pBBR1MCS-5 | Gmr broad host vector | Stored in lab. |
| pEASY-T1 | Cloning vector with multiple cloning sites; Ampr,Kmr | TransGen Biotech |
| pEASY-Psndhteto | pEASY-T1 derivative,Ampr,Kmr,teto1 | This study |
| pEASY-tetr | pEASY-T1 derivative,Ampr,Kmr,teto1 | This study |
| pBBR1MCS-5-pgen-tet | pBBR1MCS-5 derivative,GMr,pgen-tet | This study |
| pBBR1MCS-5-pgen-tetr-psndhteto-kan | pBBR1MCS-5 derivative,GMr,pgen-tetr-psndhteto-kan | This study |
PCR所用High-Fidelity DNA 聚合酶、pEASY-T1克隆载体购自北京全式金生物技术有限公司;限制性内切酶、T4 连接酶均购自大连宝生物工程公司(TaKaRa);PCR 引物由上海英骏生物技术有限公司合成;DNA 回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;其他试剂均为国产分析纯,购自生工生物(上海)股份有限公司。 1.1.3 仪器与设备
Eppendorf Mastercycler gradient PCR 扩增仪,Bio-Rad Molecular Imager Gel DOC XR 全自动凝胶成像系统,Eppendorf Mini Spin 台式高速离心机,Thermo Sorvall Evolution RC 高速冷冻离心机,Bioteke Powerwave 酶标仪。 1.1.4 培养基LB培养基:1% 蛋白胨,0.5% 酵母提取物,1% 氯化钠,pH 7.0,121 ℃灭菌20 min。 1.2 方 法 1.2.1 寡核苷酸片段的设计与合成
根据tetr基因的核苷酸序列(GenBank Accession No.J01830.1),利用DNAWORKS在线软件将全长为624 bp的tetr基因分为22条相互重叠20 bp的寡核苷酸片段,并由上海英骏生物技术有限公司合成,合成片段经脱盐,PAGE纯化后备用。同样按照此方法设计出大小为325bp的psndhteto基因的寡核苷酸片段。 1.2.2 全基因序列的人工合成
基因片段由寡核苷酸组装,将已设计的相互重叠引物等比例混合,引物之间两两搭桥,且作为模板进行PCR,PCR反应程序为:95℃变性5 min;95℃30 s,55℃退火30 s,72℃1 min,30个循环;72℃延伸10 min。获得弥散条带。以上面扩增出的弥散条带为模板,分别以首尾引物进行PCR扩增出单一明亮目的片段。 1.2.3 人工合成基因的克隆
将第二轮PCR产物纯化后,与载体pEASY-T1连接,转化到E.coli DH5α感受态细胞中,涂布含有50μg/ml卡那霉素、IPTG和X-Gal的LB培养基平板上,37℃过夜培养,经PCR验证后,分别获得克隆载体pEASY-tetr和pEASY-psndhteto,并进行DNA序列测序。 1.2.4 重组质粒的构建及X菌的转化
分别以pBBR1MCS-5和pEASY-tetr为模版,扩增出pgen和tetr的基因片段,利用Overlapping PCR技术搭接融合得到pgen-tetr片段,经BamH I和EcoR I双酶酶切,与同酶酶切后的pBBR1MCS-5空质粒连接,得到表达载体pBBR1MCS5-pgen-tetr;分别以pEASY-psndhteto和pEASY-T1为模板,扩增出psndhteto和kan的基因片段,两条片段搭接后,经EcoRV和HindIII双酶切,与同酶酶切后的pBBR1MCS5-pgen-tetr质粒连接,得到表达质粒pBBR1MCS5-pgen-tetr-psndhteto-kan。
将验证正确的重组质粒pBBR1MCS5-pgen-tetr- psndhteto-kan通过电转化方法分别转入到野生型X菌感受态细胞中,用含有庆大霉素的固体培养基培养48~72 h后长出转化子,经过菌落PCR验证,筛选出含有重组质粒pBBR1MCS5-pgen-tetr-psndhteto-kan的重组菌株XTET。 1.2.5 重组菌株的生长验证及四环素诱导浓度的优化
将验证正确的重组菌株XTET接种于培养瓶中做种子培养,24h后收集菌体,分ABC三组接种于含有庆大霉素的培养基中,摇瓶培养2h后,A组加终浓度为220μg/ml的卡那霉素;B组加入0.4μg/ml的四环素;C组加入终浓度为0.4μg/ml的四环素及终浓度为220μg/ml的卡那霉素,而后通过测定OD值定期记录菌体生长情况。
为探究不同四环素诱导浓度对菌体生长的影响,将重组菌株XTET接种于培养瓶中做种子培养,24h后收集菌体,接种于含有庆大霉素的培养基中,摇瓶培养2h后,在各瓶中加入四环素进行诱导,使其终浓度分别为0、0.2、0.4、0.6、0.8、1.0μg/ml,同时各组均加入终浓度为220μg/ml的卡那霉素,而后定期记录菌体生长情况。 2 结果与分析 2.1 psndhteto、tetr基因的寡核苷酸片段的设计
在GenBank上检索到X菌的山梨糖脱氢酶基因启动子psndh序列,利用Berkeley Drosophila Genome Project在线软件,分析出启动子psndh的-35区与-10区,根据文献报道[12],将操纵子基因teto置换了启动子psndh的-35区与-10区前一小段序列,形成了psndhteto基因,如图 1所示。而后psndhteto基因与tetr基因按照1.2.1 方法设计出寡核苷酸片段。
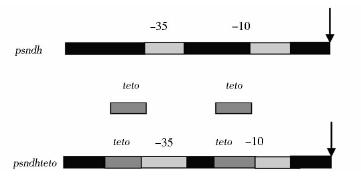
|
| 图 1 psndhteto基因的组成图示 Fig. 1 Composition of the psndhteto gene |
目的基因的合成过程如图 2所示,首先将寡核苷酸组装,通过引物两两搭桥,利用重叠PCR扩增出psndhteto基因与tetr基因的弥散条带,如图 3所示,再分别以此弥散条带为模版,利用首尾引物进行第二轮PCR,获得单一明亮的目的片段,与理论值相一致,如图 4所示。将得到的单一PCR片段经纯化后,分别与质粒pEASY-T1进行连接,获得克隆载体并进行测序分析,结果表明,所合成的基因片段序列与预期设计相一致。
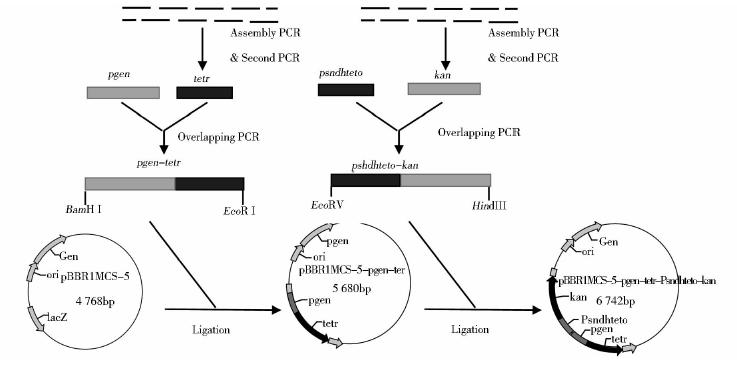
|
| 图 2 全基因的合成与表达载体的构建示意图Fig. 2 Flowchart of the gene synthesis and the expression vector construction |
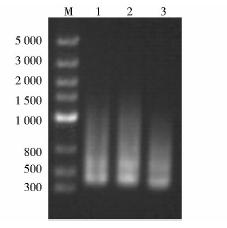
|
| 图 3 PCR弥散条带Fig. 3 PCR diffuse bands M:DNA 2k marker;1:tetr;2:psndhteto |
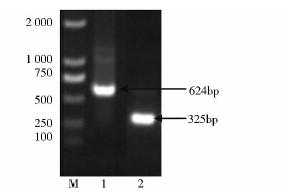
|
| 图 4 PCR扩增合成目的基因Fig. 4 PCR amplification of synthetic target band M:DNA 2k marker;1:tetr;2-3:psndhteto |
表达载体pBBR1MCS5- pgen-tetr-psndhteto-kan的构建过程如图 2 所示:分别以pBBR1MCS-5和测序正确的pEASY-tetr为模版,扩增出启动子pgen基因与tetr基因,经过Overlapping PCR搭接成pgen-tetr片段,与pBBR1MCS-5空质粒连接,构建质粒pBBR1MCS-5-pgen-tetr。如图 5(a)所示,酶切后质粒大小为4 768bp,片段大小为912bp,与理论值相一致,可以证明质粒pBBR1MCS-5-pgen-tetr构建成功。分别以测序正确的pEASY-psndhteto和pEASY-T1为模版,扩增出psndhteto基因与卡那霉素抗性基因kan,经过Overlapping PCR搭接成psndhteto-kan片段,与质粒pBBR1MCS-5-pgen-tetr相连,构建成重组质粒pBBR1MCS-5-pgen-tetr-psndhteto -kan,如图 5(b)所示,酶切后质粒大小为5 680bp,片段大小为1 062bp,与理论值相一致,可以证明重组质粒构建成功。

|
| 图 5 重组质粒的双酶切验证Fig. 5 Recombinant plasmid of double enzyme validation |
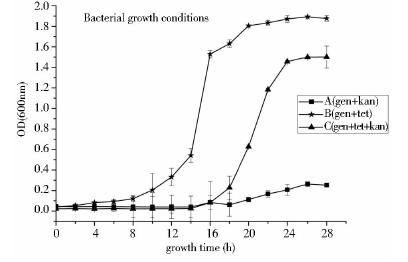
重组菌株XTET生长情况如图 6所示:A组,当无四环素诱导时,psndhteto启动子受到抑制,无法启动kan抗性基因,使卡那霉素对重组菌株具有抑制作用;C组,当加入四环素后,能够解除阻遏蛋白对psndhteto基因的抑制,从而使kan基因得以表达,菌株能够生长;B组,只加入四环素而没有添加卡那霉素,加入的四环素对菌体生长没有抑制作用,因而菌株正常生长。由此可知重组质粒pBBR1MCS-5-pgen-tetr-psndhteto-kan在X菌中非常态表达,而是通过四环素诱导后表达。
|
| 图 6 菌体生长情况Fig. 6 Bacterial growth conditions |
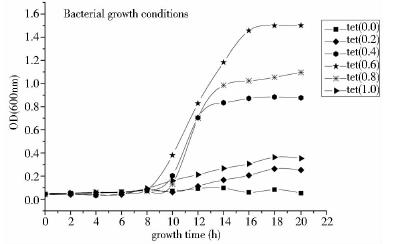
不同四环素诱导浓度对菌株生长具有不同作用,为得到最适四环素诱导浓度,分别加入终浓度为0、0.2、0.4、0.6、0.8、1.0μg/ml的四环素,由图 7可知,四环素浓度不断提高,菌株生长愈加旺盛,当四环素浓度达到0.6μg/ml时,重组菌株生长最佳,当四环素浓度继续提高时,对菌株生长产生了抑制作用,这说明四环素浓度为0.6μg/ml时,为最佳诱导浓度。
|
| 图 7 不同四环素诱导浓度对重组菌株生长的影响Fig. 7 Bacterial growth conditions |
Ketogulonigenium vulgare是一种重要的VC生产菌株,在传统的两步法发酵生产过程中扮演着关键角色,然而两步法发酵涉及多种微生物,并且需要消耗大量的能源和材料,因此迫切需要对Ketogulonigenium vulgare进行基因工程改造,进而实现VC的一步法发酵过程。但有关Ketogulonigenium vulgare的遗传操作系统的研究比较少,Miyazaki[13]等报道应用克隆载体pVK100通过接合转化到Ketogulonigenium vulgare菌中,然而pVK100质粒大小达到23kb,并且没有多克隆位点[14],因此遗传操作相对困难。与pVK100相比pBBR1MCS-2仅有5.1kb大小并且有多克隆位点[15],Fu等首次报道将pBBR1MCS-2转化到K.vulgare DSM 4025 [16]中,相比之下pBBR1MCS-2更适合遗传操作和转化到K.vulgare中。但是Ketogulonigenium vulgare菌对卡那霉素敏感度较低,浓度达220μg/ml时才有抑菌效果,经转化后假阳性也较多。本研究首次借助pBBR1MCS-5载体作为Ketogulonigenium vulgare的穿梭载体,转化后的假阳性率为0。
四环素诱导表达系统在控制基因表达中是最有价值的工具之一,并且被广泛应用于真核生物和原核生物的基因表达调控。特别是对于在原核生物中,其有效性不仅跨越了从革兰氏阴性菌到革兰氏阳性菌的广泛菌种范围,并且也持续公布和发展了对该系统的各种应用情况。Tahlan[17]等通过利用携带teto基因的合成启动子来促使lux基因在E.coli的生物传感器上的表达。Wright[18]等利用E.coli的Tet调节区来构建一种条件性的FIM突变体,用来分析肾盂肾炎大肠杆菌突变体的生物膜形成对菌毛的影响。Guo[19]等通过TetR确立了包皮垢分支杆菌的基因调控体系,证明了用于体外生长所必需的secA1表达条件。虽然四环素表达系统在Ketogulonigenium vulgare中的应用还未见报道,但该系统在微生物中的成功应用为我们提供了重要的依据,本研究采用重叠延伸PCR技术合成了阻遏蛋白TetR的编码的基因和插入了操纵基因teto的Ketogulonigenium vulgare菌山梨酮脱氢酶启动子psndh的基因序列,借助宽宿主质粒pBBR1MCS-5,构建了四环诱导表达的穿梭质粒,转化到Ketogulonigenium vulgare中,实现卡那霉素抗性的调控表达,为丰富和完善Ketogulonigenium vulgare的遗传操作系统,为快速、高效、方便、稳定地进行基因的修饰改造奠定基础。
| [1] | Yang F, Jia Q, Xiong Z, et al. Complete genome analysis of Ketogulonigenium sp. WB0104. Chinese Science Bulletin, 2006, 51(8): 941-945 |
| [2] | Xiong X, Han S, Wang J, et al. Complete genome sequence of the bacterium Ketogulonicigenium vulgare Y25. Journal of Bacteriology, 2011, 193(1): 315-316. |
| [3] | Liu W, Zhang L, Yang J, et al. Reconstruction and analysis of a genome-scale metabolic model of the vitamin C producing industrial strain Ketogulonicigenium vulgare WSH-001.Journal of Biotechnology, 2012,161 (1):42-48. |
| [4] | Berens C, Hillen W. Gene regulation by tetracyclines. European Journal of Biochemistry, 2003, 270(15): 3109-3121. |
| [5] | Geissendrfer M, Hillen W. Regulated expression of heterologous genes in Bacillus subtilis using the Tn10 encodedtet regulatory elements. Applied Microbiology and Biotechnology, 1990, 33(6): 657-663. |
| [6] | Ji Y, Zhang B, Van S F, et al. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science, 2001, 293(5538): 2266-2269. |
| [7] | Lutz R, Bujard H. Independent and tight regulation of transcriptional units in Escherichia coli via the LacR/O, the TetR/O and AraC/I1-I2 regulatory elements. Nucleic Acids Research, 1997, 25(6): 1203-1210. |
| [8] | Qian F, Pan W. Construction of a tetR-integrated Salmonella enterica serovar Typhi CVD908 strain that tightly controls expression of the major merozoite surface protein of Plasmodium falciparum for applications in human vaccine production. Infection and Immunity, 2002, 70(4): 2029-2038. |
| [9] | 李建,宁静,陈西锐,等. 小鼠H1foo基因四环素诱导表达系统的构建与表达. 畜牧兽医学报,2014,45(5):757-762. Li J, Ning J, Chen X R, et al. Construction of tetracycline-inducible expression system of H1foo gene in mouse.Acta Veterinaria et Zootechnica Sinica, 2014,45(5):757-762. |
| [10] | 解宇,汪亮,张冬杰,等.四环素诱导的猪黑素皮质激素受体-4基因真核表达载体的构建.中国畜牧兽医,2013,40(1):13-16. Xie Y, Wang L, Zhang D J, et al. Construction of tetracycline-inducible MC4R gene eukaryotic expression vector in pig. Chinese Animal Husbandry and Veterinary Medicine, 2013,40(1):13-16. |
| [11] | 吴亮,薛兰兰,王晓,等.用四环素诱导调控表达系统构建弓形虫脂肪酸合成酶FABZ缺陷株.中国寄生虫学与寄生虫病杂志,2014,32(4):264-267. Wu L, Xue L L, Wang X, et al. Construction of β-hydroxyacyl-acyl carrier protein dehydratase mutant of Toxoplasma gondii by tetracycline inducible expression system,Chinese Journal of Parasitology and Parasitic Diseases, 2014,32(4):264-267. |
| [12] | Sabine E, Guo X V, Christopher M H. Controlling gene expression in mycobacteria with anhydrotetracycline and Tet repressor. Nucleic Acids Research,2005,3(33):e21 |
| [13] | Miyazaki T, Sugisawa T, Hoshino T. Pyrroloquinoline quinone-dependent dehydrogenases from Ketogulonicigenium vulgare catalyze the direct conversion of L-sorbosone to L-ascorbic acid. Applied and Environmental Microbiology, 2006, 72(2): 1487-1495. |
| [14] | Knauf V C, Nester E W. Wide host range cloning vectors: a cosmid clone bank of an Agrobacterium Ti plasmid. Plasmid, 1982, 8(1): 45-54. |
| [15] | Kovach M E, Elzer PH, Hill D S, et al. Four new derivatives of the broad-host-range cloning vector pBBR1MCS, carrying different antibiotic-resistance cassettes. Gene, 1995, 166(1): 175-176. |
| [16] | Fu S, Zhang W, Guo A, et al. Identification of promoters of two dehydrogenase genes in Ketogulonicigenium vulgare DSM 4025 and their strength comparison in K. vulgare and Escherichia coli. Applied Microbiology and Biotechnology, 2007, 75(5): 1127-1132.. |
| [17] | Tahlan K, Ahn S K, Sing A, et al. Initiation of actinorhodin export in Streptomyces coelicolor. Molecular Microbiology, 2007, 63(4): 951-961. |
| [18] | Wright K J, Seed PC, Hultgren S J. Development of intracellular bacterial communities of uropathogenic Escherichia coli depends on type 1 pili. Cellular Microbiology, 2007, 9(9): 2230-2241. |
| [19] | Guo X V, Monteleone M, Klotzsche M, et al. Silencing essential protein secretion in Mycobacterium smegmatis by using tetracycline repressors. Journal of Bacteriology, 2007, 189(13): 4614-4623. |
 2015, Vol. 35
2015, Vol. 35




