文章信息
- 马义, 赵绍军, 洪岸
- MA Yi, ZHAO Shao-jun, HONG An
- 新型人血清白蛋白特异结合肽ML的筛选及鉴定
- Screening and Identification of the New Human Serum Albumin-specific Binding Peptides
- 中国生物工程杂志, 2015, 35(5): 74-80
- China Biotechnology, 2015, 35(5): 74-80
- http://dx.doi.org/10.13523/j.cb.20150511
-
文章历史
- 收稿日期:2015-03-02
- 修回日期:2015-03-21
由于自身的代谢和肾的滤过作用,许多多肽类及小分子药物在生物体内被迅速清除,生物利用度较低[1]。延长某些肽类等分子药物的半衰期,改善其药代动力学是现在新型分子药物研发的关键。在生物体内小分子药物可依靠它们与各种血浆成分的结合来改善其药物代谢动力学特性。人血清白蛋白(HSA,分子量为67kDa.)是人体血浆中含量最为丰富的蛋白种类,浓度约为600μmol/L,在人体内的半衰期可达19天[2, 3],它是人体血浆中主要的运输载体。把药物肽或者蛋白直接偶联到HSA上,或者利用能够与HSA特异结合的多肽与蛋白药物融合来延长药物肽或者蛋白药物在体内的半衰期,是一种重要的延长分子药物体内半衰期的研究策略[4]。
噬菌体展示技术现已广泛应用于靶分子特异结合多肽的筛选,它可将不同的外源多肽与噬菌体外壳蛋白融合表达,融合蛋白随子代噬菌体的重新组装而展示在噬菌体表面。被展示的各种结构的多肽可以保持相对独立的空间结构和生物活性,以利于靶分子的识别和结合。本技术不仅可实现高通量淘选,可筛选得到具有不同亲和力的靶分子特异结合肽,且假阳性率低。噬菌体展示肽库中噬菌体的数量可达1011,经过多轮富集和淘选,即可将有用的基因从多达百万以上的噬菌体克隆中分离出来。通过噬菌体展示技术筛选得到的靶向功能多肽RGD、CRV和ACT等都能高特异性靶向其特定的肿瘤、血管、脑等靶点组织[5, 6, 7, 8]。以甲型H1N1流感康复患者的血清作为固相靶分子,利用噬菌体展示技术筛选、确定了氨基酸序列PLHARLP为甲型H1N1流感病毒抗原的模拟表位[9]。用传染性支气管炎病毒(IBV)阳性血清纯化IgG作为靶分子,对噬菌体展示随机12肽库进行筛选,得到了2个IBV的模拟表位,具有研制染性支气管炎基因工程疫苗的潜在价值[10]。
本研究通过优化常规筛选条件,并筛选噬菌体展示随机7肽库,经过四轮筛选获得2个与HSA特异性结合的7肽序列ML1和ML2,ELISA鉴定阳性噬菌体克隆表明,所筛选得到的7肽序列与HSA具有亲和作用,且具有不同的亲和力。利用SPR技术亲和力定量测定表明,筛选得到的7肽与天然神经多肽垂体腺苷酸环化酶激活肽27 (PACAP27)构成的融合多肽(ML1-PACAP27和ML2-PACAP27)与HSA确证具有较高的亲和力。本研究筛选和鉴定的特异靶向HSA的7肽可用于靶向偶联HSA的分子药物的重组融合表达或设计,可为设计和研发长效蛋白药物、改善蛋白药物药代动力学和提高生物利用度提供新的研究工具。 1 材料与方法 1.1 材 料 1.1.1 菌株与试剂
菌株E. coli ER2738,M13噬菌体展示7肽库(美国New England Biolabs 公司);人血清白蛋白(HSA),ABTS(美国Sigma公司);卵清白蛋白,酶水解干酪素(北京普搏生物科技有限公司);兔抗M13噬菌体抗体(一抗),HRP标记的羊抗兔IgG(二抗)(上海午立生物技术有限公司);测序引物:5′-HOCCC TCA TAG TTA GCG TAA CG-3′ 为New England Biolabs,Inc 产品;其他试剂均为进口或国产分析纯产品;合成多肽在上海吉尔生物科技有限公司完成。
LB/IPTG/Xgal平板:LB培养基 + 15g/L琼脂粉,高压灭菌,冷却至低于70℃时,加入1 ml IPTG/Xgal,混匀倒平板,平板4℃避光贮存。IPTG/Xgal配方:将1.25g IPTG和1g Xgal溶于25ml二甲基甲酰胺中。溶液-20℃避光贮存。顶层琼脂: 每升含:10g细菌学蛋白胨,5g酵母提取物,5g NaCl,1g MgCl2·6H2O,7g琼脂粉。高压灭菌,分成50ml等份。固体培养基室温贮存,用时微波炉融化。TBS:50mmol/L Tris-HCl (pH 7.5),150mmol/L NaCl。PEG/NaCl:20% (w/v) PEG-8000,2.5mol/L NaCl。碘化物缓冲液: 10mmol/L Tris-HCl (pH 8.0),1mmol/L EDTA,4mol/L NaI。室温避光贮存。 1.1.2 主要仪器设备
生物分子相互作用分析仪BIACORE3000(瑞典Amersham公司);无菌聚苯乙烯培养皿(60×15mm,美国Coring Incorporated 公司);ELISA 板(美国Costar公司);单通道或多通道微量移液器,5804R型高速离心机(德国Eppendorf公司);Thermo Multiskan MK3酶标仪(芬兰Labsystems公司);DNA Mini真空浓缩仪(丹麦Heto-Holten A/S公司)。 1.2 方 法 1.2.1 M13噬菌体展示7肽库的筛选
共进行四轮筛选。溶于0.1mol/L NaHCO3(PH 8.6) 的100μg/ml HSA溶液作为靶分子溶液,溶于0.1mol/L NaHCO3(PH 8.6) 的1%(v/v)卵清白蛋白作为封闭液。在单个灭菌聚苯乙烯培养皿中加入1.5 ml靶分子溶液,在增湿容器中4℃轻微震荡,孵育过夜。倒掉包被的靶分子溶液,用封闭液4℃封闭2h,倒掉封闭液,用TBST (TBS+0.1% [v/v] Tween-20)缓冲液快速洗板6次,用1ml TBST缓冲液稀释释2×1011的噬菌体(10 μl的原始文库),然后加到已包被好的板上,室温温和摇动60 min。倾去未结合噬菌体,用TBST缓冲液洗板10次,再用1ml游离的HAS溶液(100μg/ml,溶于TBS中)室温温和摇动40 min,竞争性洗脱结合的噬菌体,少量洗脱物进行滴度测定,其余的加入20ml E.coli ER2738培养物中(菌体应当处于对数前期),37℃剧烈摇动培养4.5 h进行扩增。扩增培养物二次离心后(4℃ 10 000r/min离心10min)。将上清上部80%加入1/6体积的PEG/NaCl,4℃沉淀过夜。离心PEG沉淀15min,沉淀物重悬于1ml TBS中。离心后上清加入1/6体积的PEG/NaCl再沉淀,冰上孵育60 min。 沉淀物重悬于200 μl TBS,0.02% NaN3中。离心并保留其上清,此即为扩增后的洗脱物。用常规M13方法和LB/IPTG/Xgal平板滴定扩增后的洗脱物。确定洗脱物滴度后,计算对应于2×1011噬菌斑形成单位(pfu)的加入量,并进行下一轮筛选。前三轮的主要步骤如上。第四轮包被用HSA溶液的浓度为10 μg/ml;由溶于0.1mol/L NaHCO3(PH 8.6)的1%(v/v)酶水解干酪素作为封闭液;洗脱缓冲液TBST中Tween-20的浓度为0.3%(v/v);噬菌体库与包被板的结合时间为30 min;游离的HSA溶液竞争性洗脱结合的噬菌体的洗脱时间为60 min;第四轮洗脱物不需扩增,滴度测定时得到的噬菌斑可用于测序。 1.2.2 噬菌斑的扩增和滴定
将ER2738过夜培养物按1∶100稀释接种于LB培养基,分1 ml到培养管中。每个要鉴定的克隆一管。用灭菌牙签或吸头,挑一蓝色噬菌斑到上述1ml培养管中。 37℃摇床培养5h。培养物转入微量离心管中,离心30 sec。上清离心后,用移液器将80%的上清转入新鲜离心管,此即为扩增噬菌体贮液。
接种ER2738单菌落于5~10ml LB培养基中,摇床培养至对数中期(OD600 ≈0.5)。融化顶层琼脂,分成3 ml等份于灭菌试管中,每个噬菌体稀释度一管,保存于45℃备用。37℃预温LB/IPTG/Xgal平板,每个噬菌体稀释度取一个平板备用。在LB中10倍系列稀释的噬菌体,稀释范围:扩增的噬菌体培养物上清在108~1011之间,未扩增的淘选洗脱物在:101~104之间。当菌体培养物达对数中期,分成200μl等份于微量离心管中,每个噬菌体稀释度一管。每管加入10μl不同稀释度的噬菌体,快速震荡混匀,室温温育5min。将感染细胞加入45℃预温的上层琼脂培养管中,每次一管,快速混匀,立即倾注于37℃预温的LB/IPTG/Xgal平板上并均匀铺开。待平板冷却后,倒置于37℃培养过夜。检查平板,计数约有100个噬菌斑的平板上的斑数。然后用此数目乘以稀释因子即得到每10μl噬菌体的空斑形成单位(pfu)滴度。 1.2.3 噬菌体DNA的纯化、鉴定及7肽序列的确定
按上述方法进行噬菌斑扩增,在第一步离心后,将500μl含噬菌体上清转入一新鲜离心管。 加200μl PEG/NaCl混匀,室温放置10min。离心后弃上清液,沉淀物彻底重悬于100μl碘化物缓冲液中,加入250μl乙醇。室温温育10min,离心10min,弃上清。用70%的乙醇洗沉淀二次,短暂真空干燥。沉淀DNA重悬于30μl TE [10mmol/L Tris-HCl (pH 8.0),1mmol/L EDTA]中。应用上游引物:5′-TAA TTC GCA ATT CCT TTA GTG GTA CCT -3′ 和下游引物:5′- GCC CTC ATA GTT AGC GTA ACG ATC TAA - 3′ (-96引物)对待测噬菌体DNA进行PCR扩增;取10μl的上述模板溶液用测序引物:5′-HOCCC TCA TAG TTA GCG TAA CG-3′进行DNA测序,测得的DNA序列相应于模板的反义链,根据试剂盒说明书所列遗传密码表翻译得到7肽的氨基酸序列。 1.2.4 筛选的噬菌体病毒子与HSA的亲和作用鉴定
对每一个要鉴定的噬菌斑克隆,接种一管ER2738于20ml LB培养基中,37℃培养过夜,按1∶100的比例稀释于20ml LB培养基中;于每管ER2738培养液中加入5μl待鉴定噬菌体上清,37℃通气培养4.5h;培养物转入离心管中,10 000r/min离心10min,取80%上清于新鲜离心管中,加1/6体积的PEG/NaCl,4℃沉淀过夜。4℃ 10 000r/min离心15min,弃上清,沉淀重悬于1ml TBS中,4℃离心5min,上清转入新鲜微量离心管,加1/6体积的PEG/NaCl再沉淀,冰上作用30min,4℃离心10min,弃上清,沉淀重悬于50μl TBS中,按1. 2. 2方法中测定噬菌体滴度。
将HSA溶于0.1mol/L的NaHCO3溶液(pH 8.6),配制浓度为100 μg/ml的HSA溶液(pH 8.6),用此溶液包被ELISA板的一排空,每空加入200μL,作为阳性实验组;用另一ELISA板连续四倍稀释噬菌体,由第12孔加入1012个病毒子,进行4倍系列稀释至第1孔为2.4×105个病毒子;这两个多孔板均用1% [w/v]酶水解干酪素封闭。用多通道移液器将稀释好的噬菌体加入包被有HSA的板中,室温震荡作用2h;用TBST缓冲液(TBS缓冲液中含0.3%[v/v]的吐温-20,pH 7.5)洗板6次。在封闭液中以1∶5 000的比例稀释HRP标记的抗-M13抗体,每孔加入200μl稀释抗体,室温震荡作用1h,用TBST缓冲液(TBS缓冲液中含0.3%[v/v]的吐温-20,pH 7.5)洗板6次,然后加入ABTS/H2O2底物溶液200μl,室温作用40min,用酶标仪记录405nm处的吸光值,实验重复三次,取其平均值;对照实验组,不加入噬菌体,其他同阳性实验组,以测定底物背景吸光值。 1.2.5 等离子共振技术(SPR)测定融合肽ML-PACAP27与HSA的亲和力
采用化学合成方法合成融合多肽:筛选7肽-垂体腺苷酸环化酶激活肽27(ML-PACAP27),用PBST(PBS+0.05%Tween20,PH7.4)溶解融合肽ML-PACAP27,并稀释成浓度梯度为10、5、2.5、1.25 和0.625μmol/L的待测样品溶液;以20μl/min的流速用PBST冲洗CM5 CHIP通道1和通道2五分钟,用体积比为1∶1的EDC-HCL、NHS活化1、2通道的表面;活化后的通道2以20μl/min的流速流过20 ul浓度为1mg/ml的HSA(HSA溶于PH4.5的醋酸钠),然后以10mmol/L NaOH洗通道2后确定其结合的HSA的结合量,通道2作为检测样品的阳性通道;通道1和2同时以20μl/min 过20μl 的乙醇氨封闭芯片表面,通道1不包被HSA而作为检测样品阴性对照通道。不同浓度的检测样品分别同时流过通道1和通道2,注射时间为90s,解离时间为150s,得到的曲线数据做fc2-1处理,并做相同条件流过PBST的反应作为空白对照,利用生物分子相互作用分析仪BIACORE3000和BIAcore kinetic evaluation software (version 4.1) 和One-to-One binding model经统计学处理后,得到检测样品与HSA的解离常数(Kd)。 2 结果与分析 2.1 筛选中噬菌体的滴度及加入量
由于第二轮至第四轮筛选要用前一轮筛选扩增的洗脱物中2×1011 pfu的噬菌体量进行实验,故每一轮筛选均需进行滴度测定,以确定加入的扩增液体积。第一轮筛选中未扩增噬菌体的滴度为9.1×103pfu/10 μl,扩增后9.8×1011 pfu/10 μl,故第二轮筛选应加入2.04 μl的第一轮扩增物;第二轮筛选中未扩增噬菌体的滴度为7.9×103pfu/10μl,扩增后为8.2×1010 pfu/10 μl,故第三轮筛选应加入24.4 μl的第二轮扩增物;第三轮筛选中未扩增噬菌体的滴度为7.7×103 pfu/10 μl,扩增后为7.1×1010 pfu/10 μl,故第四轮筛选应加入28.16 μl的第三轮扩增物;第四轮筛选中未扩增噬菌体的滴度为9.3×104 pfu/10 μl。如图 1所示,在噬菌体展示的第四轮筛选中筛选得到的淡蓝色噬菌斑。
|
| 图 1 噬菌体展示7肽文库第四轮筛选的噬菌斑 Fig. 1 Plaques in the fourth round panning of M 13 phage-displayed 7-mer peptide library |
由第四轮淘选物中取3个阳性克隆,经快速纯化和抽提所选阳性克隆的噬菌体DNA,利用上游引物:5′-TAA TTC GCA ATT CCT TTA GTG GTA CCT -3′ 和下游引物:5′- GCC CTC ATA GTT AGC GTA ACG ATC TAA - 3′ (-96引物)对待测噬菌体DNA进行PCR扩增,获得目的DNA片段长度为180 bp,理论值相一致(图 2)。利用测序引物:5′-HOCCC TCA TAG TTA GCG TAA CG-3′ 对扩增的的DNA进行测序作为反义链,根据试剂盒说明书所列遗传密码表翻译得到7肽的氨基酸序列,翻译得到的3个与人血清白蛋白亲和结合的7肽的氨基酸序列,其中1号阳性噬菌体克隆(P1)对应的氨基酸序列为ML1:LKSCKPL,2号和3号阳性噬菌体克隆(P2和P3)对应的氨基酸序列ML2和ML3相同,均为:SLKSHAL。

|
| 图 2 阳性克隆噬菌体DNA目的片段的PCR鉴定Fig. 2 PCR identification of target DNA in three positive phage clones M: DNA marker; Lane1-3: PCR identification of target DNA in three positive phage clones(P1,P2 和P3) |
利用ELISA检测技术,测定筛选得到的表达不同7肽序列ML1和ML2的阳性噬菌体克隆与HSA的亲和作用,比较所筛选的7肽序列与HSA的亲和结合作用强弱,实验结果如表 1所示,表达ML2的阳性噬菌体阳性克隆与HSA的亲和结合作用明显高于表达ML1的阳性噬菌体克隆。
| 噬菌体数量样品OD405 nm | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| P1实验组 | 0.079 | 0.085 | 0.092 | 0.098 | 0.102 | 0.131 | 0.365 | 0.765 | 0.873 | 0.722 | 0.899 | 0.920 |
| P1空白对照组 | 0.047 | 0.046 | 0.049 | 0.048 | 0.051 | 0.052 | 0.050 | 0.048 | 0.051 | 0.047 | 0.049 | 0.049 |
| P2实验组 | 0.086 | 0.097 | 0.108 | 0.126 | 0.183 | 0.259 | 0.592 | 0.717 | 0.860 | 0.931 | 1.005 | 1.152 |
| P2空白对照组 | 0.052 | 0.047 | 0.052 | 0.051 | 0.051 | 0.047 | 0.049 | 0.046 | 0.049 | 0.048 | 0.051 | 0.048 |
| 注:1. 表中噬菌体数量12,11,10,9,……1表示4倍系列稀释后依次降低的噬菌体数目,如:12表示1012,11表示1012×1/4,1表示2.4×105; 2. 实验重复3次,表中数值为3次实验的平均值 | ||||||||||||
化学合成方法合成融合多肽ML1-PACAP27和 ML2-PACAP27,其氨基酸序列分别为:L K S C K P L-H S D G I F T D S Y S R Y R K Q M A V K K Y L A A V L;S L K S H A L-H S D G I F T D S Y S R Y R K Q M A V K K Y L A A V L;合成的由34个氨基酸组成融合肽ML1-PACAP27和 ML2-PACAP27经质谱鉴定,如图 3所示,其分子量分别为:3919.0 Da. 和3886.0 Da. 与其理论值相符合。
利用SPR技术,定量检测融合肽ML1-PACAP27和 ML2-PACAP27与HSA的亲和力,实验结果显示,ML1-PACAP27和 ML2-PACAP27与HSA的解离常数(Kd)分别为:8.1×10-6 mol/L和 3.7×10-6 mol/L,实验结果表明,当筛选的7肽ML1和ML1与PACAP27融合后,仍具有较高的与HSA的亲和力,这一方面验证了噬菌体展示实验的筛选结果,排除了假阳性,同时,SPR实验结果显示ML2-PACAP27与HSA的亲和结合力高于ML1-PACAP27,这也与利用ELISA技术测定表达ML1和ML2的阳性噬菌体克隆与HSA的亲和作用实验结果相一致,实验结果证明:筛选得到的7肽ML2与HSA具有更高的特异亲和力。
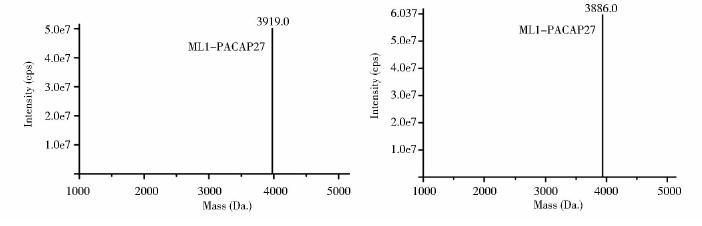
|
| 图 3 ML1-PACAP27和 ML2-PACAP27的质谱鉴定图Fig. 3 Assay of ML1-PACAP27 and ML2-PACAP27 by mass spectrometry |
噬菌体展示技术因其高灵敏性和高特异性现已逐渐被应用到蛋白药物研发中,如:以人白细胞介素-4受体(IL-4R)和完整的Puumala 汉坦病毒作为靶标,筛选到了相应的特异性配体,应用于临床前或临床药物研发[11, 12]。重组蛋白药物或多肽药物的生物利用度及生物学作用很大程度上取决于药物的药代动力学性质。分子量小于6 kDa的小分子蛋白或多肽在生物体内由于肾的滤过作用会很快被清除体外或代谢掉。因此已有许多研究致力于通过融合表达增加药物分子的大小来降低其在体内的清除,如与半衰期较长的血清白蛋白或免疫球蛋白G(IgG)的单链部分融合表达[13, 14, 15],或与PEG耦联来增加分子大小[16, 17],通过这些方法一些蛋白药物的半衰期得到有效延长,改善其药代动力学特性。但这种融合表达策略也许会影响药物分子本身的空间结构及生物学活性。因此,通过小分子蛋白药物与各种血浆成分的结合来改善其药物代谢动力学特性已逐渐成为一种新的研究策略。
人血清白蛋白不仅对于维持血浆PH值和血压有重要作用,而且可携带多种代谢物和脂肪酸,它是人体血浆种主要的运输药物分子的载体蛋白。研究表明,与血清白蛋白的非共价结合可延长短期存活蛋白的半衰期[16]。来源于链球菌G蛋白的血清白蛋白结合基团与Ι型补体受体融合表达,可使其在大鼠体内的半衰期延长3倍达5小时,而且相关的免疫反应也相应增强[17, 18]。不同生物种类血清白蛋白的半衰期不同,如兔血清白蛋白为5~6天[19],小鼠为1天[20],携有血清白蛋白结合基团的融合蛋白,其半衰期在不同生物体内可被不同程度的延长,这与不同生物血清白蛋白的半衰期不同有关。本研究通过筛选M13噬菌体展示7肽库,发现了2个与人血清白蛋白特异性结合的7肽序列,这为后续与半衰期短的治疗性的蛋白分子药物的融合表达和新型分子药物的研发提供了研究工具。由于人血清白蛋白在血浆中的含量丰富,其分子量为67 kDa,且半衰期可达19天,因此,这些与人血清白蛋白结合力不同的7肽序列与有关蛋白分子药物融合后,在人体内不仅可通过与人血清白蛋白结合而不同程度的延长其半衰期,提高其生物利用度、降低由于肾滤过作用的清除,也可有效地达到药物缓释的目的;而且这些由7个氨基酸组成的小型肽与药物分子的融合,也不会明显改变原药物分子的大小,有利于组织内的快速渗透,特别是对于针对肿瘤的分子药物的设计具有突出的优势和特点[21, 22]。因此,这些与人血清白蛋白特异性结合7肽序列的发现,对于后续新型长效蛋白药物的设计和研发具有重要的参考和应用价值。
| [1] | Malik D K, Baboota S, Ahuja A, et al. Recent advances in protein and peptide drug delivery systems. Curr Drug Deliv, 2007, 4(2):141-151. |
| [2] | Peters T. Serum A. Adv. Protein Chem, 1985, 37: 161–245. |
| [3] | Kovãcs A, Guttman A. Medicinal chemistry meets proteomics: fractionation of the human plasma proteome. Curr Med Chem, 2013, 20(4):483-490. |
| [4] | Sjolander A, Nygren P A, Stahl S, et al. The serum albumin-binding region of streptococcal protein G: a bacterial fusion partner with carrier-related properties. J Immunol Methods, 1997, 201(1):115-123. |
| [5] | Dubey P K, Mishra V, Jain S, et al. Liposomes modified with cyclic RGD peptide for tumor targeting. J Drug Target, 2004, 12(5): 257-264. |
| [6] | Ito A, Ino K, Kobayashi T, et al. The effect of RGD peptide-conjugated magnetite cationic liposomes on cell growth and cell sheet harvesting. Biomaterials, 2005, 26(31): 6185-6193. |
| [7] | Trepel M, Grifman M, Weitzman M D, et al. Molecular adaptors for vascular-targeted adenoviral gene delivery. Hum Gene Ther, 2000, 11(14): 1971-1981. |
| [8] | Wan X M, Chen Y P, Xu W R, et al. Identification of nose-to-brain homing peptide through phage display. Peptides, 2009, 30(2): 343-350. |
| [9] | 蔡炯,钟彦伟,荆霞,等.噬菌体展示技术筛选甲型H1N1流感病毒抗原模拟表位的研究.解放军医学杂志,2010,35(1):61-63. Cai J, Zhong Y W, Jing X, et al. Screening of mimotopes of swine influenza virus A(H1N1)by phage display technology. Med J Chin PLA, 2010, 35(1):61-63. |
| [10] | 安烨,王宏俊,张培军.利用噬菌体展示肽库筛选鸡传染性支气管炎病毒模拟抗原表位.生物技术通讯, 2007, 18(6):931-934. An Y, Wang H J, Zhang P J. Screening of mimotopes of avian infectious bronchitis virus from phage display peptide library. Letters In Biotechnology, 2007, 18(6):931-934. |
| [11] | Hong H Y, Lee H Y, Kwak W, et al. Phage display selection of peptides that home to atherosclerotic plaques: IL-4 receptor as a candidate target in atherosclerosis. J Cell Mol Med, 2008, 12(5B): 2003-2014. |
| [12] | Li X, Ren Z Z, Zhong G H. Application of phage display technology in protein researches. Chemistry of Life, 2009, 29(4):588-594. |
| [13] | Syed S, Schuyler P D, Kulczycky M, et al. Potent antithrombin activity and delayed clearance from the circulation characterize recombinant hirudin genetically fused to albumin. Blood, 1997, 89(9):3243-3252. |
| [14] | Yeh P, Landais D, Lematre M, et al. Design of yeast-secreted albumin derivatives for human therapy: biological and antiviral properties of a serumalbumin-CD4 genetic conjugate. Proc Natl Acad Sci U S A, 1992, 89(5):1904-1908. |
| [15] | Ashkenazi A, Chamow S M. Immunoadhesins as research tools and therapeutic agents. Curr Opin Immunol, 1997, 9(2):195-200. |
| [16] | Dennis M S, Zhang M, Meng Y G, et al. Albumin binding as ageneral strategy for improving the pharmacokinetics of proteins. J Biol Chem, 2002, 277(38):35035-35043. |
| [17] | Makrides S C, Nygren P A, Andrews B, et al. Extended in vivo half-life of human soluble complement receptor type 1 fused to a serum albumin-binding receptor. J Pharmacol Exp Ther. 1996,277(1):534-542. |
| [18] | Sjlander A, Nygren P A, Stahl S, et al. The serum albumin-binding region of streptococcal protein G: a bacterial fusion partner with carrier-related properties. J Immunol Methods, 1997, 201(1):115-123. |
| [19] | Hatton M W, Richardson M, Winocour P D. On glucose transport and non-enzymic glycation of proteins in vivo. J Theor Biol, 1993, 161(4):481-490. |
| [20] | Stevens D K, Eyre R J, Bull R J. Adduction of hemoglobin and albumin in vivo by metabolites of trichloroethylene, trichloroacetate, and dichloroacetate in rats and mice. Fundam Appl Toxicol, 1992, 19(3):336-342. |
| [21] | Wang Y, Li X, Chen W. Expression, structure prediction and functional analysis of murine single-chain fragment variable antibody against human cervical cancer. Nan Fang Yi Ke Da Xue Xue Bao, 2006, 26(1):16-21. |
| [22] | Tong Q, Liu K, Lu X M, et al. Construction and characterization of a novel fusion protein MG7-scFv/SEB against gastric cancer. J Biomed Biotechnol, 2010, 2010:121094, doi: 10.1155/2010/121094. |
 2015, Vol. 35
2015, Vol. 35




