文章信息
- 钱凯, 张晶晶, 吴素平, 蔡燕飞, 陈蕴, 金坚
- QIAN Kai, ZHANG Jing-jing, WU Su-ping, CAI Yan-fei, CHEN Yun, JIN Jian
- 利用GAP启动子在毕赤酵母中表达与纯化GLP-1类似物
- Constituted expression and purification of glucagon-like peptide-1 analogue in Pichia pastoris using GAP promoter
- 中国生物工程杂志, 2015, 35(5): 66-73
- China Biotechnology, 2015, 35(5): 66-73
- http://dx.doi.org/10.13523/j.cb.20150510
-
文章历史
- 收稿日期:2015-01-13
- 修回日期:2015-03-10
2. 江南大学药学院 无锡 214122
2. School of Pharmaceutical Sciences, Jiangnan University, Wuxi 214122, China
毕赤酵母作为高效的真核表达体系,根据美国生物科技国家中心(NCBI)统计,在2013年底已经超过1 000个外源蛋白的顺利表达[1]。来源于醇氧化酶1(alcohol oxidase 1,AOX1)的启动子,利用甲醇诱导表达的体系已经得到广泛的应用。但AOX1启动子的表达体系的应用也受到限制[2]。甲醇作为诱导剂和碳源,流速很难控制而容易导致失败,且甲醇作为食品危害的试剂,不能用于食品类物质的生产当中。甘油醛三磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAP)是糖酵解代谢途径中的关键酶,也是生命中不可或缺的组成型酶。GAP启动子首先被Waterham[3]利用表达外源蛋白。人缘的几丁质酶通过GAP启动子在毕赤酵母中表达,蛋白的表达量和活性与AOX1启动子相当[4]。羊的乳铁蛋白通过GAP启动子在毕赤酵母中表达,产量优化后能达到2 mg/ml,而且与天然的乳铁蛋白的等电点没有明显差异[5]。GAP启动子因其高转录性、安全性和操作的简便性而得到越来越多的应用[6]。
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是肠道L细胞分泌的一种糖调节激素,活性形式主要有两种,一种是全长的GLP-1(7-37),另一种是C末端的Arg酰胺化的GLP-1(7-36)-NH2。GLP-1的主要生理活性是在血液高血糖时,刺激β胰腺细胞分泌胰岛素,在血糖正常时不刺激分泌胰岛素,从而避免引发低血糖[7]。GLP-1还可以阻止胰高血糖素的分泌,促进β胰腺细胞的增殖[8],减少胃排空而减少患者的饥饿感,从多方面治疗II型糖尿病[9]。因此GLP-1成为一个具有潜力的治疗II型糖尿病的药物。然而,GLP-1被体内的二肽基肽酶IV(DPP-IV)酶切而失去活性,药物的体内半衰期仅有2 min,限制了GLP-1的成药可能性[10]。因此,针对DPP-IV的酶切位点的氨基酸突变成为一个重要的内容。Giguer[11]针对DPP-IV的酶切位点和空间构象设计了27个GLP-1的突变体,包括N端、中间和C端氨基酸的突变。结果发现在N端和中间的改造有利于活性的提高,且发现将GLP-1的第二位氨基酸丙氨酸突变为甘氨酸能很好的避免DPP-IV的酶切。由于N端的改造对GLP-1活性很重要,通过改造信号肽的蛋白酶位点,使外分泌蛋白的N端稳定性增强,活性也有提高[12]。
本课题组前期研究设计了GLP-1的突变体即GLP-1(A2G),可以将GLP-1的小鼠体内半衰期从2 min提高至30 min[13]。再将GLP-1(A2G)的二联体与人血清白蛋白(HSA)融合合成GGH,半衰期进一步提高至8 h左右[14]。实验室课题组继续在GGH融合蛋白前添加一个氨基酸作为保护氨基酸从而避免DPP-IV的剪切。设计了四种保护氨基酸的突变体,在毕赤酵母中利用AOX1启动子表达,利用天然的β胰腺瘤细胞的检测方法[15],发现添加一个丙氨酸的类似物(AGGH)的活性较添加前有明显提高[16]。本研究是在课题组发现的高活性的GLP-1类似物(AGGH)的基础上,将AGGH融合蛋白利用GAP启动子在毕赤酵母中进行表达,优化培养条件,并对两种不同的启动子表达出来的AGGH的活性进行比较。
1 材料与方法 1.1 材 料 1.1.1 质粒与菌株毕赤酵母(Pichia pastoris)表达菌株GS115、大肠杆菌菌株DH5α为本实验室保存,表达质粒pGAPZαA质粒购自Invitrogen公司。
1.1.2 药品与试剂引物由上海生工生物工程有限公司合成,核酸内切酶EcoR I和Not I、T4 ligase、DNA marker、protein marker等分子试剂购自Thermo Scientific公司;质粒小量抽提试剂盒、PCR产物纯化试剂盒、DNA胶回收试剂盒、酵母基因组DNA抽提试剂盒、蛋白胨、酵母粉、博来霉素(Zeocin)抗生素均购自上海生工生物工程有限公司;尿微量白蛋白检测试剂盒购自上海名典生物试剂有限公司。抗体购自Abcam公司。其余的化学试剂均为分析纯试剂。
1.2 方 法 1.2.1 重组质粒的构建以实验室保藏的pPIC9K/GGH为模板PCR获得AGGH基因片段(former primer:GCGAATTCGCTCACGGTGAAGGTACTTTCA;reverse primer:GAGTGCGGCC GCTTATTATAAGCCTAAG)。获得的基因片段和pGAPZαA经EcoR I和Not I酶切,经DNA胶回收试剂盒回收目标片段。回收的基因片段与pGAPZαA质粒片段用T4 ligase连接16h。连接好的质粒转化到DH5α,并在LB固体培养基(5g/L酵母粉、10g/L蛋白胨、5g/L NaCl加25μg/ml zeocin)中培养16 h后挑选单菌落,筛选获得的阳性质粒经PCR验证和测序验证正确后用于下一步实验。
1.2.2 菌株的构建与筛选验证正确的质粒经Avr II线性化酶切后,与GS115感受态细胞混合电击(1.5kV,40μF,180Ω)转化。毕赤酵母GS115的感受态细胞经标准方法制备获得[17]。在YPDS平板(20g/L蛋白胨、10g/L酵母粉、20g/L葡萄糖,15g/L琼脂糖,1mol/L山梨醇和外加100μg/ml的zeocin)培养四天。并挑选40株阳性克隆株到含800 μg/mL的zeocin抗性YPDS平板中继续培养两天。挑选15株菌落明显的阳性克隆株到YPD液体培养基(20 g/L蛋白胨、10 g/L酵母粉、20 g/L葡萄糖)中培养三天。收集上清液用尿微量白蛋白检测试剂盒检测上清液中AGGH的蛋白含量,并挑选高表达的克隆菌株。具体的步骤参考Invitrogen公司的pGAPZαA表达手册。
1.2.3 菌株的验证酵母基因组DNA抽提试剂盒提取重组菌株的基因组。以基因组为模板,用上述的引物扩增。制备好12%的SDS-PAGE胶[18],离心收集发酵上清液,150 V、80 min蛋白胶中分离,并转化到硝酸纤维素膜上。制备两份,并分别用GLP-1(ab23468,Abcam)单抗和HSA (ab31898,Abcam)多抗杂交,用羊抗小鼠的二抗孵育。孵育好的蛋白样品用ECL(chemiluminescent reagent)显色液显色。
1.2.4 菌株的碳源优化在BMY培养基(20g/L蛋白胨、10g/L酵母粉、10g/L硫酸铵、3.4g/L无氨基酵母氮源)中添加不同的碳源,分别添加量为20g/L葡萄糖、20.45g/L甘油、21.34g/L甲醇、17.27g/L蔗糖、18.38g/L甘露糖、18.38g/L山梨醇。添加不同质量碳源的碳原子摩尔数为0.66mol/L即与20g/L葡萄糖的碳摩尔数相同。配置好的不同培养基150ml装液于500ml的摇瓶中,做三个平行试验。种子菌浓OD为10时,以0.5%(V/V)的接种量接种于培养瓶中,在30℃、200r/min下培养三天。每4 h取样,检测菌浓并用尿微量白蛋白检测试剂盒检测上清液中AGGH的蛋白含量。
1.2.5 菌株的发酵罐培养GS115/pGAPZαA/AGGH菌株发酵:发酵罐选用上海保兴的5L发酵罐,初始装液量为3L。初始培养基(20g/L蛋白胨、10g/L酵母粉、10g/L硫酸铵、3.4g/L无氨基酵母氮源、100mmol/L pH 6.0磷酸钾缓冲液)加40g/L葡萄糖。在30℃,pH 6.0,400r/min条件下发酵培养。pH通过35%的磷酸和2mol/L的氢氧化钾自动控制。培养基中的葡萄糖消耗完全后,溶氧值升高,当反弹至45%,将降低发酵温度至25℃并将转速提高至600r/min。12ml/h补加防降解培养基(100g/L蛋白胨、50g/L酵母粉、50g/L硫酸铵、17g/L无氨基酵母氮源)。每4h取样,用生化酶标仪检测葡萄糖的含量并补加350g/L的葡萄糖至5g/L。每4h取样,检测菌浓、葡萄糖含量和用尿微量白蛋白检测试剂盒检测上清液中AGGH的蛋白含量。
GS115/pPIC9K/AGGH菌株发酵:初始装液量为3L,培养基为初始培养基加40g/L甘油。在30℃,pH 6.0,400r/min发酵20h后补加补料培养基200ml(100g/L蛋白胨、50g/L酵母粉、50g/L硫酸铵、17g/L无氨基酵母氮源、100g/L甘油)。转速600r/min发酵8h。一次性添加10g甲醇,温度降低为25℃诱导培养4h。将溶氧水平控制在35%,补料与溶氧负向偶联自动补加。每4h取样,检测菌浓和用尿微量白蛋白检测试剂盒检测上清液中AGGH的蛋白含量。
1.2.6 AGGH的蛋白纯化发酵液8000r/min离心10min收集发酵上清,并用0.45μm的滤膜过滤除菌。再用截留分子量为10kDa的超滤仪超滤浓缩10倍。补两次等体积的水,再次浓缩。Blue Sepharose先经A液(20mmol/L NaPB pH7.2,0.1mol/L NaCl)平衡,将浓缩后的样品上柱。淋洗平衡后以50% B液(20mmol/L NaPB pH7.2,2mol/L NaCl)和100% B液梯度洗脱。Phenyl Sepharose经B液平衡后,将上步收集100% B液洗脱液上柱。淋洗平衡后以100%的C液(20mmol/L NaPB pH7.2)洗脱。Q Sepharose柱子先以C液平衡后,将Phenyl Sepharose的洗脱液上样,淋洗平衡。用35%的D液(1mol/L NaCl pH7.2)和100%的D液洗脱阴离子柱。收集35%的D液洗脱液即为纯化的目标蛋白。
1.2.7 AGGH的活性检测用含10% FBS的DMEM培养基培养293模型细胞(human embryonic kidney 293,HEK293)。细胞模型是浙江大学杨雯利用HEK293共转染胰高血糖素样肽-1受体(GLP-1R)和cAMP响应启动子的萤火虫荧光素基因(CRE-fFlu),筛选获得稳定的细胞株。细胞以10×105 cell/mL的密度铺板于96孔板中,每孔加100μl。待细胞长至80%左右,加入用PBS稀释好的药物100μl,37℃,5%的CO2孵育2 h。弃药后,加入30μl的细胞裂解液冰上裂解10 min,并用萤火虫荧光报告基因检测试剂盒(Sigma,luc1)检测。具体步骤参照试剂盒说明书。
2 结 果 2.1 重组质粒pGAPZαA/AGGH的构建以pPIC9K/GGH为模板,PCR扩增获得Ala+GLP-1(A2G)+ GLP-1(A2G)+HSA的基因序列aggh。经EcoR I和Not I双酶切后回收获得片段和pGAPZαA双酶切后回收的片段连接,构建的重组质粒pGAPZαA/AGGH(图 1a)。以上述引物PCR扩增重组质粒,获得的片段大小为2 000bp,与理论大小相符(图 1b)。构建好的质粒经上海生工生物工程有限公司测序,结果和理论结果一致(结果未给出)。
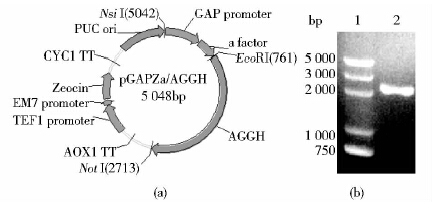
|
| 图 1 重组质粒的构建 Fig. 1 Construction of the recombinant plasmid pGAPzαA-AGGH(a) Schematic of the recombinant plasmid (b) Electrophoresis map of the recombinant plasmid with PCR 1:Molecular weight marker; 2:Sample of PCR product |
Avr II线性化重组质粒,与GS115感受态细胞混合电击转化。将转化的GS115重组菌株涂布到含100 μg/ml的zeocin的YPDS平板中。四天后能生长出150个左右的单菌落,随机挑选40个单菌落到含800 μg/ml的zeocin的YPDS平板。生长三天后,可以长出15个单菌落。将这15个菌落接种到YPD培养基的摇瓶中生长三天。尿微量白蛋白试剂盒是医药上用于检验人体尿液中白蛋白含量的检测试剂,检测的范围为20~200 mg/L。构建的融合蛋白AGGH也具有白蛋白的抗原性,可以利用检测发酵上清中白蛋白的含量来反映AGGH的含量[19]。摇瓶培养三天后检测发酵上清中的AGGH含量,因检测试剂盒的检测范围有限,有6株菌株的表达量低于20 mg/L而未被检测出来。结果显示(图 2),7号菌株的蛋白量最高,为43 mg/L。
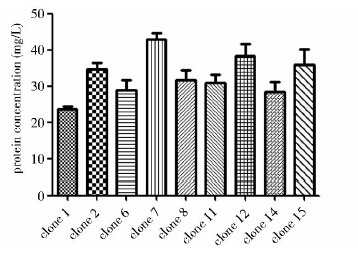
|
| 图 2 重组菌株的摇瓶筛选 Fig. 2 Screening of recombinant strains in flask |
筛选出的7号菌株的发酵上清经WB验证后,结果显示其同时具有GLP-1的抗原性和HSA的抗原性,说明发酵上清的蛋白为GLP-1和HSA的融合蛋白,且分子大小与预计的一致(图 3a)。提取酵母的基因组,PCR扩增结果显示,目标基因存在于酵母基因组中(图 3b)。后续的研究选用7号菌株作为出发重组菌株。
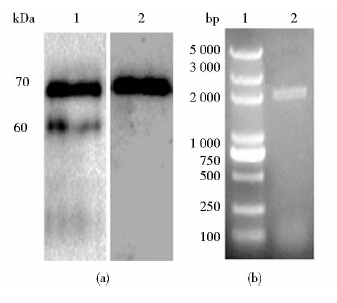
|
| 图 3 重组菌株的验证 Fig. 3 Verification of recombinant strain(a) Western blot of fermentation broth 1: Western blot with anti-GLP-1 antibody; 2: Western blot with anti-HSA antibody (b) Electrophoresis of PCR product from genomic DNA PCR 1:Molecular weight marker; 2: PCR product of genomic DNA |
在BMY培养基中添加不同质量的碳源但碳原子的浓度相同,即碳原子的摩尔浓度为0.66mol/L,与20g/L葡萄糖的碳摩尔浓度相同。菌体生长曲线(图 4)显示,以蔗糖作为碳源时,前期的菌体生长速度很慢,到36 h后才有明显的增长。碳源为葡萄糖和甘油时菌体的密度最高,在40 h后达到OD600=27的最大值,且菌体12 h就能进入对数生长期而快速增长。因检测试剂盒的灵敏性问题,碳源为蔗糖、甲醇、山梨醇和甘露醇时,蛋白的表达量低于20 mg/L而无法检测。碳源为甘油和葡萄糖时,摇瓶培养72 h蛋白表达量最高,分别为63 mg/L和68 mg/L。随着培养时间继续延长后,蛋白的表达量有降低的趋势。碳源的优化结果显示,在BMY培养基中当碳源为葡萄糖时最利于重组菌株生长和外源蛋白的表达。

|
| 图 4 不同碳源对菌体的生长影响 Fig. 4 Growth curves with different carbon sources |
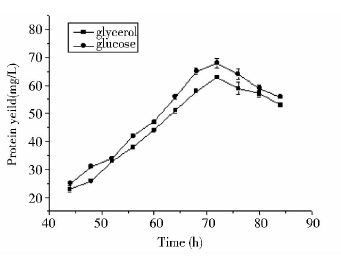
|
| 图 5 摇瓶中碳源为甘油和葡萄糖时发酵上清的蛋白表达量 Fig. 5 Protein yield in flasks with glycerol and glucose carbon sources |
为检测GS115/pGAPZαA/AGGH组成型启动子菌株发酵水平,在5L发酵罐中进行表达。菌体在8 h后就进入对数增长期,到40 h菌浓为OD600=224,达到最高值。在8h后,细胞的大量增长对葡萄糖的消耗速度加大,最大消耗速率在32h的2.53g/(L×h)。发酵进入平台期,葡萄糖的消耗速率也在减缓。从发酵过程(图 6)显示,发酵表达的AGGH含量和菌体浓度呈正相关性,这也是GAP组成型启动子的发酵表达特点。发酵到52 h时蛋白的表达量最高,为238 mg/L,随着发酵时间的延长,蛋白的降解严重而产量出现缓慢降低。

|
| 图 6 GS115/pGAPZαA/AGGH重组菌株的发酵过程 Fig. 6 The process in 5 L-fermentationCell density,protein concentration,and rate of glucose consumption were measured every 4 h |
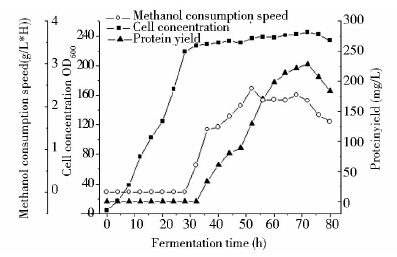
实验室前期构建的菌株GS115/pPIC9K/AGGH的5 L发酵结果(图 7)显示:菌体前期利用甘油作为碳源,28 h时OD600=219达到稳定期,此时开始将碳源转换为诱导碳源(甲醇),菌株开始表达蛋白。AGGH表达量得到快速积累,发酵72 h时蛋白表达量高达228 mg/L。72 h后甲醇的消耗速率下降明显,酵母的活率下降,蛋白的表达量开始下降。
|
| 图 7 GS115/pPIC9K/AGGH重组菌株的发酵过程 Fig. 7 The process in 5 L-fermentationCell density,protein concentration,and rate of glucose consumption were measured every 4 h |
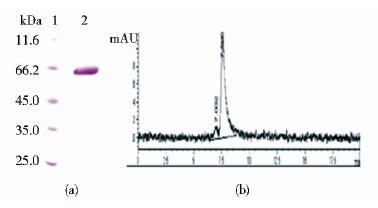
5 L发酵罐停止发酵时的体积为3.8 L。离心收集上清并过滤除菌,用超滤浓缩仪超滤获得浓缩后的蛋白粗样品。粗样品先经过Blue Sepharose柱,用50%的B液除杂,收集100%的B液洗脱液。收集的高盐样品经过Phenyl Sepharose柱,淋洗除色素和杂蛋白,直接用100%的C液洗脱,达到快速置换高盐溶液和除色素的目的。经Phenyl Sepharose置换的低盐溶液直接上样于Q Sepharose柱,收集35% D液洗脱液即为制备的最终样品。一批次纯化过程的参数详见表 1。纯化后的样品经SDS-PAGE检测和SEC-HPLC检测纯度为95.8%。
| Purification step | Volume (mL) | AGGH (mg) | Step recovery (%) | Totle recovery (%) |
| Culture supernatant | 400 | 95.2 | 100.0 | 100.0 |
| Ultrafiltration | 42 | 86.8 | 91.2 | 91.2 |
| Blue sepharose | 34 | 42.7 | 49.2 | 44.8 |
| Phenyl Sepharose | 28 | 35.4 | 82.9 | 37.1 |
| Q Sepharose | 25 | 21.7 | 61.3 | 22.8 |
|
| 图 8 蛋白终样的纯度检测 Fig. 8 Protein purity assessed by HPLC and 12% SDS-PAGE(a) SDS-PAGE of final purified protein 1:Protein molecular weight marker,2:Samples of final purified protein (b) HPLC of final purified protein. The purity was 95.8% |
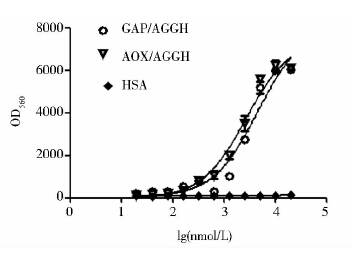
浙江大学周耐明教授利用胚胎肾293细胞共转染胰高血糖素样肽-1受体(GLP-1R)和cAMP响应启动子的萤火虫荧光素基因(CRE-fFlu),筛选获得稳定的细胞株HEK293/GLP-1R/CRE-fFlu[20]。GLP-1类似物与GLP-1R结合后激活胞内的腺苷酸环化酶(AC)使得胞内的cAMP浓度上升,并通过cAMP/PKA途径使CRE响应蛋白磷酸化,磷酸化后的蛋白使得CRE启动子启动而表达荧光素酶。通过检测荧光素酶的含量可以间接反映GLP-1类似物刺激GLP-1R的能力。结果显示,GAP启动子表达的蛋白GAP/AGGH的EC50=2 923nmol/L,AOX启动子表达的蛋白AOX/AGGH EC50=3 118nmol/L,GAP/AGGH蛋白活性略高。
|
| 图 9 样品的活性检测 Fig. 9 Bioactivity of AGGH in HEK293/GLP-1R/CRE-fFlu cells |
目前,我国有大约4 000多万糖尿病患者,其中80%以上为Ⅱ型糖尿病。Ⅱ型糖尿病患者的症状是胰腺长期高负荷地表达胰岛素而功能衰退,具体的细胞表现则是β胰腺细胞的凋亡和分泌胰岛素功能的衰退[21]。GLP-1可以在高血糖的情况下刺激β胰腺细胞分泌胰岛素,并可以减少β胰腺细胞的凋亡同时促进β胰腺细胞的增殖。因此,GLP-1(7-37)成为治疗II型糖尿病的最佳药物选择之一。
表达筛选单克隆时,我们两次逐步提高zeocin抗性浓度在YPDS平板筛选。普遍认为,提高筛选压力来筛选高产量的重组菌株。在高压力下挑选的40株有15株生长出来。生长的单克隆再全部转到摇瓶,通过检测AGGH表达量来筛选。此过程较合理的筛选获得高表达重组菌株。糖酵解过程是酵母利用碳源产能和合成其他产物的主要阶段,GAP即甘油醛-3-磷酸脱氢酶,为糖酵解过程中的关键酶,因此碳源都会刺激GAP的强启动而用于表达外源蛋白。但是用于刺激GAP启动子的最优碳源还没有明确的定论。田小梅[22]在不同碳源培养的毕赤酵母的组学研究中发现,毕赤酵母在不同碳源的培养下胞内外的蛋白酶(降解分泌蛋白)、分子伴侣等成分和含量有很大差异。实验中我们筛选了6种不同碳源对生长和蛋白的表达影响,结果显示葡萄糖有利于蛋白的表达。
利用AOX1启动子在毕赤酵母发酵过程中,碳源先利用甘油来提高酵母的生物量,然后要待甘油完全耗尽后碳源改用甲醇来诱导蛋白表达。在发酵到28 h后(图 7)将碳源由甘油转换为甲醇诱导表达,容易造成酵母的活性下降使得表达减少[23]。甲醇诱导阶段,甲醇补加通常选用与溶氧负向偶联的自动流加,甲醇的流加速度波动幅度较大,酵母利用甲醇的速率有2.1g/(L×h)降低为1.6g/(L×h)。这是由于后期甲醇的毒副作用使得酵母利用甲醇速率降低,酵母死亡率上升,酵母死亡后胞内的蛋白酶释放到胞外而降解分泌的蛋白,使得表达量下降[24]。利用GAP启动子在毕赤酵母发酵过程中,利用GAP的组成型表达,酵母的生物量增长和表达阶段是同步进行的。中间没有碳源的转换,碳源的流加速度也容易控制[25],因此,GAP启动子的发酵表达更加容易和方便。本实验室设计了GLP-1类似物AGGH,即GLP-1(A2G)的二联体与人血清白蛋白的N端融合。并在融合蛋白GGH的N端添加一个丙氨酸作为保护氨基酸,保护GLP-1被二肽基肽酶的降解。并将AGGH利用AOX1启动子在毕赤酵母中进行表达[16]。本研究将高活性的AGGH利用GAP启动子在毕赤酵母中表达。在5 L发酵罐中发酵,利用GAP启动子的发酵时间为52 h、产量为238mg/L,而利用AOX1启动子的发酵时间为72h、产量为228mg/L[16]。GAP启动子表达的蛋白GAP/AGGH的EC50=2 923nmol/L,AOX启动子表达的蛋白AOX/AGGH EC50=3 118nmol/L。两种启动子的表达产量和产物活性相当,但GAP启动子的发酵时间缩短了20h,且发酵培养过程简单方便。
| [1] | Gao M, Shi Z. Process control and optimization for heterologous protein production by methylotrophic pichia pastoris. Chinese Journal of Chemical Engineering, 2013, 21(2): 216-226. |
| [2] | 蒋慧慧, 李丰功, 陆毅,等. 三种酵母启动子在毕赤酵母中的功能比较. 中国生物工程杂志, 2011, 31(5): 60-68. Jiang H H, Li F G, Lu Y, et al. Functional analysis of three promoters from yeast in Pichia pastoris. China Biotechnology, 2011, 31(5):60-68. |
| [3] | Waterham H R, Digan M E, Koutz P J, et al. Isolation of the pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter. Gene, 1997, 186(1): 37-44. |
| [4] | Khasa Y P, Khushoo A, Srivastava L, et al. Kinetic studies of constitutive human granulocyte-macrophage colony stimulating factor (Hgm-Csf) expression in continuous culture of Pichia Pastoris. Biotechnol Lett, 2007, 29(12): 1903-1908. |
| [5] | Chen G H, Yin L J, Chiang I H, et al. Expression and purification of goat lactoferrin from Pichia Pastoris expression system. J Food Sci, 2007, 72(2): M67-M71. |
| [6] | Vogl T, Glieder A. Regulation of Pichia Pastoris promoters and its consequences for protein production. N Biotechnol, 2013, 30(4): 385-404. |
| [7] | Doyle M E, Egan J M. Mechanisms of action of glucagon-like peptide 1 in the pancreas. Pharmacology & Therapeutics, 2007, 113(3): 546-593. |
| [8] | Rondas D, D'Hertog W, Overbergh L, et al. Glucagon-like peptide-1: modulator of beta-cell dysfunction and death. Diabetes Obes Metab, 2013, 15: 185-192. |
| [9] | Donnelly D. The structure and function of the glucagon-like peptide-1 receptor and its ligands. Br J Pharmacol, 2012, 166(1): 27-41. |
| [10] | Kim Y M, Lee S M, Chung H S. Novel aglp-1 albumin fusion protein as a long-lasting agent for type 2 diabetes. Bmb Rep, 2013, 46(12): 606-610. |
| [11] | Qian J. Biological activities of glucagon-like peptide-1 analogues in vitro and in vivo. Biochemistry, 2001, 40(9): 2860-2869. |
| [12] | 路庆鹏, 许正宏, 史劲松,等. 毕赤酵母ste13基因敲除对ggh表达及其生物活性的影响. 中国生物工程杂志, 2013, 33(4): 28-33. Lu Q P, Xu Z H, Si J S, et al. The disruption of STE13 gene in Pichia pastoris improves the expression and bioactivity of GGH. China Biotechnology, 2013, 33(4):28-33. |
| [13] | 窦文芳, 张莲芬, 雷楗勇,等. 人胰高糖素样肽-1及其突变体在大肠杆菌bl21中的表达与生物活性研究. 生物技术通报, 2008, (6): 139-143. Dou W F, Zhang L F, Lei J Y, et al. Expression of human glucagon-like peptide-1 and human glucagon-like peptide-1 mutant gene in BL21. Biotechnology Bullttin of China, 2008, (6): 139-143. |
| [14] | Dou W F, Lei J Y, Zhang L F, et al. Expression, purification, and characterization of recombinant human serum albumin fusion protein with two human glucagon-Like peptide-1 mutants in pichia pastoris. Protein Expres Purif, 2008, 61(1): 45-49. |
| [15] | 耿燕, 任怡琳, 许正宏, 等. 基于胞内camp浓度测定融合蛋白ggh活性的改良方法. 中国生物工程杂志, 2013, 33(11): 63-67. Geng Y, Ren Y L, Xu Z H, et al. An improved method to measure bioactivity of the fusion protein GGH based on the intracellular cAM Plevel. China Biothchnology, 2013, 33(11): 63-67. |
| [16] | Dou W F, Feng J S, Zhang X M, et al. Expression, Purification, and Bioactivity of (Glp-1(A2g))(2)-Hsa Analogs in Pichia pastoris Gs115. Biotechnol Bioprocess Eng, 2013, 18(6): 1076-1082. |
| [17] | Wang J H, Hung W P, Tsai S H. High efficiency transformation by electroporation of yarrowia lipolytica. J Microbiol, 2011, 49(3): 469-472. |
| [18] | Laemmli U K, Zhao K, Hart C, et al. Chromosomal structural loops and functional domains- sars and boundary elements. J Cell Biochem, 1995: 121-121. |
| [19] | 钱凯, 雷楗勇, 关波, 等. 人血清白蛋白和干扰素α2b融合蛋白在毕赤酵母中表达及质量控制. 食品与生物技术学报, 2012, 31(12): 1269-1274. Qian K, Lei J Y, Guan B, et al. Expression and quality control of the recombinant human serum albumin and interferon-alpha2b fusion protein in Pichia pastoris. Chinese Journal of Food Science and Biotechnology, 2012, 31(12): 1269-1274. |
| [20] | 杨雯. 基于报告基因检测系统的g蛋白偶联受体第二信使camp、Ca2+检测方法的建立. 杭州:浙江大学,生命科学学院, 2011. Yang W. The Detection Method of Second Messenger Camp、Ca2+ Based on the Report Gene Detection System of G-protein Coupled Receptor.Hangzhou:Zhejiang University,College of Life Sciences, 2011. |
| [21] | Zhao T C. Glucagon-Like peptide-1 (Glp-1) and protective effects in cardiovascular disease: a new therapeutic approach for myocardial protection. Cardiovasc Diabetol, 2013, 12. |
| [22] | 田小梅, 任建洪, 房聪. 不同碳源下毕赤酵母gs115蛋白组学分析. 中国生物工程杂志, 2012, 32(1): 21-29. Tian X M, Ren J H, Fang C. Proteomic anlysis of Picha pastoris GS115 cultured in different carbon source mediums. China Biotechnology, 2012, 32(1): 21-29. |
| [23] | Jorda J, Suarez C, Carnicer M, et al. Glucose-methanol co-utilization in Pichia pastoris studied by metabolomics and instationary C-13 flux analysis. Bmc Systems Biology, 2013, 7. |
| [24] | Damasceno L M, Huang C J, Batt C A. Protein secretion in Pichia pastoris and advances in protein production. Appl Microbiol Biot, 2012, 93(1): 31-39. |
| [25] | Zhang A L, Luo J X, Zhang T Y, et al. Recent advances on the gap promoter derived expression system of Pichia pastoris. Mol Biol Rep, 2009, 36(6): 1611-1619. |
 2015, Vol. 35
2015, Vol. 35




