文章信息
- 韩双, 杨志丽, 陈丽梅
- HAN Shuang, YANG Zhi-li, CHEN Li-mei
- 过量表达拟南芥CAT提高烟草对气体甲醛的吸收和抗性
- Over Expression of Arabidopsis CAT Improved the Absorption and Tolerance of Gas HCHO in Tobacco
- 中国生物工程杂志, 2015, 35(5): 41-48
- China Biotechnology, 2015, 35(5): 41-48
- http://dx.doi.org/10.13523/j.cb.20150506
-
文章历史
- 收稿日期:2015-01-13
- 修回日期:2015-03-22
甲醛(HCHO)是一种广泛存在的化学物质,它主要用于化工合成﹑工业制造、医药合成等化学领域及其他工业领域,尤其在农药生产领域具有重要作用。甲醛也是一类对人和动物具有毒性的物质,在现代化学农药的生产过程中不可避免的产生大量含甲醛的农药生产废水,这些农药生产废水中除含有大量的甲醛外,还有醇、苯、酚、三聚甲醛、甲缩醛等物质,处理起来十分困难,若含甲醛的农药生产废水直接排放不仅不符合环保要求,并且对动植物都具有严重的危害性[1]。另外,随着生活质量的不断提高,装修已成为现代生活的一部分,而装修所用的材料胶合板、细木工板、中密度纤维板和刨花板等含有大量甲醛,所以甲醛气体成为装修房间中空气污染的主要化学物质之一[2]。因此,对甲醛尤其是室内甲醛的治理显的刻不容缓。
有研究表明,一些植物,包括绿萝[3]、垂叶榕[4]、拟南芥[5]、香蕉叶片[6]及常春藤[7]等对甲醛都有一定的吸收能力,提高观赏植物的甲醛吸收效率将是未来利用生物法研究净化室内甲醛的发展方向。气体甲醛主要通过植物叶片的气孔被吸收进入植物体内。在气孔开放的蓝光反应中,气孔保卫细胞的形状和体积控制了气孔的大小,在光下保卫细胞中的盐浓度升高,导致水分输入、保卫细胞膨胀及气孔开放。向光素作为一个蓝光诱导的受体可启动一系列蓝光介导的信号转导,包括活化质膜H+-ATPase,通过质膜H+-ATPase的泵氢作用提高跨质膜内部的负电势梯度,驱动电压调控的K+通道促使K+内流,钾盐在保卫细胞内的积累,保卫细胞大量吸水,膨压增加最终导致气孔开放[8]。张晓等[9]的研究证实,过氧化氢(hydrogen peroxide,H2O2)抑制保卫细胞中蓝光激活的质膜H+-ATPase脱磷酸化,进而抑制保卫细胞蓝光诱导的H+泵活性。Zhang等[10]的研究也表明逆境信号分子,如H2O2、脱落酸(abscisic acid,ABA)等也参与气孔开放的调节,外源施用H2O2可诱导保卫细胞内钙离子浓度增加,K+浓度降低。Pei等[11]的研究表明,ABA诱导保卫细胞中H2O2的产生,H2O2激活Ca2+通道,促进气孔关闭。
本研究利用植物体内过氧化氢酶对H2O2的清除作用,在烟草中转入拟南芥CAT基因并定位于H2O2主要的产所叶绿体中过量表达,考察转基因烟草对气体甲醛的吸收效率和耐受能力,为利用基因工程操作提高植物吸收甲醛的能力提供新的策略和基因资源。
1 材料与方法 1.1 植物材料野生型拟南芥(Arabidopsis thaliana,columbia)和(WT)烟草(Nicotiana tabacum cv. Xanthi)种子消毒后,播种于MS固体培养基中,待种子发芽后进行继代培养,获得无菌烟草幼苗用于转基因操作。
1.2 过表达载体pk2-PrbcS-*T-CAT的构建根据GenBank数据库中报道的拟南芥CAT基因全长序列(GenBank登录号:145353262)设计带酶切序列(酶切序列为划线部分)的引物。CAT基因上游引物(CAT-SphI):5′-GCATGCATGGATCCTTACAAGTATCGTCCAG -3′,CAT基因下游引物(CAT-XhoI):5′-CTCGAG TTAGATGCTTGGTCTCACGTTCAGA -3′。 提取拟南芥叶片总RNA,反转录为cDNA。以cDNA为模板,用CAT基因上下游引物进行PCR扩增获得CAT基因cDNA全长片段,亚克隆于TA克隆载体(TaKaRa,Japan)中获得pMD18T-CAT载体,用SphI和XhoI双酶切pMD18T-CAT和Gateway的入门载体pENTR-PrbcS-*T-gfp(PrbcS:光诱导型启动子,能实现目的基因在叶片中的高水平表达;*T:叶绿体基因信号肽,引导表达的CAT定位于叶绿体中),将目的基因cDNA编码区亚克隆到pENTR-PrbcS-*T- 载体(经SphⅠ和XhoⅠ双酶切,切除gfp)上,产生入门克隆载体pENTR-PrbcS-*T-CAT。通过Gateway的LR反应使pENTR-PrbcS-*T-CAT和目的载体pK2GW7发生重组反应,产生CAT的植物表达载体。LR反应按照LR反应试剂盒LR ClonaseTM plus Enzyme Mix(Invitrogen)说明书进行,反应混合液混匀后于25℃反应过夜,转化大肠杆菌感受态细胞DH5α,在含有50μg/ml壮观霉素(Spe)的LB培养平板上筛选重组克隆,获得植物过表达载体pk2-PrbcS-*T-CAT。 1.3 根癌农杆菌C58C1(pMP90)介导的pK2-PrbcS-*T-CAT遗传转化
通过电转化法将植物表达载体pk2-PrbcS-*T-CAT转入农杆菌[Agrobacterium tumefaciens C58C1(pMP90)]中,在含有Spe平板上筛选得到阳性克隆,经菌液PCR检测证实含有pk2-PrbcS-*T-CAT的阳性克隆电转化农杆菌。通过农杆菌介导的叶盘转化法转染WT烟草,将转染后的叶片转移到含有卡那霉素(Kan)和头孢噻肟钠(Cef)的芽诱导培养基(MS4)上诱导外植体发芽,约15天继代一次。待芽长大后从外植体上切下转入含Kan和Cef的生根培养基(MS)上诱导根的生长,得到抗Kan的烟草植株。
1.4 转CAT基因的烟草DAN和RNA水平检测用CTAB法从烟草叶片中提取基因组DNA作为模板,分别用CAT的上下游特异引物进行PCR扩增,检测CAT在转基因烟草基因组中的整合情况。用TRIzol Reagent(Invitrogen公司)提取烟草叶片的总RNA,取3μg的总RNA用M-MLV Reverse Transcriptase (Promega公司)反转录合成cDNA,用CAT的上下游特异引物做RT-PCR检测CAT的转录水平。
1.5 转CAT基因烟草的CAT活性检测CAT活性测定参照Aebi[12]的方法进行。
1.6 不同浓度气体甲醛处理转基因烟草试验材料选择温室条件下生长良好、株龄相同的野生型烟草和过量表达拟南芥CAT的转基因烟草盆栽植株。实验前依据宋中邦[13]的方法计算植株总叶面积,然后根据计算出的叶片面积进行植株叶片的调整使得各实验株总叶面积相等。依据宋中邦等的方法测定植株对气态甲醛的吸收速率,由于土壤中存在的微生物可能对试验造成一定的影响,因此我们将种植烟草的花盆用塑料袋套住,以用塑料袋套住而没有种植烟草的花盆为对照(CK)。利用实验室已有的密闭气体甲醛吸收装置进行各株系气体甲醛的吸收实验,密闭的气体甲醛吸收柜中的气体甲醛浓度分别调整为10ppm、20ppm和40ppm,并将各盆栽烟草置于其中每隔5min记录一次吸收柜中的气体甲醛浓度,处理时间为30min,以时间和剩余甲醛浓度作图,得到气体甲醛的吸收曲线。为了始终维持柜中甲醛的气态状态,所用装置中的温度和湿度保持在26~35℃和25%~55%。
1.7 可溶性总糖、可溶性总蛋白质和总叶绿素含量检测收集处理后的植株叶片,液氮充分研磨后,用Tris-HCl(pH 7.4)抽提,根据Yemm和Willis[14]的方法测定可溶性总糖含量。用蛋白质抽提缓冲液[Tris-HCl(pH 8.0) 50mmol/L,甘油10%,β-巯基乙醇10mmol/L,PMSF 1mmol/L,EDTA 2 mmol/L,Insoluble PVP 10%]提取可溶性总蛋白质,用Bradford法测定蛋白质浓度。
总叶绿素含量测定参照李合生[15]浸提法测定。
1.8 H2O2、MDA和PC含量检测H2O2含量测定按Gay和Gebicki[16]的方法;MDA含量测定参照Gurel等[17]的方法;PC含量测定参照王莎莎[18]的方法。
1.9 质膜H+-ATPase活性和氢泵活性检测收集不同浓度甲醛处理后植物的叶片,在液氮中磨碎后用质膜提取液抽提,离心收集上清液。质膜H+-ATPase活性的测定参照Giuseppina和Graziano[19]的方法;氢泵活性的测定参照Shen等[20]的方法。
1.10 气孔导度的检测植株处理30min后移出装置,用yaxin-1301植物气孔计(北京雅欣理仪科技有限公司)测定植株倒3叶(从上往下数第3片真叶)的气孔导度。
1.11 数据统计分析所有的生理生化指标分析均进行3次生物学重复。图中的数值为3组独立实验的均值±SD,用DPS(7.5)中LSD法进行统计学和差异显著性分析。不同字母表示不同处理后指标间的显著性差异(P<0.05)。
2 结果与分析 2.1 CAT过量表达转基因烟草株系的鉴定利用拟南芥CAT的编码区构建植物表达载体pk2-PrbcS-*T-CAT[图 1(a)],用pk2-PrbcS-*T-CAT转化烟草获得具有Kan抗性的转基因株系5个,以基因组DNA为模板,用CAT基因的上下游特异性引物做基因组PCR检测CAT基因在转基因烟草中的插入情况[图 1(b)],结果说明在5个(C1、C2、C3、C4、C5)具有Kan抗性的转基因烟草株系中能够扩增出CAT基因的片段(1.479kb),而对照WT中不能扩增出与转基因株系相同的DNA片段,说明在这5个转基因株系的基因组中有CAT基因插入。RT-PCR分析结果[图 1(c)]说明在WT中不能扩增出1.479kb的CAT cDNA片段,而在5个转基因株系中都扩增出1.479kb的CAT cDNA,说明在这5个转基因植株(C1、C2、C3、C4和C5)中CAT能够正常转录。选择3个(C1、C3和C5)转基因株系和野生型测其CAT活性,结果说明转基因株系的过氧化氢酶活性要明显高于野生型的过氧化氢酶活性,其中C1的CAT活性最高,C5和C3次之[图 1(d)],表明在这3个转基因株系中有CAT过量表达。
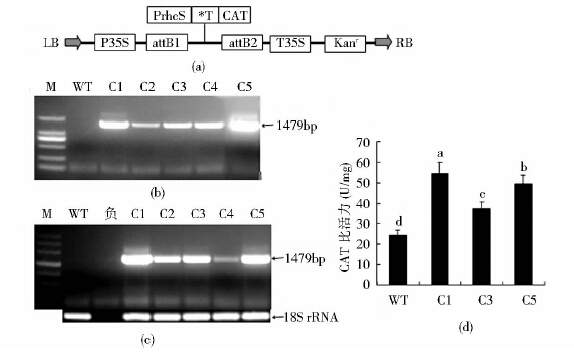
|
| 图 1 过表达载体的构建及转基因烟草的鉴定 Fig. 1 Construction of over expressing vector and identification of transgenic tobacco (a)CAT plant expression vector (b)Genomic DNA PCR (c)RT-PCR (d)CAT activity detection for transgenic tobacco lines M:Indicate DNA marker |
大量继代C1、C3号转基因烟草和野生型烟草,并种植于温室花盆。待烟草生长到一定状态,用于气体甲醛的处理,处理浓度分别为10ppm、20ppm和40ppm,处理时间为30min,测定烟草的甲醛吸收曲线(图 2)。由图 2可知,10ppm、20ppm、40ppm处理时,野生型烟草和转基因烟草甲醛吸收能力出现明显差异,且CAT比活力越大其吸收气体甲醛的能力越强,明显可见野生型烟草吸收气体甲醛的能力最弱。10ppm时,C1、C3、WT吸收的甲醛分别为85.1%、79.9%、70%[图 2(a)];20ppm时,C1、C3、WT吸收的甲醛分别为60%、51%、42%[图 2(b)];40ppm时,C1、C3、WT吸收的甲醛分别为30%、22%、17.5%[图 2(c)];这些结果表明CAT基因在烟草中的过量表达可提高其对甲醛的吸收。
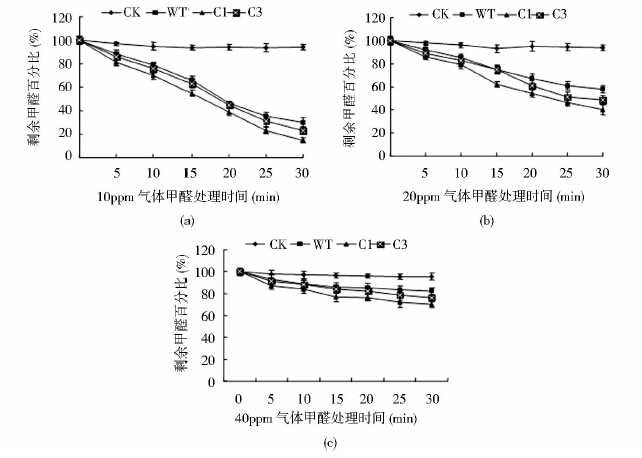
|
| 图 2 转基因烟草吸收不同浓度气体HCHO的动力学曲线 Fig. 2 Uptake kinetics of formaldehyde (HCHO) by transgenic tobacco in gas HCHO stress(a)Remaining HCHO in the 10ppm gas HCHO treatment (b) Remaining HCHO in the 20ppm gas HCHO treatment (c) Remaining HCHO in the 40ppm gas HCHO treatment |
10ppm、20ppm和40ppm的气体甲醛处理30min后,WT和转基因植株的可溶性总糖含量均随着处理浓度的上升而上升,其中C1号的总糖含量上升最为明显,且一直显著高于WT,C3也一直高于WT[图 3(a)]。WT可溶性总蛋白的含量随着处理浓度的升高出现显著性降低,转基因植株在40ppm时才有明显的下降,且WT可溶性总蛋白质含量始终显著低于转基因植株[图 3(b)]。C1、C3转基因烟草可溶性糖的含量显著性上升、可溶性总蛋白质降低趋势低于WT,说明转基因植株对甲醛胁迫的耐受性明显强于野生型。WT的总蛋白质含量出现的显著性下降,可能是由于甲醛胁迫导致了相关基因的表达有所下降,致使植物体内蛋白质水平下降,而甲醛胁迫也会促使一部分可溶性蛋白质降解。
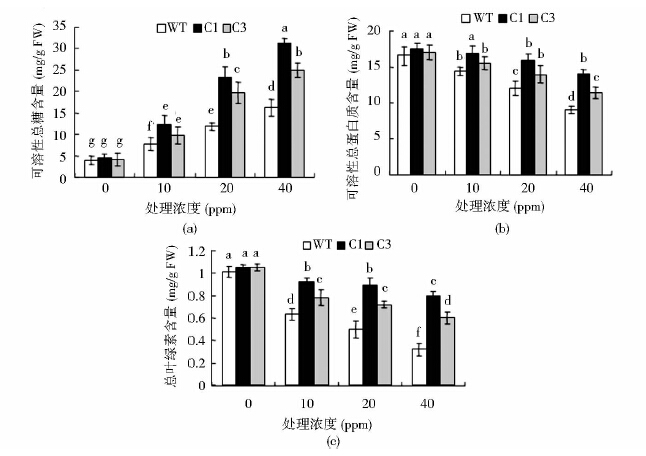
|
| 图 3 气体甲醛胁迫下烟草可溶性总糖、可溶性总蛋白质和叶绿素含量的变化 Fig. 3 Changes of total soluble glucide,soluble protein and chlorophyll content in tobacco leaves under gas HCHO stress(a) Changes of total soluble glucide content in tobacco leaves (b) Changes of total soluble protein content in tobacco leaves (c) Changes of chlorophyll content tobacco leaves |
10ppm、20ppm处理转基因烟草叶片,细胞中的总叶绿素含量没有出现显著性变化,40ppm时C1总叶绿素含量仍没有显著变化,C3总叶绿素含量有所降低,WT在3个浓度处理下总叶绿素含量都降低,且降低幅度大大高于C1、C3[图 3(c)]。说明在烟草中过量表达拟南芥CAT基因能有效降低甲醛对植物的毒害作用,使转基因烟草叶片能在较高浓度甲醛胁迫下保持较好生命活力和甲醛吸收能力。
2.4 甲醛处理后烟草叶片H2O2、MDA、PC含量测定10ppm、20ppm、40ppm气体甲醛胁迫处理30min后,WT和转基因植株H2O2的含量都随着处理浓度的上升而上升,其中野生型植株中上升的最为明显,40ppm约是C1、C3的1.42倍、1.14倍[图 4(a)],说明高浓度甲醛处理后会导致烟草细胞内H2O2积累,细胞受到氧化损伤。比较丙二醛(MDA)含量可知,随着处理浓度的升高WT中的MDA含量增长速率远大于转基因植株,最后分别为C1、C3的1.27倍、1.11倍[图 4(b)];比较羰基化蛋白(PC)含量可知,随着处理浓度的升高WT中的PC含量增长显著,在40ppm处理后其PC含量明显高于转基因植株,分别为C1、C3的1.31倍、1.23倍[图 4(c)]。说明甲醛胁迫会导致烟草中膜脂过氧化和蛋白质过氧化水平的显著性升高,但是通过在烟草叶片叶绿体中过量表达CAT基因能有效地降低这种氧化胁迫的发生,提高植物对气体甲醛的吸收速率和抗性。
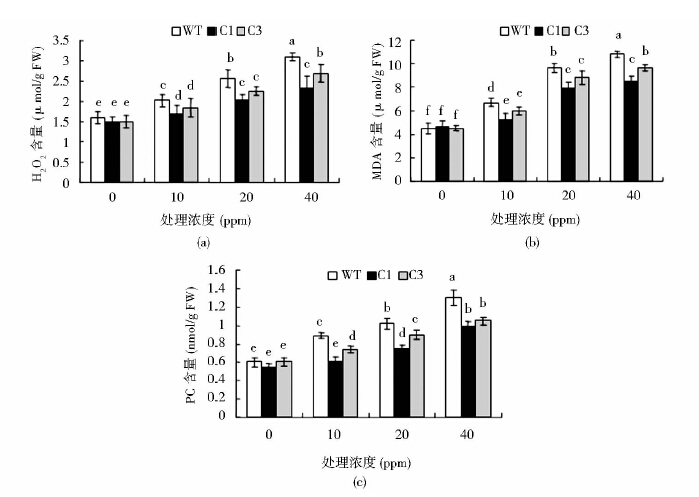
|
| 图 4 气体甲醛胁迫下烟草叶片中H2O2、MDA和PC含量的变化 Fig. 4 Changes of H2O2、MDA and PC content in tobacco leaves under gas HCHO stress(a) Changes of H2O2(hydrogen peroxide) content in tobacco leaves (b) Changes of MDA(malondialdehyde) content in tobacco leaves (c) Changes of PC(Protein carbonyl)content in tobacco leaves |
10ppm、20ppm、40ppm气体甲醛胁迫处理30min后,转基因植株和野生型植株的气孔导度都有显著下降,在40ppm时表现的最显著,WT和C1、C3相比较未处理时其气孔导度分别下降了83%、64%、73%[图 5(a)]。结果说明,随着甲醛浓度的升高,转基因植株的气孔导度的下降幅度都显著小于野生型植株,表明在甲醛胁迫时,转基因植株气孔对气体甲醛的耐受比WT明显。
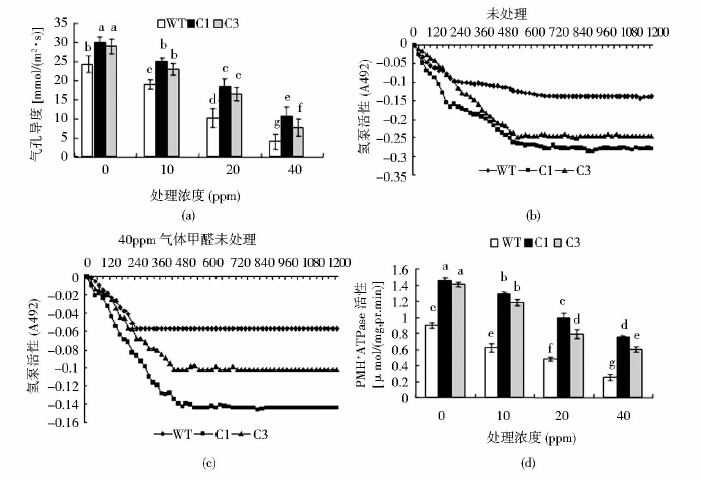
|
| 图 5 气体甲醛胁迫下烟草叶片气孔导度、PM H+-ATPase及氢泵活性测定 Fig. 5 Determination of stomatal conductance,plasma membrane H+-ATPase and hydrogen pump activity in tobacco leaves under gas HCHO stress(a)Changes of stomatal conductance of tobacco leaves (b) Hydrogen pump activity of unprocessed tobacco leaves (c)Hydrogen pump activity of tobacco leaves under 40ppm gas HCHO stress;(d) Plasma membrane H+-ATPase activity in tobacco leaves under gas HCHO stress |
有研究表明,在逆境胁迫下植物质膜H+-ATPase的活性升高有利于植物适应逆境环境,而植物生长发育遭到抑制的主要原因是由于质膜H+-ATPase的活性降低[20]。10ppm、20ppm、40ppm气体甲醛胁迫处理30min后,烟草叶片的PM H+-ATPase活性和氢泵活性都降低,但转基因植株的PM H+-ATPase活性和氢泵活性始终高于WT,在40ppm时,C1、C3的PM H+-ATPase活性分别是WT的3倍、2.4倍[图 5(d)],C1、C3的氢泵活性分别是WT的2.5倍、1.78倍[图 5(c)]。结果说明,随着甲醛浓度的升高,WT吸收甲醛的能力与转基因植株的差距越来越大。
3 讨 论据报道,植物体内的可溶性糖含量的高低能反映其对有害物质的脱毒能力,甲醛胁迫诱导逆境蛋白质的产生,植物可溶性蛋白质含量与其对逆境的耐受性有关[21],叶绿素的含量与植物的光合作用密切相关,叶绿素含量下降将导致光合作用速率下降,能反映植物在逆境胁迫下的生命活力[13]。本研究中随着处理浓度的升高,转基因植物(C1、C3)的可溶性总糖含量、总蛋白质含量和总叶绿素含量都显著高于野生型植株,这表明转入的拟南芥CAT基因能有效改善植物对气体甲醛的脱毒作用,增强植物甲醛的耐受性并保持较好的生命活力。经浓度梯度气体甲醛处理后,野生型和转基因株系的H2O2、丙二醛(MDA)和羰基化蛋白(PC)的含量都有所升高,而在过量表达拟南芥CAT基因烟草中各氧化损伤指标[13, 22]都小于野生型,说明过量表达拟南芥CAT能增强烟草对甲醛的抗性,降低甲醛进入细胞引起的氧化损伤。另有研究表明,植物质膜H+-ATPase参与植物的各种抗逆境胁迫和各种信号转导途径[23, 24]。本研究中在不同浓度气体甲醛处理植株时,转基因株系和野生型的PM H+-ATPase活性和氢泵活性是都是下降的,但在相同处理浓度下转基因株系二者的活性始终高于野生型,因此推断这可能是转基因植株表现出较强的抗逆性且能吸收更多气体甲醛的原因之一。经典的气孔开放理论[25]表明,PM H+-ATPase活性和氢泵活性的增强,会引起植物气孔保卫细胞开放,从而增强叶片的气孔导度,这与本研究的结果相符,也是植物甲醛吸收效率提高的先决条件。
| [1] | 金凯洪,王宝荣,李磊,等.农药废水中甲醛资源化回收的应用研究//持久性有机污染物论坛2010暨第五届持久性有机污染物全国学术研讨会论文集,持久性有机污染物论坛2010暨第五届持久性有机污染物全国学术研讨会, 2010, 南京:中国化学会, 2010: 212-213. Jin K H,Wang B R, Li L, et al. Application of Formaldehyde Resources Recycling on Pesticide Wastewater//POPs Forum 2010 cum Proceedings of the Fifth Persistent Organic Pollutants National Symposium .POPs Forum 2010 cum and the Fifth Persistent Organic Pollutants National Symposium, 2010, Nanjing:Chinese Chemical Society, 2010: 212-213. |
| [2] | 宋春生.室内空气污染的来源及危害.福建环境, 2001,18(5): 38-41. Song C S. Sources and harm of indoor air pollution. Fujian Environment, 2001, 18(5): 38-41. |
| [3] | Wolverton B C, Mcdonald R C, Watkins E A. Foliage plants for removing indoor air pollution from energy-efficient homes. Economic Bitany, 1984, 38(2): 224-228. |
| [4] | Schmitz H, Hilgers U, Weidner M, et al. Assimilation and metabolism of formaldehyde by leaves appear unlikely to be of value for indoor air purification. New Phytologist, 2000, 147(2): 307-315. |
| [5] | Wang S S, Song Z B, Sun Z, et al. Physiological and transcriptional analysis of the effects of formaldehyde exposure on Arabidopsis thaliana. Acta Physiologiae Plantarum, 2012, 34(3):923-936. |
| [6] | Zeng Z D, QI C J, Chen Q, et al. Absorption and metabolism of formaldehyde in solutions by detached banana leaves. Journal of Bioscience and Bioengineering, 2014, 117(5): 602-612. |
| [7] | 赵辉,郝振萍,金潇潇,等.甲醛污染对3种室内观赏植物叶片保护酶活性的影响.安徽农业科学,2009, 37(32): 55-57. Zhao H, Hao Z P, Jin X X, et al. The effect of protection enzyme activity of 3 indoor ornamental plant leaves under formaldehyde pollution. Agricultural Science of AnHui, 2009, 37(32): 55-57. |
| [8] | Christie J M, Briggs W R. Blue light sening in higher plants. J. Biol. Chem, 2001, 276 (15): 11457-11460. |
| [9] | 张晓,岛崎研一郎.过氧化氢抑制蓝光诱导的14-3-3蛋白与向光素的结合.科学通报,2005,8(50):836-838. Zhang X, Shimazaki. Hydrogen peroxide inhibited that 14-3-3 proteins induced by Blue light combined with PHOT. Chinese Science Bulletin, 2005,8(50): 36-838. |
| [10] | Zhang X, Zhang L, Dong F, et al. Hydrogen peroxid is involved in abscisic acid-induced stomatal closure in Vicia faba. Plant Physiology, 2001, 126: 1438-1448. |
| [11] | Pei Z M, Murata Y, Benning G, et al. Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells. Nature, 2000, 406(6797): 731-744. |
| [12] | Aebi H.Catalase in vitro. Methods in Enzymology, 1984, 105:121-126. |
| [13] | 宋中邦. 提高天竺葵甲醛修复能力的遗传操作及模式植物甲醛代谢途径分析.昆明:昆明理工大学,生命科学与技术学院,2010,21-22. Song Z B. The genetic manipulation for enhancing formaldehyde phytoremediation ability of geranium and the analyses on formaldehyde metabolic pathways in model plants. Kanming:Kunming University of Science and Technology, Faculty of Life Science and Technology,2010, 21-22. |
| [14] | Yemm E W, Willis A J. The estimation of carbohydrates in plant extracts by anthrone. Biochem J, 1954, 57(3): 508-514. |
| [15] | 李合生.植物生理生化实验原理和技术.北京:高等教育出版社, 2003:143-145. Li H S. The Principle and Technology of Plant Physiology and Biochemistry Experiment. BeiJing: Higher Education Press, 2003:143-145. |
| [16] | Gay C A, Gebicki J M. Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method. Anal Biochem, 2003, 315(1): 29-35. |
| [17] | Gurel A O, Coskun F, Armutcu, et al. Vitamin E against oxidative damage caused by formaldehyde in frontal cortex and hippocampus: biochemical and histological studies. Journal of Cheical Neuroanatomy, 2005,29(3):173-178. |
| [18] | 王莎莎. C1化合物影响拟南芥和烟草生长的生理基础和分子机理研究. 昆明:昆明理工大学,生命科学与技术学院,2012,55-56. Wang S S. Study on Physiological Basis and Molecular Mechanism of Arabidopsis and Tobacco Growth Effects of C1 Compounds. Kunming:Kunming University of Science and Technology, Faculty of Life Science and Technology,2012.55-56. |
| [19] | Giuseppina R, Graziano Z. Plasma membrane-bound H+-ATPase and reductase activities in Fe-defident cucumber roots. Physiologia Plantarum, 1994, 90(4):779-785. |
| [20] | Shen H, He L F, Sasaki T, et al. Citrate secretion coupled with the modulation of soybean root tip under aluminum stress. up-regulation of transcription, translation, and threonine-oriented phosphorylation of plasma membrane H+-ATPase. Plant Physiology, 2005, 138(1):287-296. |
| [21] | Chen W R, Liu M, Xu G D, et al. Effects of applicated on alleviation of aluminum toxicity to soybean. Journal of Zhejiang Normal University, 2008, 31(2):201-207. |
| [22] | Andrew D, Saori M, Hans B. Expression profiling of the response of Arabidopsis thaliana to methanol stimulation. Phytochemistry, 2004,65(16):2305-2316. |
| [23] | Serrano R. Structure and function of proton translocating ATPases in plasma membrane of plants and fungi. Bioch Bio Phy Acta, 1988, 947(1):1-28. |
| [24] | Serrano R. Structure and function of plasma membrane ATPase. Plant Biology, 1989, 40: 61- 94. |
| [25] | Christie J M, Briggs W R. Blue light sening in higher plants. The Journal of Biological Chemistry, 2001, 276(15):11457-11460. |
 2015, Vol. 35
2015, Vol. 35




