文章信息
- 张旭宁, 权春善, 廖颖玲, 柳科欢, 熊文, 范圣第
- ZHANG Xu-ning, QUAN Chun-shan, LIAO Ying-ling, LIU Ke-huan, XIONG Wen, FAN Sheng-di
- 金黄色葡萄球菌双组分系统反应调节蛋白AgrA的原核表达、纯化及活性鉴定
- Expression,Purification and Identification of AgrA, a Response Regulator Protein of Two-component Signal Transduction System in Staphylococcus aureus
- 中国生物工程杂志, 2015, 35(5): 32-40
- China Biotechnology, 2015, 35(5): 32-40
- http://dx.doi.org/10.13523/j.cb.20150505
-
文章历史
- 收稿日期:2015-01-22
- 修回日期:2015-03-11
2. 大连民族学院生物技术与资源利用国家民委-教育部重点实验室 大连 116600;
3. 大连民族学院生命科学学院 大连 116600
2. Key Laboratory of Biotechnology and Resource Utilization, State Ethnic Affairs Commission and Ministry of Education, Dalian Nationalities University, Dalian 116600, China;
3. Department of Life Science, Dalian Nationalities University, Dalian 116600, China
金黄色葡萄球菌是一种革兰氏阳性菌,在自然界分布广泛,可通过多种不同途径传播,能引起人和动物的感染[1, 2, 3]。随着抗生素的广泛使用,出现越来越多的耐药金黄色葡萄球菌株,并且呈现多重耐药性的趋势。金黄色葡萄球菌的致病性与其毒力因子有关,而毒力因子的释放主要受附属基因调节系统(accessory gene regulator,agr)调控[4]。agr系统包含一个由信号转导因子AgrC和反应调节子AgrA组成的双组分信号转导系统(TSCT)[5]。膜蛋白AgrC作为信号转导因子,能被外界环境中的同源信号分子AIP激活,发生自我磷酸化,磷酸化的AgrC将磷酸基团转移给AgrA使其磷酸化,活化后的AgrA可以与下游启动子RNAII和RNAIII间的重复序列发生特异性的结合,从而调控agr的转录与表达。RNA III作为agr的效应器,与多种毒力因子的表达有关,若被激活就可促进毒力因子的转录与表达[6, 7, 8]。
AgrA蛋白的C端包含一个能与DNA结合的LytTR区域[9],该区域存在于许多常见的致病菌中,但是在人体中并未发现LytTR同源序列。因此,如果能够以LytTR区域为靶点,找到一种能够抑制AgrA与DNA结合的化合物,从而阻断agr系统信号通路,将为金黄色葡萄球菌感染的治疗和新药的开发提供新的途径。然而,在AgrA异源表达过程中,往往在获得高水平表达的同时,容易被宿主蛋白酶降解或形成包涵体,不利于目的蛋白功能活性的研究。这一过程主要受载体、宿主菌株、培养基成分及外源蛋白表达速率等因素影响[10]。为了获得高表达量的可溶性AgrA,本文首先将GFP蛋白融合至AgrA蛋白末端作为报告蛋白[11, 12, 13],通过测定融合蛋白AgrA-GFP的荧光强度来实时检测蛋白质表达量。首先通过单因素和多因素分析实验,分离出高表达量的宿主菌株,优化出AgrA蛋白最适表达条件,然后纯化出大量的AgrA;最后基于AgrA蛋白LytTR区域的非放射性EMSA(方便起见,下文简写为EMSA) 实验验证AgrA蛋白的活性。本文提出了反应调节蛋白AgrA在大肠杆菌高效可溶性表达的策略,为双组分信号转导系统的体外研究打下基础,也为其他反应调节蛋白的可溶性表达与分离纯化提供了一个可行借鉴。 1 材料与方法 1.1 材 料 1.1.1 菌株、质粒与培养基
质粒pET-28a(+)、pET-28a(+)-GFP及宿主菌,金黄色葡萄球菌,BL21(DE3),Tuner(DE3),C41(DE3),C43(DE3),BL21-(DE3)-PlysS,BL21-CodonPlus- (DE3)-RIL,菌株都来自本实验室;三种细菌培养基配方如下,TBE: 2.4% (m/V) yeast extract,1.2% (m/V) peptone,0.4% (V/V) glycerol,2mmol/L MgSO4,20mmol/L KH2PO4,80mmol/L K2HPO4; TB: 2.4% (m/V) yeast extract,1.2% (m/V) peptone,0.4% (V/V) glycerol,20mmol/L KH2PO4,80mmol/L K2HPO4; 32Y: 3.2% (m/V) yeast extract,0.8% (m/V) peptone和0.58% (m/V) NaCl溶于10mmol/L Tris-HCl,pH 7.6。 1.1.2 主要试剂
EMSA Buffer (20mmol/L Na2HPO4,100mmol/L NaCl,10mmol/L DTT,2.5% DMSO,pH 7.0)。PBS-T(0.5% Tween-20,2.7mmol/L KCl,137mmol/L NaCl,10mmol/L Na2HPO4,2mmol/L KH2PO4)、DNA marker、切胶回收试剂盒购自宝生物(大连)有限公司,质粒提取试剂盒、Western blot试剂盒、一抗Anti-Hismouse、二抗Rabbit-Anti-Mouse、蛋白质相关marker购自北京全式金生物技术有限公司,PVDF膜购自BBI公司,脱脂牛奶购自上海生物工程有限公司,层析填料购自GE Healthcare,引物合成及测序由上海生物工程有限公司完成。 1.2 方 法 1.2.1 表达载体的构建
本文采用无限制克隆(restriction free cloning,RF cloning)的方法[14, 15]构建表达载体 pET-28a(+)-AgrA-GFP,首先设计PCR反应需要的引物,正反引物序列如表 1所示,利用高保真HS DNA聚合酶将agrA基因(GenBank: JQ066322.1)连接到pET-28a(+)载体中,构建重组载体pET-28a(+)-AgrA。
PCR结束后,利用DpnI酶能特异识别并消化甲基化位点的特性,去掉空载体。将重组载体电转导入DH5α感受态细胞,提取质粒,1%琼脂糖凝胶电泳先验证构建质粒大小与理论是否一致,若一致,测序。若测序正确,按照上述同样的方法,将gfp基因导入构建好的pET-28a(+)-AgrA载体中,构建pET-28a(+)-AgrA -GFP载体。
| Name | Sequences |
| AgrA-F | TGTTTAACTTTAAGAAGGAGATATACCATGAAAATTTTCATTTGCGAAGAC |
| AgrA-R | AGCCGGATCTCAGTGGTGGTGGTGGTGGTGTATTTTTTTAACGTTTCTCAC |
| GFP-F | TGCATCGGTGAGAAACGTTAAAAAAATAACTTCCACCTCCGCCATGAGTAAAGGAGAAG |
| GFP-R | GGGCTTTGTTAGCAGCCGGATCTCAGTGGTGGTGGTGGTGGTGTTTGTATAGT TCATCC |
| Note:Underlined sequences is the sequences of carrier,the rest is the sequences of purpose gene in the primer of agra. In the primer of GFP-F,underlined sequences is the sequences of agra 3′ end sequences,the underline tag with point is connection sequences between agra and gfp,the remaining is the sequences of gfp; In the primer of GFP-R,underlined sequences is the sequences of carrier,the rest is gfp sequences | |
为获得高表达量的融合蛋白AgrA-GFP,从宿主菌、培养基、温度、诱导时间、转速和IPTG浓度等几个方面优化表达条件。宿主菌株包括BL21(DE3)、Tuner(DE3)、C41(DE3)、C43(DE3)、BL21(DE3)-PlysS、BL21-CodonPlus(DE3)- RIL;培养基包括TBE、TB和32Y;温度设置了15℃、20℃、25℃和30℃ 4个梯度;诱导时间包括8h、12h、18h、24h、30h;转速包括120r/min、180r/min、240r/min;IPTG浓度包括0.1mmol/L、0.2mmol/L、0.3mmol/L、0.4mmol/L、0.5mmol/L 五个梯度。首先利用单因素分析的方法分别筛选这几个影响因素对蛋白质表达量的影响,筛选出影响显著的因素。在单因素实验的基础之上,通过Design Expert 8.0.6 软件对诱导时间、转速和IPTG浓度这3个影响显著的因素,设计三因素三水平的Box-Behnken(BB)实验,探究三者对蛋白质表达水平的影响并优化出最佳表达条件。具体Box-Behnken(BB)实验的各因素水平值见表 2。
| Factor | Code | Level | ||
| -1 | 0 | +1 | ||
| Induction time (h) | A | 12 | 18 | 24 |
| n (r/min) | B | 120 | 180 | 240 |
| IPTG (mmol/L) | C | 0.2 | 0.35 | 0.5 |
取200μl诱导表达的宿主菌液,PBS缓冲液洗3次后悬浮,利用BioTeK酶标仪,在激发波长为485/20nm,发射波长为510/20nm条件下,测定菌体的荧光强度,根据荧光强度的高低来确定蛋白质的表达水平。
利用荧光显微镜观察诱导后的表达菌株,取10μl滴在载玻片上,盖上盖玻片,先用低倍镜观察,后在盖玻片上滴上一滴香柏油,换100×物镜观察,图像调整清楚后,拍照保存。 1.2.4 AgrA-GFP蛋白的纯化和Western blot分析
宿主菌BL21-(DE3)-PlysS-AgrA-GFP诱导表达后,8 000g,4℃离心10min收集菌体,PBS缓冲液洗3次后悬浮,最后菌体密度达到100mg/ml,在菌悬液中加入终浓度为1mmol/L MgCl2、20mmol/L咪唑、50ml/tablet蛋白酶抑制剂混合物和100U/ml DNase混合孵育1h,然后在4℃、1 000bar压力下对菌体进行低温超高压破碎3次,收集到的破碎菌液经5 000×g、15min离心收集上清液,收集到的上清液24 000×g、25min离心后,收集上清液。
利用金属离子螯合层析(immobilized metal affinity chromatography,IMAC)和尺寸排阻层析(size exclusion chromatography,SEC)对目的蛋白质进行纯化。由于目的蛋白上含有His位点,所以可以通过Western blot 的方法对纯化到的蛋白质进行验证。利用半干式转膜仪将蛋白质转到PVDF膜上,电流大小约为2mA/cm2凝胶,转膜时间为60min. 转完膜后用5%脱脂牛奶封闭2h,PVDF膜用一抗Anti-Hismouse(1∶10 000稀释)孵育2h,取出PVDF膜,用PBS-T洗涤5min×5次。将二抗Rabbit-Anti-Mouse按照1∶10 000比例稀释后,将膜放入其中,孵育2h后,取出PVDF膜,用PBS-T洗涤5min×5次。利用Western blot试剂盒配制发光液2ml,将PVDF膜沥干,完全浸入发光液中,取出PVDF膜,沥干后放入压片夹中,在暗室中放入X射线片,显影定影并冲洗,最后晾干,观察蛋白质免疫印迹条带。可以参考文献[16]。 1.2.5 AgrA蛋白活性的检测
金黄色葡萄球菌的agr系统包含两个启动子P2和P3,P2和P3之间的序列包含4个AgrA的结合位点[17],据此,人工合成101bp核心序列,序列见表 3,稀释至1μmol/L备用。
| 名称 | 序列 |
| DNA -F | CCTAACTGTAGGAAATAAATACTTAACTGTTAAATGTAATTTGTATTTAATATTTTAACATAAAAAAATTTACAGTTAAGAATAAAAAACGACTAGTTAAG |
| DNA -R | CTTAACTAGTCGTTTTTTATTCTTAACTGTAAATTTTTTTATGTTAAAATATTAAATACAAATTACATTT AACAGTTAAGTATTTATTTCCTACAGTTAGG |
利用EMSA检测AgrA蛋白活性,反应体系为10μl,实验设置了6组,除了对照组6外,每组实验中加入等量的DNA,而AgrA蛋白的量逐渐减少,具体反应体系见表 4。混匀后室温反应30min,6%聚丙烯酰胺凝胶电泳,65V,电泳结束后首先Gel-red染色并在凝胶成像仪中观察拍照,然后考马斯亮蓝染色、脱色观察凝胶中蛋白质条带。
| 反应体系 | 反应试剂 | 1 | 2 | 3 | 4 | 5 | 6 |
| DNA (1μmol/L) | 2μl | 2μl | 2μl | 2μl | 2μl | 0 μl | |
| 10μl | AgrA (2.5μg/μl) | 4 μl | 3 μl | 2 μl | 1 μl | 0μl | 0.5 μl |
| 反应缓冲液 | 4μl | 5 μl | 6 μl | 7 μl | 8 μl | 9.5 μl |
为了快速筛选AgrA的宿主表达菌株并优化其表达条件,利用RF法构建了两种表达载体,pET-28a(+)-AgrA和pET-28a(+)-AgrA-GFP。由于GFP基因连接在AgrA的C端,在蛋白质表达过程中,可以通过荧光强度实时监测蛋白质的表达水平。
PCR扩增目的基因agrA (714bp),切胶纯化后利用1%琼脂糖凝胶电泳检测,如图 1(a)所示。纯化得到的片段大小与预期大小一致,表明agrA基因扩增成功。然后将agrA基因连接到质粒pET-28a(+)中,得到重组载体pET-28a(+)-AgrA,电泳检测结果如图 1(b)所示,片段大小为5 026~6 133bp,与预期大小一致,测序结果正确,说明重组载体pET-28a(+)-AgrA构建成功,质粒图谱如图 1(c)所示。
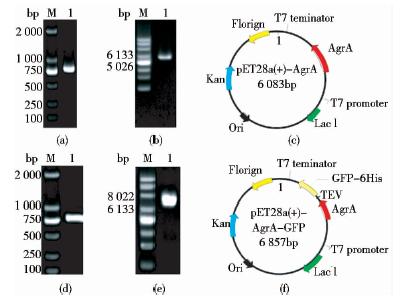
|
| 图 1 质粒载体pET-28a(+)-AgrA和pET-28a(+)-AgrA-GFP的构建 Fig. 1 Construction of plasmid pET-28a(+)-AgrA and pET-28a(+)-AgrA-GFP (a) Identification of agrA gene fragment M:DL2000 DNA marker; 1: agrA gene fragment (b) Identification of plasmid pET-28a(+)- AgrA M:Supercoiled DNA ladder marker;1: Plasmid pET-28a(+)-AgrA (c) Map of the recombinant pET-28a(+)-AgrA (d) Identification of gfp gene fragment M:DL2000 DNA marker; 1: gfp gene fragment (e) Identification of plasmid pET-28a(+)-AgrA- GFP M:Supercoiled DNA ladder marker;1: Plasmid pET-28a(+)-AgrA- GFP (f) Map of the recombinant pET-28a(+)-AgrA- GFP |
PCR扩增目的片段gfp(714bp),切胶纯化后利用1%琼脂糖凝胶电泳检测,如图 1(d)所示,纯化后的片段大小与预期大小一致,表明gfp基因扩增成功。将目的片段gfp连接到重组载体pET-28a(+)-AgrA,得到重组表达载体pET-28a(+)-AgrA- GFP,1%琼脂糖凝胶电泳检测后片段大小为6 133~8 023bp,如图 1(e)所示,重组载体pET-28a(+)-AgrA-GFP构建成功,质粒图谱如图 1(f)所示。 2.2 表达菌株的筛选
宿主菌株类似于一个“微观加工厂”,每种菌株中包含的表达元件有所差异,在表达外源基因时产生较大差别。因此,筛选出高表达的宿主菌株对表达外源基因具有决定性的作用。
将构建的重组表达载体pET-28a(+)-AgrA-GFP分别电转导入下面6种宿主表达菌株[BL21(DE3)、Tuner(DE3)、C41(DE3)、C43(DE3)、BL21-(DE3)-PlysS和BL21- CodonPlus(DE3)-RIL]中。诱导表达后,测量每种菌株的荧光强度,从而筛选出最好的表达菌株。如图 2所示,从荧光强度来看,重组蛋白在宿主菌BL21-(DE3)- PlysS中发光强度最大,间接说明AgrA-GFP融合蛋白在BL21- (DE3)-PlysS宿主菌中表达量最高。所以在后面的实验过程中,都以BL21-(DE3)-PlysS作为表达菌株。吸取10μl诱导后的BL21-PlysS-AgrA-GFP菌液制成载玻片,在荧光显微镜下观察,能清晰看到大肠杆菌发出绿色的荧光,进一步说明融合蛋白已经成功表达。
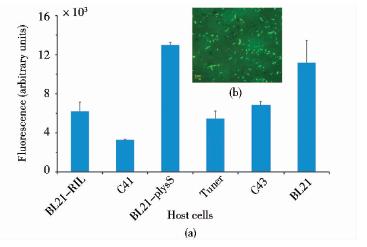
|
| 图 2 表达菌株的筛选Fig. 2 Screening of the hosts cells (a) Whole-cell fluorescence of six host strains [BL21(DE3),Tuner(DE3),C41(DE3),C43(DE3),BL21-(DE3)-PlysS,BL21-CodonPlus- (DE3) -RIL] (b) Fluorescence microscopy image of cell expressed AgrA-GFP in E.coli BL21-(DE3)-PlysS |
利用Design Expert 8.0.6 软件设计Box-Behnken(BB)实验,进行响应面分析 (RSM)。通过等高线图和三维响应面图能形象的观察各因素对响应值的影响,并能清晰观察出各因素之间的交互作用。本文在单因素实验基础之上,筛选出了诱导时间(h)、转速(r/min)、IPTG(mmol/L)3个影响显著的因素,利用Design Expert 8.0.6 软件对诱导时间(h)、转速(r/min)、IPTG(mmol/L)3个因素进行多因素分析,综合考察其对发光强度的影响,表 5列出了根据Design Expert 8.0.6 软件所设计的BB实验方案以及所得到的实验值。
| Number | Time(h) | n(r/min) | IPTG (mmol/L) | Fluorescence(ALU) |
| 1 | 1 | -1 | 0 | 17 118 |
| 2 | 0 | 0 | 0 | 19 124.5 |
| 3 | 0 | -1 | 1 | 15 321 |
| 4 | 0 | 1 | 1 | 19 874 |
| 5 | 0 | -1 | -1 | 12 421 |
| 6 | 0 | 1 | -1 | 18 875 |
| 7 | -1 | 0 | 1 | 14 452 |
| 8 | -1 | -1 | 0 | 9 858 |
| 9 | 1 | 1 | 1 | 20 568 |
| 10 | -1 | -1 | 0 | 12 441 |
| 11 | 0 | 0 | 0 | 19 192 |
| 12 | 1 | 1 | 0 | 20 372 |
| 13 | 0 | 0 | 0 | 18 762 |
| 14 | 1 | 1 | -1 | 18 005 |
| 15 | 0 | 0 | 0 | 18 970.5 |
| 16 | -1 | -1 | -1 | 13 596.5 |
| 17 | 0 | 0 | 0 | 19 139 |
利用 Design Expert 8.0.6 软件对表 5中的数据进行方差分析,以融合蛋白的发光强度为响应值,方差分析结果如表 6所示,该模型P<0.000 1显著,失拟项P=0.386 0>0.05不显著,说明此模型能够包含所有的实验数据,由实验误差导致的不能拟合现象可以忽略,由表 6可以看出,时间(A) (P<0.000 1)、转速(B) (P<0.000 1)、IPTG(C) (P<0.000 1)对融合蛋白的发光强度均具有显著影响;两两因素交互实验发现,时间-转速(P=0.111 4)对实验结果影响不显著;时间-IPTG (P=0.004 4)、转速-IPTG (P=0.002 8)对融合蛋白的发光强度具有显著影响,3个因素之间的交互作用见图 3。经过对实验结果的回归分析,得到下面的二次回归方程:发光强度=19 037.60+2 631.1A+2 751.75B+914.69C+167.75AB+426.88AC-475.25BC-2 028.86A2-2 061.49B2 -353.36C2 -1 292.50 A2B+1 166.63AB2
| Soruces of variation | DF | Sum of square | Mean square | F value | Pr>F |
| Model | 11 | 1.712E+008 | 1.557E+007 | 515.50 | <0.000 1 |
| A | 1 | 2.769E+007 | 2.769E+007 | 916.99 | <0.000 1 |
| B | 1 | 3.029E+007 | 3.029E+007 | 1002.99 | <0.000 1 |
| C | 1 | 6.693E+006 | 6.693E+006 | 221.64 | <0.000 1 |
| AB | 1 | 1.126E+005 | 1.126E+005 | 3.73 | 0.111 4 |
| AC | 1 | 7.289E+005 | 7.289E+005 | 24.14 | 0.004 4 |
| BC | 1 | 9.035E+005 | 9.035E+005 | 29.92 | 0.002 8 |
| A2 | 1 | 1.733E+007 | 1.733E+007 | 573.93 | <0.000 1 |
| B2 | 1 | 1.789E+007 | 1.789E+007 | 592.54 | <0.000 1 |
| C2 | 1 | 5.257E+005 | 5.257E+005 | 17.41 | 0.008 7 |
| A2B | 1 | 3.341E+006 | 3.341E+006 | 110.64 | 0.000 1 |
| A B2 | 1 | 2.722E+006 | 2.722E+006 | 90.14 | 0.000 2 |
| Residual | 5 | 1.510E+005 | 30 198.15 | ||
| Lack of fit | 1 | 28 860.03 | 28 860.03 | 0.95 | 0.386 0 |
| Pure error | 4 | 1.221E+005 | 30 532.68 | ||
| R2=0.963 7 | Adj-R2=0.917 1 | ||||
| Note:P<0.05 indicate significant;P<0.01 indicate very significant;P>0.05 indicate not significant | |||||
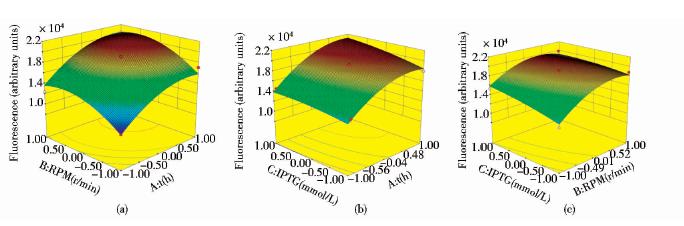
|
| 图 3 三因素(培养时间、转速大小、IPTG浓度)之间的交互作用Fig. 3 Interaction of the three factors(Incubation time,RPM,IPTG concentration) (a)The fluorescence influenced by culture time and RPM (b) The fluorescence influenced by culture time and the concentration of IPTG (c) The fluorescence influenced by the concentration of IPTG and RPM |
此方程的回归系数R2=0.963 7,Adj-R2=0.917 1,说明该模型与实验拟合较好,能较好的预测这3个影响因素(转速、时间、IPTG)对融合蛋白发光强度的影响。利用Design Expert 8.0.6软件的预测功能,3个影响因素的最优值为时间21.83h、转速222.31r/min,IPTG 0.5mmol/L,融合蛋白发光强度达到21 378.9,结合实际情况,做了如下修改,时间为22h,转速为222r/min、IPTG为0.5mmol/L,在此条件下,做了3次重复实验,得到的融合蛋白发光强度为19 532.5,与软件预测值相差不大,与优化前相比,融合蛋白发光强度提高了52.7%,从而证明了响应面法多因素筛选的有效性。 2.4 AgrA-GFP和AgrA蛋白的表达与纯化
分别将含有重组载体pET-28a(+)-AgrA和pET-28a(+)-AgrA-GFP的质粒电转导入感受态细胞BL21-(DE3)-PlysS中表达,诱导后的菌体收集、高压破碎并差速离心后,利用IMAC和SEC纯化目的蛋白,SDS-PAGE检测结果如图 4(a)所示,AgrA-GFP蛋白和AgrA蛋白的分子质量分别在55kDa和26kDa附近,与理论大小一致,蛋白质纯度达到90%以上。为了特异性的验证目的蛋白,Western blot检测AgrA-GFP和AgrA,图 4(b)条带1分子质量大小为40~60kDa,条带2分子质量为25~40kDa,与理论大小一致,说明纯化的蛋白质就是AgrA-GFP和AgrA。利用BioDrop超微量核酸蛋白测定仪测定AgrA蛋白浓度达到5.56mg/L。
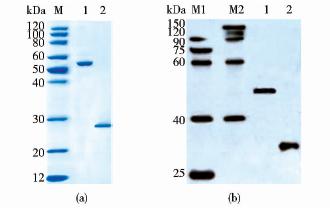
|
| 图 4 蛋白AgrA-GFP和AgrA的分离纯化Fig. 4 Purification of the fusion protein AgrA-GFP and AgrA (a)SDS-PAGE analysis of purified AgrA-GFP and AgrA M:ProteinRuler II marker; 1:Purificatied fusion protein AgrA-GFP; 2:Purificatied fusion protein AgrA (b) Western blot analysis of the purified AgrA-GFP and AgrA M1:EasySee Western Marker; M2: EasySee II Western Marker 1: Purificatied fusion protein AgrA-GFP; 2: Purificatied fusion protein AgrA |
2.5 AgrA蛋白活性的检测
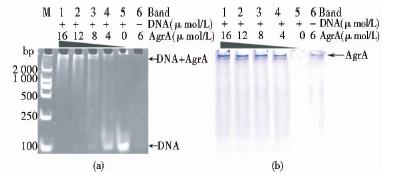
金黄色葡萄球菌的agr系统包含两个启动子P2和P3,P2和P3之间的序列包含4个AgrA的结合位点,而AgrA蛋白其C端包含一个能与DNA结合的LytTR区域。将AgrA与合成的DNA混合后,反应一段时间,AgrA即会与DNA结合,从而在聚丙烯酰胺凝胶电泳中发生迁移。
EMSA结果如图 5(a)所示,除了6外,每组反应中加入等量的DNA,5、6为对照组,对照组5中不加入AgrA,所以不产生延滞现象;对照组6中不加入DNA,也不产生延滞现象;1~4为实验组,实验组中AgrA的量梯度减少,随着AgrA的减少,DNA的延滞现象越不明显。将凝胶成像仪观察后的凝胶在考马斯亮蓝中染色并脱色,观察AgrA在凝胶中的位置,图 5(b)中,条带1~6对应于图 5(a)中的条带1~6,该图中AgrA条带位置与图 5(a)中DNA-AgrA复合物条带位置一一对应。结合图 5(a)、(b)分析,只有当所纯化出的AgrA蛋白有活性时,DNA才能被AgrA结合并发生延滞现象,因此可以得出如下结论:本实验纯化出的AgrA蛋白折叠正确,是有活性的。
|
| 图 5 AgrA蛋白的凝胶阻滞电泳分析Fig. 5 The electrophoretic mobility shift assay of AgrA(a)The PAGE gel was observed after Gel-red staining M: DL2000 DNA marker;Band1~Band5: DNA+different concentration of AgrA; Band6: AgrA (b) The PAGE gel was observed after Coomassie Blue Staining Band1-band6 is corresponds to band1-band5 in figure 5(a) one by one |
AgrC/AgrA作为agr系统典型的双组分信号转导系统,在其毒力因子的表达过程中起到独特的作用。然而,到目前为止,对金黄色葡萄球菌的研究主要集中在膜受体蛋白AgrC上[18, 19],人们试图筛选出AIP的类似物,阻断双组分信号转导系统的通路,从而筛选出新型抗菌药物[20]。AgrA作为金黄色葡萄球菌的双组分信号转导系统中的反应调节因子,在其C端含有一个LytTR区域,能与下游启动子P2与P3之间的序列发生特异性结合,激活RNAIII的转录从而释放毒力因子。AgrA蛋白的异源表达采用大肠杆菌表达系统,研究发现[10],目的蛋白在大肠杆菌中的可溶性表达主要受载体、宿主菌株、培养基成分及外源蛋白表达速率等因素影响。
为了快速筛选AgrA蛋白表达条件,将报告蛋白GFP融合至AgrA末端,通过检测荧光强度实时监测蛋白质的表达量,与传统方法相比,该方法不用破碎细胞,不必通过金属螯合层析(IMAC)和尺寸排阻层析(SEC)纯化蛋白质,不需要SDS-PAGE和Western blot分析,不必通过条带中目的蛋白纯度来确定最佳表达条件,该方法可直接测定菌体荧光强度,省时省力,大大提高了工作效率。
宿主表达菌株和表达条件的筛选对AgrA蛋白的正确表达非常重要,如果选取的不合理,易产生包涵体,使蛋白质折叠错误,没有活性。研究发现[21],重组基因表达的蛋白质在大肠杆菌中经常以包涵体的形式存在,究其原因主要是蛋白质表达太快,而大肠杆菌中又缺乏相应的修饰基因,蛋白质往往还没有正确折叠就形成包涵体了。作者也曾尝试采用pPROEX-HTa载体,BL21(DE3)表达宿主菌株表达纯化AgrA,虽然AgrA的表达量很高,但是以包涵体的形式存在,尿素复性之后发现,AgrA是不可溶的,以沉淀的形式存在,没有活性。
外源基因在大肠杆菌中的可溶性表达,最常用的方法就是从上游和下游两方面着手,即改变宿主菌株和细胞培养条件,降低细胞生长速度,适当延长培养时间,使外源基因在大肠杆菌中有充足的时间进行正确折叠[22]。从上游来说,选用了BL21(DE3) plysS作为宿主菌,其中的plysS质粒能明显降低外源基因的表达量,而且在整个大肠杆菌生长过程中,不影响菌体的正常生长,使得外源蛋白在大肠杆菌中能有充足的时间正确折叠;从下游来说,主要考察了培养基、诱导时间、温度和转速对蛋白质表达量的影响。首先利用单因素筛选的方法,对培养所用的3种培养基做了筛选(数据未给出)。结果发现,TBE培养基相比于TB和32Y培养基,有较高的发光强度。对比3种培养基发现,TBE中含有丰富的金属离子,金属离子可作为酶活性中心的组成部分,可以调节细胞渗透压、控制菌体表面的氧化还原电位并能保持蛋白质的稳定。温度与时间对于蛋白质表达来说非常重要,温度太高,外源蛋白在大肠杆菌中由于折叠不正确,主要以包涵体的形式存在,因此实验中采用低温长时间诱导。
AgrA蛋白的活性检测是通过非放射性的EMSA来验证的。放射性EMSA通常借助P32标记的ATP,结合DNA足迹分析技术,来检测AgrA在下游启动子之间序列上的结合位点[23, 24],并借助P32标记ATP的磷酸化分析实验检测AgrA的活性。放射性标记不但对实验条件有严格要求,而且对人体有巨大危害性。因此,本实验利用非放射性EMSA来验证AgrA蛋白的活性,只有所纯化的可溶蛋白AgrA正确折叠时,其中的LytTR区域才能与DNA结合,在聚丙烯酰胺凝胶中才能发生延滞现象,实验证明纯化的AgrA具有生物活性。
本文成功筛选出了AgrA的高表达量菌株且分离纯化出了有活性的AgrA,通过AgrA的LytTR区域能与DNA结合的特性,借助非放射性EMSA验证了AgrA蛋白的活性,为双组分信号转导系统的体外研究打下基础,也为其他蛋白质的分离纯化提供了一个可行借鉴。下一步,可将AgrA蛋白的LytTR区域作为药物筛选的靶点,开发新型抗金黄色葡萄球菌感染的药物。
| [1] | Larsen A, Stegger M, Goering R,et al. Emergence and dissemination of the methicillin resistant Staphylococcus aureus USA300 clone in Denmark. Euro Surveill, 2007,12(2): 22-24. |
| [2] | Chambers H F, Deleo F R Waves of resistance: Staphylococcus aureus in the antibiotic era. Nat Rev Microbiol,2009,7(9): 629-641. |
| [3] | Miller M B, Bassler B L. Quorum sensing in bacteria. Annu Rev Microbiol, 2001,55:165-199. |
| [4] | Cheung A L, Nishina K A, Trotonda M P, et al. The SarA protein family of Staphylococcus aureus. Biochem Cell Biol, 2008,40(3):355-361. |
| [5] | Waters C M, Bassler B L. Quorum sensing: cell-to-cell communication in bacteria. Annu Rev Cell Dev Biol, 2005,21:319-346. |
| [6] | Geisinger E R P, Adhikari R, Jin H F,et al. Inhibition of rot translation by RNAIII, a key feature of agr function. Mol Microbiol, 2006,61(4):1038-1048. |
| [7] | Chakrabarti S K, Misra T K, SarA represses agr operon expression in a purified in vitro Staphylococcus aureus transcription system.J Bacteriol, 2000,182(20):5893-5897. |
| [8] | Novick R P. Autoinduction and signal transduction in the regulationof staphylo- coccal virulence. Mol Microbiol, 2003,48(6):1429-1449. |
| [9] | Leonard PG, Bezar I F, Sidote D J, et al. Identification of a hydrophobic cleft in the LytTR domain of AgrA as a locus for small molecule interactions that inhibit DNA binding. Biochemistry, 2012,51(50):10035-10043. |
| [10] | 朱红裕, 李强. 外源蛋白在大肠杆菌中的可溶性表达策略.过程工程学报, 2006,6(1):151-155. Zhu H Y, Li Q. Strategies for expression of soluble heterologous proteins in Escherichia coli. The Chinese Journal of Process Engineering, 2006,6(1):151-155. |
| [11] | 胡建广,尹艳. GFP与微管结合蛋白和肌动蛋白结合区融合蛋白载体构建与表达.中国生物工程杂志, 2004,24(1):53-56. Hu J G, YIN Y, Construction of two vectors for expressing the fusion genes of GFP with microtubules associated protein 4 and actin filaments talinand their expression. China Biotecnology, 2004,24(1):53-56. |
| [12] | Drew D, Slotboom D J, Friso G A. GFP-based pipeline for membrane protein overexpression screening and purification. Protein Sci, 2005,14(8):2011-2017. |
| [13] | Drew D, Lerch M, Kunji E. Optimization of membrane protein overexpression and purification using GFP fusions. Nat Methods, 2006, 3(4):303-313. |
| [14] | Stephen R B, Christian C N. RF-Cloning org: an online tool for the design of restriction-free cloning projects. Nucleic Acids Research,2012,40(w1):209-213. |
| [15] | Fusinita V E, Jan L. RF cloning: a restriction-free method for inserting target genes into plasmids. J Biochem Biophys,2006,67(1):67-74. |
| [16] | Wang L N, Quan C S, Xiong W, et al. GFP-based overexpression screening and characterization of AgrC, a receptor protein of quorum sensing in Staphyloc- occus aureus. Int J Mol Sci, 2013,14(9):18470-18487. |
| [17] | Dindo R, Diego O A, Antoinette M, et al. Coordinated regulation by AgrA, SarA, and SarR to control expression in agr Staphylococcus aureus. J Bact- eriol, 2011,193(21):6020-6031. |
| [18] | Fowler S A, Stacy D M, Blackwell H E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett, 2008,10(12):2329-2332. |
| [19] | Mansson M, Nielsen A, Kjaerulff L, et al. Inhibition of virulence gene expression in Staphylococcus aureus by novel depsipeptides from a marine photobacterium. Mar Drugs, 2011,9(12):2537-2552. |
| [20] | Jensen R O, Winzer K, Clarke S R, et al. Differential recognition of Staphylo- coccus aureus quorum-sensing signals depends on both extracellular loops 1 and 2 of the transmembrane sensor AgrC. J Mol Biol, 2008,381(2):300-309. |
| [21] | 陈来同,茄炳根. 在大肠杆菌表达体系中以包涵体形式存在的真核生物蛋白质的分离复性和二硫键的形成. 中国生化药物杂志, 1997,18(1):46-49. Chen L T, Qie B G. Isolation, renaturation, and formation of disulfide bonds of eukaryotic proteins expressed in E. coli as inclusion bondies. Chinese Journal of Biochemical Phar- maceutics,1997,18(1):46-49. |
| [22] | 朱希强,袁勤生.EC-SOD在大肠杆菌中的可溶性表达. 食品与药品, 2005, 7(4A): 31-33. Zhu X Q, Yuan Q S. The resolution expression of EC- SOD in supernatant by E. coli. Food and Drug, 2005,7(4A):31-33. |
| [23] | Koenig R L, Ray J L, Maleki S J. Staphylococcus aureus AgrA binding to the RNAIII-agrrReg- ulatory region. J Bacteriol, 2004,186(22):7549-7555. |
| [24] | María F D P, Marta P. Enterococcus faecalis virulence regulator FsrA binding to target promoters. J Bacteriol, 2011,193(7):1527-1532. |
 2015, Vol. 35
2015, Vol. 35




