文章信息
- 冯翠, 王祺, 张纯, 秦培勇, 郑秀玉, 王健, 刘永东, 苏志国
- FENG Cui, WANG Qi, ZHANG Chun, QIN Pei-yong, ZHANG Xiu-yu, WANG Jian, LIU Yong-dong, SU Zhi-guo
- PEG定点修饰重组人睫状神经营养因子及其生物活性评价
- Preparation of mPEG-MAL-modified Recombinant Human Ciliary Neurotrophic Factor and Evaluation of Biological Activity
- 中国生物工程杂志, 2015, 35(5): 15-21
- China Biotechnology, 2015, 35(5): 15-21
- http://dx.doi.org/10.13523/j.cb.20150503
-
文章历史
- 收稿日期:2014-11-11
- 修回日期:2015-03-23
2. 中国科学院过程工程研究所生化工程国家重点实验室 北京 100190;
3. 北京生物制品研究所有限责任公司 北京 100024
2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3. National Vaccine & Serum Institute, Beijing 100024, China
睫状神经营养因子(ciliary neuronotrophic factor,CNTF)是1984年由Barbin等[1]从鸡胚的睫状神经节中提取的一种多功能细胞因子,对于维持鸡的副交感神经节的存活和营养具有十分重要的作用[2]。目前,国内外已有多家单位对CNTF及其突变体展开了临床方面的研究,相关报道[3, 4]证实,人睫状神经营养因子(human ciliary neuronotrophic factor,hCNTF)在中枢神经系统中可以促进神经干细胞的增殖,抑制其向胶质细胞的分化,具有保护受损神经元的功能。由于hCNTF无糖基化位点,不能进行糖基化修饰,易被血液中的各种蛋白酶降解;分子质量小又易被循环系统清除,体内半衰期短(30min)[5]。另外,因其自身具有较强的免疫原性和抗原性,极大的限制了其临床应用。
蛋白质或多肽的聚乙二醇修饰(PEGylation)是克服与解决上述问题的一种有效方法,它通过减少肾清除率、降低酶解速率及降低免疫原性等改善药物的理化性质,从而有效延长药物体内停留时间、增强体内药效[6, 7]。例如,王彦等[8, 9]通过对天然CNTF的 cDNA序列进行改造,运用大肠杆菌高效表达出突变基因(A17R6315),并对其N端PEG修饰,以期改善生物活性。为提高定点修饰比例,对蛋白质的N端修饰反应通常需要在pH低于5下进行,但是CNTF在酸性条件下易于沉淀,同时也不能完全避免修饰反应发生在其他的位置,难以获得位点均一的修饰产物。巯基定点修饰是基于氨基修饰无法获得理想修饰产物发展起来的,利用巯基的高亲核性,选取能够特异性与巯基偶联的PEG修饰剂,定向修饰蛋白质或多肽,从而获得修饰位点均一、生物活性较高的长效制剂[10, 11, 12]。
通过前期研究,我们获得了C17的hCNTF突变体[13],其二、三级结构及生物活性与A17R6315一致。为获得均一定点的长效睫状神经营养因子,本文采用分子质量为40kDa的聚乙二醇马来酰亚胺修饰剂(mPEG-MAL)对CNTF-C17突变体游离半胱氨酸的自由巯基进行定点修饰,考察反应条件对修饰率的影响,确定修饰混合物分离纯化条件并修饰产物的二、三级结构进行表征。最后,评价了Mono-PEG-CNTF-C17的结构变化及生物活性,该部分的实验结果为后续的药效学研究以及开放其长效品种奠定了基础。 1 材料与方法 1.1 主要材料
CNTF-C17蛋白纯品由本实验室自行制备[13]。
PEG修饰剂 (mPEG-MAL 40kDa,纯度>95%)购自北京键凯科技有限公司;乙腈和三氟乙酸购自美国Dima公司;蛋白质Marker购自日本TaKaRa公司;Q Sepharose FF购自美国GE Healthcare公司;其他试剂均为国产分析纯。
KTA purifier层析系统、HitrapTM Desalting脱盐柱、SuperdexTM 200(10/300GL)、Ultrospec 2100分光光度计购自GE Healthcare公司(美国);Mini-PROTEAN Tetra System电泳仪(美国Bio-Rad公司);Agilent 1100高效液相系统(美国Agilent公司);Jasco 810圆二色色谱仪(日本Jasco公司);FL4500荧光光谱仪(日本Hitachi公司);37℃培养箱(日本三洋公司);RP-HPLC色谱柱C4(4.6mm I.D.×250mm)(日本资生堂公司);实验用水由Milli-Q超纯水机(美国Milipore公司)制备。 1.2 实验方法 1.2.1 重组人睫状神经营养因子(CNTF-C17)的mPEG-MAL修饰
利用脱盐柱将CNTF-C17纯品置换至20mmol/L PB和20mmol/L Tris-HCl(所需pH)缓冲液,测定595nm波长下的蛋白质浓度,同时调整至一致,按一定的PEG/蛋白质的加入mPEG-MAL-40K,搅拌至完全溶解后,4℃下反应过夜。 1.2.2 蛋白质浓度的测定
测定方法参照Bradford法[14]。 1.2.3 修饰转化率的计算
采用RP-HPLC检测不同反应时间的修饰反应混合物的变化,经软件计算出各产物峰面积,单修饰转化率=单修饰物峰面积/各组分峰面积之和。 1.2.4 修饰混合物的分离纯化采用KTA purifier层析系统、Q FF层析介质分离纯化修饰混合物。自装Q FF层析柱(XK 2.6×20),上样前以Buffer A(20mmol/L Tris-HCl,pH 8.0)平衡,修饰混合物上样后用Buffer A淋洗3CV,然后用Buffer B(50mmol/L Tris-HCl,1mol/L NaCl,pH 8.0)进行0%~30% Buffer B线性梯度洗脱,收集目标洗脱峰,进行SDS-PAGE电泳分析。
1.2.5 SDS-PAGE电泳检测
参照文献[15]的方法,浓缩胶5%、分离胶12%,考马斯亮蓝染液染色。 1.2.6 高效凝胶过滤色谱检测
凝胶过滤使用KTA purifier层析系统和SuperdexTM200(10/300 GL)分析柱,缓冲液为20mmol/L PB (pH 7.0,含0.1mol/L Na2SO4),流速为0.5ml/min,检测波长为280nm。 1.2.7 反相液相色谱检测
采用日本资生堂proteonavi C4(4.6mm×250mm),流动相A为含有0.1% TFA的超纯水,流动相B为含0.1% TFA的乙腈。检测波长为280nm,洗脱梯度为5%~95%,时间为30min。 1.2.8 荧光光谱(FL)和圆二色光谱(CD)分析
蛋白质浓度为0.2mg/ml,缓冲液为20mmol/L Tris-HCl(pH 8.0)。荧光检测时激发光波长为280nm,发射光波长为300~400nm。圆二色光谱仪扫描波长为190~260nm,分辨率为1nm。以样品所处的缓冲液为空白进行校正,CD光谱谱图以3次测量结果的平均值为准。具体方法参照文献[16]。 1.2.9 LC-MS分析
分别将CNTF-C17和Mono-PEG-CNTF-C17脱盐至50mmol/L NH4HCO3(pH 8.2)的缓冲液中,调整两者的浓度一致,然后加入胰蛋白酶,置于37℃培养箱中24h后,加入TFA终止酶解反应,将消解产物在反相色谱柱上进行肽段分离。流动相组成:缓冲液A:0.1% TFA的超纯水;缓冲液B:0.1% TFA的乙腈溶液,线性洗脱条件为5%~95%的流动相B,洗脱45min,流速为0.5ml/min。 1.2.10 体外活性检测
TF-1.CN5a.1细胞测定Mono-PEG-CNTF-C17生物活性[17]。 1.2.11 药代动力学的考察
对每组3只SD大鼠进行尾部静脉注射(剂量为1mg/kg),并在既定时间点内眼眶取血,离心弃血浆,利用ELISA试剂盒(R&D,USA)检测。 2 结 果 2.1 修饰混合物的制备
PEG修饰反应条件的控制是影响目标产物收率的重要因素。在适当pH条件下,mPEG-MAL能够针对巯基进行高度专一的定点修饰,但pH、修饰剂用量及反应时间也会对单修饰物转化率的多少造成影响。目前关于巯基定点修饰睫状神经营养因子的报道还未见到,为此,本实验考察了修饰反应过程中不同缓冲液体系与反应时间关键性影响因素。由于CNTF-C17在室温下不稳定,存放一定时间会发生分子降解,因此,该反应选择在低温(4℃)下进行。
在亲核试剂处于离子化状态下修饰反应才能进行。通常蛋白质定点修饰在酸性条件下发生,但CNTF在pH小于6时接近等电点,极易产生沉淀。所以,采用mPEG-MAL 40kDa对CNTF-C17进行修饰时,pH控制在7.0~8.5。由图 1可知,在修饰反应10h时,Tris-HCl缓冲液体系下的修饰反应速率明显要比PB缓冲液体系下的迅速,并且Tris-HCl缓冲液的pH越高修饰反应越快,在修饰反应12h时单修饰率达到95%左右不再增加。考虑到pH越高,mPEG-MAL也可能修饰在蛋白质的氨基上,故选择了Tris-HCl(pH 8.0)作为最佳修饰反应体系。

|
| 图 1 不同pH及缓冲体系对CNTF-C17修饰过程[(a)~(e)]及修饰率的影响(f) Fig. 1 The effects of different pH values and different buffers on modification process[(a)-(e)] and final modification yield (f) (a) 20mmol/L PB,pH 7.0 (b) 20mmol/L PB,pH 7.5 (c)20mmol/L Tris-HCl,pH 7.5 (d)20mmol/L Tris-HCl,pH 8.0 (e)20mmol/L Tris-HCl,pH 8.5 (f) Final modification yield at different conditions |
综上,确定最佳的修饰条件为:在20mmol/L Tris-HCl (pH 8.0)、4℃下反应12h,此条件下的单修饰率可达到95%。 2.2 修饰混合物的分离纯化
据文献报道[18],经过修饰的蛋白质与离子交换介质的结合作用减弱,能通过线性提高洗脱液的离子强度将修饰后的蛋白质与原蛋白分离,而且可以排除PEG的干扰,是修饰混合物分离纯化的理想介质,因此,我们采用载量大、选择性好的阴离子交换层析介质QFF来分离CNTF-C17修饰混合物。由图 2可见,将CNTF-C17蛋白纯品按CNTF-C17/PEG摩尔配比1∶3的比例加入分子量为40kDa的mPEG-MAL,4℃下修饰反应12h后,用去离子水稀释控制电导在2ms/cm左右,然后经过离子交换层析,mPEG-MAL由于不带电荷而直接穿过离子交换柱。改变盐浓度洗脱出单修饰物和原蛋白质,其中P1洗脱峰的单修饰产物收率达到78.1%。将目标蛋白质进一步采用高效凝胶过滤色谱(HPSEC)和反相高效液相色谱(RP-HPLC)进行纯度鉴定,由图 3可知,在HPSEC和RP-HPLC图谱中单修饰产物Mono-PEG-CNTF-C17以一个单一、对称的吸收峰形式存在,并通过峰面积积分计算得出,单修饰物的纯度达到98%。
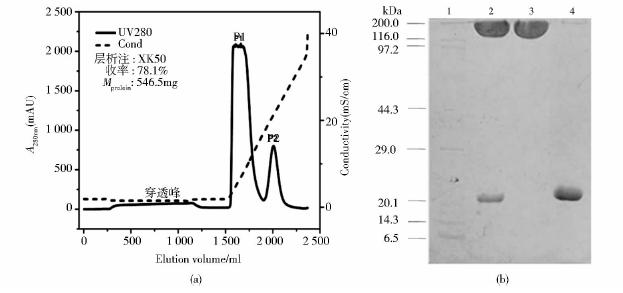
|
| 图 2 CNTF-C17单修饰物色谱纯化及电泳分析结果 Fig. 2 Chromatographic profile for the purification of mono-PEG-CNTF-C17 and SDS-PAGE analysis of the eluted peaks (a) Chromatographic profile for the purification of PEGylated mixture (b) SDS-PAGE of eluted peaks from IEC 1: Marker; 2: Reaction mixture; 3: P1; 4: P2 |
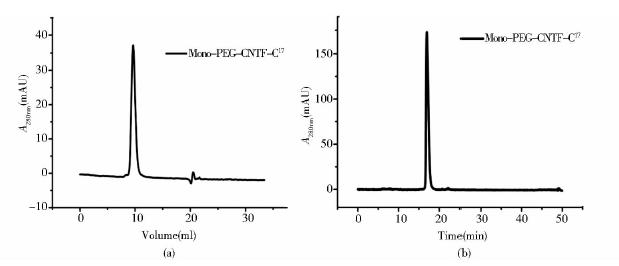
|
| 图 3 CNTF-C17单修饰物纯度分析Fig. 3 Purity analysis of mono-PEG-CNTF-C17 (a) SEC-HPLC (b) RPC-HPLC |
对CNTF-C17及其修饰产物进行圆二色和荧光光谱分析。其中图 4(a)圆二色图谱显示,经过mPEG-MAL 40kDa修饰的CNTF-C17在208nm和222nm处的两个特征负肩带与原蛋白质相近,该部分数据表明,PEG修饰并不影响CNTF-C17的二级结构。由图 4(b)可见,Mono-PEG-CNTF-C17与CNTF-C17的荧光光谱图基本一致,最大吸收峰分别位于342nm和343nm,这表明mPEG-MAL修饰并未改变CNTF-C17的分子空间构象。
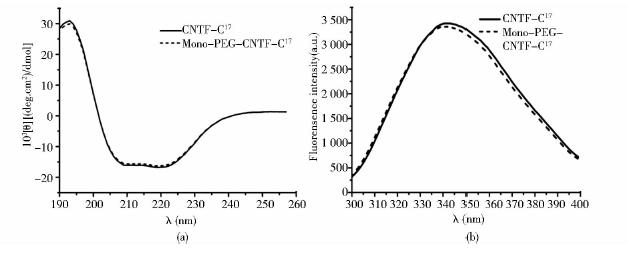
|
| 图 4 CNTF-C17及其单修饰产物的结构分析结果Fig. 4 Structuralanalysis of CNTF-C17 and mono-PEG-CNTF-C17 (a) CD spectra of CNTF-C17 and mono-PEG-CNTF-C17 (b) Fluorescence spectra of CNTF-C17 and mono-PEG-CNTF-C17 |
采用TF-1.CN5a.1细胞对CNTF-C17及Mono-PEG-CNTF-C17进行细胞活性检测,其比活结果如表 1所示。由表 1可知,mPEG-MAL 40kDa修饰的CNTF-C17体外活性比修饰之前减少了69.0%。CNTF-C17生物活性降低的原因可能有两种:①PEG分子形成的空间位阻作用大,造成抗原与抗体之间的结合能力下降,生物活性减少[21];②分子质量较大的PEG分子容易覆盖蛋白质表面的活性位点。
| Parameters | Mean biological activity(IU/mg) | Relative activity(%) |
| CNTF-C17 | 2.10×106 | 100 |
| Mono-PEG-CNTF-C17 | 6.51×105 | 31.0 |
采用ELISA试剂盒测定CNTF-C17和Mono-PEG-CNTF-C17在SD大鼠体内的停留时间,结果如图 5所示。尾部静脉注射大鼠后,CNTF-C17及分子质量40kDa的单修饰物都随时间的延长而逐渐减少,但是PEG修饰后的蛋白质代谢清除的速率要缓慢得多。CNTF-C17在体内2h左右可被清除90%以上,而修饰后的蛋白质仅仅减少了20%,PEG修饰CNTF-C17体内循环半衰期由28min延长至14.3h,提高了30.3倍。这表明PEG对延长CNTF-C17在体内的停留时间有显著的效果。
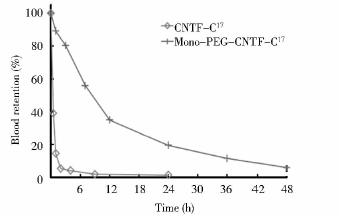
|
| 图 5 CNTF-C17及单修饰产物的药代动力学考察Fig. 5 Pharmacokinetics of CNTF-C17 and mono-PEG-CNTF-C17 |
根据已有文献报道,王彦等采用mPEG-Butyr ALD对突变体AX15(将第17位的半胱氨酸突变为丙氨酸,第63位的谷氨酰胺突变成精氨酸,去掉C端的15个氨基酸)进行醛基定点修饰,由于该反应在偏酸条件下进行,接近CNTF-C17的等电点5.8,容易产生沉淀,极大的限制了以此为基础规模化制备长效制剂。巯基定点修饰是第二代PEG修饰技术中应用较为广泛的一种定点修饰方式,由于蛋白质多肽中巯基数量相对较少,且巯基的亲核活性通常较α-氨基、ε-氨基或羟基等基团高,故采用特定的巯基修饰位点可以达到降低修饰度、减少修饰产物种类等效果。因此,本文采用这一修饰策略对CNTF-C17中预保留的第17位半胱氨酸进行巯基定点修饰的相关研究[22]。
本实验考察了修饰反应中不同缓冲液体系与反应时间、PEG/CNTF-C17摩尔配比对修饰率的影响,确定了最佳修饰条件便于后续分离纯化的操作。采用阴离子交换层析对修饰混合物进行分离纯化,获得纯度为95%的单修饰物,收率达到78.1%。荧光光谱和圆二色光谱数据表明,PEG修饰并未改变CNTF-C17的二、三级结构。LC-MS数据分析表明mPEG-MAL巯基定点修饰位点的专一性。TF-1.CN5a.1细胞活性检测表明修饰后的蛋白质比活为6.51×105IU/mg,比原蛋白质的活性显著减少了69%。对SD大鼠注射修饰前后的CNTF进行药代动力学的考察,实验结果表明,PEG修饰CNTF-C17体内循环半衰期由28min延长至14.3min,提高了30.3倍。
| [1] | Barbin G, Manthorpe M, Varon S. Purification of the chick eye ciliary neuronotrophic factor. Journal of Neurochemistry, 1984, 43(5): 1468-1478. |
| [2] | Tripathi R B, McTigue D M. Chronically increased ciliary neurotrophic factor and fibroblast growth factor-2 expression after spinal contusion in rats. Journal of Comparative Neurology,2008,510(2): 129-144. |
| [3] | 娄向新, 袁崇刚.神经干细胞的研究现状及运用前景. 生命科学研究, 2004, 8(2): 65-69. Lou X X, Yuan C G. Research and application prospects of neural stem cells. Life Science Research, 2004, 8(2): 65-69. |
| [4] | Dutta R, McDonough J, Chang A, et al. Activation of the ciliary neurotrophic factor (CNTF) signalling pathway in cortical neurons of multiple sclerosis patients. Brain, 2007,130(10): 2566-2576. |
| [5] | Emerich D F, Thanos C G. Intracompartmental delivery of CNTF as therapy for huntingtons disease and retinitis pigmentosa. Current Gene Therapy, 2006, 6(1): 147-159. |
| [6] | 曹进,田法, 高向东, 等.聚乙二醇修饰对蛋白质类药物药代动力学的影响及相关的药动学研究方法. 药学进展, 2008, 32(9): 406-411. Cao J, Tian F, Gao X D, et al. The effect of PEG-modification on the pharmacokinetics of protein and the related pharmacokinetics research methods.Process in Pharmaceutical Sciences, 2008, 32(9):406-411. |
| [7] | 姜忠义,高蓉.药物蛋白的聚乙二醇修饰. 中国药学杂志, 2002, 37(6): 409-412. Jiang Z Y, Gao R. Polyethylene glycol (peg) modification of protein drugs. Chinese Pharmaceutical Journal, 2002, 37(6):409-412. |
| [8] | 韩莉, 蔡志华, 陶红梅, 等.重组人睫状神经营养因子突变体的制备及 PEG 修饰. 重庆师范大学学报 (自然科学版), 2009, 2(26): 111-114. Han L, Cai Z H, Tao H M, et al. Preparation and PEGylation of recombinant human ciliary neurotrophic factor mutant. Journal of Chongqing Narmal University (Natural Science),2009,2(26): 111-114. |
| [9] | 王彦, 范开, 夏永鹏, 等.重组人睫状神经因子的表达、纯化以及聚乙二醇修饰. 第三军医大学学报, 2009, 31(12): 1181-1184. Wang Y, Fan K, Xia Y P, et al. Expression, purification and PEGylation of recombinant human ciliary neurotrophic factor. Acta Academiae Medicinae Militaris Tertiae, 2009, 31(12): 1181-1184. |
| [10] | 王凤山, 赵婷,袁勤生, 等.蛋白质和多肽的 PEG 定点修饰研究进展//2008 年中国药学会学术年会暨第八届中国药师周, 石家庄, 2008, 北京: 中国药学会, 2008:2321-2332. Wang F S, Zhao T, Yuan Q S, et al. Research Progress in Site-specific PEGylation of Protein and Peptide//Memoir, Society for 2008 Years of Its Academic Annual Meeting and the Proceedings of the Eighth China Week of Pharmacists,Shijiazhuang, 2008, Beijing: Chinese Pharmaceutical Association,2008:2321-2332. |
| [11] | 王旭东, 李晓辉, 苏志国, 等. 蛋白药物的聚乙二醇定点修饰策略与最佳位点. 中国生物工程杂志, 2010, 30(4): 101-109. Wang X D, Li X H, Su Z G, et al. Site-specific PEGylation strategies and suitable modified sites of protein drugs. China Biotechnology, 2010, 30(4): 101-109. |
| [12] | 唐莉, 张新国, 陈建华, 等.长效蛋白药物研究进展. 中国医药生物技术, 2008, 3(1): 58-61. Tang L, Zhang X G, Chen J H, et al.Progress of long-term drugs. Chin Med Biotechnol, 2008, 3(1): 58-61. |
| [13] | 冯翠,赵大伟, 张纯, 等.一种重组人睫状神经营养因子突变体的分离纯化及结构鉴定. 中国生物工程杂志, 2013, 33(10): 21-27. Feng C, Zhao D W, Zhang C, et al. Purification and characterization of a new recombinant ciliary neuronotrophic factor mutant expressed in souble form by E.coli. China Biotechnology,2013, 33(10): 21-27. |
| [14] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1): 248-254. |
| [15] | Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680-685. |
| [16] | Roger P. Determining the CD Spectrum of a Protein. Current Protocols in Protein Science. America: Wiley, 2005. |
| [17] | 李萍, 陆俭, 马亚茹, 等.细胞增殖法检测 rhCNTF 生物活性方法的建立和验证. 药物生物技术, 2012, 19(1): 55-59. Li P, Lu J, Ma Y R, et al. Establishment and validation an the biological activity determination method of rhCNTF by cell proliferation test. Pharmaceutical Biotechnology,2012, 19(1):55-59. |
| [18] | 张树政,仲如.蛋白质的离子交换层析技术. 微生物学通报, 1974,1(2):30-36. Zhang S Z, Zhong R. Protein ion exchange chromatography technique. Microbiology China,1974,1(2): 30-36. |
| [19] | 杨光,李祎,项光亚, 等.重组人睫状神经营养因子肽图分析. 生物技术通报, 2010(11): 162-165. Yang G, Li W, Xiang G Y, et al. Peptide mapping analysis of recombinant human ciliary neurotrophic factor. Biotechnology Bulletin,2010(11): 162-165. |
| [20] | 赵阳, 毕华, 韩春梅, 等.注射用重组人睫状神经营养因子质控方法和质量标准研究. 药物分析杂志, 2009, 29(8): 1290-1293. Zhao Y, Bi H, Han C M, et al. Development of methods and standard for quality control of recombinant human ciliary neurotrophic factor. Chin J Pham Anal, 2009, 29(8): 1290-1293. |
| [21] | 毕华, 袁力勇, 史新昌, 等.睫状神经营养因子突变体蛋白的活性研究. 中国生物工程杂志, 2007, 27(1): 1-5. Bi H, Yuan L Y, Shi X C, et al. Activity study of ciliary neurotrophic factor (CNTF) mutant, China Biotechnology,2007, 27(1): 1-5. |
| [22] | Maleki A, Madadkar-Sobhani A, Roohvand F, et al. Design, modeling, and expression of erythropoietin cysteine analogs in Pichia pastoris: improvement of mean residence times and in vivo activities through cysteine-specific PEGylation. European Journal of Pharmaceutics and Biopharmaceutics, 2012, 80(3): 499-507. |
 2015, Vol. 35
2015, Vol. 35




