文章信息
- 武睿, 周兰, 崔鲂
- WU Rui, ZHOU Lan, CUI Fang
- S100A9促进肝癌细胞HepG2的存活与侵袭依赖于RAGE
- S100A9 Promotes Human Hepatocellular Carcinoma Cell HepG2 Proliferation and Invasion Involving RAGE
- 中国生物工程杂志, 2015, 35(5): 8-14
- China Biotechnology, 2015, 35(5): 8-14
- http://dx.doi.org/10.13523/j.cb.20150502
-
文章历史
- 收稿日期:2015-01-05
- 修回日期:2015-03-22
2 重庆医科大学检验医学院 重庆 400016
2. Chongqing Medical University, Chongqing 400016, China
原发性肝癌是最常见的恶性肿瘤之一,而在我国肝癌死亡率高居癌症死亡率的第二位。因此,阐明肝癌的发生发展机制,进而在此基础上寻找预防和治疗性干预的新靶点显得尤为迫切。
S100蛋白家族是一类低分子质量的钙结合蛋白,它们参与调节细胞存活、分化、运动及细胞信号转导等多种成员,与肿瘤的发展、转移有关[1, 2]。S100A9(calgranulin B,MRP14)是该家族中比较重要的一员,在粒细胞、单核细胞和肿瘤细胞等多种细胞中呈现高表达,与感染性疾病、免疫性疾病、炎症和恶性肿瘤等密切相关[3, 4]。研究表明,S100A9在胃癌、食管癌、结直肠癌、乳腺癌和肝癌等多种肿瘤中高表达;S100A9不仅在肝癌细胞中高表达,而且与其不良分化有关[5, 6, 7, 8]。 S100A9在人和鼠肝癌细胞中表达上调,并且可以防止肝癌细胞Hep3B免受TNF-γ诱导的凋亡的影响[9]。然而,在肝癌微环境中的S100A9对肝癌的具体作用及机制尚不清楚。
晚期糖基化终末产物受体(receptor for advanced glycation end product,RAGE)是一种多配体受体,属于免疫球蛋白超家族的一员。大量研究表明,RAGE与配体结合后激活下游信号级联对肿瘤的生长及转移发挥重要作用[10, 11]。在肝癌中,已证实RAGE在癌组织中异常高表达,且参与调节癌细胞的增殖、迁移、侵袭及肿瘤血管生成等,对肝癌的发展起着重要作用[12, 13, 14, 15]。
已有研究发现RAGE能够与S100家族多种成员结合,包括S100A12、S100B、S100A1和S100P[16, 17]。此外,新近研究发现乳腺癌中RAGE能够与S100A9结合发生相互作用促进乳腺癌细胞的恶性增殖[18]。基于此,本课题拟研究肝癌微环境中S100A9对肝癌的细胞生物学作用并探讨该作用是否与膜上RAGE有关。 1 材料与方法 1.1 材 料 1.1.1 细胞
人肝癌细胞系HepG2与人正常肝细胞系L02(重庆医科大学临床检验诊断学教育部重点实验室保存)。 1.1.2 组织
收集重庆医科大学附属第一医院经病理学诊断为肝癌患者(10例)的癌组织及癌旁组织(距癌组织至少5cm),待组织切除后立即放入液氮内保存备用。组织学分化:高分化2例,中分化 6 例,低分化2例。国际抗癌联盟的肿瘤、淋巴、转移(TNM)分期标准进行分期:Ⅰ期3例、Ⅱ期3例、Ⅲ期2例、Ⅳ期2例。患者手术前均未接受放射治疗、化学药物治疗或其他治疗。所有患者术前均签署知情同意书,符合医学伦理学规定。 1.1.3 细菌及质粒
大肠杆菌BL21(重庆医科大学分子医学实验室);pGST-moluc-hS100A9、pGST-moluc(芝加哥大学医学中心分子肿瘤实验室赠送)。 1.1.4 主要试剂
DMEM/HIGH GLUCOSE培养液和胎牛血清(Hyclone公司);MTT、DMSO、基质胶ECM (Sigma);Millicell小室(Millipore公司),鼠抗人S100A9抗体(sc-58706,Santa Cruz);鼠抗人β-actin抗体 (sc-47778,Santa Cruz);兔抗人Na,K-ATPase抗体(#3010,Cell Signaling Technology);兔抗人RAGE抗体(sc-5563,Santa Cruz),RAGE中和抗体(ab89911,abcam);羊抗兔IgG/HRP标记、羊抗鼠IgG/HRP标记、SP-9002免疫组织化学染色试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司);PVDF膜(Millipore公司);化学发光试剂盒(Thermo公司);Western及IP细胞裂解液(P0013)、膜蛋白提取试剂盒、苏木精-伊红染液(HE)(上海碧云天公司);蛋白酶抑制剂和磷酸酶抑制剂(美国Roche公司);p38特异性抑制剂 (SB203580),ERK1/2特异性抑制剂 (PD98059)(Santa Cruz)。 1.2 方 法 1.2.1 Western blot
用于分析人肝癌组织与癌旁组织中S100A9的表达,GST-S100A9的鉴定及细胞膜上RAGE的表达。将研磨后的组织用PBS洗两次,加入细胞裂解液(含蛋白酶抑制剂、磷酸酶抑制剂)200μl/100mm培养皿,冰上裂解30min,4℃、12 000r/min离心20min,所得上清液即为细胞总蛋白质溶解液,用于后续S100A9的检测。根据膜蛋白提取试剂盒操作步骤进行细胞膜蛋白的提取,用于后续的膜上RAGE的检测。将以上的蛋白质进行SDS-聚丙烯酰胺凝胶电泳(PAGE),湿转法转膜,5%牛血清白蛋白封闭1h,一抗(1∶1 000)4℃孵育过夜,二抗(1∶5 000)37℃孵育1h,按ECL试剂盒说明进行显色,GelDoc凝胶成像仪采集图像,通过Quantity One软件分析获得各条带的吸光度值。 1.2.2 免疫组织化学(IHC)
将包埋好的肝癌组织与癌旁组织切片首先进行脱蜡:在56℃ 预热的二甲苯1、2中各脱蜡20min。放入100%、90%、80%、70%乙醇中各3min水化。加入0.01mol/L枸橼酸盐缓冲液抗原修复。然后在切片组织上滴加3%H2O2,室温孵育10min。滴加免疫组织化学试剂盒中的试剂A(封闭用山羊血清工作液)于组织上室温孵育10~15min。滴加S100A9抗体(1∶300稀释)37 ℃孵育2h,滴加试剂B(生物素化二抗工作液)37℃孵育15min,滴加试剂C(辣根酶标记链酶卵白素工作液)37℃孵育15min。滴加DAB显色液,显色约10min。然后浸泡于苏木精中复染3min,饱和碳酸锂中浸泡10s,盐酸乙醇中浸泡2s,再浸入饱和碳酸锂中10s。将复染后的切片依次放入70%、80%、90%、100%乙醇中,各放3min脱水。透明:二甲苯1、2、3,各放置5min。中性树脂封片。 1.2.3 重组蛋白的制备与鉴定
氯化钙法制备BL21感受态,取100μl/管的感受态BL21,分别加入pGST-moluc-hS100A9 和pGST-moluc进行化学转化,转入LB培养基中,37℃、180r/min培养1h,取100μl转化反应液铺于LB平板培养,37℃过夜,挑取菌落接种到含AMP 100μg/ml的LB培养基,37℃、180r/min培养过夜;取培养物1.5ml加到含AMP的300ml LB培养基中,振荡培养3h,加入 IPTG,继续振荡培养 3h,完成融合蛋白的诱导表达;离心收集细菌沉淀,加入蛋白酶抑制剂和0.1%的Triton-X 100,冰上超声裂解细菌,然后离心收集上清液,加入GS4BB,进行亲和吸附3h,离心弃上清液,然后加入洗脱液,洗脱3次,3h/次,上清液即为融合蛋白,取20μl进行SDS-PAGE,考马斯亮蓝染色、凝胶成像仪成像,再用Western blot进一步鉴定,超微量分光光度计进行定量(具体步骤见参考文献)[19]。 1.2.4 MTT法检测细胞存活能力
实验分组:Blank组,GST组,10μg/ml、20μg/ml、40μg/ml、80μg/ml GST-hS100A9组。取对数生长期的HepG2细胞以每孔2×103个接种于96孔板中,在完全培养基中培养12h后,换为加有处理因素的含1% FBS的培养基继续培养1天、2天、3天、4天,到指定培养时间后,加入MTT试剂10μl,然后37℃孵育4h,再加入DMSO摇床上低速振荡10min,在酶标仪上测定各孔在492nm处的OD值,相同条件下实验重复3次。在阻断实验中,HepG2细胞预先被Anti-RAGE中和抗体(100μg/ml)处理1h,然后加入GST-S100A9。 1.2.5 Transwell侵袭实验检测细胞侵袭能力
取对数生长期的HepG2细胞或L02细胞制成无血清的单细胞悬液,调节相同的细胞密度105个/ml,取已调节好的细胞悬液400μl与GST-S100A9或GST(20μg/ml)及Anti-RAGE中和抗体(100μg/ml)混合,并接种在前一天铺上基质胶ECM的Transwell小室的上腔中,下腔中加入600μl含20% FBS的完全培养基,每组3个复孔。24h后取出小室,用湿棉签拭去微孔膜上层的细胞,PBS小心冲洗,无水乙醇固定20min后,PBS冲洗,风干后苏木精-伊红(HE)染色。于倒置显微镜下放大100倍观察并计数穿膜细胞数。相同条件下实验重复3次。 1.3 统计学分析
实验数据以均值±标准差(x±s)表示,采用SPSS17.0统计软件进行单因素方差分析。 2 结 果 2.1 S100A9在人肝癌组织中的表达
收集人肝癌组织标本10例,Western blot检测结果显示,其中8例标本肝癌组织中S100A9表达较癌旁组织显著升高,选取5例作为代表图,Sample 1、2、4和5肝癌组织中S100A9表达较癌旁组织显著升高,具有统计学意义(P<0.01),Sample 3肝癌组织与癌旁组织中S100A9表达无显著性差异(P>0.05)[图 1(a)]。免疫组织化学结果与Western blot结果一致,免疫组织化学结果显示,在肝癌细胞的胞浆与胞膜中S100A9的表达较正常组织显著升高[图 1(b)]。
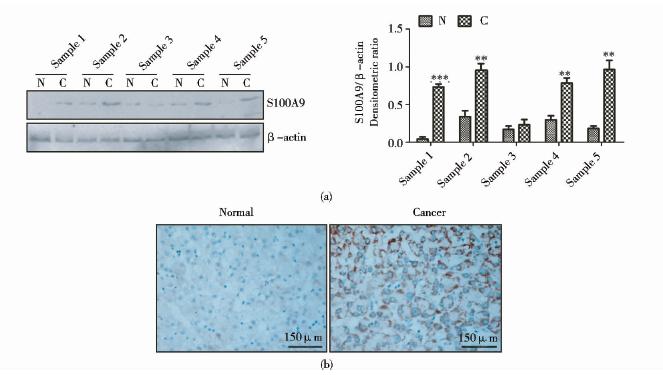
|
| 图 1 S100A9在人肝癌组织与癌旁组织中的表达 Fig. 1 S100A9 expression in human HCC tissue and normal tissue (a) Western blot (b) Immunohistochemistry* P<0.05,** P<0.01 compared with normal tissue |
如图 2(a)所示,聚丙烯酰胺凝胶电泳(SDS-PAGE)显示GST的分子质量为26kDa、GST-S100A9为39kDa。如图 2(b)所示,Western blot显示重组蛋白GST-S100A9与S100A9抗体呈阳性反应,而GST无此条带。采用Quantity One 软件计算出GST-S100A9蛋白纯度大于90% [图 2(a)]。
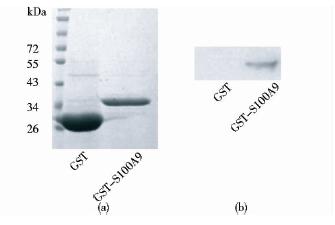
|
| 图 2 重组蛋白GST-S100A9的鉴定Fig. 2 Identification of recombinant protein GST-S100A9(a) SDS-PAGE (b) Western blot |
肝癌细胞HepG2被不同浓度的GST-S100A9(0μg/ml、10μg/ml、20μg/ml、40μg/ml、80μg/ml)处理4天后,用MTT法检测细胞密度,根据酶标仪检测的OD492值结果发现,在3天和4天时,浓度为10μg/ml和20μg/ml 的GST-S100A9处理组均促进了HepG2细胞的存活 (P<0.05和P<0.01),而空白组、GST对照组及其他浓度处理组无显著差异(P>0.05)[图 3(a)]。肝正常细胞L02同时被不同浓度的GST-S100A9(0μg/ml、10μg/ml、20μg/ml、40μg/ml、80μg/ml)处理4天后,用MTT法检测OD492值发现,各组均无显著性差异(P>0.05)[图 3(b)]。
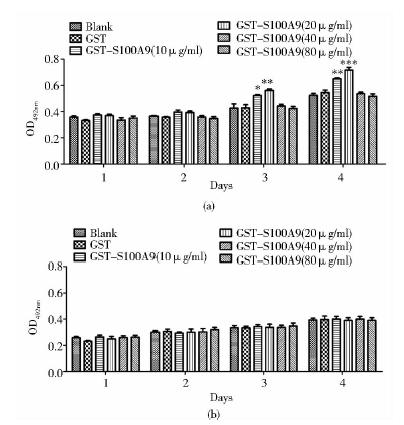
|
| 图 3 MTT法检测GST-S100A9对HepG2细胞与L02细胞存活的影响Fig. 3 Effect of GST-S100A9 on proliferation of HepG2 cells and L02 cells by MTT(a) HepG2 (b) L02 * P<0.05,** P<0.01,*** P<0.001 compared with GST group |
采用Transwell侵袭实验检测GST-S100A9对HepG2细胞与L02细胞侵袭的影响,GST-S100A9处理HepG2细胞24h后,穿膜细胞数较GST组增加1倍(P<0.01),而GST组与Blank组之间无显著性差异(P>0.05)。然而,GST-S100A9处理L02细胞24h后,Transwell侵袭实验结果显示,Blank组、GST组与GST-S100A9组的穿膜细胞数均无统计学差异(P>0.05)(图 4)。
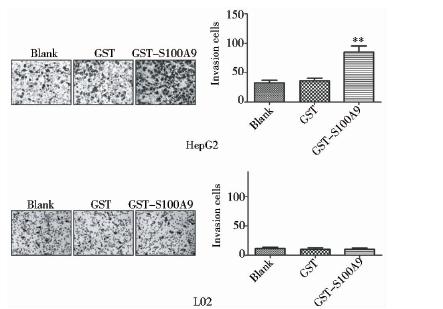
|
| 图 4 Transwell侵袭实验检测GST-S100A9对HepG2细胞与L02细胞侵袭的影响Fig. 4 Effect of GST-S100A9 on proliferation of HepG2 cells and L02 cells by Transwell invasion assay** P<0.01 compared with GST group |
提取肝正常细胞L02与肝癌细胞HepG2的细胞膜总蛋白质,采用Western blot方法检测RAGE的表达,MCF-7细胞中RAGE的表达作为阳性对照。结果显示,RAGE在HepG2细胞中表达显著高于L02细胞,差异具有统计学意义(P<0.01)(图 5)。
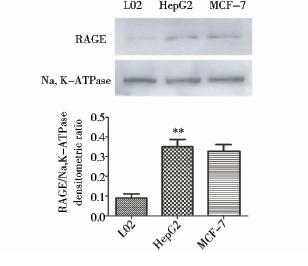
|
| 图 5 Western blot检测RAGE的表达Fig. 5 RAGE expression detected by Western blot** P<0.01 compared with L02 group |
基于RAGE在HepG2细胞的高表达及乳腺癌中与RAGE和S100A9的相互作用报道[18],我们研究RAGE是否参与介导S100A9对HepG2细胞促存活及促侵袭的作用。采用RAGE中和抗体来阻断S100A9与RAGE受体的结合作用,检测HepG2细胞存活及侵袭能力的变化。
MTT检测结果显示,GST-S100A9处理HepG2细胞3天和4天后,HepG2细胞的存活能力与Blank组、GST组、Anti-RAGE组相比,显著增强(P<0.05,P<0.01)。GST-S100A9与Anti-RAGE同时处理HepG2细胞3天和4天后,HepG2细胞的存活能力与GST-S100A9组相比显著降低(均P<0.05)。Blank组、GST组、Anti-RAGE组相比,HepG2细胞的存活能力无显著影响(P>0.05)[图 6(a)]。
Transwell侵袭实验结果显示,GST-S100A9处理HepG2细胞24h后,穿膜细胞数较Blank组、GST组、Anti-RAGE组显著增加(P<0.01)。GST-S100A9与Anti-RAGE同时处理HepG2细胞24h后,HepG2细胞的穿膜细胞数较GST-S100A9组显著降低(P<0.01)。Blank组、GST组、Anti-RAGE组相比,HepG2细胞的侵袭能力无显著影响(P>0.05)[图 6(b)]。
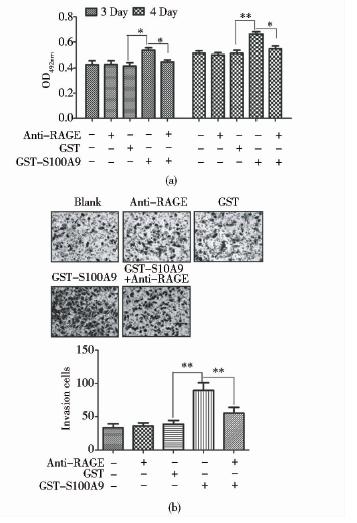
|
| 图 6 Anti-RAGE阻断S100A9对HepG2细胞促存活(a)与促侵袭(b)的作用Fig. 6 Anti-RAGE treatment abrogated the S100A9-promoted proliferation(a) and invasion(b) of HepG2 cells |
在肝癌中,肿瘤微环境对肝癌的发生发展、侵袭及转移起着至关重要的作用[20]。S100A9正是肿瘤细胞及间质细胞表达并分泌的重要分子,参与肿瘤微环境的组成。已有文献报道,S100A9在肝癌、侵袭性乳腺癌、肺腺癌、甲状腺癌宫颈癌及鼻咽癌等肿瘤中高表达,且与肿瘤的恶性程度呈正相关[8, 21, 22, 23, 24, 25]。我们也发现S100A9在肝癌中高表达,与Arai等[8]的结果一致。基于S100A9在多种肿瘤的异常表达及与肿瘤的进展密切,S100A9可能参与肿瘤的发生发展。
为阐明肝癌中S100A9的高表达是否与肝癌发生发展有关,我们使用外源性的重组S100A9蛋白(GST-S100A9)作为干预工具,探索S100A9对肝癌细胞系HepG2的生物学作用。我们发现,S100A9 (20μg/ml)可以促进肝癌细胞系HepG2的存活与侵袭。这一结果与S100A9在前列腺癌、乳腺癌及结直肠癌中的作用是一致的[7, 18, 26, 27]。此外,S100A9对肝癌细胞促侵袭作用也进一步提示其可能与肝癌的转移有关。
S100A9对肝癌细胞系HepG2有作用,而对肝正常细胞系L02无作用,我们猜测其原因与S100A9的受体有关。在乳腺癌中,RAGE可作为S100A9信号转导的受体[18]。因此,我们检测了HepG2细胞与L02细胞膜上RAGE的表达,发现HepG2细胞膜上RAGE的表达显著高于L02细胞。RAGE在肝癌细胞水平的高表达与之前Yaser等[28]报道的关于RAGE高表达于肝癌组织是一致的。值得注意的是,采用RAGE阻断抗体及封闭RAGE活性位点后,S100A9对HepG2细胞的促存活与促侵袭作用均被逆转。该部分结果也进一步解释了S100A9对肝正常细胞无影响以及对癌细胞有作用是由于其膜RAGE表达差异所致。基于RAGE与S100A9对肝癌细胞存活及侵袭的重要作用,为将来从分子水平干预肝癌的发生及转移提供了重要的实验依据。
综上,S100A9可以促进肝癌细胞系HepG2的存活与侵袭,并且是依赖于RAGE的。
| [1] | Donato R. S100: a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles. Int J Biochem Cell Biol, 2001, 33(7): 637-668. |
| [2] | Saleem M, Kweon M H, Johnson J J, et al. S100a4 accelerates tumorigenesis and invasion of human prostate cancer through the transcriptional regulation of matrix metalloproteinase 9. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(40):14825-14830. |
| [3] | Benedyk M, Sopalla C, Nacken W, et al. HaCaT keratinocytes overexpressing the S100 proteins S100A8 and S100A9 show increased NADPH oxidase and NF-kappaB activities. J Invest Dermatol, 2007, 127(8): 2001-2011. |
| [4] | Markowitz J, Carson W E 3rd. Review of s100a9 biology and its role in cancer. Biochimica et Biophysica Acta, 2013,1835(1):100-109. |
| [5] | Srikrishna G. S100A8 and S100A9: new insights into their roles in malignancy. J Innate Immun, 2012, 4(1):31-40. |
| [6] | Salama I, Malone P S, Mihaimeed F, et al. A review of the S100 proteins in cancer. Eur J Surg Oncol, 2008, 34(4): 357-364. |
| [7] | Duan L, Wu R, Ye L, et al. S100A8 and S100A9 are associated with colorectal carcinoma progression and contribute to colorectal carcinoma cell survival and migration via Wnt/beta-Catenin pathway. PLoS One, 2013, 8(4): e62092. |
| [8] | Arai K, Yamada T, Nozawa R. Immunohistochemical investigation of migration inhibitory factor-related protein (MRP)-14 expression in hepatocellular carcinoma. Med Oncol, 2000, 17(3): 183-188. |
| [9] | Nemeth J, Stein I, Haag D, et al. S100A8 and S100A9 are novel nuclear factor kappa B target genes during malignant progression of murine and human liver carcinogenesis. Hepatology, 2009, 50(4): 1251-1262. |
| [10] | Riehl A, Nemeth J, Angel P, et al. The receptor rage: Bridging inflammation and cancer. Cell Commun Signal, 2009,7(10):12. |
| [11] | Taguchi A, Blood D C, del Toro G, et al. Blockade of rage-amphoterin signalling suppresses tumour growth and metastases. Nature, 2000,405(6784):354-360. |
| [12] | Hiwatashi K, Ueno S, Abeyama K, et al. A novel function of the receptor for advanced glycation end-products (RAGE) in association with tumorigenesis and tumor differentiation of HCC. Ann Surg Oncol,2008,15(3):923-933. |
| [13] | Cheng P, Dai W, Wang F, et al. Ethyl pyruvate inhibits proliferation and induces apoptosis of hepatocellular carcinoma via regulation of the HMGB1-RAGE and AKT pathways. Biochem Biophys Res Commun,2014,443(4):1162-1168. |
| [14] | Chen R C, Yi PP, Zhou R R, et al. The role of HMGB1-RAGE axis in migration and invasion of hepatocellular carcinoma cell lines. Mol Cell Biochem,2014,390(1-2):271-280. |
| [15] | Takino J, Yamagishi S, Takeuchi M. Glycer-AGEs-RAGE signaling enhances the angiogenic potential of hepatocellular carcinoma by upregulating VEGF expression. World J Gastroenterol,2012,18(15):1781-1788. |
| [16] | Hofmann M A, Drury S, Fu C, et al. Rage mediates a novel proinflammatory axis: a central cell surface receptor for s100/calgranulin polypeptides. Cell, 1999,97(7):889-901. |
| [17] | Dattilo B M, Fritz G, Leclerc E, et al. The extracellular region of the receptor for advanced glycation end products is composed of two independent structural units. Biochemistry, 2007,46(23):6957-6970. |
| [18] | Ghavami S, Rashedi I, Dattilo B M, et al. S100A8/A9 at low concentration promotes tumor cell growth via RAGE ligation and MA Pkinase-dependent pathway. J Leukoc Biol, 2008, 83(6): 1484-1492. |
| [19] | 游莉,徐兰兰,郭元元,等.GST-hS100A9 融合蛋白的原核表达、纯化及鉴定.中国生化药物杂志,2011,32(4): 253-256. You L, Xu L L, Guo Y Y,et al. Prokaryotic expression, purification and identification of GST-human S100A9 fusion protein. Chinese Journal of Biochemical Pharmaceutics,2011,32(4): 253-256. |
| [20] | Yang J D, Nakamura I, Roberts L R. The tumor microenvironment in hepatocellular carcinoma: current status and therapeutic targets. Semin Cancer Biol, 2011, 21(1):35-43. |
| [21] | Geetha S. S100A8 and S100A9: new insights into their roles in malignancy. J Innate Immun, 2012, 4(1):31-40. |
| [22] | Salama I, Malone P S, Mihaimeed F, et al. A review of the S100 proteins in cancer. Eur J Surg Oncol, 2008, 34(4): 357-364. |
| [23] | Ito Y, Arai K, Ryushi, et al. S100A9 expression is significantly linked to dedifferentiation of thyroid carcinoma. Pathol Res Pract, 2005, 201(8-9):551-556. |
| [24] | 朱红,刘丽,刘欢,等. Galectin-7和S100A9表达与宫颈鳞癌发生发展的相关性.中南大学学报(医学版), 2013,9(38): 888-895. Zhu H, Liu L, Liu H, et al. Expression of galectin-7 and S100A9 and development of cervical squamous carcinoma.Journal of Central South University: Medical Science, 2013,9(38): 888-895. |
| [25] | 吴慧玲,董盛宇,叶耀耀,等. S100蛋白表达与鼻咽癌临床关系的研究.中国现代医药杂志, 2013, 15(5): 15-18. Wu H L,Dong S Y, Ye Y Y, et al. The expression and clinical significance of S100 protein family in nasopharyngeal carcinoma.Modern Medicine Journal Of China, 2013,15(5): 15-18. |
| [26] | Hermani A, De Servi B, Medunjanin S, et al. S100A8 and S100A9 activate MA Pkinase and NF-kappaB signaling pathways and trigger translocation of RAGE in human prostate cancer cells. Exp Cell Res, 2006, 312(2): 184-197. |
| [27] | Moon A, Yong H Y, Song J I, et al. Global gene expression profiling unveils S100A8/A9 as candidate markers in H-ras-mediated human breast epithelial cell invasion. Mol Cancer Res, 2008,6(10): 1544-1553. |
| [28] | Yaser A M, Huang Y, Zhou R R, et al. The role of receptor for advanced glycation end products (RAGE) in the proliferation of hepatocellular carcinoma. Int J Mol Sci, 2012, 13(5): 5982-5997. |
 2015, Vol. 35
2015, Vol. 35




