文章信息
- 叶雨辰, 赵俊龙, 王琳, 段娟丽, 高春辰, 秦鸿雁, 窦科峰
- YE Yu-chen, ZHAO Jun-long, WANG Lin, DUAN Juan-li, GAO Chun-chen, QIN Hong-yan, DOU Ke-feng
- EGFP-Luc-Hepa1-6细胞系的构建及其在小鼠肝癌模型中的应用
- Construction of A Cell Line EGFP-Luc-Hepa1-6 and Its Application in the Mouse Model of the Hepatoma
- 中国生物工程杂志, 2015, 35(5): 1-7
- China Biotechnology, 2015, 35(5): 1-7
- http://dx.doi.org/10.13523/j.cb.20150501
-
文章历史
- 收稿日期:2015-02-13
- 修回日期:2015-03-26
2. 第四军医大学基础部医学遗传学与发育生物学教研室 肿瘤生物学国家重点实验室 西安 710032
2. State Key Laboratory of Cancer Biology, Department of Medical Genetics and Developmental Biology, Fourth Military Medical University, Xi'an 710032, China
肝癌的动物模型是研究肝癌的发病机制、药物的疗效评价、开发新的治疗方法的重要工具,已广泛的应用于肝癌的基础研究中。其构建方法可以分为肿瘤移植、基因修饰、病毒感染、化学试剂诱导等[1]。Schneider等[2]对2周龄小鼠进行腹腔注射二乙基亚硝胺(diethylnitrosamine,DEN),42周后可见小鼠有肝癌形成。Lujambio等[3]在2周龄小鼠注射DEN的基础上,6周后腹腔注射CCl4持续12周,进一步缩短肝癌建模时间。虽然通过DEN诱导是公认的构建肝癌模型的方法,但是这种方法仍然有实验周期长,不确定因素多等缺陷。相比之下,肿瘤细胞移植构建肝癌模型因具有操作简便、周期较短等优势,而日益受到研究人员的关注。除了于肝脏原位注射肝癌细胞,肝癌模型构建的注射方式还可通过肠系膜静脉[4]、皮下[5]、足垫[6]、脾脏[7],但是这些注射方式可能存在肿瘤播散、肿瘤微环境改变的缺陷。而原位接种的肝癌模型在影像学和组织学上本身符合常见的肝癌表型待征[8],因此原位肝癌模型是反映肝癌生物学特性的最佳选择。但由于原位肝癌只有进展到一定阶段才可触及,无法监测肿瘤的连续变化,而且离体肿瘤组织中肝癌细胞形态不一,在定性、定量上有一定困难。针对这些问题,本研究通过构建同时过表达EGFP和luciferase的载体质粒pCMV-Luciferase-IRES2-EGFP,转染Hepa1-6细胞系并进行稳定筛选,以表达此载体的肝癌细胞系构建C57BL/6小鼠原位肝癌模型,对小鼠肝癌细胞进行稳定标记与活体示踪。 1 材料与方法 1.1 实验材料
C57BL/6小鼠肝癌细胞系Hepa1-6、pIRES2-EGFP质粒、pGL3-Basic质粒、大肠杆菌DH5α感受态细胞为第四军医大学基础部医学遗传学与发育生物学教研室保存。 1.2 细胞培养
小鼠Hepa1-6细胞完全培养基为含10%胎牛血清的RPMI-1640培养基,细胞置于37℃、5%CO2孵箱中进行培养。 1.3 构建pCMV-Luciferase-IRES2-EGFP重组质粒 1.3.1 pIRES2-EGFP质粒、pGL3-Basic质粒酶切验证
以pIRES2-EGFP、pGL3-Basic两种质粒常规转化大肠杆菌DH5α感受态细胞,将转化的菌液涂布于含卡纳霉素、氨苄霉素的LB 固体平板,培养过夜。挑取单克隆菌落置入含有对应抗性LB培养液的菌种管中,37℃摇菌12h。以BamH I和Hind Ⅲ对pGL3-Basic质粒进行酶切鉴定,以Nco I对pIRES2-EGFP质粒进行酶切鉴定。 1.3.2 pIRES2-EGFP质粒、pGL3-Basic质粒酶切回收
以Xho I/Sma I酶切pIRES2-EGFP质粒,琼脂糖凝胶电泳后,利用紫外灯定位以切取目的DNA片段凝胶条,回收线性载体大片段。以XbaI酶切pGL3-Basic质粒,Klenow片段、dNTP对黏性末端补平,片段纯化之后进行Xho I酶切,琼脂糖凝胶电泳后回收luciferase小片段。 1.3.3 回收产物连接重组与鉴定
取回收的luciferase小片段、pIRES2-EGFP质粒载体大片段与DNA Ligation Kit Solution I混匀后于4℃孵育过夜。以连接产物转化感受态细胞,涂布于LB固体平板上,挑菌落,摇菌,提取质粒。将重组质粒通过琼脂糖凝胶电泳及Hind Ⅲ单酶切后电泳鉴定连接产物。酶切鉴定正确的质粒送北京奥科鼎盛生物科技有限公司测序。构建成功的质粒命名为pCMV-Luciferase-IRES2-EGFP。 1.3.4 重组质粒转染Hepa1-6细胞和荧光蛋白表达检测
将Hepa1-6细胞接种于6孔板,当细胞汇合度达80%时进行瞬时转染。6孔板各孔以质粒DNA 2μg、脂质体6μl进行转染,37℃、5% CO2孵育24h。倒置荧光显微镜下观察绿色荧光蛋白的表达情况。 1.3.5 报告基因实验
Hepa1-6细胞转染48h后,消化离心弃上清液,以 1×Lysis Buffer裂解细胞并离心,取上清液加入预冷的1.5ml离心管中,添加LARⅡ迅速吹打混匀,置于GloMaxTM发光检测仪(Promega)中检测。再添加SG Reagent迅速混匀后检测,记录RLUS1、RLUS2、RATIO读数。 1.4 稳定筛选细胞系
Hepa1-6细胞转染24h后吸弃上清液,加入含有10%FCS、800μg/ml G418的RPMI 1640培养基,培养约3周,其间换液,去除死亡的细胞,筛选出稳定表达pCMV-Luciferase-IRES2-EGFP的细胞(命名为EGFP-Luc-Hepa1-6)。 1.5 检测稳筛细胞系生物发光活性
消化计数EGFP-Luc-Hepa1-6细胞,以0.4×106个、0.8×106个、1.2×106个、1.6×106个、2×106个细胞分别接种至6孔板,预留一孔仅添加培养基作为空白对照。细胞贴壁过夜后,于6孔板每孔添加15mg/ml D-luciferin,轻轻摇匀置于Lumina Ⅱ成像系统进行检测。 1.6 动物实验 1.6.1 C57BL/6小鼠原位肝癌模型构建
取20只C57BL/6小鼠随机分成对照组与实验组两组,每组10只小鼠。以0.6%戊巴比妥钠对小鼠腹腔注射进行麻醉,取仰卧位固定于鼠板,以75%乙醇常规消毒,于剑突下横行切开腹部皮肤,轻轻推挤胸腔使肝脏左外叶露出体表。将微量进样器刺入肝内约1cm,缓慢推注30μl Matrigel胶(对照组)或30μl含有2×106个EGFP-Luc-Hepa1-6细胞的Matrigel胶悬液(实验组)。缓慢拔出微量进样器,医用胶封闭针孔。逐层缝合关腹,再次乙醇消毒。 1.6.2 连续活体监测小鼠肝癌生长
以15mg/ml D-luciferin对小鼠进行腹腔注射,以异氟烷氧气实施吸入麻醉,以仰卧位摆放于LuminaⅡ成像系统暗箱中进行原位肝癌的活体成像。 1.6.3 肝癌组织病理学检测
处死建模4周后小鼠,解剖取肝癌组织,经10%福尔马林溶液固定24~48h,制备石蜡切片,HE染色进行常规病理检查。 1.6.4 肝癌组织免疫荧光染色检测
常规制备冰冻切片,室温干燥,添加1%BSA抗体稀释液100μl封闭30min后,以100μl hoechst稀释液染细胞核10min。以1×PBS清洗3次,50%丙三醇封片,荧光显微镜下观察采图。 1.7 统计学分析
实验数据采用SPSS 13.0软件进行分析,计量资料以X±S表示。两组数据间的均数比较应用独立样本t检验。接种细胞数与光通量值之间的相关性检验采用线性回归分析。P<0.05表示差异有统计学意义。 2 结 果 2.1 pIRES2-EGFP质粒、pGL3-Basic质粒酶切验证结果
如图 1(a)所示,以Nco I对pIRES2-EGFP质粒进行酶切鉴定,1号、3号、4号为正确质粒,而2号质粒可能酶切不完全。以BamH I和Hind Ⅲ对pGL3-Basic质粒进行酶切鉴定,5号、6号、7号、8号均为正确质粒。 2.2 pIRES2-EGFP质粒、pGL3-Basic质粒酶切回收
取1号、3号、4号pIRES2-EGFP质粒,以Xho I/Sma I进行酶切,琼脂糖凝胶电泳显示条带大小正确[图 1(b)],回收载体大片段。取第5号、6号、7号、8号pGL3-Basic质粒,以Xba I酶切、Klenow片段补平黏性末端、Xho I酶切,电泳结果显示条带大小均正确[图 1(c)],回收luciferase小片段。

|
| 图 1 构建pCMV-Luciferase-IRES2-EGFP质粒Fig. 1 Construction of pCMV-Luciferase-IRES2-EGFP(a) Identification results of digestion of pIRES2-EGFP and pGL3-Basic by restriction endonucleases 1~4:pIRES2-EGFP vector digested by Nco I; M:DL5000 DNA Marker; 5~8:pGL3-Basic vector digested by BamH I/Hind Ⅲ (b) pIRES2-EGFP vector digested by double endonucleases 1~3:pIRES2-EGFP vector digested by Xho I/Sma I; M:DL5000 DNA Marker (c) pGL3-Basic vector digested by double endonucleases M:DL5000 DNA Marker; 1~4:pIRES2-EGFP vector digested by Xba I,end repaired by Klenow fragment,and then digested by Xho I |
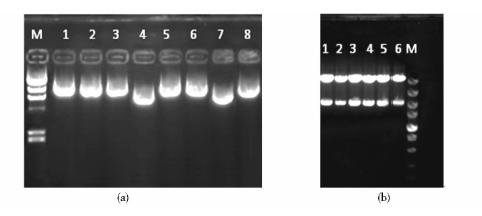
凝胶电泳结果[图 2(a)]显示,1号、2号、3号、5号、6号、8号连接产物在6 557~9 416bp有目的条带(6 977bp),表明luciferase小片段与pIRES2-EGFP质粒载体大片段连接成功。而4号、7号质粒在相应位置未见目的条带,连接未成功。将有目的条带的连接产物以Hind Ⅲ单酶切进行鉴定,电泳结果如图 2(b)所示,连接产物酶切条带大小均正确。对酶切鉴定正确的质粒进行测序,测序结果比对完全正确。
|
| 图 2 重组质粒pCMV-Luciferase-IRES2-EGFP鉴定 Fig. 2 Identification of the recombinant vector pCMV-Luciferase-IRES2-EGFP(a) Gel electrophoresis of the recombinant product pCMV-Luciferase-IRES2-EGFP M:λ-Hind Ⅲ digest DNA Marker; 1~8:Recombinant product pCMV-Luciferase-IRES2-EGFP (b) Identification results of digestion of pCMV-Luciferase-IRES2-EGFP by endonuclease 1~6:Recombinant product pCMV-Luciferase-IRES2-EGFP digested by Hind Ⅲ; M:DL5000 DNA Marker |
Hepa1-6细胞转染重组质粒24h后,于倒置荧光显微镜下观察,由图 3(a)可见Hepa1-6细胞表达绿色荧光蛋白,表明质粒转染成功。以pIRES2-EGFP转染的Hepa1-6细胞作为对照组,pCMV-Luciferase-IRES2-EGFP转染的Hepa1-6细胞作为实验组,分别进行报告基因实验。如图 3(b)所示,与前者相比,转染重组质粒的Hepa1-6细胞表达荧光素酶活性明显升高,可以用于后续的活体成像实验。

|
| 图 3 Hepa1-6转染pCMV-Luciferase-IRES2-EGFP质粒后倒置荧光显微镜观察(×10)(a)与荧光素酶活性检测(b) Fig. 3 Inverted fluorescent microscope observation(×10) (a) and detection of relative luciferase activity of Hepa1-6 cells transfected (b) with pCMV-Luciferase-IRES2-EGFP plasmid |
在LuminaⅡ成像系统下,6孔板中接种EGFP-Luc-Hepa1-6细胞的5孔均可见荧光信号产生[图 4(a)],且各孔检测到的光通量值(Avg Radiance)随着细胞数目的增加而上升,其中接种2×106个细胞的孔可见最明亮的荧光信号。线性回归分析结果显示:接种细胞数与光通量值之间存在线性相关关系(P< 0. 01),相关系数R2=0.985 7[图 4(b)]。

|
| 图 4 LuminaⅡ成像系统检测EGFP-Luc-Hepa1-6细胞生物发光活性 Fig. 4 Detection of bioluminescence of EGFP-Luc-Hepa1-6 by LuminaⅡimaging system |
在小鼠肝脏原位接种2×106个细胞后,分别于1周、2周、3周、4周以LuminaⅡ成像系统监测其肝癌的进展状况。由图 5(a)、(b)可见,实验组小鼠于2周可见较为明显的生物发光信号,并且随着时间的推移而不断增强,光通量值也随时间呈现递增的趋势,而对照组小鼠均未见明显阳性信号。

|
| 图 5 LuminaⅡ成像系统活体监测小鼠肝癌进展 Fig. 5 Monitoring the hepatoma progression of mice in vivo using LuminaⅡimaging system |
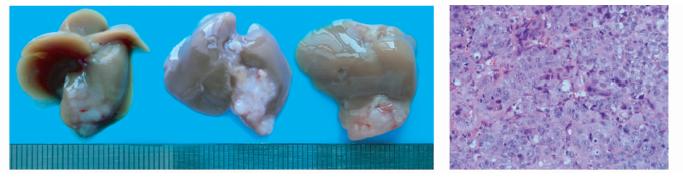
如图 6所示,肝左叶肿瘤形态不规则,呈结节状浸润生长,表面凹凸不平,质地较硬。病理切片HE染色结果显示,肝癌组织内肿瘤细胞为类圆形或不规则形,核质比失调,异型性显著,呈团块状分布。取肝癌组织冰冻切片进行免疫荧光染色,可见肝癌细胞表达绿色荧光蛋白,可以有效的与非肿瘤细胞区分开(图 7)。
|
| 图 6 小鼠原位肝癌组织大体标本与病理切片(HE染色,×40) Fig. 6 Gross specimen and pathological section(HE staining,×40) of orthotopic hepatoma tissue in mice |

|
| 图 7 小鼠原位肝癌组织免疫荧光染色(×40) Fig. 7 Immunoflurescent staining(×40) of orthotopic hepatoma tissue in mice |
Hepa1-6细胞是来源于C57小鼠BW7756肝癌[9]的细胞系,表达AFP和白蛋白,体内实验构建的肝癌在组织学上与人的肝癌高度相似[10],因此在小鼠肝癌模型构建中被广泛使用。然而,以单纯的Hepa1-6细胞进行肝癌构建无法满足活体连续检测肿瘤生长、鉴别区分肿瘤细胞等研究需求。随着近年来报告基因技术不断发展,荧光蛋白报告基因、荧光素酶报告基因等已成为基础医学研究中常用的细胞标记与示踪的方法,由于其具有方便快捷、安全直观的优点,不仅普遍应用于探索构建分子通路的分子生物学实验[11],而且越来越广泛用于构建疾病与治疗模型的动物实验。Yang等[12]构建了过表达mMIP-1alpha和GFP的Hepa1-6细胞系以构建皮下接种的异位肝癌模型,观察mMIP-1alpha对肝癌形成的抑制作用。Wang等[10]利用过表达luciferase的Hepa1-6细胞成功构建小鼠原位肝癌模型,运用小动物成像系统进行了原位肝癌的连续监测。最近,越来越多研究人员用融合表达EGFP和luciferase载体转染细胞系以对其进行双重标记。Yang等[13]建立持续性过表达EGFP和luciferase的GBM细胞系以探讨星形胶质细胞对恶性胶质瘤化疗耐药性的调节。带有双融合报告基因luciferase和EGFP的MDA-MB-231乳腺癌细胞系也已建立用以构建原位乳腺癌模型[14]。但是,目前据我们所知,用于构建原位肝癌模型的过表达EGFP和luciferase的C57小鼠肝癌细胞系尚未见报道。
本研究首先对pIRES2-EGFP质粒、pGL3-Basic质粒进行酶切鉴定,确认质粒正确后,以Xho I/Sma I对pIRES2-EGFP质粒酶切,获得载体大片段。以Xba I酶切pGL3-Basic质粒,Klenow片段补平黏性末端,再进行Xho I酶切,获得luciferase小片段。pIRES2-EGFP质粒载体大片段与luciferase小片段成功连接后,酶切鉴定与测序比对结果显示序列完全正确。以重组载体转染Hepa1-6细胞,荧光显微镜、报告基因实验检测表明载体基因在Hepa1-6细胞中能有效表达。以活体成像系统对稳定筛选后的细胞系进行生物发光活性检测显示:接种细胞数与对应光通量值之间存在线性相关关系。故以此细胞系进行小鼠肝脏原位接种构建肝癌模型,并以LuminaⅡ成像系统观察发现肝癌生物发光信号随时间逐渐增强,可以有效进行小鼠肝癌发展的连续活体监测。对建模4周的小鼠肝癌进行大体标本、组织切片HE染色观察,其符合肝癌的形态学和病理学特征。肝癌组织的免疫荧光染色显示肝癌细胞表达EGFP,对离体肿瘤组织中的肝癌细胞实现了体外标记,便于进行肿瘤细胞内分子通路的分析,或者探讨肝癌细胞与免疫细胞相互作用的机制。
以往研究中构建的过表达GFP的Hepa1-6实现了对体外肿瘤细胞的标记,但却难以对其进行活体示踪;而以过表达luciferase的Hepa1-6细胞构建原位肝癌模型虽然解决了肝癌生长的在体监测问题,但需要荧光素底物才可检测荧光素酶活性,且反应具有时效性,尚难以对离体的肝癌细胞作持续而稳定的标记。因此,我们通过构建载体质粒pCMV-Luciferase-IRES2-EGFP转染Hepa1-6细胞获得稳筛细胞系,使 Hepa1-6细胞系同时过表达EGFP和luciferase。以此细胞系构建的C57BL/6小鼠原位肝癌模型具备体内、体外双重标记肝癌细胞的特性,既能对活体肝癌组织生长进行连续监测并进行定量分析,又能在离体的肿瘤组织及体外共培养体系中标识肝癌细胞以便于准确的定性和定量。因此,此方法对小鼠原位肝癌的监测相对于以往的方法具有更方便、更快捷、更全面、更精确等优势。本研究中构建的EGFP-Luc-Hepa1-6细胞系可以为更深入的研究肝癌发生发展机制、肿瘤微环境与肿瘤细胞间的关系及抗癌药物疗效等提供便利,且pCMV-Luciferase-IRES2-EGFP载体也可运用于转染其他类型的肿瘤细胞系以进行双重标记。我们相信,细胞标记与示踪技术的迅速发展与广泛应用将为包括肿瘤研究在内的许多医学研究领域的技术问题铺平道路。
| [1] | Newell P, Villanueva A, Friedman S L,et al.Experimental models of hepatocellular carcinoma. J Hepatol, 2008,48(5): 858-879. |
| [2] | Schneider C, Teufel A, Yevsa T,et al. Adaptive immunity suppresses formation and progression of diethyl- nitrosamine-induced liver cancer.Gut, 2012, 61(12): 1733-1743. |
| [3] | Lujambio A, Akkari L, Simon J,et al. Non-cell-autonomous tumor suppression by p53. Cell,2013,153(2): 449-460. |
| [4] | Thompson K J, Swan R Z, Iannitti D A,et al. Diet-induced obesity and ethanol impair progression of hepatocellular carcinoma in a mouse mesenteric vein injection model.Surg Endosc, 2013, 27(1): 246-255. |
| [5] | Wang Y,Deng B,Tang W,et al. TGF-beta1 secreted by hepatocellular carcinoma induces the expression of the Foxp3 gene and suppresses antitumor immunity in the tumor microenvironment.Dig Dis Sci, 2013, 58(6): 1644-1652. |
| [6] | Wang L K, Kuang M, Hua Y P,et al. Profile of regulatory T cells and interferon gamma secretion in the tumor-draining lymph node from mouse Hepa1-6 cells.J Surg Res, 2013, 183(2): 900-906. |
| [7] | Jain R K, Munn L L, Fukumura D, et al. Liver tumor preparation in mice. Cold Spring Harb Protoc, 2012,12.doi:10.1101/pdb.prot072371. |
| [8] | Okubo H,Takei Y,Serizawa N,et al. Orthotopic hepatocellular carcinoma model with a controlled and reproducible tumorigenicity.J Gastroenterol Hepatol, 2007, 22(3): 423-428. |
| [9] | Szpirer C, Szpirer J. A mouse hepatoma cell line which secretes several serum proteins including albumin and alpha-foetoprotein. Differentiation, 1975, 4(2): 85-91. |
| [10] | Wang Q,Luan W, Goz V,et al. Non-invasive in vivo imaging for liver tumour progression using an orthotopic hepatocellular carcinoma model in immunocompetent mice. Liver Int, 2011,31(8): 1200-1208. |
| [11] | Si S Y, Song S J, Zhang J Z, et al. Cloning of mouse telomerase reverse transcriptase gene promoter and identification of proximal core promoter sequences essential for the expression of transgenes in cancer cells. Oncol Rep, 2011, 26(2): 377-382. |
| [12] | Yang Q, Yang G, Wei L,et al. The in vivo antitumor activity of murine liver tumor vaccine expressing MIP-1alpha. Chinese Journal of Surgery, 2002,40(10): 789-791. |
| [13] | Yang N, Yan T, Zhu H,et al. A co-culture model with brain tumor-specific bioluminescence demonstrates astrocytes-induced drug resistance in glioblastoma.J Transl Med, 2014,12(1): 278. |
| [14] | Leng L, Wang Y, He N,et al. Molecular imaging for assessment of mesenchymal stem cells mediated breast cancer therapy.Biomaterials, 2014,35(19): 5162-5170. |
 2015, Vol. 35
2015, Vol. 35




