文章信息
- 冯天祥, 王玲, 陈海敏, 盛清, 左锐, 谢文杰
- FENG Tian-xiang, WANG Ling, CHEN Hai-min, SHENG Qing, ZUO Rui, XIE Wen-jie
- 植物内生放线菌功能及生物活性物质研究进展
- Research Advances on Function and Bioactive Substances of Endophytic actinomycetes
- 中国生物工程杂志, 2015, 35(4): 98-106
- China Biotechnology, 2015, 35(4): 98-106
- http://dx.doi.org/10.13523/j.cb.20150415
-
文章历史
- 收稿日期:2014-09-18
- 修回日期:2015-01-26
植物内生菌是在其生活史的某个阶段或全部阶段生活在健康植物的组织或器官内部、不会或至少暂时不会引发宿主植物产生明显病症的真菌、细菌和放线菌[1]。Stierle等[2]在1993年首次从短叶红豆杉分离到的内生真菌能产生抗肿瘤物质紫杉醇,为紫杉醇药物的生产提供了新来源。此外,在喜树分离到的内生真菌能产生喜树碱[3]、银杏内生菌能产生黄酮类化合物[4]、三叶半夏的内生菌产生半夏蛋白[5]等,表明植物内生菌可以产生与宿主植物相同或相似的化合物,这是药物筛选的新途径。植物内生菌与宿主植物存在共生的关系,可以产生抗生素和酶等代谢产物,具有促生、抗菌、抗虫和抗氧化等多种生物学作用。
目前,相对于植物内生真菌和其他内生细菌的广泛深入研究,有关植物内生放线菌生物学作用及其活性物质的的研究相对滞后,仍然有许多领域值得进一步深入研究。随着各生物学领域的不断发展,植物内生放线菌的更多独特的生物学特性将会被发现,也将作为新兴的微生物资源对人类生活发挥更大的作用,产生更广泛的影响。本文对植物内生放线菌的生物学作用及其生物活性物质的研究进展进行总结,并对当前植物内生放线菌研究中存在的问题和今后的发展方向提出对策和建议。
1 植物内生放线菌与宿主植物的关系植物内生放线菌与宿主植物之间存在复杂的微生态关系,具有重要的生态学作用[6]。植物会选择性地与内生放线菌互生,内生放线菌对宿主也具有选择性,其相互作用还受到环境因子的影响。植物内生菌侵入宿主植物后,不易受外界环境条件的影响,具有相对稳定的生存空间,可长期在其中定植和分布[7]。内生放线菌作为植物微生态系统中的天然组成部分,可以通过自身代谢产物或借助信号转导作用对宿主产生影响[8]。植物内生放线菌可以影响植物体内的物质代谢,提高植物对营养物质的利用率。例如,弗兰克氏菌通过产生固氮酶加速植物体对氮元素的吸收和利用[9]。根据基因水平转移理论,不同生物个体之间可以进行遗传物质的交流,植物也有可能将活性基因转移到共生的内生放线菌中,从而使其产生具有特定活性的化学物质[10]。因此植物内生放线菌将成为生物活性物质筛选的新方向和重要途径之一。基于植物与共生菌之间密切的相互作用关系,植物内生放线菌及其代谢产物的开发应用前景十分广阔。
2 植物内生放线菌的生物学功能 2.1 提高宿主抗逆性植物内生放线菌作为植物体内特殊的共生生物,可以拮抗宿主植物的病原菌。孙会强等[11]研究表明从烟草分离到的内生拮抗放线菌对烟草青枯病的病原菌有较好的抑制作用,有较高的研究价值和应用潜力。内生放线菌抑制植物病害的可能机制有产生抗生素抑制病原菌的生长以及通过产生几丁质酶和葡聚糖酶使微生物的细胞壁溶解,抑制微生物菌丝体的生长,达到控制病害的目的。Conn等[12]利用模式植物拟南芥对内生放线菌与宿主关系的研究表明,内生链霉菌可以诱导植物的防御通路,使宿主植物对病原微生物产生快速应答。Cao等[13]研究表明作为生物促进剂的铁载体也可以抑制镰刀菌的生长,是有前景的香蕉枯萎病的防治剂。近年来研究的主要关注点是利用内生放线菌抑制病原微生物作用,筛选生物防治剂对抗植物病害[14]。内生放线菌具有较为广泛的抗菌谱,而且其在宿主植物体内外都显示了良好的抗微生物活性。近年来,化学农药大量使用使环境危害日益严重,而内生放线菌作为生物防治剂,应用于农林病虫害防治不会造成严重的环境影响,在植物保护方面具有良好的应用前景。
植物体内分离到的内生放线菌还可应用于植物组织培养中提高培养物的抗逆性。Shimizu等[15]从杜鹃中分离出的内生链霉菌能够抑制盘多毛孢菌,提高杜鹃种子组织培养物抗逆性。Shimizu等[16]进一步的研究显示这些链霉菌诱导植物增强抗性的机制是通过激活苯丙素通路的防御应答而不是产生抗生素杀灭病原菌。Meguro等[17]从山月桂中分离到内生放线菌AOK-30也能够抑制盘多毛孢菌。Hasegawa等[18]和Meguro等[19]对AOK-30研究还发现,AOK-30能够提高山月桂幼苗组织培养物的耐旱性,其原因是AOK-30能够增加山月桂防御相关的基因表达。
2.2 促进植物生长植物内生放线菌定植在宿主植物组织内,产生植物激素和铁载体促进宿主植物生长。内生放线菌可产生的植物激素包括生长素[20]、赤霉素[21]、细胞分裂素[21]以及生长素类似物[22]等(表 1)。其中,吲哚乙酸(IAA)是内生放线菌产生的主要激素。例如,Shutsrirung等[23]分离到的内生放线菌具有产生IAA的能力,并且链霉菌属和拟诺卡氏菌属产生的高浓度的IAA,显著促进植物根系的生长。Goudjal等[24]从阿尔及利亚撒哈拉地区恶劣环境中生长的植物中分离到27株内生放线菌,其中18株能产生IAA,可以促进番茄种子的萌发和根的伸长。此外,El-Tarabily等[21]分离到的内生放线菌中有的能够产生吲哚丙酮酸和异戊烯腺嘌呤,这些植物生长调节剂不仅能够帮助植物生长得更好,还可以修复致病菌造成的组织损伤。放线菌产生的IAA活性的增强可引起营养物积累的增加。先前的研究曾报道植物激素(如生长素)能通过调节发育组织的渗透活性,从而显著影响营养物的吸收和进一步转运[25]。目前,公众越来越关注由化肥、农药、除草剂和真菌剂引起的环境污染问题,这也促使研究者选择生物因子促进植物生长。利用植物内生放线菌促进植物生长不会对环境造成严重污染,是一种十分高效廉价的生物资源。
铁载体虽然不能直接促进植物生长发育,但是铁载体可以通过螯合土壤中的铁离子并将其传递到植物体内,提高植物所需营养物质的吸收从而刺激植物生长。许多内生放线菌能够产生铁载体,有利于宿主植物营养物质的摄入。Nimnoi等[26]研究沉香树中的内生菌时就发现这些内生放线菌可以产生包括邻苯二酚和异羟肟酸在内的铁载体。Madhurama等[27]从芦荟、野薄荷和圣罗勒中分离到的内生放线菌具有产生高浓度铁载体的能力。植物与共生的内生菌组成了一个植物-微生物的微生态系统。如果在植物内同时接种具有协同效应的内生放线菌,也即共接种,将会产生比一种内生微生物更高的生物学效应[25, 28]。
2.3 生物固氮大气中的氮必须通过生物固氮才能被植物体吸收和利用。早在1866年,Waranin首先发现了非豆科植物结瘤的存在,并通过研究赤杨根瘤切片,认为是微生物刺激植物根部形成根瘤。1886年,Brunchorst将此类微生物命名为弗兰克氏菌(Frankia)[29]。直到1978年,Callaham等[30]从香蕨木根瘤中成功分离到弗兰克氏菌纯培养,为非豆科植物共生固氮菌的研究开辟了新篇章。植物内生放线菌是通过侵染宿主植物的根,形成根瘤进而进入宿主植物。Newcomb等[31]利用荧光技术和扫描电子显微镜技术研究香蕨木的根瘤形成过程,发现土壤中的放线菌通过侵染根毛进入植物的根;然后,菌丝体使宿主细胞壁降解,使根皮层细胞穿孔,从而进入到宿主植物细胞的胞浆,最后与植物形成共生体。杜大至等[32]以沙棘根瘤做实验材料,通过显微观察发现在幼嫩的根瘤内存在较多的菌丝体,而在成熟的根瘤里内生菌主要以孢囊或孢囊孢子的形式存在。
迄今为止的研究表明,弗兰克氏菌能使8个科25个属的双子叶植物结瘤,形成共生关系。在木麻黄科、马桑科、打提斯科、胡颓子科和杨梅科中能发生结瘤,而在桦木科、鼠李科和蔷薇科中偶尔发生结瘤[29]。表 2列举了放线菌根瘤植物的分类地位及其种属的结瘤频率。弗兰克氏菌具有跨越科、属植物进行侵染结瘤固氮的特性,因而被认为是研究扩大寄主范围、结瘤机制、固氮基因转移和构建新的固氮物种的理想材料。据估计,陆地生物固氮的25%是弗兰克氏菌共生固氮贡献的。近年来的研究表明,在同一个根瘤中可能存在多个类群的弗兰克氏菌,因此研究弗兰克氏菌类群必须建立在它们与宿主植物共生关系的基础上[33]。但是,由于植物间关系的不确定性以及对与根瘤植物共生的弗兰克氏菌多样性缺乏足够了解,有关共生体的进化到目前为止仍是模糊的。随着对弗兰克氏菌特性的不断认识,人们试图将这种共生体系的固氮功能由木本植物转移到禾本科作物上,以解决农田氮肥自给问题,减少农作物对氮素化肥的依赖。
| 亚纲 | 科 | 结瘤的属数/总属数 | 属 | 结瘤的种数/总种数 |
| 金缕梅亚纲Hamamelidae | 桦木科 | 1/6 | 桤木属 | 47/47 |
| 木麻黄科 | 4/4 | 异木麻黄属木麻黄属隐孔木麻黄属裸孔木麻黄属 | 52/5718/182/218/18 | |
| 蔷薇亚纲Rosidae | 杨梅科 | 2/3 | 香蕨木属杨梅属 | 1/128/60 |
| 胡颓子科 | 3/3 | 胡颓子属沙棘属水牛果属 | 35/452/32/3 | |
| 鼠李科 | 8/55 | 美洲茶属可氏茶属盘枣属刺枝树属雷坦果属塔勒古恩属特里沃属刺灌属 | 31/554/175/102/22/31/12/61/1 | |
| 蔷薇科 | 5/100 | 尾果茶属矮刺藤属科恩木属仙女木属珀氏梅属 | 4/201/21/251/32/4 | |
| 木兰亚纲Magnoliidae | 马桑科 | 1/1 | 马桑属 | 16/16 |
| 王桠果亚纲Dilleniidae | 打提斯科 | 1/3 | 达提斯加属 | 2/2 |
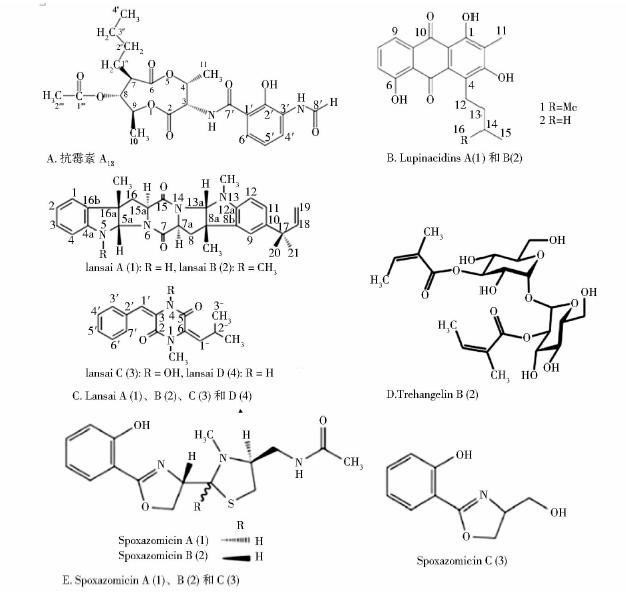
放线菌所产生的生物活性代谢产物中,抗生素最引人注目。至今发现的近万种天然抗生素中,约有60%是放线菌产生的,其中许多具有重要的医用价值已应用于临床[34]。Taechowisani等[35]首次从红豆蔻植物中分离到具有产生放线菌素D能力的链霉菌Tc022,能够强烈地抑制香蕉炭疽菌和白色念珠菌。Yan等[36]从红树林植物分离内生放线菌,发现一株能够产生抗霉素的内生黄白链霉菌,通过质谱鉴定,确定此化合物为抗霉素A18。抗霉素A18是抗霉素家族的一员,具有抗昆虫、螨类和真菌等活性。此外,放线菌还是新型抗生素的产生来源。Castillo等[37]从Grevillea pteridifolia分离的内生链霉菌NRRL 30566能够产生新型抗生素kakadumycins。Kakadumycins和喹喔啉类抗生素棘霉素相似,可以抑制炭疽杆菌和恶性疟原虫,还能够抑制RNA的合成,是新型具有潜在药理作用的资源。Inahashi等[38]在兰科植物的根部中分离到Streptosporangium oxazolinicum可以产生抗锥体虫的新型抗生素spoxazomicins。Lu等[39]在云南美登木分离到的Streptoyces sp. CS 产生新型抗生素24-demethyl-bafilomycin C1,抗菌实验显示该抗生素强烈抑制棒色霉菌(Penicillium avellaneum)。Pullen等[40]也从卫矛科植物分离到的链霉菌,它可产生新型抗生素celastramycins A(I)和B(Ⅱ)。这些都表明植物内生放线菌是新型抗生素的重要产生来源。
3.2 酶 类植物内生放线菌也是酶类物质的重要来源,各种各样的酶陆续在植物内生放线菌中被发现。植物内生放线菌产生的酶类主要包括几丁质酶[41]、果胶酶[42]、木聚糖酶[43]、淀粉酶[44]、角蛋白酶[45]和葡糖淀粉酶[46]等(表 3)。杜慧镜等[47]对药用植物内生放线菌的研究发现一些菌株表现出磷酸酶、酯酶、芳胺酶、β-糖醛酸甙酶和葡萄糖甙酶等酶的活性。
| 酶 | 内生放线菌 | 植物 | 发现者 | 参考文献 |
| 几丁质酶Chitinase | 链霉菌属 | 香豌豆 | Niamsup | [41] |
| 果胶酶Pectinase | 链霉菌属 | 杜鹃 | Minamiyama | [42] |
| 木聚糖酶Xylanase | 链霉菌属 | 杜鹃 | Minamiyama | [42] |
| 酯酶Esterase | 链霉菌属 | 杜鹃 | Minamiyama | [42] |
| 淀粉酶Amylase | 拟诺卡氏菌属 | 豆薯 | Stamford | [44] |
| 葡聚糖酶Glucanase | 链霉菌属、小单孢菌属、游动放线菌属、小双孢菌属、链孢子囊菌属 | 黄瓜 | El-Tarabily | [21] |
| 角蛋白酶Keratinase | 小单孢菌属 | 含生草 | El-Bondkly | [45] |
| 葡糖淀粉酶Glucoamylase | 链孢子囊菌属 | 玉米 | Stamford | [46] |
内生放线菌的酶类物质可以应用于工业生产。例如,利用木质素降解酶作为重要的水解酶资源降解木质素生产乙醇,是第二代乙醇生产技术的重点研究之一[48]。Stamford等[44, 46]为了改善工业生产中淀粉酶降解的热不稳定性,从内生放线菌中筛选出热稳定性α-淀粉酶和葡糖淀粉酶,以改善淀粉的降解过程,降低生产成本。在工业上,微生物所产生的果胶酶也可以用来生产果酒,或者直接利用微生物发酵进行生产。
3.3 抗肿瘤物质植物内生放线菌还可以产生许多抗肿瘤活性物质。Lin等[49]从红树林植物桐花树中分离到的内生放线菌能够产生三种新型的吡喃酮衍生物norcardiatones A(1),B(2)和C(3)(图 1),其中化合物A(1)对海拉细胞显示有细胞毒性。Igarashi等[50]从内生放线菌Micromonospora lupini中得到的新型蒽醌类化合物lupinacidins,能够强烈抑制小鼠结肠26-L5癌细胞侵蚀。Yu等[51]从健康的荷莲豆茎中分离的链霉菌YIM56209能够产生bafilomycins,后者对人肺腺癌细胞系A-549、结直肠腺癌细胞系HT-29有细胞毒性,而且能够抑制表皮生长因子和催乳素介导的细胞外调节蛋白激酶磷酸化从而使信号通路被阻断达到抑癌效果。Huang等[52]从海南12种药用植物的组织中分离到280株内生放线菌。大约有41.1%菌株的发酵液提取物有抑制肝癌细胞SMMC-7721的活性。Tuntiwachwuttikul等[53]研究表明内生链霉菌Streptomyces sp. SUC1产生的次级代谢产物显示有抗肿瘤活性,并将此类物质命名为lansai。Caruso等[54]从红豆杉植物分离的内生放线菌可以产生紫杉烷类物质,浓度为50~100ng/L,其中一株北里孢菌具有紫杉醇的全部合成途径,但其调控机制尚待研究。
此外,还有一些研究发现具有抗肿瘤、抗癌或细胞毒性作用的内生放线菌功能菌株,但具体活性成分尚未被鉴定。例如,Li等[55]从云南热带雨林药用植物中分离的内生链霉菌中,有31.7%的菌株培养物显示有细胞毒性,但是并不明确这些细胞毒性物质的具体成分。冯治翔等[56]从连翘和水茄根部分离到14株内生放线菌,其中10株菌的发酵粗提物具有不同程度的抗肿瘤活性。
3.4 其他生物活性植物内生放线菌的代谢产物及其生物学作用具有多样性。在众多的代谢产物中,同一种物质可以有多种不同的生物学活性。例如,放线菌酮既可以作为抗微生物药物,也可以抑制真核生物蛋白质合成,具有抑癌作用[57]。
内生放线菌产生的代谢产物还具有一些独特的生物学作用。Nakashima等[58]发现一种红色多形态孢菌(Polymorphospora rubra)K07-0510 产生的新型代谢产物trehangelins,具有抑制由光激活的脱镁叶绿酸造成的红细胞溶血活性。Jasmine等[59]研究表明从长春花分离出来的一些内生放线菌产生的代谢产物具有抑制α-葡糖苷酶活性和抗氧化作用,是治疗肥胖和糖尿病的潜在药物。Christhudas等[60]从曼陀罗中分离的内生放线菌同样具有α-葡糖苷酶抑制活性和抗氧化的作用。Huang等[52]分离到的丝状内生放线菌具有抑制caspase 3蛋白和蛋白质酪氨酸磷酸酯酶1B的活性,而这两种蛋白分别与神经变性疾病和糖尿病相关。随着植物内生放线菌研究的深入,一定还会有更多的新型活性物质被发现。图 1所示的是植物内生放线菌产生的部分代表性的活性化合物结构式。
近年来,植物内生放线菌在生物防治、促生作用等方面的研究广泛开展。但是有关植物内生放线菌与宿主植物的关系及生物学作用的研究仍然处于基础研究阶段,有关内生放线菌及其活性物质在生产中的应用还不多。究其原因,可能是植物内生放线菌与宿主植物的相互作用关系及其生物学作用的机制尚未完全阐明,而且植物内生放线菌丰富的物种多样性及其代谢产物的多样性处于动态变化之中,为研究和应用增加了难度。目前,从植物内生放线菌分离到的代谢产物主要集中于抗生素和酶,而且这些物质的生物学作用也仍然以抗菌、抗肿瘤活性为主。内生放线菌的代谢产物是否具有抗炎、抗血栓、降血压等其他生物学和药理活性还有待深入研究。
内生放线菌研究目前面临的瓶颈问题有:一方面,由于培养方法以及筛选条件的限制,许多内生放线菌的功能菌株尚未得到分离。另一方面,植物内生放线菌的许多生理活性在离开宿主植物的共生环境后,很有可能退化或丧失。因此,如何在最大程度上维持植物内生放线菌所生存的环境,特别是能否建立起人工培养条件下内生放线菌和宿主植物细胞之间的共培养体系,可能是充分挖掘内生放线菌资源的次生代谢能力和活性物质的关键。
基因工程、细胞工程、细胞生物学技术和蛋白质组学技术等生物技术的发展和应用,为植物内生放线菌的研究提供了更为丰富的手段。内生放线菌与宿主植物的相互作用必将成为今后植物内生放线菌研究的重要发展方向,如植物修复系统中内生放线菌的作用、内生放线菌与宿主植物生理生化,尤其是次生代谢调控的关系等将成为研究热点。在内生放线菌代谢产物研究方面,还可以关注内生放线菌产生的色素和多糖等物质的筛选。在生物活性方面,可以重点关注塑料等难降解化合物的降解、环境的治理以及从治疗现代人类疾病的作用等方面开展研究。总之,植物内生放线菌具有极强的代谢能力,能产生种类丰富的活性物质,是极具开发潜力的新型微生物资源,随着研究的不断深入,植物内生放线菌对人类的影响将会更加深远。
| [1] | Stone J K, Bacon C W, White J. An overview of endophytic microbes: Endophytism defined. Microbial Endophytes, 2000, 3:29-33. |
| [2] | Stierle A, Strobel G. Taxol and taxane production by Taxomyces andreanae an endophytic fungus of Pacific yew. Science, 1993, 260(5105): 214. |
| [3] | 李霞, 刘佳佳, 陈建华, 等. 产喜树碱喜树内生真菌的筛选及喜树内生真菌的SRAP分析. 中国生物工程杂志, 2011, 31(7): 60-64. Li X, Liu J J, Chen J H, et al. Screening of camptothecin prodution and SRAP analysis of endophytic fungi from Camptotheca acuminata decne. China Biotechnology, 2011, 31(7): 60-64. |
| [4] | Liu X, Dong M, Chen X, et al. Antioxidant activity and phenolics of an Endophytic xylaria sp. from Ginkgo biloba. Food Chemistry, 2007, 105(2): 548-554. |
| [5] | 张晓晗, 竺锡武, 谭济才, 等. 一株产凝集素的三叶半夏内生真菌的研究. 中国生物工程杂志, 2009, 29(6): 63-67. Zhang X H, Zhu X W, Tan J C, et al. Study on one strain endophytic fungi isolated from Pinellia ternata (Thunb.)Breit which could produce lectins. China Biotechnology, 2009, 29(6): 63-67. |
| [6] | 石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展. 生态学报, 2006, 26(7): 2395-2401. Shi J Y, Chen W X, Liu A Y. Advances in the study of endophytes and their effects on control of plant diseases. Acta Ecologica Sinica, 2006, 26 (7): 2395-2401. |
| [7] | 徐亚军, 赵龙飞, 陈普, 等. 植物病原菌拮抗性野生艾蒿内生菌的分离、筛选和鉴定. 生态学报, 2013, 33(12): 3697-3705. Xu Y J, Zhao L F, Chen P, et al. Isolation, screening and characterization of phytopathogen antagonistic endophytes from wild Artemisia argyi. Acta Ecologica Sinica, 2013, 33 (12): 3697-3705. |
| [8] | 王莉衡. 植物内生菌的研究进展. 化学与生物工程, 2011, 28(3): 5-7. Wang L H. Research advance on plant endophyte. Chemistry & Bioengineering, 2011, 28 (3): 5-7. |
| [9] | Huss-Danell K. Actinorhizal symbioses and their N2 fixation. New Phytologist, 1997, 136(3): 375-405. |
| [10] | 梁宗琦. 真菌次生代谢产物多样性及其潜在应用价值. 生物多样性, 1999, 7(2): 145-150. Liang Z Q. The diversity of fungal secondary metabolites and their potential applications. Chinese Biodiversity, 1999, 7(2): 145-150. |
| [11] | 孙会强, 周赛男, 谭周进, 等. 一株烟草内生拮抗放线菌发酵条件优化. 应用与环境生物学报, 2011, 17(6): 914-917. Sun H Q, Zhou S N, Tan Z J, et al. Optimization of fermentation conditions of an endophytic actinomycetes from tobacco plant. Chin J Appl Environ Biol, 2011, 17 (6): 914-917. |
| [12] | Conn V, Walker A, Franco C. Endophytic actinobacteria induce defense pathways in Arabidopsis thaliana. Molecular Plant-Microbe Interactions, 2008, 21(2): 208-218. |
| [13] | Cao L, Qiu Z, You J, et al. Isolation and characterization of endophytic streptomycete antagonists of Fusarium wilt pathogen from surface-sterilized banana roots. FEMS Microbiol Lett, 2005, 247(2): 147-152. |
| [14] | Kunoh H. Endophytic actinomycetes attractive biocontrol agents. Journal of General Plant Pathology, 2002, 68(3): 249-252. |
| [15] | Shimizu M, Fujita N, Nakagawa Y, et al. Disease resistance of tissue-cultured seedlings of rhododendron after treatment with Streptomyces sp. R-5. Journal of General Plant Pathology, 2001, 67(4): 325-332. |
| [16] | Shimizu M, Meguro A, Hasegawa H, et al. Disease resistance induced by nonantagonistic endophytic Streptomyces spp. on tissue-cultured seedlings of rhododendron. Journal of General Plant Pathology, 2006, 72(6): 351-354. |
| [17] | Meguro A, Hasegawa S, Shimizu M, et al. Induction of disease resistance in tissue-cultured seedlings of mountain laurel after treatment with Streptomyces padanus AOK-30. Actinomycetologica, 2004, 18(2): 48-53. |
| [18] | Hasegawa H, Meguro A, Toyoda K, et al. Drought tolerance of tissue-cultured seedlings of mountain laurel (Kalmia latifolia L.) induced by an Endophytic actinomycete II. acceleration of callose accumulation and lignification. Actinomycetologica, 2005, 19(1): 13-17. |
| [19] | Meguro A, Toyoda K, Ogiyama H, et al. Genes expressed in tissue-cultured seedlings of mountain laurel (Kalmia latifolia L.) with colonizing Streptomyces padanus AOK-30. Journal of General Plant Pathology, 2012, 78(5): 303-310. |
| [20] | Merzaeva O V, Shirokikh I G. The production of auxins by the endophytic bacteria of winter rye. Applied Biochemistry and Microbiology, 2010, 46(1): 44-50. |
| [21] | El-Tarabily K A, Nassar A H, Hardy G E, et al. Plant growth promotion and biological control of Pythium aphanidermatum, a pathogen of cucumber, by Endophytic actinomycetes. J Appl Microbiol, 2009, 106(1): 13-26. |
| [22] | Igarashi Y, Iida T, Furumai T. Pteridic acids a and b,novel plant growth promoters with auxi-like activity from Streptomyces hygroscopicus TP-A0451. J Antibiot (Tokyo), 2002, 55(8): 764-767. |
| [23] | Shutsrirung A, Chromkaew Y, Pathom-Aree W, et al. Diversity of Endophytic actinomycetes in mandarin grown in northern thailand, their phytohormone production potential and plant growth promoting activity. Soil Science and Plant Nutrition, 2013, 59(3): 322-330. |
| [24] | Goudjal Y, Toumatia O, Sabaou N, et al. Endophytic actinomycetes from spontaneous plants of Algerian Sahara: Indole-3-acetic acid production and tomato plants growth promoting activity. World J Microbiol Biotechnol, 2013, 29(10): 1821-1829. |
| [25] | Nimnoi P, Pongsil P N, Lumyong S. Co-inoculation of soybean (Glycine max) with actinomycetes and Bradyrhizobium japonicum enhances plant growth, nitrogenase activity and plant nutrition. Journal of Plant Nutrition, 2014, 37(3): 432-446. |
| [26] | Nimnoi P, Pongsil P N, Lumyong S. Endophytic actinomycetes isolated from Aquilaria crassna pierre ex Lec and screening of plant growth promoters production. World Journal of Microbiology and Biotechnology, 2009, 26(2): 193-203. |
| [27] | Madhurama G, Sonam D, Urmil P G, et al. Diversity and biopotential of Endophytic actinomycetes from three medicinal plants in India. African Journal of Microbiology Research, 2014, 8(2): 184-191. |
| [28] | El-Tarabily K A, Hardy G E, Sivasithamparam K. Performance of three Endophytic actinomycetes in relation to plant growth promotion and biological control of Pythium aphanidermatum, a pathogen of cucumber under commercial field production conditions in the united Arab emirates. European Journal of Plant Pathology, 2010, 128(4): 527-539. |
| [29] | 刘志恒, 姜成林. 放线菌现代生物学与生物技术. 北京: 科学出版社, 2004. Liu Z H, Jiang C L. Modern Biology and Biotechnology of Actinomycetes. Beijing: Science Press, 2004. |
| [30] | Callaham D, Deltredici P, Torrey J. Isolation and cultivation in vitro of the actinomycete causing root nodulation in Comptonia. Science, 1978, 199(4331): 899-902. |
| [31] | Newcomb W, Peterson R l, Callaham D, et al. Structure and host-actinomycete interactions in developing root nodules of Comptonia peregrina. Canadian Journal of Botany, 1978, 56(5): 502-531. |
| [32] | 杜大至, 王毅岩. 非豆科植物共生固氮的研究I.根瘤内生菌的观察方法. 微生物学报, 1983, 23(4): 347-350. Du D Z, Wang Y Y. Studies on symbiotic nitrogen fixation of non-leguminous plants I. a method for observation of the endophytic organism of the root nodules. Acta Microbiologica Sinica, 1983, 23 (4): 347-350. |
| [33] | 徐丽华, 娄恺, 张华, 等. 微生物资源学. 北京: 科学出版社, 2010.9. Xu L H, Lou K, Zhang H, et al. Microbial Resources. Beijing: Science Press, 2010.9. |
| [34] | 徐丽华, 李文均, 刘志恒, 等. 放线菌系统学——原理、方法及实践. 北京: 科学出版社, 2007. Xu L H, Li W J, Liu Z H, et al. Actinomycetes Systematics—Principle, Methods and Practice, Beijing: Science Press, 2007. |
| [35] | Taechowisani T, Wanbanjob A, Tuntiwachwuttikul P, et al. Identification of Streptomyces sp TC022, an endophyte in Alpinia galanga, and the isolation of actinomycin. Annals of Microbiology, 2006, 56(2): 113-117. |
| [36] | Yan L L, Han N N, Zhang Y Q, et al. Antimycin A18 produced by an endophytic Streptomyces albidoflavus isolated from a mangrove plant. J Antibiot (Tokyo), 2010, 63(5): 259-261. |
| [37] | Castillo U, Harper J K, Strobel G A, et al. Kakadumycins, novel antibiotics from Streptomyces sp. NRRL 30566, an endophyte of Grevillea pteridifolia. FEMS Microbiology Letters, 2003, 224(2): 183-190. |
| [38] | Inahashi Y, Iwatsuki M, Ishiyama A, et al. Spoxazomicins A-C, novel antitrypanosomal alkaloids produced by an endophytic actinomycete, Streptosporangium oxazolinicum K07-0460T. J Antibiot (Tokyo), 2011, 64(4): 303-307. |
| [39] | Lu C, Shen Y. A new macroline antibiotic with antitumor activity produced by Streptomyces sp. CS, a commensal microbe of Maytenus hookeri. J Antibiot (Tokyo), 2003, 56(4): 415-418. |
| [40] | Pullen C, Schmitz P, Meurer K, et al. New and bioactive compounds from streptomyces strains residing in the wood of Celastraceae. Planta, 2002, 216(1): 162-167. |
| [41] | Niamsup H, Tang-um J. Chitinase production and antifungal potential of endophytic Streptomyces strain P4. Maejo International Journal of Science and Technology, 2012, 6(1): 95-104. |
| [42] | Minamiyama H, Shimizu M, Kunoh H, et al. Multiplication of isolate R-5 of Streptomyces galbus on rhododendron leaves and its production of cell wall-degrading enzymes. Journal of General Plant Pathology, 2003, 69(1): 65-70. |
| [43] | 蔡爱群, 田新莉, 周世宁. 水稻内生放线菌降解酶活性的分析. 韶关学院学报, 2007, 28(3): 107-109. Cai A Q, Tian X L, Zhou S N. Analysis of degration activities of Endophytic actinomycete from rice. Journal of Shaoguang University Natural Science, 2007, 28 (3): 107-109. |
| [44] | Stamford T, Stamford N, Coelho L, et al. Production and characterization of a thermostable α-amylase from Nocardiopsis sp. Endophyte of yam bean. Bioresource Technology, 2001, 76(2): 137-141. |
| [45] | El-Bondkly A M, El-Gendy M M. Keratinolytic activity from new recombinant fusantaya 2000, derived from endophytic micromonospora strains. Can J Microbiol, 2010, 56(9): 748-760. |
| [46] | Stamford T, Stamford N, Coelho L, et al. Production and characterization of a thermostable glucoamylase from Streptosporangium sp. endophyte of maize leaves. Bioresource Technology, 2002, 83(2): 105-109. |
| [47] | 杜慧镜, 苏静, 余利岩, 等. 药用植物内生放线菌的分离和生物学特性. 微生物学报, 2013, 53(1): 15-23. Du H J, Su J, Yu L Y, et al. Isolation and physiological characteristics of endophytic actinobacteria from medium plants. Acta Microbiologica Sinica, 2013, 53 (1): 15-23. |
| [48] | Mergel C M, Robl D, de Oliveira Gregório Z M, et al. Bioprospecting lignocellulolytic enzymes from Endophytic actinomycetes aiming at second generation ethanol production. New Biotechnology, 2012, 29: S39. |
| [49] | Lin C, Lu C, Shen Y. Three new 2-pyranone derivatives from mangrove Endophytic actinomycete strain Nocardiopsis sp. A00203. Records of Natural Products, 2010, 4(4): 176-179. |
| [50] | Igarashi Y, Trujillo M E, Martinez-Molina E, et al. Antitumor anthraquinones from an endophytic actinomycete Micromonospora lupini sp. Nov. Bioorg Med Chem Lett, 2007, 17(13): 3702-3705. |
| [51] | Yu Z, Zhao L X, Jiang C L, et al. Bafilomycins produced by an endophytic actinomycete Streptomyces sp. YIM56209. J Antibiot (Tokyo), 2011, 64(1): 159-162. |
| [52] | Huang X L. Isolation and bioactivity of endophytic filamentous actinobacteria from tropical medicinal plants. African Journal of Biotechnology, 2012, 11(41): 9855-9864. |
| [53] | Tuntiwachwuttikul P, Taechowisan T, Wanbanjob A, et al. Lansai A-D, secondary metabolites from Streptomyces sp. SUC1. Tetrahedron, 2008, 64(32): 7583-7586. |
| [54] | Caruso M, Colombo A L, Crespi-Perellino N, et al. Studies on a strain of Kitasatospora sp. paclitaxel producer. Annals of Microbiology, 2000, 50(2): 89-102. |
| [55] | Li J, Zhao G Z, Chen H H, et al. Antitumour and antimicrobial activities of endophytic streptomycetes from pharmaceutical plants in rainforest. Lett Appl Microbiol, 2008, 47(6): 574-580. |
| [56] | 冯治翔, 栗敏, 刘洋, 等. 连翘和水茄内生放线菌的多样性、活性及生物合成基因的PCR筛查. 微生物学通报, 2011, 38(4): 539-546. Feng Z X, Li M, Liu Y, et al. Diversity, activity and PCR screening of biosynthesis genes of endophytic actinomycetes isolated from Forsythia suspensa. Microbiology China, 2011, 38 (4): 539-546. |
| [57] | Huang S X, Yu Z, Robert F, et al. Cycloheximide and congeners as inhibitors of eukaryotic protein synthesis from endophytic actinomycetes Streptomyces sps. YIM56132 and YIM56141. J Antibiot (Tokyo), 2011, 64(1): 163-166. |
| [58] | Nakashima T, Okuyama R, Kamiya Y, et al. Trehangelins a, b and c, novel photo-oxidative hemolysis inhibitors produced by an endophytic actinomycete, Polymorphospora rubra K07-0510. J Antibiot (Tokyo), 2013, 66(6): 311-317. |
| [59] | Jasmine D J, Agastian P. In vitro antioxidant activity and in vivo alpha glucosidase activity of endophytic actinomycetes isolated from Catharanthus roseus (l.) G. Don. Journal of Pharmacy Research, 2013, 6(6): 674-678. |
| [60] | Nimal Christhudas I V, Praveen Kumar P, Agastian P. In vitro alpha-glucosidase inhibition and antioxidative potential of an endophyte species (Streptomyces sp. Loyola UGC) isolated from Datura stramonium L. Curr Microbiol, 2013, 67(1): 69-76. |
 2015, Vol. 35
2015, Vol. 35