文章信息
- 陈静静, 邢桂春, 张令强
- CHEN Jing-jing, XING Gui-chun, ZHANG Ling-qiang
- 基于Loxp-Cre系统的FBXL15基因敲除小鼠模型的建立
- Generation of FBXL15 Conditional Knockout Mice Using the Loxp-Cre Strategy
- 中国生物工程杂志, 2015, 35(4): 74-79
- China Biotechnology, 2015, 35(4): 74-79
- http://dx.doi.org/10.13523/j.cb.20150411
-
文章历史
- 收稿日期:2015-01-16
- 修回日期:2015-02-05
2. 军事医学科学院放射与辐射医学研究所 北京 100850
2. State Key Laboratory of Proteomics, Beijing Proteome Research Center, Beijing Institute of Radiation Medicine, Beijing 100850, China
真核生物通过泛素介导的蛋白质降解途径精确有序地对体内的蛋白质进行降解,是蛋白质含量和质量控制的重要因素之一。泛素-蛋白酶体途径异常将导致许多疾病的发生,例如癌症、神经退行性疾病等[1, 2]。 作为“死亡标签”的泛素在泛素激活酶 (ubiquitin-activating enzyme,E1)[3]、 泛素结合酶 (ubiquitin-conjugating enzyme,E2)[4]和泛素连接酶 (ubiquitin ligase,E3)[5]的酶促级联反应中对蛋白质进行标记并使其被蛋白酶体所识别、最终完成降解过程。目前在人类基因组中所发现的E3约有1 000个,它们决定底物的特异性,因此,E3成为泛素-蛋白酶体系统在疾病治疗研究中最富有前景的靶分子[6]。 揭示新的 E3及其生物学功能成为 E3研究领域的重点。根据结构特点和作用方式的不同,可将E3分为两大类: RING (really interesting new gene)锌指结构域类和 HECT(homologous to E6AP C-terminus)结构域类。其中,RING类E3占目前发现的E3的大部分。包括单体和复合体两种形式。基于Cullin所形成的SCF(Skp1-Cullins-F-box)复合体是研究较多的RING类E3复合体。它以支架蛋白Cullin为中心,C端结合RING锌指蛋白Roc1,N端结合接头蛋白Skp1,Skp1又进一步募集不同的F-box蛋白,F-box蛋白担当底物识别亚基的角色,SCF复合体依赖于F-box蛋白特异性地结合不同的底物,进而在细胞周期调控、细胞生长及肿瘤发生等多种生物学过程中发挥着重要作用[7, 8, 9, 10]。
FBXL15(F-box and leucine-rich repeat protein15)属于F-box家族类的蛋白,是RING类SCF复合体的底物识别亚基,F-box蛋白是一个大的蛋白家族,人源共有69个成员。根据C端所含结构域的不同,F-box蛋白可以分为三类:含有WD40结构域的FBXW亚家族,含有LRR区的FBXL亚家族,以及含有其它结构域的FBXO亚家族。FBXL15属于其中的FBXL亚类,由300个氨基酸组成,包括N端的F-box模序和C端的6个亮氨酸富含区。前期我们实验室发现SCFFBXL15反式作用调控Smurf1蛋白稳定性,并介导其泛素化和蛋白酶体降解,首次建立起SCF复合体与HECT类E3之间的功能联系,并且揭示了SCFFBXL15复合体在斑马鱼胚胎背腹轴极性、大鼠骨量代谢平衡维持中的重要作用[11],拓宽了对SCF复合体的调控底物的认识,但是在小鼠体内是否也发挥着相同的功能不得而知,因此为了更好地研究该复合物存在的遗传学意义,我们构建了FBXL15基因条件型敲除小鼠模型,希望能够进一步在小鼠这一模式动物体内研究该基因的功能。
1 材料与方法 1.1 材 料FBXL15条件性敲除小鼠的打靶载体由本实验室构建。用于电转的胚胎干细胞B6/BLU由本室保存,实验所用小鼠购于北京市丰台区实验动物研究所,饲养于军科院实验动物中心SPF 环境下,鉴定筛选所用PCR引物由北京英潍捷基公司合成,PCR试剂盒购自TaKaRa公司,鼠抗人FBXL15单克隆抗体购自Abcam公司,X-gal染色试剂盒购自康为世纪公司。
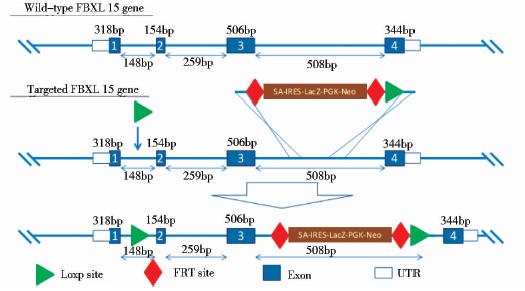
1.2 方 法 1.2.1 FBXL15条件性基因敲除载体pFBXL15-KO的构建和鉴定采用KO first策略,1stloxP插入intron1-2,在intron3-4中插入FRT-SA-IRES-lacZ-loxP-neo-loxP元件如图 1所示,参考相关文献[12]构建相应的pFBXL15-KO载体,如图 2所示。
|
| 图 1 打靶位点示意图 Fig. 1 The modes of FBXL15 targeting strategy |

|
| 图 2 pFBXL15-cKO条件性基因敲除载体质粒图谱Fig. 2 The plasmid profile of PL253-FBXL15-loxp-lacZ vector |
转染前将载体用ScaI和SpeI酶切鉴定,并且将打靶载体进行线性化。ES细胞用胰酶消化后重悬于PBS中。取40μg载体DNA与1ml细胞混匀,加入电穿孔槽中电击,电穿孔条件:电压240V,电容500F,时间10ms,电压256V[13]。将电击后的细胞分入已铺好滋养层细胞的培养皿中,置于CO2孵箱培养,24h后换成ES细胞筛选培养液。
1.2.3 ES细胞阳性克隆的筛选和鉴定克隆筛选条件为含有300μg/ml G418,筛选10天,每天更换ES细胞筛选培养液,第10天挑取ES细胞克隆。将挑取的单个未分化ES克隆置于96孔板中,充分消化后转移至24孔培养板上扩增并提取基因组DNA[14],分别用SpeI和ScaI酶切消化8h,缓慢电泳36h,随后利用敲除载体的5′和3′端外侧进行Long Range PCR反应以及Southern blot。
1.2.4 显微注射制备嵌合体小鼠(1)小鼠囊胚的准备 选4周龄左右,体质量12.5~14.5g的C57BL/6J雌鼠,48h腹腔间隔注射马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(HCG)促进排卵,将雌鼠与雄鼠合笼,次晨检查阴栓(记为0.5d),第2天脱颈处死有阴栓的雌鼠[15],取出子宫中的囊胚,待其囊胚腔明显膨大后即可用于注射。
(2)囊胚显微注射 挑选形状圆润,表面光亮,状态良好的ES细胞进行注射,每个囊胚腔注射12~15个ES细胞。注射后的囊胚继续置于孵箱内培养2h。挑选形态正常,透明带完整的囊胚进行移植。
(3)FBXL15囊胚的子宫移植 选8~10周龄状态良好的雌鼠与输精管结扎的雄鼠合笼,第二天检查阴栓(记为0.5d),2天后可用于囊胚的子宫移植。然后麻醉假孕雌鼠,将5~8个囊胚移植入子宫,待嵌合体小鼠出生。
1.2.5 获得FBXL15基因敲除小鼠并进行基因型鉴定嵌合体小鼠出生后,将嵌合率>50%的成熟小鼠与C57BL/6J雌鼠进行交配,筛选FBXL15-LoxP转基因小鼠,并提取基因组DNA,进行PCR鉴定。
(1)基因组DNA提取:剪小鼠鼠尾于1.5mlEP管中,加入裂解液和蛋白酶K,混匀恒温电热振荡箱中55℃过夜后加入如下试剂:酚,氯仿,异戊醇,混匀12 000r/min,离心5min,吸上层至另一EP管加入等体积异丙醇,沉淀DNA,4℃离心10min倒掉上层,加入75%乙醇倒掉乙醇,干燥后加入适量TE缓冲液溶解。测DNA浓度。
(2)PCR反应体系:FBXL15loxptF:5′-CATCTAATGGTACATCACTGGTCCGT-3′
FBXL15loxptR:5′-AGCACGTCTTCCCAGGGCAGGT-3′
PCR体系: H2O 14.8μl,10×PCRbuffer 2.0μl,5mmol/L dNTP 0.7μl,FBXL15-F 0.5μl,FBXL15-R 0.5μl,TaqPol. 0.5μl,DNA模板1.0μl,共20μl。
反应条件:预变性:95℃5min;变性:95℃40s;退火:65℃30s;延伸72℃40s,共34个循环;最后延伸:72℃10min,4℃保存。
(3)2%琼脂糖凝胶电泳:琼脂糖2g,0.5×TBE 100ml,溴化乙啶(EB)5μl;上样:DNA10μl,上样缓冲液1L,电泳电压170V,时间为20min。
1.3 用X-gal对组织进行染色根据插入元件中LacZ启动子的反应特性,进行X-gal染色,用预冷的4%多聚甲醛固定组织,接着用洗脱液在冰上洗脱2~3h,LacZ染色8~48h(视各个组织着色时间长短来定),经过固定-脱水-包埋-切片步骤后,在显微镜下观察FBXL15在不同器官中的表达情况。
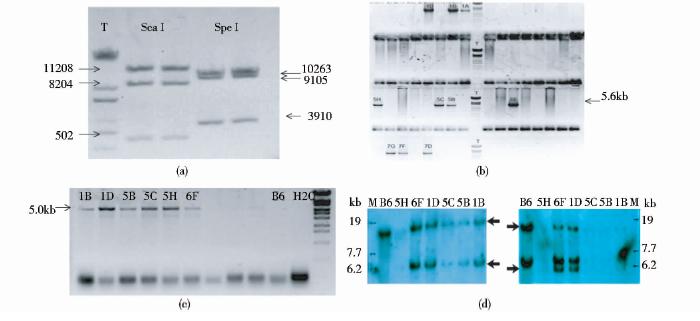
2 结果与分析 2.1 FBXL15条件性基因敲除载体以及ES细胞筛选将构建的pFBXL15-KO质粒经ScaI和SpeI酶切后鉴定(图 3a),使用Ais SI将打靶载体线性化,电转到B6/BLUES Cell line进行打靶,通过Long Range PCR及Southernblot筛选出中靶克隆(图 3b,3c)。首先合成Long range PCR所需引物,Primers for 5′:FBXL15 ESF2:ACCAAAGTAGTCCCACTCACCG;ES5R1:TCCGATCATATTCAATAACCCTT;Primers for3′:ESR2:ATGTTGAACAAAACTATTCGAA,PNF:ATCCGGGGGTACCGCGTCGAG。然后进行PCR阳性筛选,筛选结果(图 3c)可以看出条带大概在5.6K,阳性结果分别为1A,1B,1D,5B,5C,5H,6F,7D,7F,7G,同样进行3′end long range PCR(图 3c),条带大概在5K,阳性结果分别为1A,1B,1D,5B,5C,5H,6F,7D,7F,7G,为进一步验证所筛选到的阳性克隆细胞,随后且进行相应的Southern blot,阳性结果为1B,1D,5B,5C,5H,6F,如图 3d所示。
|
| 图 3 FBXL15条件性基因敲除载体鉴定以及ES细胞筛选结果Fig. 3 The conditional knock out mouse of plasmid of FBXL15 and targeted right ES (a)The FBXL15 plasmid result of ScaI and SpeI enzyme (b)Result of 5′end long range PCR (c)Result of 3′end long range PCR (d)Result of Southern blot |
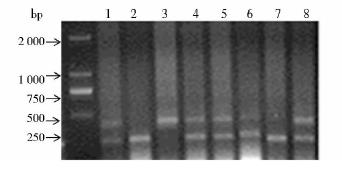
选择克隆#5B进行显微注射,ES克隆状态较好,注射后的囊胚移植入假孕小鼠受体子宫,受体为C57BL/6J与CBA杂交得到F1代,一共得到9只嵌合鼠,包括7雄鼠和2只雌鼠,其中3只嵌合雄鼠嵌合率>50%。然后将嵌合率>50%的雄鼠与野生型C57BL/6J雌鼠进行交配,后代中出现8只灰色小鼠,取这些小鼠鼠尾的DNA进行PCR鉴定,鉴定所需要引物序列为FBXL15loxptF:5′-CATCTAATGGTACATCACTGGTCCGT-3′;FBXL15loxptR:5′-AGCACGTCTTCCCAGGGCAGGT-3′,鉴定出5只为FBXL15-LoxP小鼠,其中WT allele=283bp Floxed allele=391bp如图 4所示。
|
| 图 4 FBXL15-LoxP敲除小鼠的基因型鉴定Fig. 4 The analysis gene of FBXL15-Loxp knock out mouse by PCR 1,4,5,6,8:FBXL15 knock out mouse; 2,3,7: FBXL15WT mouse |
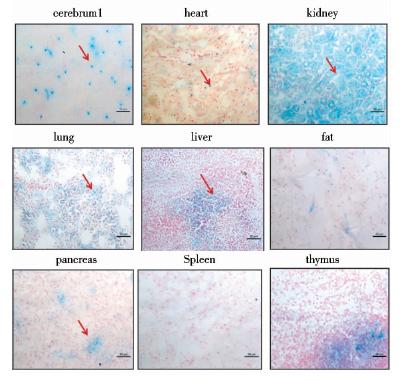
根据插入元件中LacZ启动子的反应特性,我们利用X-gal染色(图 5),红色箭头所指示的为FBXL15抗体的特异性染色,结果发现在大脑,肺脏和肾脏中表达高,提示我们FBXL15可能在这些器官中发挥重要的作用,为后续的试验提供参考价值。
|
| 图 5 X-gal染色后FBXL15蛋白在各个器官的表达情况Fig. 5 FBXL15 protein expressed in different of tissues by X-gal technology |
FBXL15属于F-box家族类的蛋白,是RING类SCF复合体的底物识别亚基,由300个氨基酸组成,包括N端的F-box模序和C端的6个亮氨酸富含区,主要定位在人类10号染色体上,前期我们实验室在分子和细胞水平上证明 FBXL15 可以发挥拮抗 Smurf1 对于 BMP通路的抑制效应,而且是 BMP通路的正向调控因子,在体内也首次发现FBXL15 参与斑马鱼胚胎发育过程中背腹轴的分化,且在成年大鼠骨组织中敲低FBXL15 表达后,大鼠呈现明显的骨质疏松表型,暗示 FBXL15 也可能参与调控体内骨平衡[4]。这些动物表型的获得推进了对 FBXL15 生理功能的认识,但是对于 FBXL15 对 Smurf1 调控效应在什么生理条件或刺激下发生及其机制目前还并不清楚,FBXL15 敲低后的动物整体表型是否依赖 Smurf1 也没有得到确证,要回答这些问题还需要进一步的研究。因此我们构建了FBXL15基因敲除小鼠模型,希望能够在小鼠体内更好地研究FBXL15所发挥的重要作用。
条件性基因敲除技术是研究细胞基因组中某基因去除或使基因失去功能活性的技术,利用相应的打靶策略特异地去除所研究生物体内特定的某个基因组中的基因,并且借助基因工程相关手段将小鼠所发挥正常功能基因的编码区破坏而使特定的基因失活,从而进一步研究该基因在某些特定类型的细胞或组织中以及在小鼠发育的某些特定阶段中的功能,现在使用较多的Cre-LoxP技术是一种基于位点特异性重组技术,使得对小鼠基因组的修饰在时空范围上处于可调控状态[17, 18],本研究中pFBXL15-KO载体的构建策略是在FBXL15基因的1,2号以及3,4外显子两侧分别加入单个LoxP位点,且在3,4号外显子之间加入具有筛选标记的LacZ,neo基因作为正筛选基因,通过电击转染和正负筛选的方法得到阳性ES细胞并通过显微注射到C57BL/6J鼠的囊胚中,移植到代孕受体小鼠子宫后得到嵌合体小鼠,嵌合体小鼠与C57BL/6J小鼠交配获得FBXL15-LoxP转基因小鼠,利用LacZ筛选标记,用X-gal染色,冰冻切片后检测FBXL15在小鼠组织器官中的表达情况,发现在大脑,肺脏和肝脏中表达高,提示我们FBXL15分子在这些器官中发挥着很重要的功能,因此我们将利用已经构建好的小鼠模型,结合后续研究的方向进一步探索FBXL15在体内发挥的重要功能。
| [1] | Staub M S A O. HECT E3s and human disease. BMC Biochemistry,2007,8(Suppl 1):S6:1471-2091. |
| [2] | Louise Madsen A S, Petersen M S. Ubiquitin domain proteins in disease. BMC Biochemistry, 2007, 8(Suppl 1):S1:1-14. |
| [3] | Schulman B A, Harper J W. Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways. Nature Reviews Molecular Cell Biology, 2009. 10(5):319-331. |
| [4] | Ye Y, Rape M. Building ubiquitin chains: E2 enzymes at work. Nature Reviews Molecular Cell Biology, 2009,10(11):755-764. |
| [5] | Deshaies R J, Ring J. domain E3 ubiquitin ligases. Annual Review of Biochemistry, 2009,78(1):399-434. |
| [6] | Nalepa G, Rolfe M, Harper J W. Drug discovery in the ubiquitin-proteasome system. Nature Reviews Drug Discovery, 2006,5(7):596-613. |
| [7] | Lin H, Wang G, Chen Z, et al. Phosphorylation-dependent regulation of cytosolic localization and oncogenic function of Skp2 by Akt/PKB. Nature Cell Biology, 2009,11(4):420-432. |
| [8] | Jennifer Harrell, Jonason N G. Regulation of SCFSKP2 ubiquitin E3 ligase assembly and p27KIP1 proteolysis by the PTEN pathway and cyclin D1.Cell Cycle,2007,6(8):951-961. |
| [9] | Lin H, Chen Z,Wang G,et al. Skp2 targeting suppresses tumorigenesis by Arf-p53-independent cellular senescence. Nature, 2010,464(7287):374-379. |
| [10] | Chan C H, Li C F,Yang W L,et al. The Skp2-SCF E3 ligase regulates Akt ubiquitination, glycolysis, herceptin sensitivity, and tumorigenesis. Cell, 2012,149(5):1098-1110. |
| [11] | Cui Y, He S, Xing C C,et al. SCFFBXL(1)(5) regulates BMP signalling by directing the degradation of HECT-type ubiquitin ligase Smurf1. Embo Journal, 2011,2675-2689. |
| [12] | Liu P,Jenkins N A,Copeland N G.A highly efficient recombineering-based method for generating conditional knockout mutations.Genome Res,2003,13(3):476-484. |
| [13] | Sedivy J M,Joyner A L.Gene Targeting.Oxford:Oxford University Press,1992. |
| [14] | 赵玲,杜晓兰,苏楠,等. HIF-1α条件性基因敲除嵌合体小鼠的获得. 第三军医大学学报, 2007(14): 1361-1363. Zhao L,Du X L,Su N,et al.Generation of chineras for HIF-1αconditional knockout mice. Acta Academiae Medicinae Militaris Tertiae, 2007(14): 1361-1363. |
| [15] | 冯贵莲,舒洋,王保曼,等, Tex101条件性基因敲除小鼠模型的建立和表型鉴定. 上海交通大学学报(医学版), 2014,1: 1-6. Feng G L,Shu Y,Wang B M,et al.Generation of Tex101 conditional knockout mice and phenotype identification.Journal of Shanghai Jiao Tong University (Medical Science),2014,1: 1-6. |
| [16] | Schm D,Tsupprian M,Rajewsky K. Vagaries of conditional gene targeting.Nat Immunol,2007,8(7):665-668. |
| [17] | Shiina H,Matsumoto T,Sato T,et al.Premature ovarian failure in androgen receptor-deficient mice. Proc Natl Acad Sci USA,2006,103(1):224-229. |
| [18] | Rojek A,Fuchtbauer E M,Kwon T H,et al.Severe urinary concen-trating defect in renal collecting duct-selective AQP2 conditional-knockout mice.Proc Natl Acad Sci USA,2006,103(15):6037-6042. |
 2015, Vol. 35
2015, Vol. 35




