文章信息
- 张宇, 白豆, 朱乃硕
- ZHANG Yu, BAI Dou, ZHU Nai-shuo
- Taqman多重实时荧光定量PCR检测裸鼠肿瘤转移模型中肿瘤转移率方法的建立
- Multiplex Taqman Real-time PCR for Detection of Malignant Tumor Metastasis Rate in Cancer Metastasis Model in Nude Mice
- 中国生物工程杂志, 2015, 35(4): 66-73
- China Biotechnology, 2015, 35(4): 66-73
- http://dx.doi.org/10.13523/j.cb.20150410
-
文章历史
- 收稿日期:2014-10-19
- 修回日期:2015-03-04
Taqman实时荧光定量PCR技术(Taqman Real-time qPCR)应用寡核苷酸探针与引物扩增区段内的模板序列发生特异性杂交,在PCR反应的延伸过程中,标记在探针5′端的荧光报告基团(Reporter)被水解脱落,与 3′端的荧光淬灭基团(Quencher)分离并发射荧光。起始模板浓度越高荧光信号越强[1, 2, 3, 4, 5]。多重PCR技术(Multiplex PCR)是在同一PCR反应体系里用多对引物同时对多个DNA模板进行扩增[6]。多重荧光定量PCR技术则是将多重PCR技术与实时荧光定量 PCR技术结合在一起的新型检测技术,可以在同一反应体系内对多个基因模板进行定量检测[2]。
PCR方法在检测恶性肿瘤的转移性特征等方面的应用多年来一直是肿瘤研究与临床诊断的热点[7, 8, 9]。早在1998年,Kobayashi等[8]就曾用PCR的方法检测了人类前列腺癌的微转移。2003年Baker等[9]应用SYBR Green实时荧光定量PCR技术对乳腺癌进行了较灵敏的临床检测。本文研究涉及到的涎腺腺样囊性癌(Adenoid cystic carcinoma,ACC)是一种死亡率较高的口腔恶性肿瘤,易发生肺转移,早先有文章报道其肺转移率可达96%[10, 11, 12, 13, 14]。因此,精确检测该肿瘤的转移率对其临床诊断与治疗就显得尤为重要。
以往在肿瘤转移动物实验模型的研究中,对肿瘤转移率的测定多采用对肿瘤微转移灶分离称重的方法进行计算[2, 10, 11]。由于微小转移灶常常不可见及操作人员的经验和主观认识的差异导致此法难以准确分析,误差很大[2]。本文结合分子生物学技术,建立了多重Taqman荧光定量PCR检测方法用于检测恶性肿瘤动物体内转移模型中肿瘤转移率,结果表明,该法具有灵敏,快速,通量高,特异性强等优点,具有很好的应用价值。
1 材料与方法 1.1 材料、试剂和设备人涎腺腺样囊性癌细胞株ACC细胞 (上海第二医科大学口腔医学院口腔颌面外科肿瘤生物实验室提供)和 BALB/c 小鼠骨髓瘤细胞(Sp2/0)(武汉博士德生物工程有限公司);BALB/c裸鼠人涎腺腺样囊性癌转移模型肺组织样本(复旦大学感染与免疫实验室提供);天根血液/细胞/组织基因组 DNA提取试剂盒(TIANamp Genomic DNA Kit,DP304,北京天根生物技术公司);2×THUNDERBIRD Probe qPCR Mix(TOYOBO东洋纺公司,OSAKA JAPAN);2×THUNDERBIRD SYBR qPCR Mix(TOYOBO东洋纺,OSAKA JAPAN); 天根50bp DNA Ladder(天根生物技术公司);枫岭 FTC 3000 系列荧光定量PCR仪、引物和 Taqman 探针由上海生工生物工程公司合成。
1.2 方 法 1.2.1 引物和探针在 GenBank 上获取人和小鼠的β2m基因组 DNA (gDNA) 序列: 小鼠β2m gDNA 序列(Mus musculus B2m gDNA)为:Chromosome 2-NC_000068.7,REGION: 122147687..122153082,GI:372099108,5396 bp。
人类β2m gDNA 序列 (Homo sapiens B2m gDNA)为:Chromosome 15-NC_000015.10,REGION: 44711487..44718159,GI:568815583,6673 bp。
用在线多序列比对工具 MAFFT(http://www.ebi.ac.uk/Tools/msa/mafft/)对人和小鼠 B2m 基因序列进行全局比对,针对人和小鼠B2m 基因序列的差异位点设计用于定量PCR的引物和探针。引物和探针的搜索由在线工具 Primer 3(http://primer3.ut.ee)完成,并通过 NCBI的序列比对工具 blastn、 Primer-BLAST 和软件 Oligo 6.0对选取的引物和探针的特异性及其他各项参数进行评价(表 1)。
| Primer/Probe name | Sequence (5′→3′) | Product length(bp) |
| Human B2m-F | GCTGTCTCCATGTTTGATGTATCTG | 171 |
| Human B2m-R | GCACGCTTAACTATCTTAACAAGCTTTG | |
| Human-probe | HEX-AGGGCTGGCAACTTAGAGGTGGGGAGC-BHQ1 | |
| Mouse B2m-F | AGGCTTCTCTTTTTCTCCTCTGCTG | 200 |
| Mouse B2m-R | TTTTCTCTCGACTTCGGTTGGATC | |
| Mouse-probe | FAM-CGGAAGCTGAGCCCCGACCACGGGA-BHQ1 |
细胞、组织样品依照天根血液/细胞/组织基因组 DNA提取试剂盒中的操作说明提取全基因组DNA,用NanoDrop2000c测定浓度和纯度。将人 ACC 细胞提取的基因组DNA和小鼠Sp2/0 细胞提取的基因组DNA按10倍连续梯度稀释的方法依次稀释,即100、10-1、10-2、10-3、10-4、10-5 等6个梯度,获得浓度分别为60 ng/μl、6 ng/μl、0.6 ng/μl、0.06 ng/μl、0.006 ng/μl、0.0006 ng/μl,以用于定量检测。
1.2.3 单一荧光定量PCR方法的建立引物和探针分组配对,分别对人和小鼠的DNA进行检测,验证引物与探针的扩增有效性和特异性,建立分别检测人和小鼠DNA的单一荧光PCR方法。用2.5% 琼脂糖凝胶电泳检测目的产物条带,并将 DNA模板分别为人和小鼠的荧光定量PCR阳性产物送铂尚生物技术有限公司(BioSune)测序,分析比对序列,确定阳性扩增产物是否为目的片段。
1.2.4 单一荧光定量PCR方法反应体系和反应条件按照TOYOBO(东洋纺公司) THUNDERBIRD Probe qPCR Mix 和 THUNDERBIRD SYBR qPCR Mix 的操作说明进行单一模板的Real-time qPCR反应。PCR体系:总体积20μl,2× SYBR(染料法)/Probe(探针法) qPCR Premix 10μl (终浓度1×),50× ROX Reference Dye 0.04 μl (终浓度 0.1×),上、下游引物(10μmol/L)各0.6μl(终浓度 0.3μmol/L),Taqman 探针(10μmol/L)0.4μl(终浓度 0.2μmol/L,探针法),模板上样量 1μl(每 20μl 体系以100 ng 为上限),用灭菌 MilliQ 水补足。 PCR反应条件:95℃ 预变性 5min; 95℃ 变性30s →60℃退火延伸 60s,反应循环数40,信号采集设在延伸步骤。PCR反应结束后对扩增产物进行溶解曲线分析,以确保特异性扩增。
1.2.5 单一荧光定量PCR方法的灵敏度实验将提取后稀释至同一浓度的人和小鼠来源的DNA模板进行梯度稀释,即100、10-1、10-2、10-3、10-4、10-5等6个梯度,以上述1.2.4 的反应体系和反应条件,分别进行人和小鼠DNA样品的荧光定量检测、溶解曲线检测、 PCR产物电泳检测和PCR产物测序验证。
1.2.6双重荧光定量PCR方法的建立两对引物和两条探针组合起来,模板采用等体积混合的人和小鼠各浓度梯度的DNA 稀释液(按人模板100、10-1、10-2、10-3、10-4、10-5 6个稀释梯度与鼠模板10-5、10-4、10-3、10-2、10-1、100 6个稀释梯度的顺序两两高低组合),依照方法1.2.4 ,对体系进行适度优化,利用多重实时荧光定量PCR对人和小鼠的梯度模板稀释液进行检测,考察检验方法的特异性和灵敏度。
1.2.7双重荧光定量PCR方法反应体系和反应条件20μl双重real-time PCR反应体系如表 2所示。
| PCR反应组份 | 体积/μl | 终浓度 |
| 2× THUNDERBIRD Probe qPCR Mix | 10 | 1× |
| 50× ROX reference dye | 0.04 | 0.1× |
| 人引物、探针混合液(20 ×) | 1 | 上、下游引物各0.4μmol/L,探针0.2μmol/L |
| 鼠引物、探针混合液(20 ×) | 1 | 上、下游引物各0.4μmol/L,探针0.2μmol/L |
| 模板DNA | 2 | 不超过100 ng |
| 灭菌超纯水 | 补足至20 | |
| 总体积 | 20 |
其中,20× 引物、探针混合液由 8μmol/L的上游引物,8μmol/L的下游引物和 4μmol/L的探针溶液混合而成。 2μl的DNA模板包括1μl的人的DNA模板和1μl的鼠的DNA模板。PCR反应条件:95℃ 预变性 5min; 95℃ 变性30s ;60℃退火延伸 60s,反应循环数40,信号采集设在延伸步骤。以 Ct 值小于 35 的扩增作为样本检测的阳性结果。
1.2.8 样品检测(1)转移瘤细胞DNA实验:在106个小鼠Sp2/0细胞中掺入不同数量的人ACC(以DNA量推算出细胞数量)细胞 [2, 11],抽提DNA,按前述标准条件进行PCR,确定该方法的检测下限。
(2)将BALB/c裸鼠人涎腺腺样囊性癌转移模型肺组织样本称重后剪碎,研磨至匀浆状,用天根生物技术公司生产的基因组 DNA提取试剂盒抽提基因组DNA。以人ACC细胞和鼠Sp2/0细胞基因组DNA梯度稀释液作为模板绘制标准曲线(1.2.2 ),待测DNA分别对应人或鼠的标准曲线做绝对定量,得到的数据以小鼠β2m基因扩增量代表小鼠肺组织的量,以人β2m基因扩增量代表肺转移灶人源细胞的量,两者比值代表每只小鼠中人肿瘤细胞ACC的转移率,并用统计软件R对数据进行统计学处理。
(3)肿瘤微转移灶称重法及其与PCR法计算肿瘤体内转移率的比较:裸鼠(BALB/c,nu/nu)尾静脉注射1×106/0.1ml人ACC肿瘤细胞,8周后处死,取出肺脏称重后在肉眼可见的条件下,以手术剪剥离肿瘤转移灶并称重[11, 12],随后将肿瘤块与原肺组织混合匀浆提取DNA进行荧光定量PCR 检测,比较二者结果。
2 结 果 2.1 单一荧光定量PCR方法的建立用试剂盒分别抽提人ACC细胞和小鼠Sp2/0细胞基因组DNA,分别利用对应的引物和探针进行单重荧光定量PCR实验和交叉实验,2.5% 琼脂糖凝胶电泳如图 1所示。扩增产物条带单一,人目的基因β2m条带大小为171bp,小鼠目的基因β2m条带大小为200bp,均与目标相符。交叉实验结果表明所建立的单重荧光定量PCR体系具有较高的特异性,在所考察的范围内,除了对种属内的DNA模板呈阳性外,对其他种属的DNA模板均显阴性。定量PCR扩增曲线及溶解曲线分析结果均与电泳结果吻合。
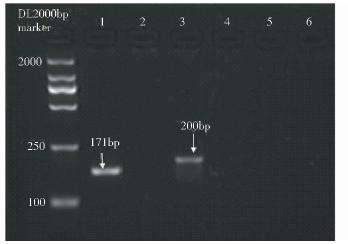
|
| 图 1 人和小鼠目的片段的PCR扩增电泳检测结果 Fig. 1 Electrophoresis results of PCR products amplified M: DNA Ladder Marker; 1: Human DNA and its primers and probe; 2: Human DNA and the primers and probe of mouse; 3: Mouse DNA and its primers and probe; 4: Mouse DNA and the primers and probe of human; 5: The negative control of human; 6: The negative control of mouse |
将提取后稀释至同一浓度的人和小鼠来源的DNA模板进行梯度稀释,即100、10-1、10-2、10-3、10-4、10-5 等6个梯度,以上述1.2.4 的反应体系和反应条件,分别进行人和小鼠DNA样品的荧光定量检测。将检测结果绘制成标准曲线,如图 2所示。分析溶解曲线反映PCR有很好的特异性,无非特异扩增产物及引物二聚体。在20μl反应体系中,人和鼠的DNA检测灵敏度均达到6pg,大约相当于单个体细胞。在60ng/μl到0.006ng/μl DNA范围内呈很好的线性关系。凝胶电泳检测扩增条带的结果与溶解曲线分析结果一致,条带的亮度变化清楚反映了模板DNA浓度的变化梯度。测序验证扩增条带均 与数据库中数据一致,为目的基因片段。
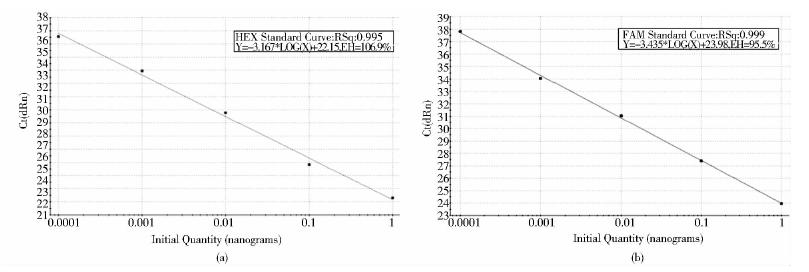
|
| 图 2 标准曲线Fig. 2 Standard curve (a) The standard curve of the β2m gene of human ACC cell (singled by HEX) (b) The standard curve of the β2m gene of mouse Sp2/0 cell (singled by FAM) |
将小鼠和人的β2m基因按一定浓度比例关系混合进行检测(按1.2.6 所述方法混合,即浓度为10-1 人模板与浓度为10-5 鼠模板,依此类推以1μl等体积混合),结果如图 3所示。荧光定量扩增曲线能清楚地将人和鼠的同一目的基因(β2m基因)区分开来,凝胶电泳的条带变化趋势(图 3a)与Ct值的变化相吻合。说明建立的该检测方法有较好的特异性和灵敏性。
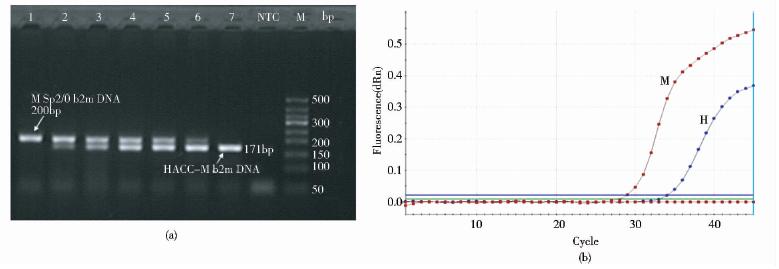
|
| 图 3 双重荧光定量PCR同时检测人和小鼠β2m基因Fig. 3 Duplex fluorescence quantitative PCR detect human beings and mouse β2m gene simultaneously (a) The electrophoresis of duplex fluorescence quantitative PCR 1: 60ng mouse DNA and 0ng human DNA; 2: 6ng mouse DNA and 0.6pg human DNA; 3: 0.6ng mouse DNA and 6pg human DNA; 4: 0.06ng mouse DNA and 0.06ng human DNA; 5: 6pg mouse DNA and 0.6ng human DNA; 6: 0.6pg mouse DNA and 6ng human DNA; 7: 0ng mouse DNA and 60ng human DNA (b) The amplification plots of the third sample (0.6ng mouse DNA and 6pg human DNA) |
图 4表示的是在106个小鼠Sp2/0细胞中混入不同数量的人ACC细胞(以DNA量计算)后,在前述标准条件下进行PCR检测的结果。图 4a是琼脂糖凝胶电泳图,其中所示泳道1是阴性对照(不添加任何DNA模板),泳道2~7分别是不同掺入量的人ACC细胞,依次是107、106、104、500、50、5个细胞,在掺入最少为50个细胞时,条带可检测。对应的定量PCR扩增曲线结果如图 4b所示。
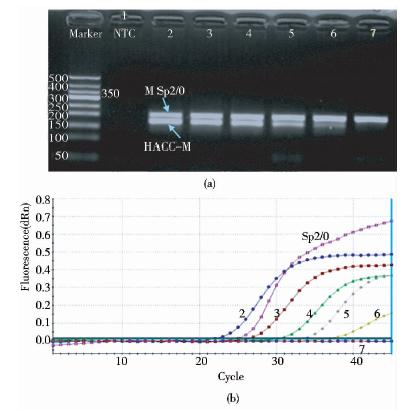
|
| 图 4 细胞DNA回收实验结果Fig. 4 Cellular DNA affixes recovery test results |
每只裸鼠(转移有人涎腺腺样囊性癌细胞株ACC)肺组织基因组DNA作为一个样本,用靶向标记人和鼠β2m基因的探针做双重荧光定量PCR实验,每份样本DNA各以相同的浓度在相同的条件下按前述建立的方法标准(见1.2.6 ,1.2.7)批内重复20次实验,共5份组织DNA样品。计算5个样品 Ct平均值、标准差SD值以及变异系数CV值见表 3。得到的数据以小鼠β2m基因扩增量代表小鼠肺组织的量,以人β2m基因扩增量代表肺转移灶人源细胞的量,两者比值代表每只小鼠中人肿瘤细胞ACC的转移率(表 4),对数据进行统计学处理,并通过分析称重法计算的裸鼠肺转移率和荧光定量PCR法计算的裸鼠肺转移率,比较这两种检测方法的差异。
| 样品编号 | 人ACC转移瘤组织 | 裸鼠肺组织 | ||
| Ct值 | CV | Ct值 | CV | |
| 1 | 28.480±1.195 | 0.0420 | 23.570±1.406 | 0.0597 |
| 2 | 28.634±1.247 | 0.0436 | 24.309±0.855 | 0.0352 |
| 3 | 32.846±1.383 | 0.0421 | 24.788±0.498 | 0.0201 |
| 4 | 27.003±0.230 | 0.0085 | 23.917±0.381 | 0.0159 |
| 5 | 29.046±0.559 | 0.0192 | 22.131±0.436 | 0.0197 |
| 样品编号 | 定量PCR计算的转移率 | 称重法计算的转移率 | ||
| Mean ± SD | CV | Mean ± SD | CV | |
| 1 | 0.827 ± 0.027 | 0.033 | 0.586 ± 0.116 | 0.198 |
| 2 | 0.850 ± 0.043 | 0.050 | 0.647 ± 0.057 | 0.088 |
| 3 | 0.756 ± 0.037 | 0.048 | 0.496 ± 0.293 | 0.591 |
| 4 | 0.886 ± 0.017 | 0.019 | 0.706 ± 0.215 | 0.305 |
| 5 | 0.762 ± 0.022 | 0.029 | 0.528 ± 0.098 | 0.186 |
| 平均值 | 0.816 ± 0.056 | 0.036 | 0.593 ± 0.086 | 0.274 |
采用成对学生 t 检验方法对多重荧光定量PCR法与称重法检测涎腺腺样囊性癌动物体内实验转移模型中肿瘤转移率的比较分析,结果为P=9.635E-05 < α =0.001,认为对同一样品,通过定量PCR法检测得到的肿瘤平均转移率与传统电子天平称重法检测得到的肿瘤平均转移率之间存在极显著差别。两种检测方法计算的平均转移率相差0.223。比较两种方法重复性检测的组间变异系数CV值,定量PCR的组间平均CV值为3.58%,称重法的组间CV值为27.4%,PCR法比称重法具有更良好的重复性和灵敏度。
3 讨 论目前,针对单一模板的荧光定量PCR技术在科研、临床疾控检测中已经非常成熟,相对于传统的检测方法有着快速、特异、灵敏等绝对的优越性[3, 5, 15]。在恶性肿瘤动物转移模型的转移率检测中,对多重荧光定量PCR技术的研究却非常少[2, 11, 13]。
本文采用两组PCR引物和Taqman探针,在国内首次建立了一套检测裸鼠模型体内人涎腺腺样囊性癌细胞株(ACC)肿瘤转移率的方法,并与传统的组织解剖转移灶称重检测方法进行比较。两对引物特异性较好(图 1),PCR产物条带单一,无非特异性扩增;重复实验结果表明该方法重复性较好,组间平均CV值为0.0358。在最终转移率统计数据中,Real-time qPCR法检测转移率所获得的均值与解剖称重法检测转移率获得的均值比较P< 0.001,说明PCR法与称重法比较有显著差异。在组织学分析无法检测到微转移灶的样本中,荧光定量PCR比方法能够检出转移至小鼠肺部的人源肿瘤细胞的存在,灵敏度高达0.06ng DNA。综合以上分析,多重荧光定量PCR比传统组织称重法更灵敏、稳定、精简、便捷;多重定量PCR比单重荧光定量PCR减少了试剂和时间的消耗,节约了费用、耗材,提高了检测的效率、通量、敏感性和系统准确性。
多重荧光定量PCR 除了要求不同引物对能在同一反应体系中对多个不同模板序列进行特异性扩增以外,还要求添加由不同荧光报告基团标记的多个探针能特异地结合靶序列,准确地对各靶序列进行定量。由于同一反应体系中混合有多种不同的DNA模板序列、引物和探针,因而多重荧光定量PCR的扩增及定量的效果也受到了多种因素的影响,主要有反应体系、各引物和探针间的相互干扰、模板之间的竞争、反应条件、不同荧光通道间的渗漏干扰等[16, 17, 18]。限制多重荧光定量PCR技术发展的瓶颈主要有两个关键问题:(1)多个靶点扩增与标记条件不兼容,影响了扩增效率和检测灵敏度甚至特异性[6, 17, 18];(2)荧光定量PCR仪检测通道的设计和配置限制了该方法的检测通量和质量。而解决这两个问题的关键在于三点:1)设计高质量的引物和探针;2)高性能的DNA聚合酶;3)改进定量PCR仪,实现全波长范围的高分辨率检测。此外,样本DNA的抽提也是影响多重PCR成功率的一个重要方面[17, 18],如从混合样本中抽提低丰度样本DNA 的成功率直接决定了后续多重定量PCR 的检测灵敏度[17]。
| [1] | Livak K J, Flood S J A, Marmaro J, et al. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probes system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl, 1995, 4: 357. |
| [2] | 杨捷琳. 腺样囊性癌高、低转移细胞株基因表达差异性及B7-1、XAGE-1b与转移相关性研究. 上海:复旦大学, 2005. Yang J L. Study on the high metastatic and low metastatic adenoid cystic carcinoma cell lines gene expression differences and the correlation between metastasis and B7-1、XAGE-1b. Shanghai:Fu Dan University, 2005. |
| [3] | 赵焕英, 包金风. 实时荧光定量 PCR 技术的原理及其应用研究进展. 中国组织化学与细胞化学杂志, 2007, 16(4):492-497. Zhao H Y, Bao J F. The principles, application and development of real-time quantitative PCR. Chinese Journal of Histochemistry and Cytochemistry, 2007, 16(4):492-497. |
| [4] | 袁亚男, 刘文忠. 实时荧光定量 PCR 技术的类型, 特点与应用. 中国畜牧兽医, 2008, 35(3): 27-30. Yuan Y N, Liu W Z. The types, characteristics and applications of real-time fluoescent quantitative PCR techniques. China Animal Husbandry & Veterinary Medicine, 2008, 35(3): 27-30. |
| [5] | 张蓓, 沈立松. 实时荧光定量 PCR 的研究进展及其应用. 国外医学: 临床生物化学与检验学分册, 2004, 24(6): 327-329. Zhang P, Shen L S. The application and development of real-time fluorescent quantitative PCR. Foreign Medical Sciences (Section of Clinical Biochemistry and Laboratory Medicine), 2004, 24(6): 327-329. |
| [6] | 陈明洁, 方倜, 柯涛, 等. 多重 PCR —— 一种高效快速的分子生物学技术. 武汉理工大学学报, 2005, 27(10): 33-36. Chen M J, Fang T, Ke T, et al. Multiplex PCR—A molecular biotechnique of high efficiency and speed. Journal of Wuhan University of Technology, 2005, 27(10): 33-36. |
| [7] | 汪洋, 宫琳琳, 邵淑娟. 实时荧光定量 PCR 在肿瘤研究中的应用. 肿瘤, 2004, 24(2): 196-197. Wang Y, Gong L L, Shao S J. The application of real-time fluorescent quantitative PCB in tumor research. Tumor, 2004, 24(2): 196-197. |
| [8] | Kobayashi T, Koshida K, Endo Y, et al. A chick embryo model for metastatic human prostate cancer. European Urology, 1998, 34(2): 154-160. |
| [9] | Baker M, Gillanders W E, Mikhitarian K, et al. The molecular detection of micrometastatic breast cancer. The American Journal of Surgery, 2003, 186(4): 351-358. |
| [10] | 关晓峰, 邱蔚六, 何荣根, 等. 肺高转移性涎腺腺样囊性癌细胞株的筛选.中华口腔医学杂志.1996, 31(2): 74-76. Guan X F, Qiu W L,He R G, et al. The selection of highly lung metastatic salivary adenoid cystic carcinoma clone. Chinese Journal of Stomatology, 1996, 31(2): 74-76. |
| [11] | 关晓峰, 杨捷琳, 朱乃硕, 等. 腺样囊性癌高, 低转移细胞株基因表达谱差异性及转移相关基因研究. 中华口腔医学杂志, 2004, 39(2): 118-121. Guan X F, Yang J L, Zhu N S, et al. Gene expression differences between high and low metastatic cells of adenoid cystic carcinoma. Chinese Journal of Stomatology, 2004, 39(2): 118-121. |
| [12] | 秦兴军, 张恩礁, 杨捷琳, 等. 应用抑制性消减杂交技术分析涎腺腺样囊性癌转移相关基因. 中国医科大学学报, 2006, 35(4): 392-394. Qin X J, Zhang E J, Yang J L, et al. Identification of genes associated with the adenoid cystic carcinoma by suppression subtractive hybridization. Journal of China Medical University, 2006, 35(4): 392-394. |
| [13] | Guan X F, Qiu W L, He R G, et al. Selection of adenoid cystic carcinoma cell clone highly metastatic to the lung: an experimental study. International Journal of Oral Maxilofacial Surgery, 1997, 26: 116-119. |
| [14] | Guan X, Wang Y, Ge S, et al. The comparative study on karyotypes of clones from salivary adenoid cystic carcinoma with high and low metastasis. J of China Medical University, 1996, 25(4): 368-370. |
| [15] | 曹际娟, 徐君怡, 曹冬梅, 等. 实时荧光聚合酶链式反应检测转基因小麦 B73-6-1, B72-8-11b 和 B102-1-2 品系. 食品科学, 2014, 35(8): 156-159. Cao J J, Xu J Y, Cao D M, et al. A real-time polymerase chain reaction method to detect genetically modified wheat strains B73-6-1, B72-8-11b and B102-1-2. Food Science, 2014, 35(8): 156-159. |
| [16] | 邵彪, 黄伟东, 周鸣镝, 等. 多重荧光定量 PCR 检测食品污染菌. 中国食品学报, 2012, 12(1): 176-181. Shao B, Huang W D, Zhou M D, et al. Multiplex fluorescence quantitative PCR detection of food contaminative bacteria. Journal of Chinese Institute of Food Science and Technology, 2012, 12(1): 176-181. |
| [17] | 李媛, 任长虹, 吴永红, 等. 多重 PCR 在质粒拷贝数检测中的应用. 中国生物工程杂志, 2011, 31(6): 93-98. Li Y, Ren C H, Wu Y H, et al. A new method to identify the copy number of plasmid by multiplex PCR. China Biotechnology, 2011, 31(6): 93-98. |
| [18] | 王趁芳, 李新云, 王志伟, 等. 转基因小鼠的多重PCR快速检测技术. 畜牧兽医学报, 2009, 40(2): 185-190. Wang C F, Li X Y, Wang Z W, et al. Multiplex PCR detection of exogenous gene in transgenic mice. Acta Veterinaria et Zootechnica Sinica, 2009, 40(2): 185-190. |
 2015, Vol. 35
2015, Vol. 35




