文章信息
- 郭兆来, 白学贵, 严金平, 陈宣钦, 李昆志, 徐慧妮
- GUO Zhao-lai, BAI Xue-gui, YAN Jin-ping, CHEN Xuan-qin, LI Kun-zhi, XU Hui-ni
- 菠菜SoHb基因的原核表达及功能分析
- Prokaryotic Expression and Function Analysis of SoHb from Spinach
- 中国生物工程杂志, 2015, 35(4): 54-59
- China Biotechnology, 2015, 35(4): 54-59
- http://dx.doi.org/10.13523/j.cb.20150408
-
文章历史
- 收稿日期:2014-11-14
- 修回日期:2014-12-08
植物血红蛋白是一类由珠蛋白和血红素组成的结合蛋白,广泛存在于植物界。根据植物血红蛋白的序列、表达方式以及与配体的结合性质,植物血红蛋白可分为三类:共生的血红蛋白(symHb)、非共生的血红蛋白(nsHb或GLB)、截短的血红蛋白(trHb)[1, 2]。共生血红蛋白主要存在于豆类和非豆类植物的固氮根瘤菌感染的细胞中[3]。截短的血红蛋白在植物中发现得较晚,最近的研究表明其在末端氧化、氧的感应和清除以及NO的清除等方面发挥作用[4, 5, 6]。非共生的血红蛋白的分布范围很广泛,不仅存在于含有共生血红蛋白的植物中,而且也存在于其他植物中[3]。非共生的血红蛋白可以分为两类:非共生血红蛋白1(class 1)和非共生血红蛋白2(class 2)。植物非共生血红蛋白在大麦、水稻、玉米、拟南芥、番茄、棉花、山黄麻属等许多单子叶和双子叶植物中存在[7],许多非共生血红蛋白基因已经从这些植物中获得,这些基因的编码序列高度相似。植物非共生血红蛋白在植物生长发育和抗逆性等方面发挥重要作用[3]。病菌侵染、缺氧胁迫、营养缺乏、激素处理等多种生物和非生物胁迫下,nsHb表达量增加[8, 9, 10, 11]。硝酸盐、亚硝酸盐和NO供体显著诱导水稻的ORYsaGLB1a和ORYsaGLB1b的表达[12]。
NO在植物的种子萌发、细胞分裂、开花和衰老等生长发育过程[13, 14, 15, 16]以及对生物和非生物胁迫应答等方面发挥重要作用[17, 18, 19]。现在越来越多的研究表明在非生物胁迫和其他细胞水平上,植物nsHb蛋白调控细胞内的NO水平[10, 20, 21, 22]。拟南芥的血红蛋白1通过与NO反应形成S-亚硝基血红蛋白,清除NO,减少了低氧胁迫下NO的释放[21]。拟南芥非共生血红蛋白通过Hb/NO循环,依赖NAD(P)H将NO解毒为NO3-[23, 24]。大麦nsHb在低氧胁迫下参与NO代谢,过表达大麦nsHb的转基因拟南芥中NO释放量减少[11]。
本研究构建了菠菜非共生血红蛋白1(SoHb)基因编码区与His融合在一起的融合表达载体,并使其在大肠杆菌中表达,并对该蛋白质进行纯化、抗体制备及Western blot检测分析,以期为SoHb蛋白质功能研究和表达水平检测奠定基础。
1 材料与方法 1.1 材 料菠菜品种为‘超级菠菜’,购于云南省昆明市小板桥种子市场。限制性内切酶、T4 DNA连接酶、dNTP Mixture、DNA Marker、pMD-18T载体等购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、碱性磷酸酶标记的羊抗鼠二抗购自康为世纪生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂、氨苄青霉素等为Sigma公司产品;蛋白纯化试剂盒MagneHisTM Protein Purification System为Promega公司产品;大肠杆菌菌株DH5a和BL21 star(DE3)、pET32a载体均为本实验室保存。
1.2 方 法 1.2.1 SoHb基因的克隆根据菠菜SoHb的序列(GenBank注册号:KC142173)设计引物,Hb-FB(5′-ggatcc ATGAGTCTCGAAAATGTCAAC-3′,下划线为BamHI酶切位点)和Hb-RX(5′-ctcgag ATGAACTTCTAAAATTGTC-3′,下划线为XholI酶切位点)。PCR扩增程序为:94℃预变性5 min,94℃变性30 s,55℃复性30 s,72℃延伸45 s,72℃后延伸10 min,30个循环。PCR产物经过琼脂糖凝胶DNA回收试剂盒回收后,连接到pMD-18T载体中,由上海生工生物技术有限公司测序。
1.2.2 pET32a-SoHb原核表达载体的构建提取含有pMD18T-SoHb阳性克隆的质粒,用BamHI和XholI进行双酶切,琼脂糖凝胶电泳检测后用试剂盒回收。挑取含pET32a空载体的克隆,提取质粒进行双酶切(步骤同上),将回收的目的片段与酶切后pET32a空载体用T4 DNA连接酶连接,得到重组表达质粒pET32a-SoHb,转化E.coli BL21感受态细胞,筛选阳性克隆由上海生工生物技术有限公司测序,鉴定所插入的序列及其读码框是否正确。
1.2.3 重组蛋白的原核表达
将阳性工程菌在含氨苄青霉素(Amp 100 mg/L)的LB液体培养基中培养至OD值达0.6左右时,加入终浓度为1 mmol/L的IPTG(Isopropyl-beta-D-thiogalactoside),在16℃下诱导 0、2、4、6、8 h,28℃和37℃诱导8 h,进行SDS-PAGE电泳鉴定表达情况。
1.2.4 融合蛋白的纯化及多克隆抗体的制备大量培养含重组质粒pET32a-SoHb的表达菌株,优化条件诱导表达SoHb蛋白质,粗裂解液经10 000 r/min离心15 min,收集上清液,加入洗脱缓冲液重悬浮,超声波破碎5 min,分别利用Ni2+ NTA亲和柱纯化并进行SDS-PAGE凝胶电泳分析。
用纯化得到的融合蛋白为抗原,4次免疫昆明小鼠后采集血液,制备抗血清。
1.2.5 pET32a-SoHb重组菌的硝化胁迫耐受性分析将转化pET32a-SoHb和pET32a的BL21菌种接种于5 ml液体含氨苄青霉素的LB中,37℃ 200 r/min摇床培养过夜。次日以1∶100的比例转接到新的含氨苄青霉素液体LB培养基中,在37℃条件下,200 r/min摇床培养至OD值约为0.6,随后加入终浓度1 mmol/L的1PTG进行诱导表达,同时分别加入100和500 μmol/L NO供体硝普钠(SNP)进行硝化胁迫耐受性分析,以不加SNP为对照处理,处理后0、30、60、90、150、210、270、330、390、450、510 min后取样,测定650 nm下的吸光度值。实验重复3次。
1.2.6 Western blot分析样品蛋白经SDS-PAGE电泳后,经电转仪恒压15V 20 min转移到硝酸纤维素膜上,用含5%脱脂奶粉的PBST溶液4℃封闭过夜,清洗后加入制作的多克隆抗体(1∶10 000),于摇床上37℃反应1.5 h,PBST洗3次;再加HRP标记的羊抗兔IgG(1∶3 000),37℃摇床反应1.5 h,PBST洗3次。取等体积的ECL试剂A液、B液混合滴于膜正面,压上X光片,定影显影后拍片保存。
2 结果与分析 2.1 SoHb基因的克隆及pET32a-SoHb原核表达载体的构建提取菠菜根系的总RNA,以反转录后的cDNA为模板,经PCR扩增和电泳检测,得到大小约为500 bp的特异性条带,将产物连接到pMD-18T载体上,获得重组质粒pMD18T-SoHb,测序结果与网站中公布的序列完全一致,表明我们所克隆的基因为菠菜的SoHb基因(图 1a)。

|
| 图 1 SoHb基因的RT-PCR扩增(a)及pET32a-SoHb重组质粒酶切鉴定(b) Fig. 1 RT-PCR amplification analysis of SoHb of spinach (a) and restrict enzyme analysis of pET32a-SoHb plasmid (b) M: Marker; 1: The PCR product of SoHb; 2: The restrict enzyme analysis product of pET32a-SoHb |
pMD18T-SoHb中的SoHb基因完整编码框通过BamHI和XholI酶切、回收,连接入原核表达载体pET32a中,获得重组质粒pET32a-SoHb。双酶切分析结果显示可切出大约500 bp的条带 (图 1b)。测序证实重组质粒插入的外源基因序列未突变、读码框正确,表明SoHb基因的原核表达载体pET32a-SoHb构建成功。
2.2 pET32a-SoHb的原核表达将构建好的原核表达载体pET32a-SoHb转化大肠杆菌BL21(DE3)。用1 mmol/L IPTG 在16℃、28℃、37 ℃诱导不同时间后,提取大肠杆菌总蛋白进行SDS-PAGE分析。结果显示,插入有外源片段的重组质粒pET32a-SoHb经IPTG诱导后,能够表达1条约38 kDa的特异蛋白带,且其表达量在16℃时,在0~8h内,随处理时间的增加而增加(图 2)。
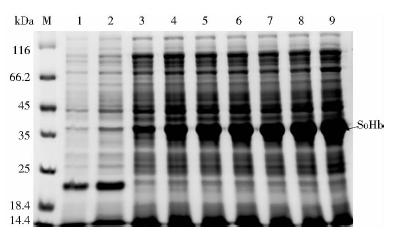
|
| 图 2 SDS-PAGE检测pET32a-SoHb融合蛋白的表达Fig. 2 SDS-PAGE analysis of the expression of pET32a-SoHb fusion protein M: Protein molecular weight maker; 1:BL21(pET32a) total protein before induction; 2: BL21(pET32a) total protein after 1mmol/L IPTG induction for 8 h;3~7: BL21(pET32a-SoHb) total protein after 1 mmol/L IPTG induction for 0,2,4,6,8 h at 16℃; 8~9: BL21(pET32a-SoHb) total protein after 1 mmol/L IPTG induction for 8 h at 28℃ and 37℃,respectively |
将构建好的原核表达载体pET32a-SoHb转入大肠杆菌BL21(DE3),在16℃下,经1 mmol/L IPTG诱导扩大培养,使蛋白质充分表达。诱导菌经超声波处理后,离心收集上清液和沉淀,分别进行SDS-PAGE电泳,结果表明,重组菌裂解的上清和沉淀中都有目的融合蛋白的表达 (图 3)。对上清液利用Ni2+NTA亲和柱纯化目的蛋白,分别用10、200 mmol/L的咪唑洗脱液进行洗脱,结果发现200 mmol/L的咪唑溶液洗脱后,经SDS-PAGE凝胶电泳检测出1条38 kDa左右单一条带。表明SoHb基因已在大肠杆菌中得到了融合表达,并成功进行了纯化。
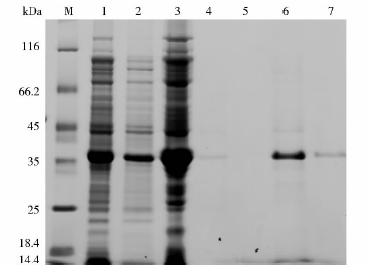
|
| 图 3 SDS-PAGE检测pET32a-SoHb融合蛋白的纯化Fig. 3 SDS-PAGE analysis of the purification of pET32a-SoHb fusion protein M: Protein molecular weight maker; 1: BL21(pET32a-SoHb) total protein after induction for 6 h; 2~3: The supernatant and the pellet part of BL21(pET32a-SoHb) total protein after induction for 6 h; 4~5:Eluted fraction with 10 mmol/L imidazole buffer for the first and second time; 6~7:Eluted fraction with 200 mmol/L imidazole buffer for the first and second time |
在37℃,IPTG终浓度为1 mmol/L的条件下,外源施加100和500 μmol/L SNP进行硝化胁迫分析。结果表明,在正常LB培养基里,pET32a-SoHb的生长速度在100 min后开始增加,而pET32a空载体在200 min后才开始增加。外源施加100和500 μmol/L SNP后,pET32a-SoHb重组菌的生长速度一直高于pET32a空载体,在450 min时,pET32a-SoHb重组菌的吸光度值分别为1.02和0.61,而空载体的吸光度值分别为0.32和0.089(图 4)。结果说明pET32a-SoHb重组菌对硝化胁迫的耐受性增强。
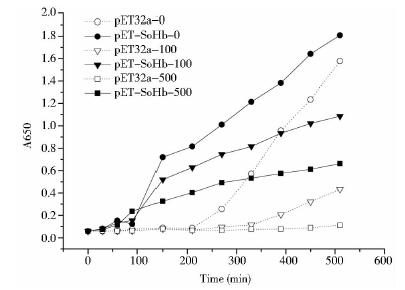
|
| 图 4 SoHb重组菌在硝化胁迫下的生长曲线Fig. 4 Growth curve of the recombinant pET32a-SoHb under nitrosative stress |
将纯化的融合蛋白免疫昆明小鼠,制备抗体。利用Western blot方法检测SoHb融合蛋白多克隆抗体的特异性和灵敏度,结果显示pET32a-SoHb原核表达菌体总蛋白、纯化的原核表达的目的蛋白处均出现一条目的条带(图 5)。抗体的稀释倍数为1∶10 000,表明该抗体的效价较高,可以用于后续试验。

|
| 图 5 SoHb多克隆抗体的Western blot检测Fig. 5 Western blot analysis of polyclonal antiserum of the SoHb protein 1~2: Total protein of BL21(pET32a); 3~4: Total protein of BL21(pET32a-SoHb); 5: Purified pET32a-SoHb protein |
植物非共生血红蛋白基因在植物界广泛存在。nsHb基因在逆境胁迫下,尤其是低氧胁迫下发挥重要作用。在蛋白水平上研究nsHb,对于其功能的深入研究具有重要的意义。大肠杆菌原核表达系统制备重组蛋白质具备不受寄主影响、成本较低、周期相对较短、表达量大、高效稳定等很多优点,这项技术已被广泛应用于多种植物基因的蛋白质表达研究[25]。本研究通过原核表达的方法在大肠杆菌中表达了菠菜SoHb基因的蛋白。实验结果表明SoHb在大肠杆菌中高效表达,我们通过Ni2+ NTA亲和层析法纯化了该蛋白,制备了其特异性多克隆抗体。蛋白质印迹检测显示,其可以和对应的抗原特异结合显示单一条带,为后续进一步研究SoHb的生物学功能奠定了基础。
血红蛋白参与NO的清除[26, 27]。nsHb抑制表达的转基因苜蓿根系中的NO积累量是过表达植株中的2.5倍[20],低氧胁迫下不同玉米细胞系中的NO含量与nsHb的含量呈负相关[28]。将百脉根非共生血红蛋白转化酵母黄素血红蛋白(flavoHb)突变体,发现Glb1-2提高了由S-亚硝基谷胱甘肽诱导的硝化胁迫抗性[29]。本研究也发现pET32a-SoHb重组表达菌对硝化胁迫的抗性增强,与拟南芥Glb1能在体内清除NO结果一致[30]。nsHb也表现出类似过氧化物酶活性,参与NO代谢,在植物与病菌的相互作用中可保护植物免受硝化胁迫[1]。杨礼香等[31]通过原核表达拟南芥血红蛋白1 (AtGLB1)发现其能与过氧化氢相互作用。但Violante-Mota等[32]研究了水稻中融合的血红蛋白的过氧化物酶活性发现,与典型的植物过氧化物酶相比,水稻Hb1清除H2O2的能力较差,认为植物中的nsHb不可能作为过氧化物酶发挥作用。我们同样研究了pET32a-SoHb重组表达菌在H2O2胁迫下的生长曲线,与pET32a空载体相比,重组菌的生长同样受到抑制(数据未显示),说明菠菜SoHb可能不具有过氧化物酶的活性。
| [1] | Dordas C. Nonsymbiotic hemoglobins and stress tolerance in plants. Plant Sci, 2009, 176(4): 433-440. |
| [2] | Jokipii-Lukkari S, Frey A D, Kallio P T, et al. Intrinsic non-symbiotic and truncated haemoglobins and heterologous Vitreoscilla haemoglobin expression in plants. J Exp Bot, 2009, 60(2): 409-422. |
| [3] | 徐慧妮, 赵秀玲, 何小钊, 等. 植物非共生血红蛋白的研究进展. 植物生理学报, 2012, 48 (3): 217-222. Xu H N, Zhao X L, He X Z, et al. Research progress in plant non-symbiotic hemoglobin. Plant Physiology Journal, 2012, 48 (3): 217-222. |
| [4] | Wittenberg J B, Bolognesi M, Wittenberg B A, et al. Truncated hemoglobins: a new family of hemoglobins widely distributed in bacteria, unicellular eukaryotes, and plants. J Biol Chem, 2002, 277:871-874. |
| [5] | Milani M, Pesce A, Ouellet H, et al. Truncated hemoglobins and nitric oxide action. IUBMB Life, 2003, 55:623-627. |
| [6] | Kim D Y, Hong M J, Seo Y W. Role of wheat trHb in nitric oxide scavenging. Mol Biol Rep, 2014, 41(9): 5931-5941. |
| [7] | Hebelstrup K H, Igamberdiev A U, Hill R D. Metabolic effects of hemoglobin gene expression in plants. Gene, 2007, 398(1-2): 86-93. |
| [8] | Seregelyes C, Barna B, Hennig J, et al. Phytoglobins can interfere with nitric oxide functions during plant growth and pathogenic responses: a transgenic approach. Plant Sci, 2003, 165(3): 541-550. |
| [9] | Ohwaki Y, Kawagishi-Kobayashi M, Wakasa K, et al. Expression analysis of the two class-1 non-symbiotic hemoglobin genes in cultured rice cells. Plant & Cell Physiol, 2005, 46: S189-S189. |
| [10] | Igamberdiev A U, Bykova N V, Hill R D. Structural and functional properties of class 1 plant hemoglobins. Iubmb Life, 2011, 63(3): 146-152. |
| [11] | Hebelstrup K H, Shah J K, Simpson C, et al. An assessment of the biotechnological use of hemoglobin modulation in cereals. Physiol Plant, 2014, 150(4): 593-603. |
| [12] | Ohwaki Y, Kawagishi-Kobayashi M, Wakasa K, et al. Induction of class-1 non-symbiotic hemoglobin genes by nitrate, nitrite and nitric oxide in cultured rice cells. Plant & Cell Physiol, 2005, 46(2): 324-331. |
| [13] | Beligni M V, Lamattina L. Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyl elongation, three light-inducible responses in plants. Planta, 2000, 210:215-221. |
| [14] | He Y, Tang R H, Hao Y, et al. Nitric oxide represses the Arabidopsis floral transition. Science, 2004, 305:1968-1971. |
| [15] | Guo F Q, Crawford N M. Arabidopsis nitric oxide synthase1 is targeted to mitochondria and protects against oxidative damage and dark-induced senescence. Plant Cell, 2005, 17: 3436-3450. |
| [16] | Gniazdowska A, Krasuska U, Czajkowska K, et al. Nitric oxide and plant hemoglobins. Postepy Biologii Komorki, 2009, 36: 233-250. |
| [17] | Neill S J, Desikan R, Clarke A, et al. Hydrogen peroxide and nitric oxide as signalling molecules in plants. J Exp Bot, 2002, 53:1237-1247. |
| [18] | Romero-Puertas M C, Perazzolli M, Zago E D, et al. Nitric oxide signalling functions in plant-pathogen interactions. Cell Microbiol, 2004, 6: 795-803. |
| [19] | Corpas F J, Leterrier M, Valderram R, et al. Nitric oxide imbalance provokes a nitrosative response in plants under abiotic stress. Plant Sci, 2011, 181: 604-611. |
| [20] | Dordas C, Hasinoff B B, Igamberdiev A U, et al. Expression of a stress-induced hemoglobin affects NO levels produced by alfalfa root cultures under hypoxic stress. Plant J, 2003, 35(6): 763-770. |
| [21] | Perazzolli M, Dominici P, Romero-Puertas M C, et al. Arabidopsis nonsymbiotic hemoglobin AHb1 modulates nitric oxide bioactivity. Plant Cell, 2004, 16(10): 2785-2794. |
| [22] | Shimoda Y, Shimoda-Sasakura F, Kucho K, et al. Overexpression of class 1 plant hemoglobin genes enhances symbiotic nitrogen fixation activity between Mesorhizobium loti and Lotus japonicus. Plant J, 2009, 57(2): 254-263. |
| [23] | Igamberdiev A U, Seregélyes C, Manaċ h N, et al. NADH dependent metabolism of nitric oxide in alfalfa root cultures expressing barley hemoglobin. Planta, 2004, 219: 95-102. |
| [24] | Limami A M, Diab H, Lothier J. Nitrogen metabolism in plants under low oxygen stress. Planta, 2014, 239(3): 531-541. |
| [25] | 刘晓庆, 徐照龙, 许玲, 等. 大豆GmNAC8基因克隆与原核表达. 江苏农业学报, 2013, 29(4):734-737. Liu X Q, Xu Z L, Xu L, et al. Cloning and prokaryotic expression of GmNAC8 gene isolated from soybean. Jiangsu J of Agr Sci, 2013, 29(4):734-737. |
| [26] | Hebelstrupa K H, Shahb J K, Igamberdiev A U. The role of nitric oxide and hemoglobin in plant development and morphogenesis. Physiol Plant, 2013, 148(4): 457-469. |
| [27] | Hill R D, Huang S L, Stasolla C. Hemoglobins, programmed cell death and somatic embryogenesis. Plant Sci, 2013, 211: 35-41. |
| [28] | Dordas C, Hasinoff B B, Rivoal J, et al. Class-1 hemoglobins, nitrate and NO levels in anoxic maize cell-suspension cultures. Planta, 2004, 219: 66-72. |
| [29] | Sainz M, Perez-Rontome C, Ramos J, et al. Plant hemoglobins may be maintained in functional form by reduced flavins in the nuclei, and confer differential tolerance to nitro-oxidative stress. Plant J, 2013, 76(5): 875-887. |
| [30] | Hebelstrup K H, Jensen E O. Expression of NO scavenging hemoglobin is involved in the timing of bolting in Arabidopsis thaliana. Planta, 2008, 227(4): 917-927. |
| [31] | 杨礼香, 王正询, 柯德森, 等. 拟南芥血红蛋白1 (AtGLB1)与过氧化氢的相互作用.氨基酸和生物资源, 2009, 31 (4): 1-4. Yang L X, Wang Z X, Ke D S, et al. Interaction of AtGLB1 and H2O2. Amino Acids & Biotic Resources, 2009, 31 (4): 1-4. |
| [32] | Violante-Mota F, Tellechea E, Moran J F, et al. Analysis of peroxidase activity of rice (Oryza sativa) recombinant hemoglobin 1:Implications for in vivo function of hexacoordinate non-symbiotic hemoglobins in plants. Phytochem, 2010, 71: 21-26. |
 2015, Vol. 35
2015, Vol. 35




