文章信息
- 王晓艳, 陈娜子, 艾君, 赵央, 吴美玉, 黄金枝, 姜潮, 李校堃
- WANG Xiao-yan, CHEN Na-zi, AI Jun, ZHAO Yang, WU Mei-yu, HUANG Jin-zhi, JIANG Chao, LI Xiao-kun
- HBVpre-c-Fc融合蛋白在杆状病毒表达系统中的表达及其生物学活性研究
- Expression and Purification of Biological-active Recombinant HBV Precore Protein-Mouse IgG Fc Based on Baculovirus Expression Vector System
- 中国生物工程杂志, 2015, 35(4): 42-47
- China Biotechnology, 2015, 35(4): 42-47
- http://dx.doi.org/10.13523/j.cb.20150406
-
文章历史
- 收稿日期:2015-01-22
- 修回日期:2015-03-02
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球尤其是我国面临的严重问题。全世界超过2亿人已经或正在感染乙型肝炎病毒,它能够引起肝炎、肝硬化乃至肝细胞肝癌 (hepatocellular carcinoma,HCC)。据统计,每年约有78万人死于乙型肝炎引起的相关疾病,严重危害人类的健康,影响人们的生活质量① [1, 2]。HBV全基因组可编码多种病毒蛋白,深入探讨各种病毒蛋白的生物学功能对HBV感染相关疾病的发生机制的揭示和临床检测治疗的指导具有非常重要的意义[3, 4, 5]。
① World Health Organization media center fact sheet hepatitis B,http://www.who.int/mediacentre/factsheets/fs204/zh/ (2014)
目前上市的乙肝疫苗大多数是HBV的表面抗原即s蛋白,但乙肝病毒逃逸现象仍有发生,相关研究表明乙肝病毒c蛋白和e蛋白与乙肝病毒逃逸现象的发生密切相关[6]。乙肝病毒前c蛋白(hepatitis B virus precore,HBV pre-c) 是乙肝病毒c蛋白和e蛋白的前体,生物学功能尚不十分明确。相关研究表明,HBV pre-c 蛋白可与c蛋白结合形成的复合物可能有利于病毒的持续感染[7, 8]。
设计疫苗的关键在于能够有效地活化抗原呈递细胞(antigen presenting cell,APC),促进抗原呈递和激活免疫反应[9]。并且由于APC的表面能够表达FcR(Fc receptor),所以抗原-Fc融合蛋白可以作为抗原的运载工具,借助Fc片段靶向作用结合APC,从而缩短抗原在血液中的游离时间,减少蛋白酶对抗原的降解,因而能够提高抗原半衰期,加强抗原的呈递[10]。
1983年由Smith等[11]建立了具有高蛋白表达水平、翻译后修饰目的蛋白、周期短等优势的杆状病毒表达系统(baculovirus expression vector system,BEVS)。继2007年第一个被美国食品药品监督管理局(FDA)批准上市的宫颈癌预防双价人乳头瘤病毒疫苗Cerearix[12]批准上市,2013年美国FDA批准预防18~49岁人群季节性流感的疫苗FluBlok[13]上市以来,杆状病毒表达系统现已广泛应用于疫苗的生产、生物制药和基因工程当中。
本实验运用杆状病毒表达系统表达乙型肝炎病毒前C蛋白-小鼠IgG Fc的融合蛋白作为疫苗,希望能够获得具有免疫活性的重组蛋白,为慢性乙型肝炎的免疫治疗的研究奠定基础并开拓新的思路。
1 材料与方法 1.1 材 料 1.1.1 载体及菌种含有HBV pre-c-Fc基因序列(昆虫密码子优化)的pUC57载体、pFastBac1载体、E.coli DH10Bac菌种、E.coli DH5α菌种均由本实验室保存。
1.1.2 试剂Ex-Taq酶、限制性内切酶BamHⅠ和HindⅢ、DNA Marker 2000、DNA连接试剂盒均购自TaKaRa生物工程公司。高纯质粒小量制备试剂盒、琼脂糖凝胶DNA回收试剂盒(BioTeke)。BCA蛋白浓度测定试剂盒(Tansgene)。PVDF膜(BIO-RID)。HBV核心蛋白单克隆抗体(abcam)。辣根过氧化酶标记驴抗鼠抗体(Santa Cruz)。Cellfectin Ⅱ Reagent (Invitrogen)。Sf900 Ⅱ SFM 1×、Sf9 (Gibco)。HiTrap Protein G HP(GE),HBV 核心蛋白标准品(Asiapeptide亚肽生物),HBV核心蛋白抗体免疫酶联反应(Elisa)试剂盒(InTec英科),引物由华大基因合成。
1.2 方 法 1.2.1 设计引物PCR扩增HBV pre-c-Fc基因片段
pUC57载体中包含编码HBV pre-c-Fc全长的433个氨基酸序列。运用primer 5.0软件设计含有BamHⅠ和Hind Ⅲ酶切位点的上游引物和下游引物。
上游引物:5′- GGATCCATGGACATTGATCC-3′;
下游引物:5′-AAGCTTTTAGCTACCGCG-3′;
PCR扩增,PCR产物切胶回收。实验方法见说明书。
1.2.2 重组pFastBac-HBV pre-c-Fc载体的构建同时对pFastBac质粒及含HBV pre-c-Fc基因的质粒进行BamHⅠ、HindⅢ双酶切,酶切产物切胶回收。DNA连接试剂盒连接需要片段。将连接产物转化感受态DH5α,37℃过夜,挑取单菌落进行PCR及酶切鉴定,将鉴定正确的菌液送Invitrogen公司进行基因测序。
1.2.3 重组Bacmid-HBV pre-c-Fc载体的构建将测序正确的pFastBac-HBV pre-c-Fc质粒转座含有Bacmid质粒的DH10Bac感受态,通过抗性和蓝白斑筛选出阳性单菌落进行PCR鉴定,运用目的基因HBV pre-c-Fc上下游引物分别和Bacmid质粒含有的M13上下游引物,进行PCR扩增鉴定。
1.2.4 重组杆状病毒的获得Invitrogen Life Technologies Instruction Manual. Guide to Baculovirus Expression Vector Systems (BEVS) and Insect Cell Culture Techniques将正确的Bacmid-HBV pre-c-Fc质粒与细胞转染试剂(Cellfectin Reagent)混合均匀,滴加到Sf9上,27℃培养5h。轻轻吸除上清液,添加sf900Ⅱ培养基2ml,27℃培养。待75%细胞发生病毒侵染时,取上清即P1病毒。取P1病毒继续侵染Sf9细胞3次后即获得P4病毒。
1.2.5 利用噬斑法测定P4病毒滴度①准备10-3到10-8连续6个稀释梯度的病毒。27℃一定湿度条件下含有琼脂糖的培养基中孵育7~10d,观察噬菌斑个数直到连续2d计数不变。按照公式计算病毒滴度。
滴度(pfu/ml)=噬斑数×稀释倍数×1/每孔病毒体积
1.2.6 HBV pre-c-Fc蛋白的表达与鉴定取对数生长期(细胞密度2×106个/ml)悬浮培养昆虫细胞。用P4病毒进行转染,27℃、无CO2、110r/min悬浮培养。分别收获36,48,60,72,84,96,108,120 h的细胞上清[14]。并用同样生长状态下6瓶细胞,不同感染复数(MOI)侵染细胞,84h后收获蛋白。Western blot检测。
1.2.7 HBV pre-c-Fc蛋白的纯化收获转染病毒的上清,用50kDa超滤离心管(MILIPORE)处理,上样于20mmol/L PB平衡过的HiTrap Protein G HP(GE),用0.1mol/L 甘氨酸-盐酸洗脱,将各部分样品进行SDS-PAGE分析蛋白洗脱效果。
1.2.8 免疫小鼠BALB/c小鼠随机分为3组,每组6只。空白对照组大腿内侧肌肉注射生理盐水,阳性对照组注射大肠杆菌来源的HBV 核心蛋白(Asiapeptide亚肽生物),实验组注射HBV pre-c-Fc 20 μg/只[15],所有小鼠都在0d,14d,28d三次大腿内侧肌肉注射,于首次免疫后6周眼眶取血,血清储存于-80℃备用。
1.2.9 血清中抗体的检测分别使用HBV核心蛋白抗体免疫酶联反应(Elisa)试剂盒(InTec英科),每孔加入PBS稀释2倍的血清100μl/孔。酶标仪450nm波长下检测吸光度值。实验步骤详见说明书。
2 结 果 2.1 HBV pre-c-Fc表达纯化以及生物活性测定利用Bac-to-Bac杆状病毒表达载体表达HBV pre-c-Fc,亲和层析柱Protein G根据特异结合Fc结构纯化融合蛋白HBV pre-c-Fc,大腿内侧肌肉注射免疫小鼠,血清HBV c ab免疫酶联反应检测抗体的产生量,如图 1所示。
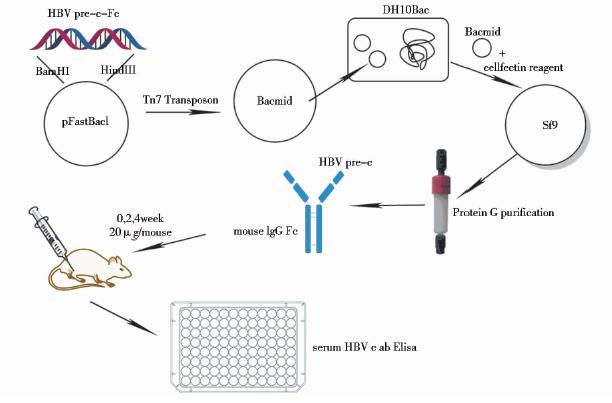
|
| 图 1 HBV pre-c-Fc表达纯化以及生物活性测定示意图 Fig. 1 The schematic diagram of HBV pre-c-Fc expression,purification and bioassay |
HBV pre-c-Fc基因由433个氨基酸组成,全长1 299bp。PCR扩增克隆有HBV pre-c-Fc基因的pUC57载体为模板的目的基因。PCR产物进行琼脂糖凝胶电泳,1 000bp邻近明显可见特异性目的条带(图 2)。
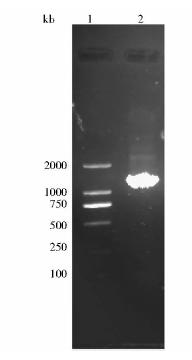
|
| 图 2 PCR扩增HBV pre-c-Fc基因Fig. 2 PCR product of HBV pre-c-Fc gene 1:DNA Marker DL 2000;2:HBV pre-c-Fc gene |
提取pFastBac-HBV pre-c-Fc质粒,用BamHⅠ和HindⅢ进行双酶切鉴定,酶切产物片段位置与目的基因大小位置一致(图 3)。

|
| 图 3 pFastBac-HBV pre-c-Fc双酶切鉴定Fig. 3 Identification of recombinant plasmid pFastBac-HBV pre-c-Fc 1:DNA Marker DL 2000;2:pFastBac-HBV pre-c-Fc digested with BamHⅠand HindⅢ |
以Bacmid-HBV pre-c-Fc重组质粒为模板,HBV pre-c-Fc上下游引物及M13上下游引物分别交错进行PCR对重组杆状病毒进行鉴定。结果显示大约在2 000bp左右位置处有目的条带出现,与预期结果一致。(图 4)。

|
| 图 4 PCR鉴定重组杆状病毒DNAFig. 4 Identification of recombinant baculovirus DNA by PCR 1:Negative control;2:DNA Marker DL 2000;3,4:Bacmid transposed with pFastBac-HBV pre-c-Fc |
重组杆状病毒载体Bacmid-HBV pre-Fc在细胞转染试剂的作用下侵染昆虫细胞,72h后于普通光学显微镜下观察,发现被侵染的细胞与正常细胞相比,细胞破裂,证明杆状病毒包装完成,成为成熟杆状病毒(图 5)。

|
| 图 5 正常及感染后的Sf9细胞(100μm)Fig. 5 Normal Sf9 and Sf9 cells infected after 72h(100μm) (a)Normal Sf9 cells (b) Sf9 cells infected after 72h |
P4病毒转染细胞后,在不同时间点和不同MOI收获相同体积细胞上清进行Western blot鉴定。结果表明,转染36h细胞开始表达蛋白,84h时蛋白的表达量最高;MOI为4时蛋白表达最高(图 6)。

|
| 图 6 Western blot 检测不同时间蛋白表达情况Fig. 6 Detection of expression of recombinant HBV pre-c-Fc protein in different infection time and MOI by Western blot |
将收获的细胞及细胞上清上样于蛋白G柱,从洗脱样品的聚丙烯酰胺凝胶条带来看(图 7),目的蛋白在洗脱液0.1mol/L 甘氨酸-盐酸洗脱后每1ml收集样品,条带相对单一,由SDS-PAGE条带分析结果显示,蛋白纯度达到90%以上。由于重组蛋白中含有小鼠IgG Fc片段,因此可能会发生聚合现象,因而在高分子量处出现条带,为25kDa处出现的条带Fc片段发生降解所致。

|
| 图 7 HBV pre-c-Fc 蛋白纯化结果Fig. 7 Purification of HBV pre-c-Fc Purification by HiTrap Protein G HP,lane 1 was protein ladder; 2 was Sf9 medium sample; 3 was flow-through; 4~8 was 0.1mol/L glycine-HCl elution buffer eluted fraction |
小鼠血清中HBV 核心蛋白抗体的免疫酶联检测结果显示,与HBV c 抗体免疫酶联检测试剂盒中的阳性和阴性对照对比,HBV pre-c-Fc 蛋白组小鼠中大多数都有免疫反应,而大肠杆菌来源的标准蛋白HBV 核心蛋白组小鼠仅有一只有阳性反应,生理盐水组小鼠没有阳性反应。t检验结果也显示: HBV pre-c-Fc蛋白和大肠杆菌生产的HBV核心蛋白免疫后两组小鼠的血清抗体产生量有显著性差异(P=0.0044<0.05,n=6)(图 8)。

|
| 图 8 小鼠血清中HBV 核心蛋白抗体的Elisa检测Fig. 8 Enzyme-linked immune response in serum HBV core protein antibody t-test of HBV pre-c-Fc and HBc protein,P=0.0044<0.05,n=6,there are significantly different between two date groups |
HBV 前c蛋白作为乙型肝炎病毒蛋白的表达前体蛋白,能够转变成HBV c蛋白和HBV e蛋白,HBV 前c蛋白是参与慢性乙型肝炎感染过程的一个关键的病毒蛋白,例如下调先天的免疫应答。如果针对其病毒蛋白,或许可提供一个新的潜在的治疗方法[6]。目前市场上大多是以乙型肝炎病毒的 s 蛋白免疫蛋白的肌肉注射疫苗。但仍然有乙型肝炎病毒发生逃逸现象而无法免疫,因而仍然有很大潜在性会染慢性乙型肝炎[16]。并且市场上的乙型肝炎疫苗大多采用大肠杆菌表达或者酵母菌表达,缺乏一定的糖基化,从而使得免疫原性大大降低,需要寻找新的免疫手段预防乃至治疗慢性乙型肝炎[5]。
杆状病毒表达系统对于疫苗生产方面有以下几点优势[14]:能够容纳较大外源基因插入而不影响表达;杆状病毒转染起1~2周即可完成蛋白的表达和纯化,疫苗只需要较短时间完成生产;能够对目的蛋白进行翻译后加工,昆虫细胞对蛋白的翻译后加工与哺乳动物的十分接近,但是又有所不同,能够增加疫苗的免疫原性[12]。
1989年,Capon等[17]首次在《自然》杂志上报道了一种能够结合HIV囊膜蛋白gp120,阻碍HIV-1感染T细胞和单核细胞的CD4-Fc融合蛋白。此后,基于抗体Fc段的Fc融合蛋白研究和开发在世界范围内得到迅速的发展。参考文献[9]中报道Santiago等的研究表明,APC的表面表达有Fc受体,所以抗原-Fc融合蛋白可以作为抗原的运载工具,借助Fc片段靶向作用结合APC,从而缩短抗原在血液中的游离时间,减少酶对抗原的降解,因而能够提高抗原半衰期,加强抗原的呈递作用[9]。
本实验对重组HBV前c蛋白融合小鼠IgG Fc(HBV pre-c-Fc)的cDNA进行昆虫细胞密码子优化,融合杆状病毒转染了sf9昆虫细胞。将转染后不同时间点收获的蛋白进行Western blot鉴定,结果显示:自转染36h开始表达目的蛋白,84h时达到表达量最大值(图 6)。转染84h后收获的蛋白经过蛋白G亲和层析柱后,纯度达到90%以上(图 7)。纯化后蛋白产量经过BCA法检测为3.03mg/L. 并且对小鼠免疫后的血清中乙型肝炎病毒核心蛋白抗体进行Elisa检测(图 8),由于鼠源IgG的提高抗原半衰期和加强抗原的呈递作用,该重组融合蛋白HBV pre-c-Fc能够大大提高小鼠的免疫反应。
目前,对于慢性乙型肝炎的治疗药物缺乏,而药物带来的副作用也无法估计。如若能够利用患者自身的免疫系统清除乙型肝炎病毒,将是比较理想的治疗方案。本课题将继续深入探究和尝试,希望从增强免疫方面引导患者自身免疫系统,加大对乙型肝炎病毒的识别和清除,从而治愈乙型肝炎。
| [1] | Shepard C W, Simard E P, Finelli L, et al. Hepatitis B virus infection: epidemiology and vaccination. Epidemiol Rev, 2006, 28:112-125. |
| [2] | Liaw Y F, Kao J H, Teerha P, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol Int, 2012, 72(12):9365-9369. |
| [3] | Seeger C, Mason W. Hepatitis B virus biology. Microbiol Mol Biol, 2000, 64:51-68. |
| [4] | 曾显坤, 扈瑞平. 乙肝病毒入侵干细胞的研究现状. 生物技术世界, 2014, 12:143-144. |
| [5] | Katrin B, Robert T. Natural history of chronic hepatitis B virus infection. Med Microbiol Immunol, 2014, 14:369-376. |
| [6] | Kenny R, Sarah D B, Bert S, et al. Hepatitis B core-based virus-like particles to present heterologous epitopes. Vaccines, 2013, 12(2):183-198. |
| [7] | Marion D, Anne T, Stéphane B, et al. Conserved aromatic residues of the hepatitis B virus precore propeptide are involved in a switch between distinct dimeric conformations and essential in the formation of heterocapsids. Virology, 2014, 463:273-282. |
| [8] | 赵培庆, 曲忠花, 盖潇潇等. 乙肝病毒核心蛋白真核表达载体的构建与表达. 山东大学学报:医学版, 2010, 48(2):67-71. Zhao P Q, Qu Z H, Gai X X, et al. Construction of eukaryotic expression vectors containing the HB c gene and their expressions in the human hepatoma cell line. 2010,48(2):67-71. |
| [9] | 王宇恒, 郭薇, 王欣等. Fc融合蛋白在药学领域的研究进展. 药学进展, 2014, 38(6):419-425. Wang Y H, Guo W, Wang X, et al. Advances in research on Fc fusion protein in pharmaceutical field. Progress in Pharmaceuncal Sciences, 2014, 38(6):419-425. |
| [10] | Santiago T, Kulenzin S V, Reshetmikova E S, et al. FCRLA is a resident endoplasmic reticulum protein that associates with intracellular IgS, IgM, IgG and IgA. Int Immunol, 2011, 23(1):43-53. |
| [11] | Smith G E, Fraser M J, Summers M D. Molecular engineering of the Autographa califarnica nuclear polyhedrosis virus genome: deletion mutations within the polyhedron gene. Journal of Virology, 1983, 46(2):584-593. |
| [12] | Emma J C, Henry C K. CervarixTM- a bivalent L1 virus-like particle vaccine for prevention of human papillomavirus type 16- and 18-associated cervical cancer. Biol. Ther, 2007, 7(3):391-396. |
| [13] | Kate T. First recombinant flu vaccine approved. Am J Health-Syst Pharm, 2013, 70:382. |
| [14] | 朱小静, 薛萍, 王晓艳等. 重组角质细胞生长因子-1在杆状病毒表达系统中的表达及其生物活性研究. 中国生物工程杂志, 2013, 33(3):47-53. Zhu X J, Xue P, Wang X Y, et al. Expression and purification of biological-active recombinant human keratinocyte growth factor-1 base on baculovirus expression vector system. China Biotechnology, 2013, 33(3):47-53. |
| [15] | Ying Y, Sheng Z, Cai C G, et al. Deletion modification enhances anthrax specific immunity and protective efficacy of a hepatitis B core particle-based anthrax epitope vaccine. Immunobiology, 2014, 219:97-103. |
| [16] | 林志龙, 吴珍红. 乙肝疫苗常规免疫无应答者增加接种剂量后免疫效果和安全性观察. 预防医学论坛, 2014, 20(9):707-708. |
| [17] | Capon D J, Chamow S W, Mordenti J, et al. Designing CD4 immunoadhesins for AIDS therapy. Nature, 1989, 337(6207):525-531. |
 2015, Vol. 35
2015, Vol. 35




