文章信息
- 孟赞, 徐丹, 李真, 李静, 李刚, 刘永刚, 刘兆雨, 吴宏, 唐勇, 彭彦
- MENG Zan, XU Dan, LI Zhen, LI Jing, LI Gang, LIU Yong-gang, LIU Zhao yu, WU Hong, TANG Yong, PENG Yan
- TRPC3参与糖氧剥夺致培养的少突胶质细胞凋亡
- Oxygen Glucose Deprivation-induced Apoptosis in Oligodendrocytes Through TRPC3
- 中国生物工程杂志, 2015, 35(4): 23-29
- China Biotechnology, 2015, 35(4): 23-29
- http://dx.doi.org/10.13523/j.cb.20150404
-
文章历史
- 收稿日期:2015-02-05
- 修回日期:2015-03-12
随着社会人口老龄化,神经退行性疾病(如阿尔茨海默病、帕金森病等)的发病率日益增高,不仅使患者生活活动能力及其生活质量下降,也使预期寿命和健康预期寿命缩短,而且给家庭和社会带来沉重的经济负担。瑞士研究者发现神经系统退行性疾病与髓鞘脱失有关[1],进一步研究证明少突胶质细胞退化导致脱髓鞘 [2]。少突胶质细胞对缺血缺氧损伤较其他胶质细胞敏感,在大脑的某些特定区域甚至比神经元对缺血缺氧损伤更敏感[3]。因此,有学者提出少突胶质细胞缺血缺氧损伤是神经退行性疾病的重要原因[4]。
少突胶质细胞的存活和凋亡是一个非常重要的生理和病理过程,少突胶质细胞的缺血缺氧损伤是神经退行性疾病的重要原因。钙是很重要的细胞内信使,参与神经分泌、感觉、长时程增强、基因调节、细胞的生长和分化[5, 6],很多证据显示钙离子稳态的改变与许多神经系统疾病有关[7, 8],近年来细胞内钙离子持续升高介导的缺血性神经细胞损伤已成为研究者关注的焦点之一。现有数据表明内质网钙离子水平和线粒体钙离子水平受瞬时电位受体通道(TRPC)蛋白激活致使钙离子内流影响[9, 10],TRPC有7个不同的亚型,其中少突胶质细胞上主要表达TRPC3[11]。本实验通过构建体外大鼠少突胶质细胞OGD模型,初步探讨 TRPC3 是否参与少突胶质细胞凋亡,将有助于揭示机体少突胶质细胞缺血缺氧损伤的分子机制。
1 材料与方法 1.1 材料与试剂清洁级出生0~3d SD 乳鼠,由重庆医科大学实验动物中心提供;B104 神经母细胞瘤细胞株为第三军医大学赠送;DMEM/F12、胎牛血清、0.25%胰酶购于HyClone公司;多聚赖氨酸(polyd-lysine,PDL)、胰岛素(insulin)、N-乙酰基-L-半胱氨酸(NAC)、小鼠抗大鼠A2B5和Pyr3购于Sigma公司;血小板衍生生长因子AA(PDGF-AA)、碱性成纤维细胞生长因子(bFGF)购于Peprotech公司;兔抗鼠MBP购于Santa Cruz公司;fluo-3购于碧云天生物技术有限公司;羊抗鼠TRPC3购于Abcam公司。
1.2 少突胶质细胞原代培养 1.2.1 B104上清液收集B104细胞株常规培养,细胞80%~90%融合时,更换(DMEM/F12+1%N2 supplement)培养液,4天后收集上清液。
1.2.2 少突胶质细胞原代培养取SD乳鼠,无菌下取出大脑皮质,剥离脑膜,取脑皮质切成1mm2小块,吸管反复吹打制成细胞悬液,种植于直径10cm PDL包被的培养皿内,入孵箱常规培养5d,培养液为(DMEM/F12+10%FBS),隔天换液。5d后B104CM(DMEM/F12+20%B104CM+1%N2 supplement)增殖培养3d,EDTA消化机械吹打分离纯化得到的少突胶质细胞前体细胞(Oligodendrocyte precursor cells,OPC)分化培养3d[12, 13, 14]。
1.3 免疫荧光染色细胞以3×107/ml的密度种植在两个24 孔板中分别培养1d 和分化培养3d,PBS清洗,4%多聚甲醛固定30min,山羊血清37℃封闭30 min,加一抗,OPC以A2B5(小鼠IgG,1∶100) 标记,少突胶质细胞(oligodendrocyte,OL)以髓鞘碱性蛋白(Myelin basic protein,MBP)(羊IgG,1∶100)标记,4℃过夜,加二抗,湿盒内37℃孵育30min,PI染核30s,50%缓冲甘油封片,荧光显微镜下采集图片。
1.4 少突胶质细胞OGD模型构建及实验分组以三气培养箱缺氧、无糖DMEM相结合的方法建立体外少突胶质细胞OGD损伤模型,即培养箱调整为(94%N2+5%CO2+1%O2),培养基更换为无糖DMEM,分别培养1h,2h,3h后取出细胞,更换为正常少突胶质细胞培养基,恢复正常的培养条件继续培养,同时常氧常糖设置为正常对照。
以常氧常糖培养的细胞做为正常对照组,以OGD2h的细胞设为模型组,以TRPC3的选择性阻滞剂Pyr3+模型组(OGD2h)为处理组,Pyr3的终浓度为10μmol/L。
1.5 Western boltting检测少突胶质细胞中 Beta-catenin、TRPC3蛋白的表达细胞以1×107/ml的密度接种,分正常组和模型组培养,0.25%胰酶消化,收集各组细胞,提取总蛋白,检测蛋白浓度,用Bio-Rad的方法定量蛋白。取蛋白,进行SDS-PAGE电泳,电转到PDVF膜上,5%脱脂奶粉封闭2 h,抗体β-actin(1∶1000)TRPC3(1∶1000)4℃孵育过夜,用TBST缓冲液漂洗,二抗37℃孵育1.5h,TBST缓冲液漂洗后用ECL显色剂显色、曝光,运用Quantity One图像分析软件测得条带的吸光度值,将内参条带和目的比值后,比较组间有差异。
1.6 MTT比色法检测细胞活力细胞以1×104/孔接种于96孔培养板,随机分为以下3组: 对照组、模型组、Pyr3处理组,每孔培养液总体积为200μl,每孔加入20μl MTT,培养3~4h,吸去孔内培养液,加入150μl二甲基亚砜(DMSO),37℃温箱孵育10min,置酶标仪490nm处测定OD值。以正常组细胞活力为100%,按以下公式计算:细胞活力(%)=实验组OD值/对照组OD值×100%。实验重复3次。
1.7 流式细胞技术检测细胞凋亡细胞以1×107/ml的密度接种,随机分为以下3组: 对照组、模型组、Pyr3处理组。收集细胞,按照Annexin V-FTIC/PI双染细胞凋亡检测试剂盒说明书方法染色,30min后送流式细胞仪检测,采用CELIQUEST软件分析得出细胞早期凋亡比例。实验重复3次。
1.8 激光共聚焦扫描显微镜技术测定细胞内钙离子浓度细胞以1×107/ml接种到共聚焦皿,随机分为以下3组: 对照组、OGD组、Pyr3处理组。实验当天,以生理盐溶液冲洗3次,以荧染料fluo-3负载50min,同时加入20%的pluronicF-127促进fluo-3进入细胞。负载结束后,用生理盐溶液洗去细胞外多余染液,将共聚焦皿置于共聚焦显微镜载物台上,选择镜下细胞分布均匀、染色良好的视野采集图像。实验重复3次。
1.9 流式细胞技术测定细胞内钙离子浓度细胞以1×107/ml的密度接种,随机分为以下3组:对照组、OGD组、Pyr3处理组。生理盐溶液冲洗3次,以荧染料fluo-3负载50min,同时加入20%的pluronicF-127促进fluo-3进入细胞。负载结束后,用生理盐溶液洗去细胞外多余染液,收集细胞,送流式细胞仪检测。实验重复3次。
1.10 统计学分析数据均经SPSS17.0统计软件处理,各方法计量资料单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果 2.1 少突胶质细胞生长观察混合培养5d,可见两种形态不同的细胞,多数细胞体积较大,紧贴瓶底生长,呈扁平状有较粗大突起,胞核较大,呈圆形,此细胞为星型胶质细胞。位于扁平细胞的表面可见一些体积小,胞体呈圆形或椭圆形,强折光性强,具有单极或双极的细小突起呈聚集生长的细胞为OPC(图 1a)。培养第8d,在倒置显微镜下观察,细胞完全融合,小圆形或椭圆形、强折光性强,具有单极或双极的细胞铺面瓶底(图 1b)。纯化后培养1d(9d)的OPC胞体成椭圆型,折光性强,有单极或双极的细小突起(如图 1c)。分化培养的细胞(第12d)胞体逐渐由椭圆形变为圆形或不规则形,细胞突起增多(图 1d)。
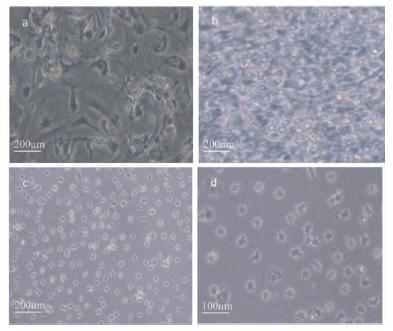
|
| 图 1 混合神经胶质细胞生长情况及少突胶质细胞各时期形态 Fig. 1 Morphological features of mixed nerve cells and oligodendrocyte morphological changes in each period a、b、c、d cultured at days 5d,8d,9d and 12d |
OPC特异性抗原A2B5阳性细胞占细胞总数的95%以上,A2B5(绿色荧光)作为OPC的标志性蛋白主要表达在细胞膜上(图 2a);OL特异性抗原MBP阳性细胞占细胞总数 95%以上,MBP(绿色荧光)作为OL的标志性蛋白主要表达在细胞膜上(图 2d);OPC胞体呈椭圆形,具有典型的双极细小突起,A2B5标记的特异性抗原(绿色荧光)位于胞体和突起上(图 2 b、图 2c)。少突胶质细胞胞体为圆形,细胞突起多,次极细胞突起交互成网样,MBP标记的特异性抗原(绿色荧光)位于胞体和突起上(图 2e、图 2f)。细胞核染PI为红色荧光。
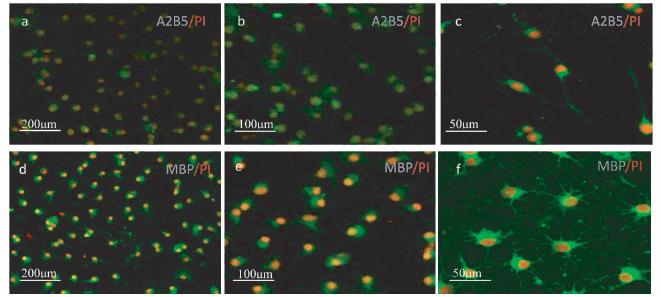
|
| 图 2 少突胶质细胞的形态及鉴定Fig. 2 Digital photomicrographs and identification of oligodendrocyte |
MTT结果显示,细胞OGD1h细胞活力变化不明显,OGD2h细胞活力降为(54.57±0.42)%,并且随着缺氧时间延长存活细胞减少,凋亡细胞增多,至OGD3h大多数细胞破碎,细胞活力降至(38.14±0.42)%,与对照组比较差异具有统计学意义(P<0.05)
对照组与OGD1h、2h、3h比较,凋亡比例增加,正常对照组凋亡率为(6.86±0.05)%,OGD1h凋亡率为(14.43±0.20)%、OGD2h凋亡率为(21.99±0.42)%、OGD3h凋亡率为(44.71±0.20)%,差异有统计学意义(P<0.05)
2.4 OGD模型少突胶质细胞TRPC3表达的变化OGD模型少突胶质细胞TRPC3蛋白质水平的Western blot结果见图 3。定量分析发现少突胶质细胞TRPC3蛋白表达量(与内参β- actin 的灰度值比值)对照组中为(0.410±0.0034),处理组中为(0.689±0.0090),二者比较差异有统计学意义(P<0.05)。

|
| 图 3 Western blot 检测OGD少突胶质细胞中TRPC3蛋白表达 1~3:OGD组;4~6:处理组Fig. 3 The expression of TRPC3 in oligodendrocyte exposed to OGD |
MTT结果显示,OGD组细胞活力降为(54.34±6.55)%,处理组细胞活性明显提高为(72.26±5.41)%,差异具有统计学意义(P<0.05)。流式细胞仪测细胞凋亡结果显示,正常对照组凋亡率为(6.23±0.6)%,OGD组凋亡率为(24.24±0.86)%,处理组凋亡率(14.82±0.28)%,差异有统计学意义(P<0.05)(图 4)。处理组细胞活性和凋亡率减少说明TRPC3参与了OGD少突胶质细胞的凋亡。
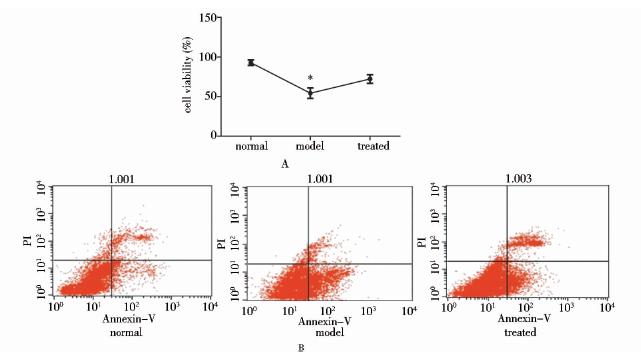
|
| 图 4 MTT和流式细胞仪检测OGD及TRPC3对少突胶质细胞活性及凋亡的影响Fig. 4 The effect of OGD and TRPC3 on oligodendrocyte cell viability and apoptosis *:P<0.05 nomal vs model,model vs treated |
激光共聚焦测钙离子浓度结果显示,正常对照组荧光强度为(28.89±4.43)%,OGD组荧光强度为(58.05±5.80)%、处理组荧光强度为(42.26±5.44)%(图 5A),差异有统计学意义(P<0.05)。流式细胞术测定细胞内钙离子浓度结果显示,正常对照组荧光强度为(4.15±0.65)%,OGD组荧光强度为(23.99±1.22)%,处理组荧光强度为(10.54±0.73)%(图 5B),差异有统计学意义(P<0.05)。两组结果均显示,OGD组细胞内钙水平升高,表现为胞内荧光强度增加,而加入TRPC3阻断剂Pyr3后,胞内钙增加得到显著抑制,说明TRPC3参与了OGD引起的钙内流。
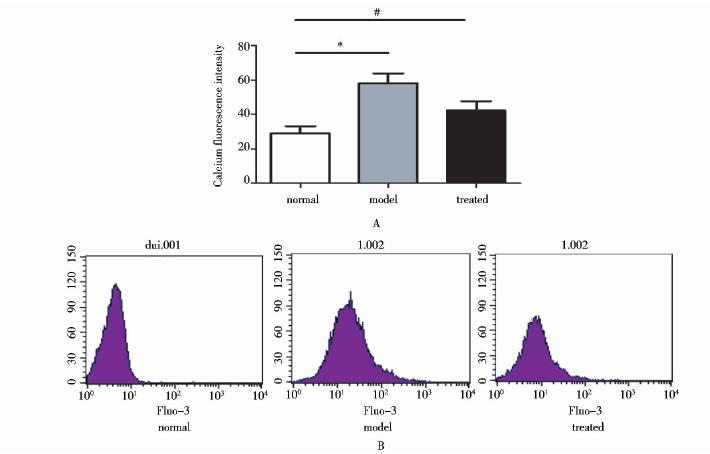
|
| 图 5 激光共聚焦和流式细胞仪检测OGD及TRPC3对细胞内钙的影响Fig. 5 The effect of OGD and TRPC3 on intracellular Ca2+ concentration *:P<0.05 nomal vs model #:P<0.05 model vs treated |
近几十年,胶质细胞生物学的研究已逐渐成为当前神经科学研究的热点[15]。少突胶质细胞是中枢神经系统唯一成髓鞘细胞,其末端扩展成扁平的薄膜,这些薄膜包绕神经元的轴突形成了髓鞘,髓鞘的形成对中枢神经系统起到绝缘、保护和快速传导作用[16]。此外,少突胶质细胞还可分泌神经营养因子如脑源性神经营养因子(brain derived neurophic factor,BDNF)、胰岛素样生长因子-1(insulin like-growth factor-1,IGF-1) 和神经营养因子-3(neurotrophin-3,NT-3)等,这些生长因子对神经元存活和正常生理功能至关重要[17],少突胶质细胞损伤可直接损害神经元功能,导致神经变性性疾病,比如多发性硬化症和其它脑白质营养不良等[18]。少突胶质细胞对各种损伤刺激较敏感,研究表明少突胶质细胞对缺血缺氧损伤较其他胶质细胞敏感,在大脑的某些特定区域甚至比神经元对缺血缺氧损伤更敏感[4]。
原代培养的少突胶质细胞作为一种相对简化的模型,生长发育特征与体内相似,且样本纯度高,实验条件比较恒定且可控[19],在阐明许多疾病的细胞及分子机制方面有着不可替代的作用。本实验体外原代培养了新生SD大鼠少突胶质细胞,培养的少突胶质细胞特异性抗原表达阳性,纯度可达到95%以上。本实验模拟衰老机体的缺血缺氧状态,体外培养少突胶质细胞,采用无糖DMEM培养液代替正常培养液培养细胞,将细胞放入三气培养箱培养相应时间后,更换正常培养液常氧培养24h后,检测细胞凋亡率和细胞活力的改变,比较各组细胞的缺氧程度,确定适合少突胶质细胞的缺血缺氧时间,本实验的结果显示,在缺血缺氧培养2h少突胶质细胞凋亡明显。
目前少突胶质细胞缺血缺氧机制尚不清楚。正常状态下Ca2+参与胞膜生化和电活动过程,对细胞的正常功能有重要的作用[11, 12, 13, 14, 15, 16, 17, 18, 19, 20],钙稳态紊乱是缺氧缺血后神经细胞死亡诸多途径的共同节点[21]。介导外钙内流主要有:电压依赖的和非电压依赖的钙通道两种方式[22],TRPC通道是一类非电压依赖跨膜蛋白,对胞内离子稳态起到重要作用,是维持Ca2+稳态的重要离子通道。TRPC是已知最大的离子通道超家族,哺乳动物TRPC可分为TRPC1、TRPC2、TRPC4/5、TRPC3/6/7四个亚型,TRPC3通道在大脑中广泛表达,研究表明TRPC3异常激活可致神经退行性疾病,但是TRPC3是否参与缺血缺氧少突胶质细胞的损伤,目前并不清楚。
因此本实验首先离体培养大鼠少突胶质细胞,以OGD2h为少突胶质细胞OGD模型,采用TRPC3阻断剂Pyr3阻断TRPC3后,检测少突胶质细胞存活、凋亡的变化以及细胞内钙离子浓度的变化,结果显示阻断TRPC3对OGD少突胶质细胞凋亡具有显著的抑制作用,促进了少突胶质细胞的存活。因此,本实验结果提示TRPC3确是参与了OGD少突胶质细胞内钙超载,促进了OGD引起的少突胶质细胞凋亡,是缺血缺氧损伤中枢神经系统功能的分子机制之一,TRPC3可能成为一种新的神经退行性疾病的防治靶点,但具体的作用机制还有待进一步的研究。本文中对 TRPC3 通道与少突胶质细胞凋亡的关系做了初步探讨,期盼为神经退行性疾病的防治提供新的理论依据和可行的途径。
| [1] | Tang Y,Nyengaard J R,Pakkenberg B,et al.Age-induced white matter changes in the human brain:a stereological investigation.Neurobiol Aging,1997,18(6):609-615. |
| [2] | 张蕾,卢伟,闵琦珵,等.大鼠大脑海马结构内有髓神经纤维髓鞘老年性改变的体视学研究.第三军医大学学报,2010,32(19):2053-2057. Zhang L, Lu W, Min Q, et al. Age-related changes in myelin sheaths of myelinated fibers in rat hippocampus:a stereological study. Acta Academiae Medicinae Militaris Tertiae, 2010,32(19):2053-2057. |
| [3] | Mifsud G,Zammit C,Muscat R,et al.Oligodendrocyte pathophysiology and treatment strategies in cerebral ischemia.CNS Neurosci Ther,2014,20(7):603-612. |
| [4] | McTigue D M,Tripathi R B.The life,death,and replacement of oligodendrocytes in the adult CNS.J Neurochem,2008,107(1):1-19. |
| [5] | McCormack J G.Role of calcium ions in regulation of mammalian intramitochondrial metabolism.Physiol Rev,1990,70(2):391-425. |
| [6] | Orrenius S,Zhivotovsky B,Nicotera P.Regulation of cell death:the calcium-apoptosis link.Nat Rev Mol Cell Biol,2003,4(7):552-565. |
| [7] | Bezprozvanny I.Calcium signaling and neurodegenerative diseases.Trends Mol Med,2009,15(3):89-100. |
| [8] | Marambaud P,Dreses W U,Vingtdeux V.Calcium signaling in neurodegeneration.Mol Neurodegener,2009,4:20. |
| [9] | RA R,DD B,MM M,et al.Ca2+ entry through TRPC channels regulates fibroblast biology in chronic atrial fibrillation.Circulation,2012,126(17):2039-2041. |
| [10] | Cvetkovic-Lopes V,Eggermann E,Uschakov A,et al.Rat hypocretin/orexin neurons are maintained in a depolarized state by TRPC channels.PLoS One,2010,5(12):e15673. |
| [11] | 丁月,肖楚瑶,蒋建敏.瞬时感受器电位通道与疾病[J] .现代生物医学进展,2008,8(12): 2381-2384. Ding Y,Xiao C Y,Jiang J M. Transient receptor potential channel and disease. Progress in Modern Biomedicine,2008,8(12): 2381-2384. |
| [12] | Chen Y,Balasubramaniyan V,Peng J,et al.Isolation and culture of rat and mouse oligodendrocyte precursor cells.Nat Protoc,2007,2(5):1044-1051. |
| [13] | Niu J,Wang L,Liu S,et al.An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells.J Neurosci Methods,2012, 209(1):241-249. |
| [14] | Zhu B,Zhao C,Young F I,et al.Isolation and long-term expansion of functional, myelinating oligodendrocyte progenitor cells from neonatal rat brain.Curr Protoc Stem Cell Biol,2014,31:2D.17.1-2D.17.15. |
| [15] | Cicchetti F,Barker R A. The glial response to intracerebrally delivered therapies for neurodegenerative disorders: is this a critical issue? Front Pharmacol,2014, 5:139. |
| [16] | Cui Q L,Kuhlmann T,Miron V E,et al.Oligodendrocyte progenitor cell susceptibility to injury in multiple sclerosis.Am J Pathol,2013, 183(2):516-525. |
| [17] | Du Y,Dreyfus C F.Oligodendrocytes as providers of growth factors.J Neurosci Res,2002,68(6):647-654. |
| [18] | Kuzdas D,Stemberger S,Gaburro S, et al. Oligodendroglial alpha-synucleinopathy and MSA-like cardiovascular autonomic failure:experimental evidence. Exp Neurol, 2013,247:531-536. |
| [19] | 姜茜,姜玉武,王静敏,等.一种改进的大鼠皮层神经元原代培养方法及其性质鉴定. 北京大学学报(医学版),2009,02:212-216. Jiang X,Jiang Y W,Wang J M,et al.An improved method for primary culture of rat cortical neuron and cell identification.Journal of Peking University(Health Sciences),2009,02:212-216. |
| [20] | 文莉莉,米永杰,陈纯海,等.TRPC3参与电磁辐射致培养的海马神经元凋亡.第三军医大学学报,2013,35(6):491-494. Wen L L,Mi Y J,Chen C H,et al.Electromagnetic irradiation- induced apoptosis in hippocampal neurons through.Journal of Third Military Medical University,2013,35(6):491-494. |
| [21] | 王岩,王莎莉,赵香琴,等.TRPC通道对PC12细胞缺氧缺糖再灌注后氧化损伤的保护作用.中国生物化学与分子生物学报,2014,01:85-92. Wang Y,Wang S L,Zhao X Q,et al. Protective of transient receptor potential canonical on oxygen-glucose deprivation/reperfusion (OGD-R)-induced injury in PC12 cells.Chinese Journal of Biochemistry and Molecular Biology, 2014,01:85-92. |
| [22] | Selvaraj S,Sun Y.TRPC channels and their implication in neurological diseases.CNS Neurol Disord Drug Targets,2010,9(1):94-104. |
 2015, Vol. 35
2015, Vol. 35




