文章信息
- 方世雄, 马义, 沈淑桃, 赵绍军, 洪岸
- FANG Shi-xiong, MA Yi, SHEN Shu-tao, ZHAO Shao-jun, HONG An
- 基因重组TNFα衍生物TRSP10的高效制备及其对DU145细胞抑制作用研究
- Efficient Preparation of TNFα Derivatives TRSP10 and Preliminary Study of Its Inhibitory Effect on Prostate Cancer DU145 Cells
- 中国生物工程杂志, 2015, 35(4): 11-16
- China Biotechnology, 2015, 35(4): 11-16
- http://dx.doi.org/10.13523/j.cb.20150402
-
文章历史
- 收稿日期:2015-01-04
- 修回日期:2015-01-20
TNFα是一种具有多重功能的细胞因子[1],发展至今,在促肿瘤细胞凋亡以及炎症的发生上有较多的研究。参考文献[2]报道:1968年,Granger 和Williams发现一种由T淋巴细胞分泌的可溶性的淋巴毒素。1975年,Carswell等[3]在由内毒素产生的肿瘤的出血性坏死的研究过程中,发现了存在某种物质的血清能导致肿瘤发生出血性坏死的现象,并将这种物质命名为肿瘤坏死因子(tumor necrosis factor,TNF),由此拉开了对TNF研究的序幕。TNF的概念于1984年被分离,是TNFα和TNFβ两种细胞因子的统称,分别由巨噬细胞和T淋巴细胞分泌[4]。
在1985至1988年间,重组TNFα在肿瘤医学上有了广泛的研究,不过因其毒副作用大,在体内半衰期短,癌症病人均表现出非常低的最大耐受剂量,虽然在其后的研究中采用局部多次灌注的方法取得了一定的疗效[5],但仍然暴露出其毒副作用大[6],在体内半衰期短的缺陷。因此在TNFα抗肿瘤治疗的研究过程中,降低或消除其毒副作用、延长其在体内的半衰期,是解决问题的重点和难点。因此,寻找新型高效、低毒的抗肿瘤药物一直是国内外医药研发的热点。抗肿瘤小分子多肽较之蛋白类大分子药物具有分子量小、低毒性、易被吸收等优点[7],且采用基因工程手段合成成本较低,在生产应用上有得天独厚的优势。本研究在立足于TNFα结构与功能,查阅大量相关资料,借助于生物信息学模拟,设计得到TNFα的衍生多肽TRSP10,采用基因工程技术,通过构建基因工程菌,摸索表达纯化的条件,高效稳定制备TRSP10,并重点研究了其在体外对前列腺癌细胞的生物学效应,为后续机制的研究、药物的研发奠定了基础。
1 材料与方法 1.1 菌株、载体、细胞与试剂大肠杆菌ER2566为暨南大学生物医药研究院分子生物学实验室保存;质粒载体pKYB-MCS 购自美国New England Biolabs公司;前列腺癌细胞DU145、PCR purification Kit、Gel Extraction Kit 和Plasmid Miniprep Kit 购自德国Qiagen公司;T4 DNA连接酶购自TaKaRa公司;限制性核酸内切酶NdeI和SapI、Chitin-Beads购自美国New England Biolabs公司;乙腈(HPLC 级) 和甲酸购自美国Tedia公司;三氟乙酸(TFA) 购自美国Merck公司;MTT粉末购自美国SIGMA公司;其他均为国产分析纯试剂。引物合成及DNA测序由华大基因有限公司完成。
1.2 仪器设备高速冷冻离心机(美国赛默飞世尔科技公司);核酸蛋白分析仪(日本日立公司);微量移液器(日本立洋公司);带C18反相柱的HPLC系统(美国Agilent公司);PCR仪(美国BIO-RED 公司)JN-MultiT2.0温控超高压连续流细胞破碎仪(中国广州聚能生物科技有限公司)。
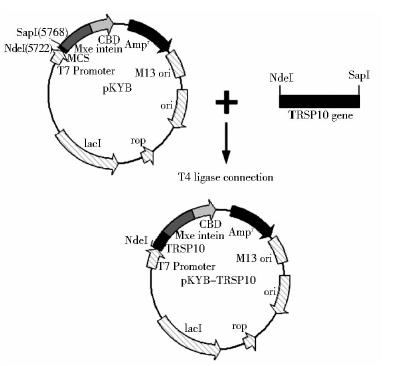
1.3 方 法 1.3.1 重组质粒pKYB-TRSP10的构建与鉴定选用大肠杆菌偏爱密码子分段设计引物,以重叠延伸PCR方法合成TRSP10基因序列,并插入高效表达的质粒载体pKYB-MCS的NdeI和SapI酶切位点之间,从而构建出重组质粒pKYB-TRSP10(图 1),通过CaCl2法制备ER2566感受态细胞,将构建好的重组质粒转入大肠杆菌ER2566,转化菌涂在含有0.1%的氨苄霉素的平板上,挑取单菌落培养12~18h,进而抽提质粒,经双酶切鉴定(图 2),及T7启动子的通用引物加以测序验证(图 3)。
|
| 图 1 重组质粒载体pKYB-TRSP10的构建 Fig. 1 Construction of the recombinant plasmid pKYB-TRSP10 |

|
| 图 2 重组质粒pKYB-trsp10的酶切鉴定Fig. 2 Identification of recombinant plasmid by pKYB-trsp10 enzyme digestion M: High molecular DNA marker;1: Recombinant plasmid pKYB-trsp10 enzyme digestion |

|
| 图 3 目的基因TRSP10的PCR鉴定Fig. 3 PCR identification of TRSP10 gene M:Low molecular DNA marker; 1,2: trsp10 gene amplified by PCR |
构建成功的重组质粒pKYB-TRSP10转化大肠杆菌表达菌ER2566,在含有50mg/ml氨苄霉素的LB培养基中,37℃,150r/min摇菌培养至OD600为0.6~0.8,取1 ml作为阴性对照,向剩余培养液加入IPTG 至终浓度为1 mmol /L,37℃ 180 r/min诱导表达6 h,10 000 r /min 离心10 min,收集菌体,用PBS洗涤一次,50μl上样缓冲液重悬,取10μl进行15%SDS-PAGE 电泳鉴定。在目的蛋白的诱导表达过程中,设置不同的诱导温度(12,17,22,27,32,37℃)、不同的诱导时间(2,4,6,8h)和不同诱导剂IPTG浓度(0.2,0.4,0.6,0.8,1.0mmol/L),进行诱导表达,各取菌液1L,7 000 r/min离心30min,用含有20 mmol/L Tris-HCI,500 mmol/L NaCl,1 mmol/L EDTA,0.1% Triton-X100 的缓冲液中溶解JN-MultiT2.0温控超高压连续流细胞破碎仪进行破碎,破碎产物4℃,15 000 r/min离心30min,取上清进行15%SDS-PAGE电泳分析。
1.3.3 目的肽TRSP10的纯化、制备与鉴定按优化的表达体系进行诱导表达,收集菌体,按m/V =1/10用Buffer 1进行溶解,用JN-MultiT2. 0温控超高压连续流细胞破碎仪进行破碎,破碎产物4℃,15 000r/min离心30min,取上清液过Chirin-Beads柱纯化,整个纯化过程在4℃层析冷柜中进行。用含有20mmol/L Tris-HCI,500mmol/L NaCl,1mmol/L EDTA,40mmol/L DTT的切割缓冲液快速过柱,剩留适量的切割缓冲液与结合融合蛋白的Chitin-Beads 4℃共孵育24h,然后收集切割缓冲液,用截留相对分子质量1 k的透析袋纯水透析。利用HPLC制备的重组肽TRSP10并分析其纯度,分析及制备条件为: 流动相A(5%CNCH3∶ 95%H2O,0.1%TFA),流动相B(100%CNCH3,0.1%TFA),体积流量1.5ml/min,20min线性梯度洗脱,B相至65%,光吸收检测波长为280nm。制备的TRSP10用电泳和ESI-MASS鉴定其分子质量,目的肽样品-20℃保存备用。
1.3.4 MTT法检测TRSP10对前列腺癌细胞DU145增殖的抑制作用前列腺癌细胞DU145复苏后,于体积分数为10%胎牛血清的TRSP10-1640培养基中,放置于37℃、饱和湿度及体积分数为5%的CO2培养箱中培养,每隔2~3天换液,待细胞长满后及时传代。实验过程中,取对数生长状态下的DU145细胞,在96孔细胞培养板上,以100μl/孔的体积接种5000~8000个细胞,过夜放置于培养箱内培养,待其贴壁。在已摸清大致作用浓度的条件下,分别设空白对照组、5μmol/L、10μmol/L、20μmol/L、40μmol/L TRSP10处理组,对照及每个处理均设6个复孔,放置于培养箱中继续培养48h,处理时间结束后,吸去孔内的培养基,缓慢加入40μl已配置好的1×MTT溶液,于培养箱中孵育4~6h后吸去MTT溶液,加入100μl DMSO,待其溶解,酶标仪测OD值(波长570nm,参考波长630nm),测得吸光度A值。
药物对细胞生长抑制率的计算公式: 生长抑制率IR(%)=[1-(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2 结 果 2.1 重组质粒pKYB-TRSP10的鉴定将重组表达菌接种于LB培养基中,培养3h,培养基明显变浑浊时,抽提质粒,双酶切鉴定(图 2),以T7启动子通用引物作为测序引物扩增目的基因(图 3),得到目的片段后由华大基因测序有限公司测序,得到序列结果后,经过Blast后,序列并无碱基错配,确定重组表达质粒pKYB-TRSP10构建成功。
2.2 融合蛋白TRSP10-intein-CBD诱导表达条件的优化 2.2.1 可溶性融合蛋白IPTG诱导表达浓度的确定以1.0mmol/L为IPTG最高诱导表达浓度,0.2mmol/L为间隔浓度,向下设置6个诱导浓度梯度,分别是1.0,0.8,0.6,0.4,0.2,0mmol/L,诱导表达过夜,收集菌体破碎后15 000r/min离心取上清制得样品后经过15% SDS-PAGE分析,结果如图 4所示,经BandScan5.0软件分析,在菌体质量相同的情况下,0.8mmol/L的IPTG诱导菌体表达可溶性融合蛋白的量要明显高于其他各组的结果,因此可以得出0.8mmol/L的IPTG为最佳的诱导剂浓度。

|
| 图 4 IPTG浓度对可溶性融合蛋白诱导表达的影响Fig. 4 Impact of IPTG concentration on the dissoluble fusion protein expression M: Protein marker; 1~6: The supernatant of transformed E. coli induced by IPTG with 0,0.2,0.4,0.6,0.8,1.0 mmol/L IPTG |
以37℃为最高表达温度,5℃为间隔温度,向下设置6个温度梯度,分别是12℃、17℃、22℃、27℃、32℃、37℃,诱导表达过夜,收集菌体破碎后15 000r/min离心取上清制得样品后经过15% SDS-PAGE分析,结果如图 5所示,经BandScan5.0软件分析,在菌体质量相同的情况下,37℃条件下诱导菌体表达可溶性融合蛋白的量要明显高于其他各组的结果,因此可以得出37℃为最佳的诱导温度。

|
| 图 5 温度对可溶性融合蛋白诱导表达的影响Fig. 5 Impact of temperature on the dissoluble fusion protein expression M: Protein marker; 1~6: The supernatant of E. coli induced by IPTG at 37,32,27,22,17,12℃; 7: The supernatant of trnsformed E. coli without IPTG |
以8h为最长表达时间,2h为间隔时间,向下设置4个温度梯度,分别是2h、4h、6h、8h,收集菌体破碎后15 000r/min离心取上清制得样品后经过15% SDS-PAGE分析,结果如图 6所示,经BandScan5. 0软件分析,在菌体质量相同的情况下,8h条件下诱导菌体表达可溶性融合蛋白的量要明显高于其他各组的结果,因此可以得出8h为最佳的诱导温度。

|
| 图 6 时间对可溶性融合蛋白诱导表达的影响Fig. 6 Impact of time on the dissoluble fusion protein expression M: Protein marker; 1~4: The supernatant of transformed E. coli induced by IPTG for 8,6,4,2 h |
从以上实验结果我们可以得出结论:可溶性融合蛋白TRSP10-intein-CBD最佳诱导表达条件为:诱导剂IPTG浓度为0.8 mmol/L、诱导表达温度37℃、诱导表达时间8h。
2.3 小分子目的多肽TRSP10的制备及鉴定依据IMPACT纯化系统,收集可溶性融合蛋白,通过DTT诱导intein,使其发生自剪切行为将目的多肽从亲和标签上洗脱出来。利用HPLC技术对目的多肽进行再纯化,接出相应的峰,冻干后纯度可高达96%,经15% SDS-PAGE分析(图 7)和质谱鉴定(图 8),确定其相对分子质量为3.59kDa,与理论值一致。

|
| 图 7 重组多肽TRSP10的SDS-PAGE鉴定Fig. 7 SDS-PAGE identification of recombinant peptide TRSP10 M: Protein marker; 1: TRSP10 Recombinant peptide after purification |

|
| 图 8 重组多肽TRSP10的质谱鉴定Fig. 8 MS identification of recombinant peptide TRSP10 |
通过40μmol/L TRSP10对DU145细胞做不同时间的处理,检测其细胞抑制率,其中各个时间点处理与阴性对照相比,其P值均小于0.05,实验结果表明,于48h细胞抑制率最高(图 9)。接下来用40μmol/L,20μmol/L,10μmol/L,5μmol/L的4个处理组及阴性,阳性两个对照组作用于DU145前列腺癌细胞48h,其中阴性对照组为未加药组,阳性对照组为10μmol/L TNFα。通过MTT法检测,在以上浓度处理下均对细胞有增殖抑制作用,且各个药物浓度处理与阴性对照处理相比,其P值均小于0.05,差异显著,如表 1所示,说明TRSP10对前列腺癌细胞DU145的增殖有一定的抑制作用。

|
| 图 9 40μmol/L TRSP10处理DU145细胞不同时间的抑制率Fig. 9 Inhibition rate of DU145 cell treated with 40μmol/L TRSP10 in different time |
| 浓度(μmol/L) | 样品数 | 光吸收值 | 抑制率 |
| 阴性对照 | 6 | 0.777±0.020 | 0 |
| 5.0 | 6 | 0.652±0.021* | 11.40% |
| 10.0 | 6 | 0.600±0.023* | 22.97% |
| 20.0 | 6 | 0.509±0.016* | 33.26% |
| 40.0 | 6 | 0.403±0.015* | 48.35% |
| TNFα | 6 | 0.446±0.017* | 42.50% |
| *P<0.05; TRSP10处理组vs阴性对照组 | |||
TNFα是一种被广泛研究的,能发生多种生物学效应的细胞因子[8]。TNFα可以引发炎症反应、免疫反应[9]、肿瘤细胞凋亡等广泛的细胞反应,可以激活多条信号通路起始凋亡。TNFα的受体包括有TNFR1、TNFR2,TNFα的功能主要由TNFR1介导[10],虽然TNFR2与TNFα的亲和力高于TNFR1约5倍,但因为TNFR2主要在免疫细胞表达,且其不含有起始凋亡通路的死亡结构域[11],其凋亡功能主要依赖于TNFR1起作用[12],且有研究表明一些炎性疾病和癌症的发生与其表达量上调有关[13]。在TNFR1上有3个功能域,通过与不同的蛋白相互作用,可以转换不同的细胞内信号,从而起始不同的信号通路[14]。凋亡通路主要依赖于包括TRADD、FADD、JNK、RIP、cPLA2、caspase等凋亡相关的蛋白分子发挥作用[15]。
综上所述,TNFα可通过以上通路使肿瘤细胞发生凋亡,不过由于该细胞因子半衰期短,有较强的毒副作用,有研究表明,在缺血性心脏病及外围血管病变等疾病的发病过程中,TNFR2的表达量明显上调,而TNFR1的表达量没有变化[16]。因此本研究就其半衰期短及毒副作用强的缺陷对其结构进行优化,并通过生物信息学加以验证,得到TNFα衍生物TRSP10。TRSP10是TNFα的一段衍生多肽,能与TNFR1结合,从而保证其能够起始由TNFR1介导的凋亡信号通路;和TNFR2的结合变弱,在一定程度上能够降低TNFα起始的TNFR2通路,从而降低其毒副作用。本研究采用基因工程手段发酵生产TRSP10重组多肽,通过构建TRSP10-pKYB-ER2566重组菌,经过长时间的实验,主要对可溶性融合蛋白IPTG诱导表达浓度、温度、时间等条件进行了摸索,建立一个能够高效稳定表达可溶性蛋白的较为理想的条件,即37℃,0. 8 mmol/L IPTG诱导表达8 h,在后续的纯化过程中,通过对IMPACT系统条件的摸索,确定了DTT诱导蛋白内含肽自切割的条件,形成了一套从载体构建到重组菌表达纯化的工艺技术条件,通过重组表达保证了多肽的活性,而且能够有效地提高多肽制备的效率,更加节约了实验过程中的经济投入,为后续的实验研究奠定了坚实的基础。
本研究在体外主要对前列腺癌细胞DU145进行研究,通过重组表达纯化的多肽TRSP10作用培养的DU145细胞48h,MTT检测发现,重组多肽TRSP10对DU145细胞有明显的增殖抑制作用,这表明重组多肽TRSP10能够抑制DU145细胞的增殖。可通过后续的毒理实验及相关的动物实验,深入探究重组多肽TRSP10对DU145的抑制作用,使其成为治疗前列腺癌的小分子多肽类药物。
| [1] | 李卫,刘佳,白家媛,等. α肿瘤坏死因子的研究进展. 动物医学进展, 2010(12): 108-111. Li W,Liu J,Bai J Y,et al. The research progress of tumor necrosis factor alpha. Animal Medical Progress, 2010(12):108-111. |
| [2] | Idriss H T, Naismith J H. TNF alpha and the TNF receptor superfamily: Structure-function relationship(s). Microscopy Research and Technique, 2000,50(3):184-195. |
| [3] | Carswell E A, Old L J, Kassel R L,et al. An endotoxin-induced serum factor that causes necrosis of tumors. Proceedings of the National Academy of Sciences of the United States of America, 1975,72(9): 3666-3670. |
| [4] | Shalaby M R, Aggarwal B B,Rinderknecht E, et al. Activation of human polymorphonuclear neutrophil functions by interferon-gamma and tumor necrosis factors. Journal of Immunology, 1985,135(3): 2069-2073. |
| [5] | Lejeune F J, Ruegg C, Lienard D. Clinical applications of TNF-alpha in cancer. Current Opinion in Immunology, 1998,10(5): 573-580. |
| [6] | Lienard D, Ewalenko P, Delmotte J J, et al. High-dose recombinant tumor necrosis factor alpha in combination with interferon gamma and melphalan in isolation perfusion of the limbs for melanoma and sarcoma. Journal of Clinical Oncology, 1992,10(1):52-60. |
| [7] | 张冉, 劳兴珍, 郑珩. 抗肿瘤小分子多肽的研究进展. 氨基酸和生物资源, 2012,4: 42-46. Zhang R,Rao X Z, Zheng Y. The research progress of antitumor of small molecular peptides. Aminoacids, and Biological Resources, 2012,4:42-46. |
| [8] | 张钧. 肿瘤坏死因子参与心血管疾病的发生及在治疗中的潜在作用. 心血管病学进展, 2004,1: 32-35. Zhang J. Tumor necrosis factor involved in the occurrence of cardiovascular disease and potential role in treatment. Progress in Cardiovascular Epidemiology, 2004,1:32-35. |
| [9] | Biton J, Boissier M C, Bessis N. TNFalpha: activator or inhibitor of regulatory T cells. Joint Bone Spine, 2012,79(2): 119-23. |
| [10] | Chen G, Goeddel D V. TNF-R1 signaling: a beautiful pathway. Science, 2002,296(5573): 1634-1635. |
| [11] | van Horssen R, Hagen T L M, Eggermont A M M. TNF-alpha in cancer treatment: Molecular insights, antitumor effects, and clinical utility. Oncologist, 2006,11(4): 397-408. |
| [12] | Gupta S. A decision between life and death during TNF-alpha-induced signaling. Journal of Clinical Immunology, 2002,22(4):185-194. |
| [13] | Carpentier I, Coornaert B, Beyaert R. Function and regulation of tumor necrosis factor receptor type 2. Current Medicinal Chemistry, 2004,11(16):2205-2212. |
| [14] | Ding W X, Yin X M. Dissection of the multiple mechanisms of TNF-alpha-induced apoptosis in liver injury. Journal of Cellular and Molecular Medicine, 2004,8(4):445-454. |
| [15] | Sethu S, Melendez A J. New developments on the TNFalpha-mediated signalling pathways. Biosci Rep, 2011,31(1):63-76. |
| [16] | Benjafield A V, Wang X L, Morris B J. Tumor necrosis factor receptor 2 gene (TNFRSF1B) in genetic basis of coronary artery disease. Journal of Molecular Medicine, 2000,79(2-3):109-115. |
 2015, Vol. 35
2015, Vol. 35




