文章信息
- 房战, 徐美娟, 饶志明, 满在伟, 许正宏, 耿燕, 陆茂林
- FANG Zhan, XU Mei-juan, RAO Zhi-ming, MAN Zai-wei, XU Zheng-hong, GENG Yan, LU Mao-lin
- 过量表达钝齿棒杆菌柠檬酸合酶编码基因prpC2对L-精氨酸合成的影响
- Cloning, Expressing of the prpC2 Gene Encoding Citrate Synthase from Corynebacterium crenatum and Its Effect on L-arginine Synthesis
- 中国生物工程杂志, 2015, 35(3): 49-55
- China Biotechnology, 2015, 35(3): 49-55
- http://dx.doi.org/10.13523/j.cb.20150307
-
文章历史
- 收稿日期:2014-12-31
- 修回日期:2015-01-29
2. 江南大学药学院 无锡 214122;
3. 江苏省微生物研究所有限公司 无锡 214063
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China;
3. Jiangsu Institute of Microbiology Corporation Limited, Wuxi 214063, China
L-精氨酸是鸟氨酸循环中的重要代谢物,作为人类的一种非必需氨基酸,对维持正常的机体有重要作用,且在食品、药物、化妆品方面有重要的应用[1]。在过去的20年里,人们已经开始使用微生物如谷氨酸棒状杆菌(Corynebacterium glutamicum)、嗜乙酰乙酸棒杆菌(Corynebacterium acetoacidophilum)来生产精氨酸[2]。C. crenatum SYPA5-5是本实验室在土样中筛选到的一株钝齿状、无芽胞的精氨酸高产菌株,经逐级诱变后,5L发酵罐产精氨酸水平达30.6g/L[3],并通过基因工程手段对精氨酸合成代谢途径从葡萄糖到精氨酸进行了一系列改造。例如,卢妍等[4]在C. crenatum SYPA5-5中对EMP途径中的关键酶丙酮酸激酶进行克隆表达及酶学性质研究以提高精氨酸产量;在C. crenatum SYPA5-5中对精氨酸合成途径中的关键酶argB、argH在大肠杆菌中进行克隆表达和酶学性质研究,并在C. crenatum SYPA5-5中加强表达,精氨酸产量比原始菌有所提高[5, 6];在C. crenatum SYPA5-5中加强表达N-乙酰鸟氨酸转氨酶,重组菌发酵精氨酸产量达39.7g/L,与对照相比提高了14.7%[7];在C. crenatum SYPA5-5中过量表达精氨酸合成关键酶基因簇argC~H,发酵精氨酸产量达45.9g/L,与原始菌相比提高了26.5%[8];定点突变改造精氨酸合成关键酶N-乙酰谷氨酸激酶以解除精氨酸反馈抑制,5L发酵罐发酵过程中,精氨酸产量达45.6g/L[9]。
研究中心代谢途径对精氨酸合成影响的报道很少,本实验室研究了EMP途径改造对精氨酸合成的影响[4]。Becker等[10]报道过从代谢流分析的角度考虑,TCA循环的代谢改造是提高氨基酸产量的重要方法,如提高谷氨酸产量[11]。柠檬酸合酶(citrate synthase,CS; EC 2. 3. 3. 5)作为TCA途径的关键酶,催化乙酰CoA与草酰乙酸生成柠檬酸。柠檬酸合酶酶活及表达量的调节是一个关键的酶反应调节,因为柠檬酸合酶位于TCA循环的入口及草酰乙酸节点处,草酰乙酸节点对谷氨酸和赖氨酸的合成很重要[12],国内外研究柠檬酸合酶对氨基酸产量的影响多集中在赖氨酸、柠檬酸[13, 14]。有研究报道赖氨酸合成受到草酰乙酸到柠檬酸代谢流变化的影响,减弱草酰乙酸到柠檬酸的代谢流可使赖氨酸产量增加[15, 16]。在C. crenatum SYPA5-5精氨酸发酵过程中,赖氨酸是最主要的氨基酸副产物,然而本实验研究过敲除lysC基因不能提高精氨酸的产量,反而使得谷氨酸到精氨酸的合成能力降低,因此,通过研究柠檬酸合酶过量表达以调节精氨酸与代谢副产物赖氨酸合成方向代谢流。
钝齿棒杆菌是一株高耗氧、高产精氨酸菌株,在发酵精氨酸过程中,高通量的TCA循环途径可为精氨酸合成提供ATP和辅酶NADPH,且TCA代谢直接与精氨酸合成前体谷氨酸相关,这对研究精氨酸的合成非常重要。柠檬酸合酶处于草酰乙酸的关键节点处且是TCA循环中第一个关键酶,可调节TCA循环速率及碳代谢流。Chen等[17]报道在研究谷氨酸合成最佳基本模式中,柠檬酸-异柠檬酸节点是一个影响谷氨酸合成的关键节点并且可以影响谷氨酸产率。本研究克隆来自C. crenatum SYPA5-5柠檬酸合酶的编码基因prpC2,并将其在C. crenatum SYPA5-5中加强表达,对重组钝齿棒杆菌C. crenatum SYPA5-5/pDXW-10-prpC2进行5L发酵罐发酵产精氨酸分析,同时对发酵液中其它氨基酸、有机酸进行测定分析。根据细胞体内精氨酸生物合成途径,作出C. crenatum SYPA5-5胞内从葡萄糖到精氨酸合成的简图,如图 1所示。
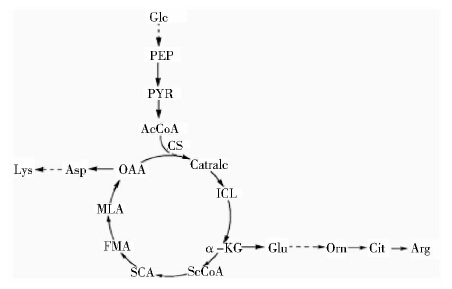
|
| 图 1 钝齿棒杆菌胞内葡萄糖到精氨酸合成简图 Fig. 1 The intracellular arginine biosynthesis from glucose in C. crenatum SYPA5-5A Glc: Glucose; PEP: Phosphoenolpyruvate; PYR: Pyruvate; CS: Citrate synthase; OAA: Oxaloacetate; ICL: Isocitrate; α-KG: α-oxoglutarate; Glu: Glutamate; Orn: Ornithine; Cit: Citrulline; Arg: Arginine; ScCoA: Succinyl-CoA; SCA: Succinate; FMA: Fumarate; MLA: Malate; Asp: Aspartate; Lys: Lysine |
钝齿棒杆菌C. crenatum SYPA5-5为课题组筛选诱变获得,E. coli JM109为研究室保藏,克隆载体pMD18-T购自TaKaRa公司,表达载体pDXW-10由江南大学食品科学与技术国家重点实验室王小元教授惠赠,重组质粒pDXW-l0-prpC2、pMD18-T-prpC2为本研究构建。
1.2 主要试剂与培养基质粒小量提取试剂盒、胶回收试剂盒、抗生素、PCR引物、草酰乙酸等购于上海生工生物工程有限公司。乙酰CoA购于Sigma公司;PCR相关酶,EcoRI、SacI,DL2000等购自TaKaRa公司;其他试剂为国产分析纯。丙烯酰胺、甲叉双丙烯酰胺(American Promega Corporation)、广范围蛋白质分子质量标准购自Fermentas公司。PCR仪购自BioRad公司;移液枪、电转仪购自Eppendorf公司;离心机购自Sigma公司;5L发酵罐购自上海保兴生物设备工程有限公司。
LB培养基(g/L):Tryptone 10、Yeast Extract 5、NaC1 10,pH 7.0;
LBG培养基(g/L):Tryptone 10、Yeast Extract 5、NaC1 10、葡萄糖5,pH 7.0;
感受态培养基(g/L):Tryptone 10、Yeast Extract 5、NaC1 10、Glycine 5、Tween 80 1,pH 7.0;
种子培养基(g/L):葡萄糖30、玉米浆20、(NH4)2SO4 20、尿素1.5、KH2PO4 1、MgSO4·7H2O 0.5,pH 7.0;
发酵培养基(g/L):葡萄糖150(分消)、玉米浆40、生物素8×10-5、L-组氨酸5×10-4、(NH4)2SO4 20、KH2PO4 1.5、MgSO4·7H2O 0.5、FeSO4·7H2O 0.02、MnSO4·H2O 0.02,pH 7.0。
1.3 柠檬酸合酶基因prpC2的克隆及表达载体pDXW-10-prpC2的构建C. crenatum SYPA5-5的遗传背景尚不清楚,但经16S rDNA鉴定,发现其与谷氨酸棒杆菌ATCC13032同源性达99.4%,因此,根据NCBI谷氨酸棒杆菌ATCC13032的全基因组核酸序列中柠檬酸合酶的基因序列(NCBI Reference Sequence: NC_006958.1),设计了柠檬酸合酶编码基因prpC2的引物,并在上游引物中引入合成的SD序列:
P1:CGCGAATTCAAAGGAGGGAAATCATGTCCAGCGCCACAACCAC (EcoRI)
P2:CGCGAGCTCTTAGCGCTTTTCAATGGGCGCG(SacI)
提取C. crenatum SYPA5-5染色体DNA为模板,PCR扩增获得目的基因片段prpC2,PCR扩增条件为:94℃预变性1min,94℃变性1min;56℃退火1min,72℃延伸1.5min,30个循环;72℃延伸10min。所得基因片段经胶回收后与克隆载体pMD18-T连接,转化E. coli JM109,经过氨苄青霉素抗性平板筛选,挑取阳性转化子。阳性转化子经上海Sangon公司测序,经测序验证正确的重组质粒命名为T-prpC2。用EcoRI和SacI对测序正确的重组质粒T-prpC2和表达载体pDXW-10进行双酶切,然后胶回收经双酶切的prpC2基因和pDXW-10载体,连接后转化E. coli JM109,筛选阳性转化子,单双酶切验证,得到重组表达载体pDXW-l0-prpC2。采用电击转化法[18]将重组表达载体pDXW-l0-prpC2电转到C. crenatum SYPA5-5中,在卡那霉素终浓度为30μg/ml的固体LBG平板上培养36h后筛选阳性转化子[19],并对阳性转化子进行单双酶切验证,验证正确后得到重组菌C. crenatum SYPA5-5/pDXW-10-prpC2。
1.4 柠檬酸合酶在钝齿棒杆菌中的表达将经验证正确的重组菌C. crenatum SYPA5-5/pDXW-10-prpC2接种至含有30μg/ml卡那霉素的LBG液体培养基中30℃,160r/min过夜培养,次日以1%的接种量转接至50ml LBG液体培养基中30℃培养16h。将发酵液于10 000r/min 4℃离心15min,收集菌体,用10mmol/L PBS Buffer (pH 7.4)洗涤2次,然后悬浮于50mmol/L Tris-HCl Buffer (pH 7.5)中。采用超声波细胞破碎法破碎细胞(300W,工作3s停7s,工作时间为10min),15 000r/min 4℃离心30min,所得上清液用于胞内柠檬酸合酶比酶活的测定和SDS-PAGE分析。
1.5 柠檬酸合酶酶活力的测定柠檬酸合酶酶活力是通过5,5′-二硫代双(2-硝基苯甲酸)在412nm下的吸光值测定的[14],柠檬酸合酶催化草酰乙酸与乙酰CoA生成柠檬酸和CoA,5,5′-二硫代双(2-硝基苯甲酸)与CoA反应以改变其在412nm下的吸光值。1ml反应体系含有Tris-HCl Buffer (pH 8.0),93mmol/L;乙酰-CoA,0.16mmol/L;草酰乙酸,0.2mmol/L;5,5′-二硫代双(2-硝基苯甲酸),0.1mmol/L;适量的酶液。酶活力单位定义为每分钟每毫克蛋白质转化1mmol/L底物所需的酶量。
1.6 重组钝齿棒杆菌的精氨酸发酵培养重组钝齿棒杆菌C.crenatum SYPA5-5/pDXW-10-prpC2经LBG液体培养基活化后,按10%的接种量转接至150ml种子培养基中,于30℃,转速为160r/min培养24h后在5L发酵罐上进行放大试验,装液量为2.5L,转速为600r/min,通气量为3L/min,30℃培养至糖耗尽,发酵过程中跟踪检测细胞浓度OD562nm、OD520nm及残糖含量。
1.7 发酵液中氨基酸、还原糖、有机酸的测定细胞浓度通过对发酵液的稀释,测定细胞OD562nm。残糖浓度测定参考文献[20]利用SBA-40B生物传感分析仪。精氨酸等氨基酸含量的测定利用氨基酸自动分析仪。发酵液中有机酸含量的测定参照文献[21]采用高效液相色谱法。
2 结果与讨论 2.1 钝齿棒杆菌prpC2基因的克隆及表达载体pDXW-10-prpC2的构建以C. crenatum SYPA5-5DNA为模板,P1、P2为引物进行PCR,获得大小约为1 152bp的基因片段prpC2(图 2),与克隆载体pMD18-T连接后测序,结果表明,C. crenatum SYPA5-5的prpC2基因与C. glutamicum ATCC13032的prpC2基因同源性为98.7%,相差5个氨基酸。将T-prpC2与pDXW-10进行EcoRI、SacI双酶切,胶回收prpC2基因和pDXW-10载体,连接后转化E. coli JM109,挑取阳性转化子,经LB培养后提取质粒,EcoRI、SacI单双酶切所提取质粒进行酶切验证及PCR验证(图 3),得到大小约为8 351bp和1 152bp大小片段,对应pDXW-10和prpC2的大小,证明重组表达载体pDXW-10-prpC2构建成功。
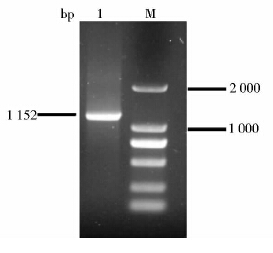
|
| 图 2 prpC2基因的扩增 Fig. 2 Fig. 2 PCR amplification of prpC2 gene M: DL2 000 marker; 2: PCR products |
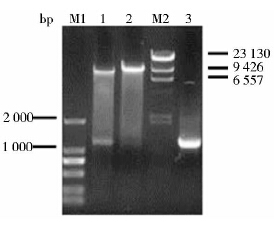
|
| 图 3 重组质粒pDXW-10-prpC2的酶切验证及PCR验证 Fig. 3 Enzyme digestion and PCR analysis of the recombinant plasmid pDXW-10-prpC2 M1: DL2 000 marker; 1: pDXW-10-prpC2/EcoRI+ SacI; 2: pDXW-10-prpC2/ EcoRI; M2: λ-Hind III marker; 3: PCR product |
将验证正确的重组表达载体pDXW-10-prpC2电转到C. crenatum SYPA5-5构建重组菌C. crenatum SYPA5-5/pDXW-10-prpC2,在卡那霉素终浓度为30μg/ml的固体LBG平板上长出单菌落,挑取阳性转化子于LBG培养,提取质粒经单双酶切验证正确,即得到重组菌C. crenatum SYPA5-5/pDXW-10-prpC2。采用超声破碎法破碎重组菌细胞与对照菌细胞,12%的SDS-PAGE显示,重组菌C. crenatum SYPA5-5/pDXW-10-prpC2样品与对照菌C. crenatum SYPA5-5样品相比,在大小约为42kDa处有明显条带(图 4),与prpC2基因测序后推算的蛋白质大小一致;酶活测定分析经超声破碎后重组菌粗酶液中的酶活为25.28U/mg,约为对照菌株酶活的5.37倍(表 1),表明柠檬酸合酶基因prpC2在重组菌C. crenatum SYPA5-5/pDXW-10-prpC2得到过量表达。
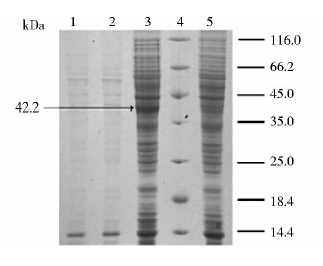
|
| 图 4 柠檬酸合酶的SDS-PAGE分析 Fig. 4 SDS-PAGE analysis of citrate synthase from C.crenatum SYPA 5-5 1:The fermentation sediment from C. crenatum SYPA5-5/pDXW-10-prpC2; 2: The fermentation sediment from C. crenatum SYPA5-5; 3:C. crenatum SYPA5-5/pDXW-10-prpC2 cell extract; 4: Protein marker; 5:C. crenatum SYPA5-5 cell extract |
| Enzyme | Total activity (U/ml) | Total protein (mg/ml) | Specific activity (U/mg) |
| C. crenatum SYPA5-5 | 18.41 | 3.91 | 4.71 |
| C. crenatum SYPA5-5/pDXW-10-prpC2 | 66.23 | 2.62 | 25.28 |
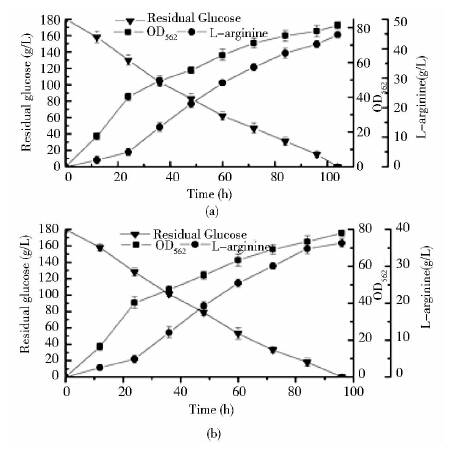
5L发酵罐同时发酵重组菌C. crenatum SYPA5-5/pDXW-10-prpC2与对照菌C. crenatum SYPA5-5,在发酵期间取样测定细胞浓度、葡萄糖及精氨酸产量,并绘制发酵曲线(图 5),由图 5可知,发酵96h结束时,原始菌C. crenatum SYPA5-5发酵液中精氨酸产量为36.3g/L;重组菌C. crenatum SYPA5-5/pDXW-10-prpC2发酵96h,残糖还有约15g/L,精氨酸产量为41.5g/L,提高了14%,发酵104h结束时,重组菌的精氨酸产量积累到44.7g/L,与原始菌C. crenatum SYPA5-5的36.3g/L相比,产量约提高了23.1%,即prpC2过量表达使发酵后期产率还维持在一个较高的水平,发酵104h可以提高至44.7g/L。重组菌与原始菌细胞浓度曲线表明prpC2的过量表达对细胞的生长几乎没有影响。
|
| 图 5 C. crenatum SYPA5-5/pDXW-10-prpC2(a)和C. crenatum SYPA5-5(b)5L发酵罐发酵曲线比较 Fig. 5 Comparison of fermentation process curve between C. crenatum SYPA5-5/pDXW-10-prpC2(a) and C. crenatum SYPA5-5 (b) |
根据以前研究可知,C. crenatum SYPA5-5菌株在5L发酵罐中发酵精氨酸的最多副产物是赖氨酸,被柠檬酸合酶催化生成柠檬酸的催化底物草酰乙酸是赖氨酸合成的重要前体,且有研究表明草酰乙酸-柠檬酸-异柠檬酸途径的代谢调控影响赖氨酸合成[22]。为进一步研究过量表达柠檬酸合酶对精氨酸发酵副产物赖氨酸及其他氨基酸和有机酸的影响,发酵精氨酸结束后测定发酵液中有机酸和氨基酸浓度。测定结果见表 2。
| 氨基酸(g/L) | C. crenatum SYPA5-5 | C. crenatum SYPA5-5/pDXW-10-prpC2 | 有机酸 (g/L) | C. crenatum SYPA5-5 | C. crenatum SYPA5-5/pDXW-10-prpC2 |
| 精氨酸 | 36.3±1.3 | 44.7±1.5 | α-酮戊二酸 | 0.13±0.02 | 0.11±0.02 |
| 谷氨酸 | 0.82±0.05 | 0.93±0.05 | 柠檬酸 | 0.06±0.01 | 0.09±0.03 |
| 赖氨酸 | 5.96±0.5 | 1.21±0.3 | 异柠檬酸 | 0.58±0.05 | 0.79±0.07 |
| 鸟氨酸 | 0.48±0.03 | 0.36±0.04 | 草酰乙酸 | 0.05±0.01 | 0.01±0.005 |
| 瓜氨酸 | 1.03±0.06 | 0.98±0.06 | 乙酸 | 0.14±0.01 | 0.15±0.01 |
| 甘氨酸 | 0.20±0.02 | 0.17±0.02 | 乳酸 | 0.05±0.01 | 0.07±0.01 |
| 丙氨酸 | 0.18±0.02 | 0.21±0.02 | |||
| 异亮氨酸 | 1.32±0.3 | 1.11±0.3 | |||
| 苯丙氨酸 | 0.05±0.01 | 0.07±0.01 |
发酵液中氨基酸的测定结果表明,重组菌发酵液的精氨酸含量为44.7g/L,相较于出发菌的精氨酸的浓度提高最为明显,比出发菌的36.3g/L约提高了23.1%,柠檬酸合酶过量表达增强了由草酰乙酸生成柠檬酸代谢途径,钝齿棒杆菌是一株高产精氨酸菌株,在加强表达柠檬酸合酶后,精氨酸产量明显提高。与原始菌赖氨酸浓度5.96g/L相比,重组菌发酵液赖氨酸浓度明显下降,只有1.21g/L。大量研究表明柠檬酸合酶表达及酶活力降低可增加赖氨酸浓度[23, 24],因此,柠檬酸合酶在重组菌C. crenatum SYPA5-5/pDXW-10-prpC2过量表达及其比酶活的提高影响了重组菌中TCA循环代谢流,使赖氨酸合成代谢流减弱,最终在减少代谢主要副产物赖氨酸浓度的同时提高了精氨酸产量。在钝齿棒杆菌中其他主要的与TCA循环相关的氨基酸副产物,如谷氨酸、鸟氨酸、瓜氨酸、异亮氨酸浓度也有相应变化,但是几乎没有受到柠檬酸合酶过量表达的影响。
发酵液中有机酸测定结果表明,发酵结束时,prpC2过量表达提高了精氨酸合成所需的TCA循环中间代谢物的浓度,如柠檬酸、异柠檬酸的浓度,重组菌发酵液中柠檬酸浓度为0.09g/L,比出发菌的0.06g/L提高了0.03g/L;异柠檬酸含量为0.79g/L,比出发菌的0.58g/L提高了0.21g/L。C. glutamicum突变株高产谷氨酸,通过异柠檬酸脱氢酶碳通量从20%上升到36%[25]。异柠檬酸上游的TCA循环关键酶是柠檬酸合酶,通过柠檬酸合酶过量表达调节谷氨酸合成途径上游的柠檬酸-异柠檬及草酰乙酸代谢流以研究其对精氨酸合成的影响。柠檬酸,异柠檬酸作为TCA循环中间代谢物被利用以参与胞内细胞代谢过程,因而积累量不高,但其浓度的提高表明柠檬酸合酶的过量表达提高了TCA循环在柠檬酸-异柠檬酸节点处的代谢强度从而提高精氨酸产量;以草酰乙酸为催化底物的prpC2过量表达减少了草酰乙酸的浓度,检测胞外草酰乙酸浓度仅为0.01g/L,与出发菌0.05g/L相比明显减少,草酰乙酸浓度的减少也解释了以其为前体合成的赖氨酸浓度的降低。
3 结 论本研究以高产精氨酸菌株C. crenatum SYPA5-5作为出发菌株,克隆其柠檬酸合酶基因prpC2,构建重组质粒pDXW-10-prpC2,将重组质粒转化入C. crenatum SYPA5-5,构建重组钝齿棒杆菌C. crenatum SYPA5-5/pDXW-10-prpC2。重组菌中柠檬酸合酶比酶活为25.28 U/mg,比出发菌株比酶活提高了5.37倍。由此可知,柠檬酸合酶在C. crenatum SYPA5-5/pDXW-10-prpC2中得到了过量表达。
对重组菌株和出发菌进行5L发酵罐发酵实验,与原始菌相比,重组菌C. crenatum SYPA5-5/pDXW-10-prpC2中L-精氨酸的最高产量为44.7g/L,提高了23.1%;发酵主要副产物赖氨酸为1.21g/L,与原始菌5.96g/L相比,下降了约80%。柠檬酸合酶是催化草酰乙酸合成柠檬酸的关键酶,过量表达柠檬酸合酶后,加强了从草酰乙酸到柠檬酸的碳源通量,重组菌的柠檬酸、异柠檬酸等精氨酸中间代谢产物产物都有不同程度地增加,草酰乙酸通过高表达的柠檬酸合酶转变为精氨酸中间产物柠檬酸、异柠檬酸等,赖氨酸碳源通量相应地会减少,使赖氨酸副产物降低。
| [1] | Lu C D. Pathways and regulation of bacterial arginine metabolism and perspectives for obtaining arginine overproducing strains. Appl Microbiol Biotechnol, 2006, 70 (3):261-272. |
| [2] | Utagawa T. Production of arginine by fermentation. J Nutr, 2004, 134(10 suppl):2854-2867. |
| [3] | Xu M, Rao Z, Xu H, et al. Enhanced production of L-arginine by expression of vitreoscilla hemoglobin using a novel expression system in Corynebacterium crenatum. Appl Biochem Biotechnol, 2011, 163 (6):707-719. |
| [4] | 卢妍, 饶志明, 徐美娟, 等. 钝齿棒杆菌丙酮酸激酶的克隆表达及其对精氨酸合成的扰动影响. 中国生物工程杂志, 2014, 34 (3):48-55. Lu Y, Rao Z M, Xu M J, et al. Cloning, expression of the pyruvate kinase gene from Corynebacterium crenatum and its effect on L-arginine synthesis. China Biotechnology, 2014, 34 (3):48-55. |
| [5] | 刘飞. 钝齿棒杆菌N-乙酰谷氨酸激酶编码基因argB的克隆表达研究. 无锡:江南大学,生物工程学院, 2008. Liu F. Cloning and expression of N-acetylglutamate kinase gene from Corynebacterium crenatum. Wuxi:Jiangnan University School of Biotechnology, 2008. |
| [6] | 饶志明, 徐美娟, 陆元修, 等. 钝齿棒杆菌精氨酸琥珀酸酶编码基因argH的克隆表达及其重组菌发酵产精氨酸研究. 中国生物工程杂志, 2010, 30 (9):49-55. Rao Z M, Xu M J, Lu Y X, et al. Clong, expression and analysis of the argH gene encoding argininosuccinate lyase from Corynebacterium crenatum. China Biotechnology, 2010, 30 (9):49-55. |
| [7] | 徐美娟, 张显, 饶志明, 等. 钝齿棒杆菌N-乙酰鸟氨酸转氨酶的克隆表达分析及其重组菌的精氨酸发酵. 生物工程学报, 2011, 27 (7):1013-1023. Xu M J, Zhang X, Rao Z M, et al. Cloning, expression and characterization of N-Acetylornithine aminotransferase from Corynebacterium crenatum and its effects on L-arginine fermentation. Chinese Journal of Biotechnology, 2011, 27 (7):1013-1023. |
| [8] | Xu M J, Rao Z M, Yang J, et a1. Heterologous and homologous expression of the arginine biosynthetic argC-H cluster from Corynebacterium crenatum for improvement of L-arginine production. J Ind Microbiol Biotechnol, 2012, 39 (3):495-502. |
| [9] | Xu M J, Rao Z M, Dou W F, et a1. Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production. Amino Acids, 2012, 43 (1):255-266. |
| [10] | Becker J, Klopprogge C, Schroder H, et al. Metabolic engineering of the tricarboxylic acid cycle for improved lysine production by Corynebacterium glutamicum. Appl Environ Microbiol, 2009, 75 (24):7866-7869. |
| [11] | Marx A, Striegel K, de Graaf A A, et al. Response of the central metabolism of Corynebacterium glutamicum to different flux burdens. Biotechnol Bioeng, 1997, 56 (2):168-180. |
| [12] | Wiegand G, Remington S J. Citrate synthase: structure, control, and mechanism. Annu Rev Biophys Biophys Chem, 1986, 15:97-117. |
| [13] | Radmacher E, Eggeling L. The three tricarboxylate synthase activities of Corynebacterium glutamicum and increase of L-lysine synthesis. Appl Microbiol Biotechnol, 2007, 76 (3):587-595. |
| [14] | Buch A D, Archana G, Kumar G N. Enhanced citric acid biosynthesis in Pseudomonas fluorescens ATCC 13525 by overexpression of the Escherichia coli citrate synthase gene. Microbiol, 2009, 155(8):2620-2629. |
| [15] | Wittmann C, Heinzle E. Genealogy profiling through strain improvement by using metabolic network analysis: metabolic flux genealogy of several generations of Lysine-producing corynebacteria. Appl Environ Microbiol, 2002, 68 (12):5843-5859. |
| [16] | Tosaka O, Yoshihara Y, Ikeda S, et al. Production of L-lysine by fluoropyruvate-sensitive mutants of Brevibacterium lactofermentum. Agric BioL Chem, 1985, 49 (5):1305-1312 |
| [17] | Chen N, Du J, Liu H, et al. Elementary mode analysis and metabolic flux analysis of L-glutamate biosynthesis by Corynebacterium glutamicum. Ann Microbiol, 2009, 59 (2):317-322. |
| [18] | Kirchner O, Tauch A. Tools for genetic engineering in the amino acid-producing bacterium Corynebacterium glutamicum. J Biotechnol, 2003, 104 (1/3):287-299. |
| [19] | Yin L, Hu X, Xu D, et al. Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum. Metab Eng, 2012, 14 (5):542-550. |
| [20] | 王镜岩, 沈同. 生物化学. 第三版. 北京: 高等教育出版社, 2001:78-278. Wang J Y, Shen T. Biochemistry. 3ed. Beijing: High Education Press, 2001:78-278. |
| [21] | 徐美娟. 钝齿棒杆菌SYPA5-5发酵产L-精氨酸的代谢工程改造. 无锡: 江南大学, 生物工程学院, 2012. Xu M J. Metabolic engineering of Corynebacterium crenatum SYPA5-5 for the L-arginine production. Wuxi: Jiangnan University, College of Bioteehnology, 2012. |
| [22] | Ohnishi J, Hayashi M, Mitsuhashi S, et al. Efficient 40℃ fermentation of L-lysine by a new Corynebacterium glutamicum mutant developed by genome breeding. Appl Microbiol Biotechnol, 2003, 62 (1):69-75. |
| [23] | Radmacher E, Eggeling L. The three tricarboxylate synthase activities of Corynebacterium glutamicum and increase of L-lysine synthesis. Appl Microbiol Biotechnol, 2007, 76 (3):587-595. |
| [24] | Shiio I, Ozaki H, Ujigawa-Takeda K. Production of aspartic acid and lysine by citrate synthase mutants of Brevibacterium flavum. Agric Biol Chem, 1982, 46 (1):101-107. |
| [25] | Marx A, Striegel K, de Graaf AA, et al. Response of the central metabolism of Corynebacterium glutamicum to different flux burdens. Biotechnol Bioeng, 1997, 56 (2):168-180. |
 2015, Vol. 35
2015, Vol. 35




