文章信息
- 李小鑫, 高明昊, 张苗苗, 刘晓晨, 乔长晟
- LI Xiao-xin, GAO Ming-hao, ZHANG Miao-miao, LIU Xiao-chen, QIAO Chang-sheng
- 溶解氧对γ-聚谷氨酸合成的影响
- Effect of Dissolved Oxygen on γ-PGA Fermentation
- 中国生物工程杂志, 2015, 35(3): 42-48
- China Biotechnology, 2015, 35(3): 42-48
- http://dx.doi.org/10.13523/j.cb.20150306
-
文章历史
- 收稿日期:2014-10-08
- 修回日期:2014-12-31
2. 天津北洋百川生物技术有限公司 天津 300457
2. Tianjin Peiyang Biotrans Company Limited, Tianjin 300457, China
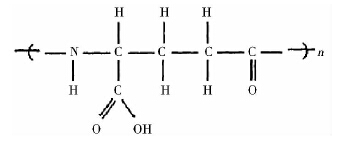
γ-聚谷氨酸(γ-PGA)是一种天然存在的,由L型和D型谷氨酸两种单体通过γ-酰胺键连接起来的均聚氨基酸,其结构式见图:
γ-PGA具有极佳的成膜性、成纤维性、阻氧性、可塑性、黏结性、保湿性和可生物可降解等许多独特的物理和化学特性,无毒、无害,对人体无任何不良反应[1, 2, 3, 4]。然而,不同立体化学组成的γ-PGA有着不同的应用领域。例如,γ-PGA中含有大量L-谷氨酸,由于其对皮肤兼容性好的特点,可以作为化妆品材料;在一些领域,γ-PGA中高含量D-谷氨酸不断被消耗,这是我们有必要调整γ-PGA的立体化学成分,以满足不同应用领域的需求[5]。
至今,国内外学者对γ-PGA的合成机制进行了大量研究[6],但其合成机制尚未明了。溶解氧是好氧发酵中一个很重要的发酵参数,可以通过它来监控整个发酵过程中菌体的生长情况和发酵过程的好坏。溶解氧在发酵过程中受通气量、转速、发酵液性质、罐压等诸多因素影响。控制好溶解氧,摸索清楚菌体在发酵过程中好氧情况,适当增加或是降低溶解氧会让发酵产量大大提升。
近10年来,基因组尺度代谢网络模型发展十分迅速,构建方法和工具也逐渐成熟,已经有很多高质量的代谢网络模型发表。代谢通量平衡研究是一个对细胞功能代谢有价值的工具[7]。在枯草芽孢杆菌CGMCC 0833的碳代谢途径中提出了该菌对葡萄糖和谷氨酸的利用情况[8]。在目前的工作中,我们主要通过测量地衣芽孢杆菌副产物的积累及关键酶的活性,计算γ-PGA的合成速率,研究细胞生长和γ-PGA生产的控制策略,可能会发现一个经济有效的γ-PGA生产方法。
1 材料与方法 1 材料与方法 1.1 材 料 1.1.1 主要仪器摇床:SKY-2102(上海苏坤实业有限公司);酶标仪:Sunrise(瑞士TECAN);生物传感仪:SBA-40E(山东省科学院生物研究所);高效液相色谱仪:1200系列(美国Agilent);PCR仪:Tct5(上海领成);台式冷冻离心机:1-14K(德国Sigma)。
1.1.2 菌株所用菌种为地衣芽孢杆菌(Bacillus licheniformis CGMCC3336)(由本研究组筛选得到并保存在天津科技大学工业微生物重点实验室)。
1.1.3 培养基斜面保藏培养基为LB培养基(g/L):蛋白胨 10,酵母粉5,NaCl 10,琼脂20,pH 7.0,每个月转代一次。
种子培养基(g/L):酵母膏7,胰蛋白胨10,葡萄糖30,K2HPO4·H2O 0.5,MgSO4·7H2O 0.5,pH 7.2±0.1。于121℃灭菌20min。
发酵培养基(g/L):葡萄糖 80,谷氨酸钠 80,酵母膏 20,NaCl 10,NH4NO3 4.1,MgSO4·7H2O 0.5,CaCl2 1,FeSO4 0.01,pH 7.2±0.1。于121℃灭菌20min。
1.2 方 法 1.2.1 种子液制备接一环培养好的斜面种子于500ml挡板瓶中,装液量50ml,37℃、220r/min培养16h至对数生长期,制得种子液。
1.2.2 5L罐发酵培养5L罐发酵装液量为3L,接种量10%,培养条件400r/min、37℃、通风量1∶1vvm,发酵时间72h。
1.2.3 菌体浓度由1ml发酵液稀释25倍采用752s UV-Vis分光光度计在660nm 处测得吸光光度值表示。
1.2.4 酶活的分析不同时间的发酵液,利用离心机在4℃,2 500g离心20min获得菌体,利用磷酸盐缓冲液(pH=7.0)洗涤两次后,向沉淀中添加5ml磷酸盐缓冲液,DNA酶25μl,溶菌酶300μl,在37℃条件下震荡30min,然后利用离心机在4℃ 14 000g离心20min,得到的上清液为细胞裂解液,用于酶活检测。葡萄糖激酶,六磷酸葡萄糖脱氢酶,异柠檬酸脱氢酶、谷氨酸脱氢酶和丙酮酸脱氢酶活性依前文所述方法[9, 10]。
随着发酵过程的进行,γ-PGA不断积累、菌体不断生长、发酵液黏度不断增大、氧的体积传递系数不断降低,溶解氧的不足导致将发酵结束,通过提高通风量或搅拌转速可以达到提高溶解氧从而达到提高产量的目的。溶解氧对微生物自身生长的影响体现在多个方面,其中对微生物酶的影响是不可忽略的重要因素。本文研究的初始发酵条件为:初始转速300r/min,通风量4.5L/min,恒定pH 7.2,通过调节转速控制溶解氧分别恒定在10%、30%、60%三个梯度,考察该菌在5L发酵罐上不同溶解氧对菌体生长、聚谷氨酸的积累,以及葡萄糖激酶、6-磷酸葡萄糖脱氢酶、丙酮酸脱氢酶、异柠檬酸脱氢酶和谷氨酸脱氢酶的活性的影响。
1.2.5 聚谷氨酸含量的测定水解法:将发酵液离心(10 000r/min,10min),去除菌体。取上清液5ml,加入20ml的无水乙醇进行醇沉,重新溶解到5ml的蒸馏水中,然后进行二次醇沉。取固体80℃烘干至恒重后得到聚谷氨酸粗品,将聚谷氨酸粗品用蒸馏水溶解,定容5ml,过滤。然后对滤液用6mol/LHCI(体积比1∶1,于水解管中密封)120℃水解16h,水解前后的D-/L-谷氨酸单体含量通过高效液相色谱法检测,采用Crownpak CR(+)/CR(-)手性柱(大赛璐),流动相为pH 2.0的高氯酸水溶液,利用紫外检测器测量计算得到。水解前后谷氨酸含量之差即为纯聚谷氨酸含量,每组实验重复三次。
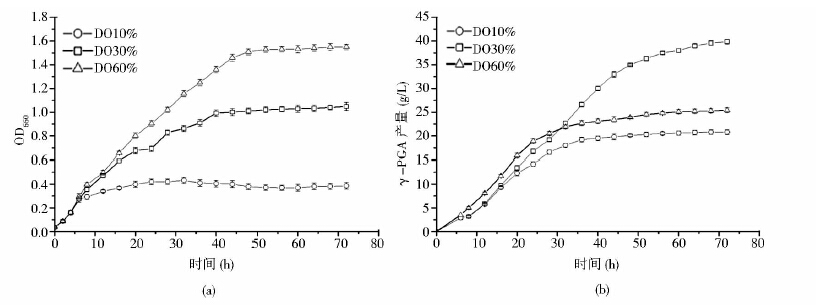
2 结果与讨论 2.1 不同溶解氧水平对菌体浓度和γ-PGA产量的影响从图 1中可以看出,在控制溶解氧60%条件下,菌体生长较快,前期γ-PGA积累速率较快,后期积累速率缓慢,在发酵结束时γ-PGA的产量也明显低于控制溶解氧30%条件组;控制溶解氧10%组,菌体生长和γ-PGA的积累速率均低于其他两个对照组,由于γ-PGA的积累与菌体生长是部分偶联的关系,所以较低的菌体量不能够使γ-PGA大量积累;溶解氧30%组,发酵结束时,γ-PGA的产量最大。可见当菌体浓度积累到一定的程度就能够正常高效的合成γ-PGA,过高的菌体浓度只会使营养物质浪费,不能有效提高γ-PGA的积累;相反过低的菌体浓度也不利于γ-PGA的高效积累。
|
| 图 1 溶解氧对γ-PGA发酵的影响 Fig. 1 The influence on the fermentation of γ-PGA under different Do conditions (a)Cell growth under different DO conditions (b)γ- PGA production curve under different DO conditions |
研究发现,γ-PGA的合成与菌体的生长有关,所以需考虑菌体生长和产物合成的主要代谢途径,物料平衡方程中需考虑菌体的合成。文献报道,地衣芽孢杆菌当葡萄糖进入菌体后主要通过EMP、HMP和TCA三个途径进行代谢。基于以下几点假设构建代谢网络:
(1)细胞内的中间代谢产物均处于拟稳态,即瞬间浓度变化速率为0;
(2)地衣芽孢杆菌中NADPH和NADH能相互转化,并且不需要能量,NADH和FADH2都可以通过电子传递链生成ATP;
(3)在各发酵阶段,所有生化反应的化学计量均不发生变化(生物量合成反应化学计量关系也不变),无分支的代谢途径可简化成一步反应;
(4)谷氨酸、γ-PGA、柠檬酸的转运均耗能;
(5)不考虑γ-PGA分支中L-谷氨酸和D-谷氨酸的来源差别,γ-PGA聚合过程可简化为:1 Glu+1 AT P=1 PGA。
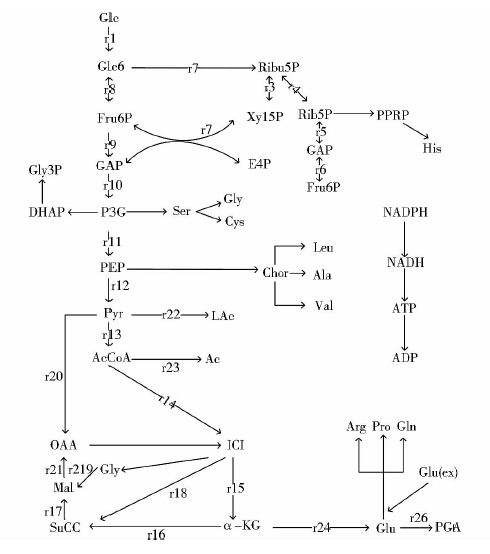
基于上述假设,同时参考KEGG网站上的资源以及其他有关地衣芽孢杆菌代谢的研究资料,B.licheniformis CGMCC3336的代谢网络图如图 2所示。
|
| 图 2 γ-PGA的生物合成途径 Fig. 2 γ-PGA biosynthesis metabolic network Glc:Glucose;Glc6P:Glucose,6-phosphate;Ribu5P:Ribulose,5-phosphate;Xyl5P:Xylulose;Rib5P:Ribose6-hosphate;Sed7P:Sedoheptose,6-phosphate;E4P:Erythrose;Fru6P: Fructose-6-phosphate;GAP:Glyceraldehyde,3-phosphate;P3G:Glycerate,3-phosphat;PEP:Phosphoenolpyruvic acid; Pyr:Pyruvic acid; AcCoA:Acetyl-CoA; OAA:Oxalacetic acid;α-KG:α-Ketoglutaric acid; Glu:Glutamic acid; Lac:Lactic acid; Ac:Acetic acid; ICI:Citric acid; GLY: Glyoxylic acid; Mal: Maleic acid; SuCC: Succinic acid;α-PGA |
根据代谢网络图以及各步反应的化学计量平衡式,可以得出各反应速率具有以下计量关系,代谢通量方程式如表 1所示:
| Metabolites | Metabolic flux equations | Metabolites | Metabolic flux equations |
| Glc6 | r1-r2-r8=0 | Pyr | r12-r22-r13-r20=0 |
| Ribu5P | r2-r3-r4=0 | AcCoA | r13-r23-r14=0 |
| Xyl5P | r3-r5-r7=0 | OAA | r20-r14-r21=0 |
| Rib5P | r4-r5=0 | ICI | r14-r15-r18=0 |
| Seq7P | r5-r6=0 | α-KG | r15-r16-r26=0 |
| E4P | r6-r7=0 | NADH | r10+r13+r16-r21-r22=0 |
| GAP | 2r9-r10+r5+r7-r6=0 | GLY | r18-r19=0 |
| Fru6P | r8-r9+r6+r7=0 | SuCC | r18+r16-r17=0 |
| P3G | r10-r11=0 | NADPH | 2r2+r15-r24=0 |
| PEP | r11-r12=0 |
可以观察出地衣芽孢杆菌发酵合成γ-PGA的代谢网络,自由度为5,需测定5 步反应速率就可确定芽短梗霉代谢网络的流量分配。在γ-PGA的发酵过程中葡萄糖的消耗速率 r1、乳酸的生成速率 r22、乙酸生成速率 r23、Glu 消耗速率 r25和γ-PGA的生成速率r26,以此为已知参量,代入上述代谢速率平衡方程组,利用 MATLAB 软件下的linprog函数求得代谢流分布。
该代谢网络主要由以下几个部分组成。
(1)糖酵解途径(EMP):该途径主要包括r8、r9、r10、r11、r12、r13和r14共7个反应;
(2)磷酸戊糖途径(HMP):包括r2、r3、r4、r5、r6、r7共6个反应;
(3)三羧酸循环(TCA):主要包括r15、r16和r17共3个反应;
(4)谷氨酸合成:r24。
(5)外源谷氨酸摄取:r25。
(6)γ-PGA合成:r26。
2.4 不同溶解氧代谢流分析根据不同条件下菌体的的生长曲线,发酵中后期菌体浓度变化均不大,符合拟稳态假设理论。分别测定出地衣芽胞杆菌CGMCC 3336不同溶解氧条件下,发酵时间为(8h、32h、56h)发酵液中的菌体干重、葡萄糖、乙酸、乳酸、谷氨酸和γ-PGA的细胞外浓度,计算各自的消耗或积累速率,研究代谢网络中在该阶段的代谢流分布状况。结果见表 2。
| 途径 | 8h | 32h | 56h | ||||||
| 10% | 30% | 60% | 10% | 30% | 60% | 10% | 30% | 60% | |
| EMP | 8.425 2 | 9.423 8 | 11.471 1 | 2.893 2 | 8.999 9 | 9.371 9 | 1.158 6 | 2.653 9 | 9.321 2 |
| HMP | 1.901 8 | 1.489 6 | 5.158 3 | 1.001 8 | 1.184 2 | 4.952 9 | 0.553 0 | 1.205 9 | 3.024 8 |
| TCA | 2.805 0 | 3.260 0 | 4.640 0 | 2.957 3 | 3.623 6 | 3.785 9 | 1.024 6 | 1.279 3 | 1.606 3 |
| 谷氨酸合成 | 0.176 8 | 0.258 0 | 0.920 8 | 0.745 8 | 1.493 0 | 0.302 2 | 0.112 4 | 0.593 4 | 0.138 2 |
| 谷氨酸消耗 | 2.216 0 | 9.369 0 | 9.998 6 | 1.946 4 | 6.342 1 | 7.342 3 | 2.216 0 | 1.890 3 | 1.974 9 |
| γ-PGA合成 | 0.57 | 7.87 | 9.52 | 0.50 | 9.21 | 8.05 | 0.41 | 7.21 | 0.29 |
进入菌体的葡萄糖经EMP途径,1分子葡萄糖将被转化为2分子丙酮酸,HMP途径主要为菌体的生长和产物合成提供前体和还原力,三羧酸循环(TCA)主要为菌体生长代谢提供ATP和还原力,综合表 2数据,谷氨酸合成通量和外源谷氨酸摄取通量对γ-PGA的合成通量有直接影响,EMP和TCA通量的提高能为菌体利用外源谷氨酸提供能力,间接提高外源谷氨酸摄取通量。
控制溶解氧10%、30%、60%的条件下在发酵8h、32h、56h时的主要代谢途径通量见表 2。发酵8 h时三组实验菌体处于高速生长阶段,此段时间内菌体需要大量的生物合成前体,因此8 h时EMP途径的通量分别达到了8.425 2 mmol/(gDW·h)、9.423 8 mmol/(g DW·h)、11.471 1 mmol/(g DW·h)。此时谷氨酸合成通量较低,主要依靠外源味精摄合成γ-PGA。发酵32h,溶解氧30%组相比于其他两组谷氨酸合成通量与外源谷氨酸摄取通量均维持一个较高的水平,分别达到1.493 0mmol/(g DW·h)、6.342 1mmol/(g DW·h),能够很好地促进γ-PGA的积累。谷氨酸发酵56h时菌体生长几乎停止,EMP和HMP途径的通量均处于比较低的水平,但是56 h时γ-PGA合成通量并没有明显的降低是由于谷氨酸合成通量得到提高且用于γ-PGA合成的谷氨酸与用于菌体合成的谷氨酸的比例得到了提高。
不同时间、不同条件下r1、r2、r13、 r15、r24这5个代谢反应通量的变化尤为重要。为了更好的分析γ-PGA的生物合成途径,需要测量以上5个代谢途径的关键酶的活性。
2.5 关键酶活性对代谢途径和γ-PGA生产速中的影响如图 2所示,葡萄糖先经过EMP途径进入TCA循环提高己糖激酶、异柠檬酸脱氢酶、丙酮酸脱氢酶,有助于提高EMP途径及TCA循环通量的增加,谷氨酸脱氢酶可以促进合成γ-PGA前体的形成所以能够相应的使γ-PGA生产速率增加;6-磷酸葡萄糖脱氢酶使6-磷酸葡萄糖经过催化生成6-磷酸葡萄糖酸,进入磷酸戊糖途径,经过磷酸戊糖途径最后生成3-磷酸甘油醛及6-磷酸果糖,后二者还可重新进入糖酵解途径而进行代谢。6-磷酸葡萄糖脱氢酶活性的增加,提高了磷酸戊糖途径的通量,造成碳源的损失,不利用γ-PGA的合成。
在图 3、表 3中可以看出,8h与32h处控制溶解氧60%组己糖激酶、异柠檬酸脱氢酶、丙酮酸脱氢酶、谷氨酸脱氢酶、6-磷酸葡萄糖脱氢酶的活性都高于其他两个实验组,与此对应的γ-PGA的积累速率也高于其他两组,在8h时,γ-PGA的生产速率达到1.15,但是后期积累速度明显降低,在32h时γ-PGA的积累速率仅有0.275。控制溶解氧60%的条件下,γ-PGA积累量并不高,其原因是:一方面较高的丙酮酸脱氢酶和异柠檬酸脱氢酶的活性虽然能在一段时间内提高γ-PGA的生产速率,但是在利用丙酮酸脱氢酶与异柠檬酸脱氢酶进行催化反应的的同时,也释放了大量的二氧化碳,使碳源损失;另一方面,较高的6-磷酸葡萄糖脱氢酶使磷酸戊糖途径的代谢通量增加,损失了大量合成γ-PGA的前体物质,造成γ-PGA的最终产量也较低。控制溶解氧10%条件下,以上几种酶活性均较低,可能由于溶解氧不足,氧不足的情况下不能为菌体代谢提供足够的能量,导致以上关键酶活性均较低,抑制了关键反应途径的速率,且细胞进行无氧呼吸,产生乳酸,浪费碳源,使γ-PGA合成情况不理想。

|
| 图 3 γ-PGA合成的相关酶的活性 Fig. 3 Related enzyme of γ-PGA synthesis activity determination (a) Related enzyme of γ-PGA synthesis activity determination at 8h (b)Related enzyme of γ-PGA synthesis activity determination at 32h (c)Related enzyme of γ-PGA synthesis activity determination at 56h.G6Pd:Glucose-6-phosphate dehydrogenase; GDH:Glutamate dehydrogenase; ICDH:Isocitric dehydrogenase; PDH:Pyruvate dehydrogenase |
| Production efficiency [g/(L·h)] | |||
| DO(%) | 8h | 32h | 56h |
| 60 | 1.15 | 0.9 | 0.275 |
| 30 | 0.75 | 0.875 | 0.925 |
| 10 | 0.7 | 0.6125 | 0.325 |
在发酵得到的γ-PGA中,含有一部分的D-型谷氨酸,而在发酵前期只添加了L-型谷氨酸,所以合成γ-PGA中很大部分的D-/L-谷氨酸是菌体自身合成的,因此,提高谷氨酸脱氢酶的活性对γ-PGA的生产效率有直接影响,与之相比,控制溶解氧30%的条件下,以上5种酶活的在一个比较适中的范围内且谷氨酸脱氢酶活性始终维持在0.15U/mg左右,有助于γ-PGA的积累,最终产量达到39.9g/L。
3 结 论研究不同溶解氧水平对γ-PGA合成的影响,结果表明提高己糖激酶、谷氨酸脱氢酶活性,并适当的提高丙酮酸脱氢酶、异柠檬酸脱氢酶活性,能够适当的增加EMP途径通量和TCA循环通量,并且降低6-磷酸葡萄糖脱氢酶的活性从而减少磷酸戊糖途径的通量。希望今后能够通过以上方法在保证γ-PGA合成效率的基础上,达到高效经济生产γ-PGA的条件。
| [1] | Hara T, Ueda S.Regulation of polyglutamate production in Bacillus subtilis (natto): transformation of high PGA productivity.Agricultural and Biological Chemistry,1982,46(9):2275-2281. |
| [2] | Kubota H, Matsunobu T, Uotani K, et al.Production of poly (γ-glutamic acid) by Bacillus subtilis F-2-01.Bioscience, Biotechnology, and Biochemistry,1993,57(7):1212-1213. |
| [3] | Thorne C B, Gómez C G, Noyes H E, et al.Production of glutamyl polypeptide by Bacillus subtilis.Journal of Bacteriology,1954,68(3):307. |
| [4] | Troy F A.Chemistry and biosynthesis of the poly (γ-d-glutamyl) capsule in Bacillus licheniformis I. properties of the membrane-mediated biosynthetic reaction.Journal of Biological Chemistry,1979,254(14):6262-6269. |
| [5] | Hamano Y. AminoAcid Homopolymers Occuring in Nature//Microbiology Monographs:Vol15. Berlin:Springer, 2010:1923,3334. |
| [6] | Ashiuchi M, Kamei T, Misono H.Poly-γ-glutamate synthetase of Bacillus subtilis.Journal of Molecular Catalysis B: Enzymatic,2003,23(2):101-106. |
| [7] | Dauner M, Bailey J E, Sauer U.Metabolic flux analysis with a comprehensive isotopomer model in Bacillus subtilis.Biotechnology and Bioengineering,2001,76(2):144-156. |
| [8] | Zhu F, Cai J, Wu X, et al.The main byproducts and metabolic flux profiling of γ-PGA-producing strain B. subtilis ZJU-7 under different pH values. J Biotechnol,2013,164(1):67-74. |
| [9] | Shimizu H, Tanaka H, Nakato A, et al.Effects of the changes in enzyme activities on metabolic flux redistribution around the 2-oxoglutarate branch in glutamate production by Corynebacterium glutamicum.Bioprocess and Biosystems Engineering,2003,25(5):291-298. |
| [10] | Hasegawa T, Hashimoto K I, Kawasaki H, et al.Changes in enzyme activities at the pyruvate node in glutamate-overproducing Corynebacterium glutamicum.Journal of Bioscience and Bioengineering,2008,105(1):12-19. |
 2015, Vol. 35
2015, Vol. 35




