文章信息
- 袁佩佩, 曹伟佳, 王震, 张博文, 陈可泉, 李艳, 欧阳平凯
- YUAN Pei-pei, CAO Wei-jia, WANG Zhen, ZHANG Bo-wen, CHEN Ke-quan, LI Yan, OUYANG Ping-kai
- 大肠杆菌产L-苯丙氨酸发酵调控及代谢通量分析
- Regulation on L-phenylalanine Fermentation by Escherichia coli and Its Metabolic Flux Analysis
- 中国生物工程杂志, 2015, 35(3): 25-34
- China Biotechnology, 2015, 35(3): 25-34
- http://dx.doi.org/10.13523/j.cb.20150304
-
文章历史
- 收稿日期:2015-01-05
- 修回日期:2015-01-26
L-苯丙氨酸是一种芳香族氨基酸,是人体内必需的八大氨基酸之一。L-苯丙氨酸可以用作食品、饲料添加剂及某些医药的中间体[1]。其中,L-苯丙氨酸广泛应用于甜味剂阿斯巴甜的合成[2]。L-苯丙氨酸的生产方法主要有酶法和微生物发酵法[3]。由于酶的稳定性差、酶和底物成本高,酶法在工业生产中的运用受到了很大的限制[4]。微生物发酵法具有原料廉价易得、环境污染小、产物纯度高等特点[5],受到国内外研究者的关注。近年来,为了提高L-苯丙氨酸的产量和收率,人们大多专注于有关微生物发酵产L-苯丙氨酸的发酵策略优化[6]以及产L-苯丙氨酸菌株的基因工程改造[7]的研究。但是,基于代谢通量分析的微生物发酵产L-苯丙氨酸的调控手段很少有文献报道。
代谢通量分析(MFA)是一种专门对代谢途径通量进行测定分析的方法,可定量描述代谢网络中各个支路的通量分配关系,有助于分析目的产物合成过程的关键节点和理解细胞的代谢调控机制[8]。潘军华等[9]通过添加乙酸盐、生物素、泛酸盐等对 FP094 菌株中由磷酸烯醇式丙酮酸、丙酮酸和草酰乙酸构成的“三角区”进行扰动,定性分析了此扰动对赖氨酸合成所需前提物代谢流量的调节机制,从而提高赖氨酸的产量。Underwood等[10]的研究表明,添加TCA 循环中间产物可以促进大肠杆菌KO11的生长和乙醇的生成,提高了乙醇得率和生产强度。
微生物发酵法制备L-苯丙氨酸的过程主要是将 EMP途径中得到的PEP和HMP途径得到的E4P经由莽草酸途径生成L-苯丙氨酸;该过程涉及的关键酶主要有己糖激酶、葡萄糖-6-磷酸脱氢酶、丙酮酸激酶、丙酮酸脱氢酶等;而中间代谢产物、维生素B1和硫酸镁等对某些酶起到激活或抑制的作用。Akshay等[11]的研究表明,柠檬酸对乙酸的生成和丙酮酸激酶起一定的抑制作用;Waygood等[12]的研究表明,琥珀酰辅酶A对丙酮酸激酶起一定的抑制作用;Sanwal[13]的研究表明,镁离子能激活葡萄糖-6-磷酸脱氢酶。
本文根据大肠杆菌YP1617利用葡萄糖作为碳源合成L-苯丙氨酸的代谢网络,从代谢通量角度分析,考察外源添加中间代谢产物、维生素B1和硫酸镁对大肠杆菌YP1617发酵产L-苯丙氨酸及代谢通量分布的影响,并分析说明其影响机制,为优化发酵过程控制提供参考。
1 材料与方法 1.1 菌 种本实验使用菌株为L-酪氨酸营养缺陷型菌株大肠杆菌YP1617,现保藏于中国典型培养物保藏中心 (保藏号: CCTCC M 2013320)。
1.2 培养基种子培养基 (g/L): 蛋白胨10、酵母粉 5、NaCl 5、硫酸卡那霉素 0.04 (过滤除菌),自然pH,121℃灭菌15min。
分批发酵培养基 (g/L): 葡萄糖 45 (分消)、MgSO4 3、KH2PO4 3、NaCl 1、(NH4)2SO4 5、CaCl2·2H2O 0.015、FeSO4·7H2O 0.112 5、柠檬酸三钠 1、酵母粉 10、L-酪氨酸 0.3、维生素B1 0.075 (过滤除菌)、硫酸卡那霉素 0.04 (过滤除菌)、微量元素 (TES) 1.5ml/L (分消),pH=7.00,121℃灭菌15min。
TES(g/L): Al2(SO4)3·18H2O 2、CoSO4·7H2O 0.75、CuSO4·5H2O 2.5、H3BO3 0.5、 MnSO4·7H2O 24、Na2MoO4·2H2O 3、NiSO4·6H2O 2.5、ZnSO4·7H2O 15。
补料分批发酵初始培养基 (g/L): 葡萄糖 20 (分消),其余与分批发酵培养基相同。
1.3 培养方法种子培养: 种子用500ml的三角瓶培养,装液量50ml,接种量2%,于37℃、200r/min摇床培养8h。
分批发酵: 在1.4L级联发酵罐中进行,装液量0.7L,接种量7%,pH由20%的氨水控制在7.0±0.2,温度37℃,初始转速200r/min,通气量0.7vvm,DO降至10%通过提高转速维持在10%左右,当培养基中葡萄糖耗尽,此时DO迅速上升,发酵终止。
补料分批发酵: 在1.4L级联发酵罐中进行,装液量0.5L,接种量10%,pH由20%的氨水控制在7.0±0.2,温度37℃,初始转速和通气量为200r/min、0.5vvm,DO降至10%通过提高转速和通气量来维持在10%左右。当初始培养基中葡萄糖耗尽(发酵10~12h)时,补加700g/L的葡萄糖控制糖浓度在5g/L左右并且以0.003g/h恒速流加L-酪氨酸,发酵72h。
1.4 分析方法细胞干重测量[14]:称出干燥10ml离心管重量(G1),取4ml发酵液置于离心管中,8 000r/min离心10min,弃上清液;再用4ml蒸馏水清洗2次,离心,于60℃烘箱中干燥至恒重后称重(G2),则菌体干重(g/L)=(G2-G1)/4。
葡萄糖测定:采用SBA-40C生物传感仪(山东省科学院生物研究所,济南,山东)。
O2和CO2测定:采用S-000118905尾气分析仪(Infors AG,Bottmingen,Switzerland)。
乙酸和L-苯丙氨酸测定:采用高效液相色谱法(安捷伦1290 Infinity LC 系统),色谱柱为Prevail有机酸分析柱(5μm,250nm×4.6mm,Grace,USA),以25mmol/L KH2PO4(pH通过磷酸调至2.5)为流动相,流速1ml/min,进样体积20μl,柱温25℃,利用紫外检测器检测,波长为215nm。
1.5 代谢通量计算方法细胞大分子物质 (糖、蛋白质、脂类) 进行分解代谢和合成代谢,涉及的代谢网络非常复杂。要建立一个完整的网络是比较困难的,因此常根据所研究的系统进行简化处理。根据相关文献[14, 15]及发酵产物,建立了Escherichia coli YP1617以葡萄糖作为碳源,合成L-苯丙氨酸的代谢网络 (图 1),主要包括EMP、HMP、TCA循环、氧化磷酸化、维持消耗及生物量的合成途径。在建立网络模型时做了以下假设和简化处理:①细胞中的中间代谢物处于拟稳态,在整个反应中不积累;②只考虑主要中心碳代谢反应的物流平衡;③忽略培养基中有机氮源对细胞合成通量的贡献;④HMP途径是产生NADPH的主要途径,产生的NADPH全部用于生物合成;⑤P/O假设为1.5,NADH、FADH2、ATP供需平衡;⑥没有支路的代谢反应合并为一个反应;⑦Escherichia coli YP1617细胞组成,单一化为CH1.93O0.55N0.25P0.021统一处理。简化后的代谢网络包括27个代谢反应方程(表 1)。
根据拟稳态假设求解通量,即假设细胞内的中间代谢物浓度变化速率为 0,有 Ar=X,其中,A 为胞内代谢反应计量系数矩阵 (n×m),r 为代谢反应速率向量 (m×1),X为代谢物净积累速率向量 (n×1),m 与n 分别为反应方程和代谢中间体的个数[16]。整个代谢网络包含27个代谢反应,其中中间代谢物为23个,自由度为4;可测速率有 6 个,即葡萄糖消耗速率、乙酸生成速率、L-苯丙氨酸生成速率、细胞生成速率、O2吸收速率、CO2生成速率。根据中间产物代谢平衡方程(表 2)列出矩阵A。由于可测定的速率大于自由度,该系统为超定系统,可用最小二乘法求得简单解,利用 MATLAB软件线性规划求得代谢分布。在代谢通量的计算中,均以 100mmol/(g DCW·h) 的葡萄糖为计算基准,所有代谢通量r的单位均为mmol/(g DCW·h)[17]。
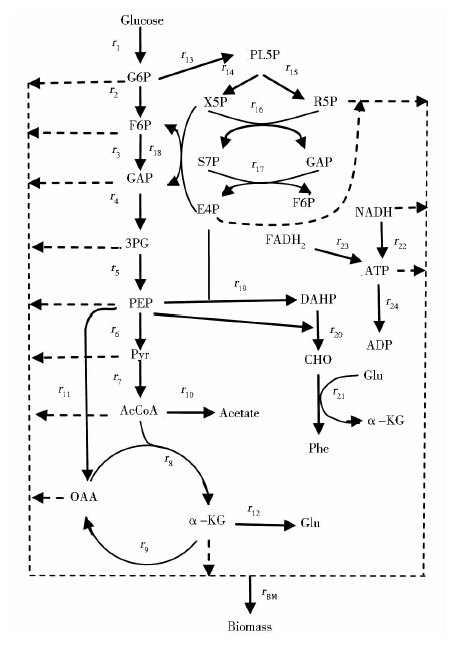
|
| 图 1 大肠杆菌YP1617的代谢途径 Fig. 1 Metabolic pathway of Escherichia coli YP1617 |
| NO. | Metabolic reactions |
| Glycolysis pathway | |
| r1 | Glucose + ATP= G6P+ ADP |
| r2 | G6P= F6P |
| r3 | F6P+ ATP= 2GAP+ADP |
| r4 | GAP+ NAD+ +Pi + ADP= 3PG + NADH + ATP |
| r5 | 3PG =PEP+ H2O |
| r6 | PEP+ ADP+Pi =Pyr + ATP |
| TCA cycle | |
| r7 | Pyr + CoASH + NAD+ = AcCoA + CO2 + NADH |
| r8 | AcCoA + OAA + H2O + NAD+ = CoASH + α-KG + NADH + CO2 |
| r9 | α-KG + FAD + ADP+Pi + 2NAD+ + H2O = OAA + CO2 + FADH2 + ATP+ 2NADH |
| r10 | AcCoA + ADP+Pi + H2O = Acetate + ATP+ CoA-SH |
| Amphibolic reactions | |
| r11 | PEP+ CO2 + H2O + ATP= OAA + ADP+ Pi |
| Glutamate formation | |
| r12 | NH3 + α-KG + NADPH = Glu + H2O + NADP+ |
| athway | |
| r13 | G6P+ 2NADP+ H2O = RL5P+ CO2 + 2NADPH |
| r14 | RL5P= X5P |
| r15 | RL5P= R5P |
| r16 | X5P+ R5P= S7P+ GAP |
| r17 | S7P+ GAP= F6P+ E4P |
| r18 | X5P+ E4P= F6P+ GAP |
| Aromatic amino acid biosynthesis | |
| r19 | E4P+ PEP= DAHP+ Pi |
| r20 | PEP+ DAHP+ NADPH + ATP= CHO + NADP+ + ADP+ 3Pi+ H2O |
| r21 | CHO + Glu = Phe + α-KG + H2O + CO2 |
| Oxidative Phosphorylation P/O=1.5 | |
| r22 | NADH + 0.5O2 + 1.5ADP+ 1.5Pi = NAD+ + 1.5ATP |
| r23 | FADH2 + 0.5O2 + 0.75ADP+ 0.75Pi = FAD + 0.75ATP |
| ATP Consumption for Maintenance | |
| r24 | ATP= ADP+Pi |
| Biomass synthesis: CH1.93O0.55N0.25P0.021 | |
| rBM | 1.782ATP+ 0.036NAD+ +0.135NADPH+ 0.021G6P+ 0.007F6P+ 0.063R5P+ 0.036E4P+ 0.013GAP+ 0.134 3PG + 0.051 PEP+ 0.083Pyr + 0.293AcCoA + 0.148OAA + 0.087α-KG = 0.293CoASH + 1.782ADP+ 1.782Pi + 0.036NADH + 0.135NADP+0.168CO2 + Biomass |
| Note: G6P: Glucose-6-phosphate; F6P: Fructose-6-phosphate; GAP: Glyceraldehyde-3-phosphate; 3PG: 3-Phosphglycerate; PEP: Phosphoenolpyruvate; Pyr: Pyruvate; AcCoA: Acetyl CoA; α-KG: α-Ketoglutarate; OAA: Oxaloacetate; Glu: Glutamate; RL5P: Ribulose-5-phosphate; X5P: Xylulose-5-phosphate; R5P: Ribose-5-phosphate; S7P: Sedoheptulose-7-phosphate; E4P: Erythrose-4-phosphate; DAHP: 3-Deoxy-D-arabinoheptulosonate 7-phosphate; CHO: Chorismate; Phe: Phenylalanine | |
| NO. | Metabolic intermediate | Equations from metabolic flux balance |
| 1 | G6P | r1 - r2 - r13 - 0.021rBM = 0 |
| 2 | F6P | r2 - r3 + r17 + r18 - 0.007rBM =0 |
| 3 | GAP | 2r3 - r4 + r16 - r17 + r18 - 0.013rBM = 0 |
| 4 | 3PG | r4 - r5 - 0.134rBM = 0 |
| 5 | PEP | r5 - r6 - r11 - r19- r20 - 0.051rBM = 0 |
| 6 | Pyr | r6 - r7 - 0.083rBM = 0 |
| 7 | AcCoA | r7 - r8 - r10 - 0.293rBM = 0 |
| 8 | α-KG | r8 - r9 - r12 + r21 - 0.087rBM = 0 |
| 9 | OAA | - r8 + r9 + r11 - 0.148rBM = 0 |
| 10 | RL5P | r13 - r14 - r15 = 0 |
| 11 | X5P | r14 - r16 - r18 = 0 |
| 12 | R5P | r15 - r16 - 0.063rBM = 0 |
| 13 | S7P | r16 - r17 = 0 |
| 14 | E4P | r17 - r18 - r19 - 0.036rBM = 0 |
| 15 | DAHP | r19 - r20 = 0 |
| 16 | CHO | r20 - r21 = 0 |
| 17 | Glu | r12 - r21 = 0 |
| 18 | NADPH | - r12 + 2r13 - r20 - 0.135rBM = 0 |
| 19 | NADH | r4 + r7 + r8 +2 r9 - r22 + 0.036rBM = 0 |
| 20 | FADH2 | r9 - r23 = 0 |
| 21 | ATP | -r1-r3+r4+r6+r9+r10-r11-r20+1.5r22+0.75r23-r24-1.782 rBM = 0 |
| 22 | O2 | -0.5r22 - 0.5r23 - rO2 = 0 |
| 23 | CO2 | r7 + r8 + r9 - r11 + r13 + r21- rCO2 +0.168rBM = 0 |
外源添加少量的中间代谢产物可能对代谢网络中关键酶活产生影响,从而影响代谢产物的分布情况。本实验考察1g/L柠檬酸三钠、α-酮戊二酸、琥珀酸钠、草酰乙酸、延胡索酸、苹果酸、丙酮酸钠对菌体生长及发酵产L-苯丙氨酸的影响,结果见图 2。由图 2可知,外源添加各种中间代谢产物对菌体浓度、发酵副产物乙酸浓度及L-苯丙氨酸产量都有一定的影响。添加1g/L柠檬酸三钠和α-酮戊二酸对菌体生长没有影响,而对菌体产L-苯丙氨酸均有一定的促进作用,其产量分别为9.734g/L和9.957g/L,产酸率分别提高了6.417%和8.852%;添加1g/L柠檬酸三钠对发酵副产物乙酸的生成有一定的抑制作用,乙酸的生成量为1.655g/L,降低了32.942%。其余中间代谢产物的添加对L-苯丙氨酸的生成都有一定的抑制作用。
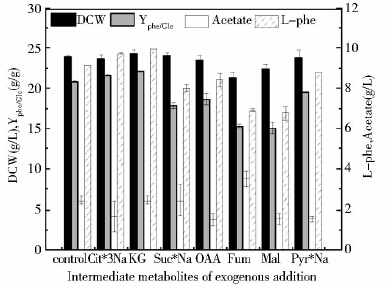
|
| 图 2 添加中间代谢产物对L-苯丙氨酸发酵的影响 Fig. 2 Effects of adding intermediate metabolite on L-phenylalanine fermentation |
为探讨外源添加柠檬酸三钠和α-酮戊二酸的影响机制,对E.coliYP1617进行代谢通量分析。利用菌体细胞稳定且碳代谢流旺盛时 (稳定期) 的培养检测参数作为代谢通量常数项,因此选择 13h、13.5h、14h、14.5h、15h取样分析发酵液中的菌体、葡萄糖、L-苯丙氨酸、乙酸、O2及CO2的浓度,得到在14h时的单位时间浓度变化率,并计算得到各反应(r1~rBM) 的代谢通量[16]。柠檬酸三钠和α-酮戊二酸添加和未添加的代谢通量分布情况如表 3所示。
| Flux | Value[mmol/(g DCW·h)] | ||
| Constract | Cit·3Na | α-KG | |
| r1 | 100 | 100 | 100 |
| r2 | 69.0 | 64.7 | 60.9 |
| r3 | 75.8 | 73.3 | 70.6 |
| r4 | 140.9 | 134.4 | 127.7 |
| r5 | 130.6 | 124.9 | 118.0 |
| r6 | 60.3 | 46.7 | 31.9 |
| r7 | 53.9 | 40.8 | 25.8 |
| r8 | 10.8 | 7.7 | 6.8 |
| r9 | 4.1 | 1.6 | 0.4 |
| r10 | 20.7 | 12.4 | -2.2 |
| r11 | 18.0 | 16.6 | 17.1 |
| r12 | 24.2 | 29.0 | 32.7 |
| r13 | 29.4 | 33.8 | 37.6 |
| r14 | 7.3823 | 9.0 | 10.2 |
| r15 | 22.0 | 24.7 | 27.4 |
| r16 | 17.2 | 20.3 | 22.9 |
| r17 | 17.2 | 20.3 | 22.9 |
| r18 | -9.8 | -11.3 | -12.5 |
| r19 | 24.2 | 29.0 | 32.7 |
| r20 | 24.2 | 29.0 | 32.7 |
| r21 | 24.2 | 29.0 | 32.7 |
| r22 | 216.6 | 188.6 | 163.8 |
| r23 | 4.1 | 1.6 | 0.4 |
| r24 | 199.3 | 134.1 | 54.2 |
| ro2 | -110.3 | -95.1 | -82.1 |
| rco2 | 117.3 | 108.1 | 98.5 |
| rBM | 76.6 | 70.7 | 72.6 |
从表 3可以看出,添加1g/L柠檬酸三钠发酵所引起的通量变化主要集中于G6P、PEP和Pyr节点。其中G6P是影响涉及L-苯丙氨酸合成和能量代谢的HMP途径的关键节点,PEP是影响L-苯丙氨酸合成的关键节点,Pyr是影响副产物乙酸生成的关键节点。调节结果见图 3(a)。由图 3(a)可知,在G6P节点处,添加1g/L柠檬酸三钠后流向HMP途径通量比对照提高了15.0%,这与文献报道的柠檬酸钠对L-亮氨酸发酵代谢流分布的影响作用一致[18];在PEP、Pyr节点处,流向Pyr和流向乙酸通量比对照降低了22.6%和40.1%,得出柠檬酸三钠能抑制丙酮酸激酶活性和乙酸的合成,这与Akshay等[11]的结论相一致。柠檬酸三钠的添加能增强HMP途径,而HMP途径主要的作用是为L-苯丙氨酸的合成提供前体物质E4P及反应所需的还原力NADPH;同时,能抑制丙酮酸激酶和乙酸合成,从而削弱了L-苯丙氨酸的前体物质PEP流向Pyr,增强PEP流入莽草酸途径;从而得出柠檬酸三钠的添加有利于L-苯丙氨酸发酵的结论。
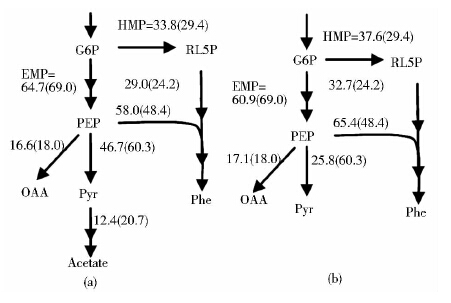
|
| 图 3 添加Cit·3Na(a)和α-KG(b)对关键节点处代谢通量分布的影响(括号内数值为不添加的情况) Fig. 3 Effects of adding Cit·3Na(a) and α-KG(b) on metabolic flux distribution of key node |
从表 3可以看出,添加1g/L α-酮戊二酸所引起的通量变化主要集中于G6P和PEP。其中G6P是影响涉及L-苯丙氨酸合成和能量代谢的HMP途径的关键节点,PEP是影响L-苯丙氨酸合成的关键节点。调节结果见图 3(b)。由图 3(b)可知,在G6P节点处,添加1g/L α-酮戊二酸后流向HMP途径通量比对照提高了27.9%;在PEP节点处,流向Pyr通量比对照降低了57.2%;合成L-苯丙氨酸处的通量比对照提高了35.1%。这可能是:一方面α-酮戊二酸经TCA循环合成琥珀酰辅酶A,而它能抑制丙酮酸激酶[12];另一方面α-酮戊二酸参与合成L-苯丙氨酸的氨基转移反应,从而使α-酮戊二酸的添加有利于L-苯丙氨酸的发酵。
2.2 不同浓度的维生素B1对发酵和代谢通量分布的影响众所周知,丙酮酸通过柠檬酸循环进行脱羧和脱氢反应,氢原子随着载体(NAD+、FAD)进入电子传递链经过氧化磷酸化作用,形成水分子并释放出能量合成ATP,保证机体能量供给;柠檬酸循环也是脂肪酸、氨基酸等各种燃料分子氧化分解所经历的共同途径;柠檬酸循环的中间体还可作为许多生物合成的前体[19]。柠檬酸循环的前体物质是乙酰辅酶A,其由丙酮酸氧化脱羧这一限速反应形成[20, 21],α-酮戊二酸的氧化脱羧形成琥珀酸辅酶A并释放能量;而维生素B1是参与丙酮酸和α-酮戊二酸氧化脱羧的辅助因子[22],由此调控维生素B1浓度在维持菌体生长和产物的形成中起着重要作用。
本实验考察不同浓度的维生素B1对菌体生长及发酵产L-苯丙氨酸的影响,结果见图 4。由图 4可知,随着维生素B1浓度的增加,乙酸生成量逐渐减少,而对菌体生长影响不是很大;在0~150mg/L时,L-苯丙氨酸的生成随着维生素B1浓度的增加而增加,在150mg/L之后,维生素B1浓度增加不利于L-苯丙氨酸的生成。与少量维生素B1(浓度为75mg/L)和过量维生素B1(即浓度为300mg/L)相比,在150mg/L维生素B1浓度下,L-苯丙氨酸的产量为10.324g/L,分别提高了12.9%和10.1%。
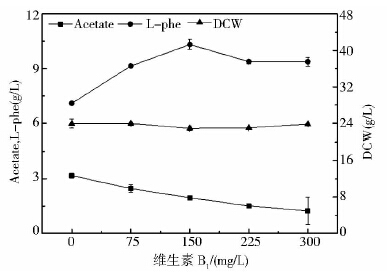
|
| 图 4 不同浓度的维生素B1对L-苯丙氨酸发酵的影响 Fig. 4 Effects of different concentrations of thiamine on L-phenylalanine fermentation |
为探讨外源添加不同浓度维生素B1的影响机制,对E.coliYP1617进行代谢通量分析。以菌体细胞稳定且碳代谢流旺盛时(稳定期)的培养检测参数作为代谢通量常数项,因此在维生素B1浓度为75mg/L、150mg/L、300mg/L条件下,选择13h、13.5h、14h、14.5h、15h取样分析发酵液中的菌体、葡萄糖、L-苯丙氨酸、乙酸、O2及CO2的浓度,得到在14h时的单位时间浓度变化率,并计算各反应(r1~rBM) 的代谢通量[16]。添加75mg/L、150mg/L、300mg/L维生素B1的代谢通量分布情况如表 4所示。
| Flux | Value[mmol/(g DCW·h)] | ||
| 75mg/L | 150mg/L | 300mg/L | |
| r1 | 100 | 100 | 100 |
| r2 | 69.0 | 68.1 | 84.7 |
| r3 | 75.8 | 76.7 | 89.1 |
| r4 | 140.9 | 142.4 | 173.0 |
| r5 | 130.6 | 136.3 | 171.1 |
| r6 | 60.3 | 67.5 | 138.9 |
| r7 | 53.9 | 63.7 | 137.7 |
| r8 | 10.8 | 41.4 | 133.4 |
| r9 | 4.1 | 37.4 | 132.1 |
| r10 | 20.7 | 8.9 | 0 |
| r11 | 18.0 | 10.7 | 3.4 |
| r12 | 24.2 | 27.8 | 14.0 |
| r13 | 29.4 | 30.9 | 15.0 |
| r14 | 7.4 | 8.9 | 4.6 |
| r15 | 22.0 | 22.1 | 10.5 |
| r16 | 17.2 | 19.2 | 9.6 |
| r17 | 17.2 | 19.2 | 9.6 |
| r18 | -9.8 | -10.3 | -5.0 |
| r19 | 24.21 | 27.8 | 14.0 |
| r20 | 24.2 | 27.8 | 14.0 |
| r21 | 24.2 | 27.8 | 14.0 |
| r22 | 216.6 | 324.1 | 708.9 |
| r23 | 4.1 | 37.4 | 132.1 |
| r24 | 199.3 | 473.8 | 1.4 |
| ro2 | -110.3 | -180.8 | -420.5 |
| rco2 | 117.3 | 198.3 | 431.3 |
| rBM | 76.6 | 45.7 | 14.5 |
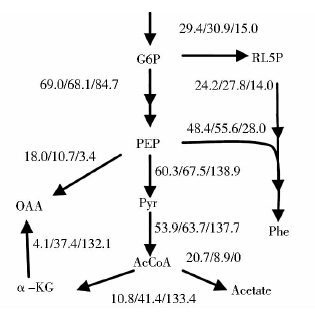
从表 4可以看出,添加75mg/L、150mg/L、300mg/L维生素B1所引起的通量变化主要集中于G6P、PEP、Pyr节点和C3途径。调节结果见图 5。在AcCoA节点处,添加75mg/L、150mg/L的维生素B1流向α-KG通量为10.8、41.4,而流向乙酸合成的通量为20.7、8.9;可得出,过少的维生素B1减弱了流向α-KG的通量,而增强了流向乙酸的通量,这能是由于维生素B1是α-酮戊二酸氧化脱羧的辅助因子[22];而过多的乙酸不利于菌体的生长和产物的形成。在PEP节点处,添加75mg/L、150mg/L的维生素B1流向OAA通量为18.0、10.7,而流向L-苯丙氨酸合成的通量为48.4、55.6;可以得出,过少的维生素B1增强了流向OAA的通量,削弱了流向L-苯丙氨酸合成的通量;这可能是在过少维生素B1情况下,流向α-KG通量较少,造成流向OAA通量较少,为了维持TCA循环,就必须通过回补途径获取足够的OAA。于是,过少的维生素B1不利于L-苯丙氨酸的合成。在G6P节点处,添加150mg/L、300mg/L维生素B1后流向HMP途径通量为30.9、15.0;过多的维生素B1造成合成L-苯丙氨酸的前体E4P和还原力NADPH的不足。在添加150mg/L、300mg/L维生素B1后,PEP节点处流向Pyr通量为67.5、138.9,Pyr节点处流向AcCoA的通量为63.7、137.7;由于维生素B1是丙酮酸脱羧反应的辅助因子[22],过多的维生素B1造成大量Pyr流向AcCoA,引起PEP流向Pyr的通量增强,所以 PEP流向合成L-苯丙氨酸途径的通量会相对削弱。于是,过量的维生素B1不利于L-苯丙氨酸的合成。由此可以得出,150mg/L维生素B1对发酵产L-苯丙氨酸较有利。
|
| 图 5 添加75mg/L、150mg/L、300mg/L维生素B1对关键节点处代谢通量分布的影响 Fig. 5 Effects of adding thiamine of 0mg/L,150mg/L and 300mg/L on metabolic flux distribution of key node |
金属离子是所有生态系统组成的一部分,其中有些是生命系统的重要组成部分,称为必需金属离子。这些金属离子对生命体的次级代谢具有深远影响,这是由于它们可以负责活化某些基因和生物合成途径的关键酶[23]。例如,镁离子能激活己糖激酶和葡萄糖6磷酸脱氢酶[13]。在各种金属离子之间,镁离子在生产针对性的次级代谢产物过程中起到重要的作用[24],并且对菌体的生长起着重要作用[25]。
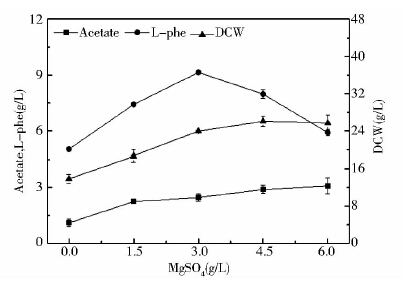
本实验考察不同浓度硫酸镁对菌体生长及发酵产L-苯丙氨酸的影响,结果见图 6。由图 6可知,随着硫酸镁浓度的增加,菌体浓度逐渐上升,乙酸生成量逐渐减少;0~3g/L时,L-苯丙氨酸的生成随着硫酸镁浓度增加而增加,在3g/L之后,硫酸镁浓度增加不利于L-苯丙氨酸的生成。与添加少量硫酸镁(浓度为1.5g/L)和过量硫酸镁(浓度为4.5g/L)相比,在3g/L硫酸镁浓度下,L-苯丙氨酸产量为9.147g/L,分别提高了23.2%和14.6%。
|
| 图 6 不同浓度硫酸镁对L-苯丙氨酸发酵的影响 Fig. 6 Effects of different concentrations of MgSO4 on L-phenylalanine fermentation |
为探讨外源添加不同浓度硫酸镁的影响机制,对E.coliYP1617进行代谢通量分析。以菌体细胞稳定且碳代谢流旺盛时(稳定期)的培养检测参数作为代谢通量常数项,在硫酸镁浓度为1.5g/L、3g/L、4.5g/L条件下,选择13h、13.5h、14h、14.5h、15h取样分析发酵液中的菌体、葡萄糖、L-苯丙氨酸、乙酸、O2及CO2的浓度,得到在14h时的单位时间浓度变化率,并计算各反应(r1~rBM) 的代谢通量[16]。添加1.5g/L、3g/L、4.5g/L硫酸镁的代谢通量分布情况如表 5所示。
| Flux | Value[mmol/(g DCW·h)] | ||
| 1.5g/L | 3g/L | 4.5g/L | |
| r1 | 100 | 100 | 100 |
| r2 | 82.7 | 69.0 | 70.9 |
| r3 | 86.2 | 75.8 | 77.0 |
| r4 | 166.2 | 140.9 | 143.8 |
| r5 | 159.4 | 130.6 | 133.3 |
| r6 | 119.3 | 60.3 | 66.4 |
| r7 | 115.1 | 53.9 | 59.9 |
| r8 | 91.8 | 10.8 | 7.8 |
| r9 | 87.4 | 4.1 | 1.0 |
| r10 | 8.4 | 20.7 | 29.1 |
| r11 | 11.9 | 18.0 | 18.4 |
| r12 | 12.8 | 24.2 | 22.2 |
| r13 | 16.2 | 29.4 | 27.5 |
| r14 | 3.8 | 7.4 | 6.7 |
| r15 | 12.4 | 22.0 | 20.8 |
| r16 | 9.2 | 17.2 | 15.9 |
| r17 | 9.2 | 17.2 | 15.9 |
| r18 | -5.4 | -9.8 | -9.2 |
| r19 | 12.8 | 24.2 | 22.2 |
| r20 | 12.8 | 24.2 | 22.2 |
| r21 | 12.8 | 24.2 | 22.2 |
| r22 | 549.8 | 216.6 | 216.4 |
| r23 | 87.4 | 4.1 | 1.0 |
| r24 | 970.1 | 199.3 | 208.1 |
| ro2 | -318.6 | -110.3 | -108.7 |
| rco2 | 319.9 | 117.3 | 113.2 |
| rBM | 50.8 | 76.6 | 78.5 |
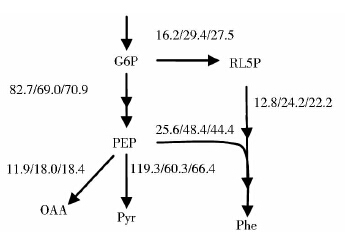
从表 5可以看出,添加1.5g/L、3g/L、4.5g/L硫酸镁所引起的通量变化主要集中于G6P节点处。调节结果见图 7。在G6P节点处,添加1.5g/L、3g/L、4.5g/L硫酸镁后流向HMP途径的通量为16.2、29.4、27.5;硫酸镁浓度过低或过高,流向HMP途径的通量都有所降低。这是因为镁离子能激活己糖激酶和葡萄糖6磷酸脱氢酶[13];前者催化G6P流向EMP,后者催化G6P流向HMP;EMP为合成L-苯丙氨酸提供前体物质PEP,并且HMP为合成L-苯丙氨酸提供前体物质E4P和还原力NADH。由此可知,3g/L硫酸镁对发酵产L-苯丙氨酸较有利。
|
| 图 7 添加1.5g/L、3g/L、4.5g/L硫酸镁对关键节点处代谢通量分布的影响 Fig. 7 Effects of adding magnesium sulfate of 1.5g/L,3g/L and 4.5g/L on metabolic flux distribution of key node |
柠檬酸三钠、α-酮戊二酸、维生素B1和硫酸镁的添加对大肠杆菌E.coliYP1617的生长和L-苯丙氨酸的发酵有利,其主要能调节PEP和G6P节点处的代谢通量分布,从而使更多的葡萄糖流向L-苯丙氨酸的合成。
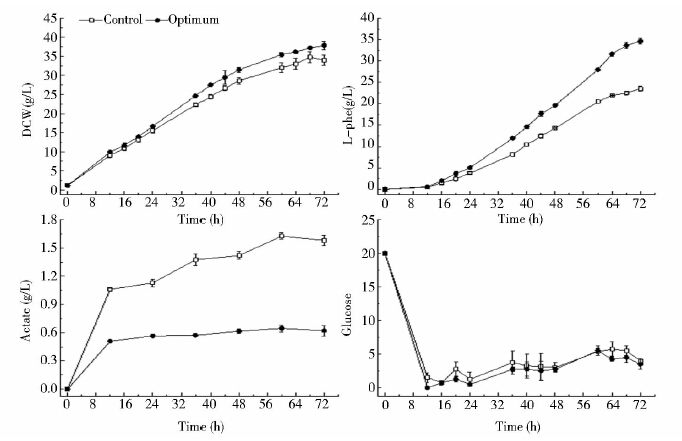
本实验考察并比较最优和基础培养基条件时菌体生长及发酵产L-苯丙氨酸的影响,结果见表 6和图 8。由表 6可知,与对照相比,优化条件下菌体对总葡萄糖的消耗提高了24.49%,菌体终浓度提高了23.50%,L-苯丙氨酸的终浓度提高了62.87%,L-苯丙氨酸的收率提高了30.88%,乙酸的合成降低了56.51%。由图 8可知,菌体浓度、L-苯丙氨酸浓度和乙酸浓度随着时间而增加;在优化条件下,菌体浓度和L-苯丙氨酸浓度比对照增加的更迅速;在12h内,优化后乙酸的生成比对照缓慢,12h后,乙酸的合成很少。由此得出,优化后的条件有利于菌体生长、L-苯丙氨酸的合成、葡萄糖的消耗,极大地抑制了乙酸的形成。
| Parameters | Control | Optimum |
| Glucose(g/L) | 122.50±3.536 | 152.50±3.536 |
| Time(h) | 72 | 72 |
| V(L) | 0.70±0.028 | 0.78±0.007 |
| DCW (g/L) | 33.92±0.011 | 41.89±1.642 |
| L-phe (g/L) | 23.52±1.501 | 38.31±1.140 |
| Yphe/Glc (%) | 19.19±0.672 | 25.12±0.165 |
| Acetate (g/L) | 1.58±0.007 | 0.67±0.069 |
|
| 图 8 优化与基础培养基条件对菌体生长、L-苯丙氨酸和乙酸生成及葡萄糖利用的影响 Fig. 8 Effects of the optimal and basic medium on cell growth,L-phe and acetate formation,glucose consumption |
(1)外源添加代谢中间体对菌体生长及发酵产L-苯丙氨酸均有一定的影响,其中添加1g/L柠檬酸三钠和α-酮戊二酸的效果最好,L-苯丙氨酸的收率分别提高了6.417%和8.852%。应用代谢通量分析得出,添加1g/L柠檬酸三钠后,G6P节点处流向HMP途径的通量比对照提高了15.0%,PEP和Pyr节点处流向Pyr和乙酸的通量比对照降低了22.6%和40.1%;添加1g/L α-酮戊二酸后,G6P节点处流向HMP途径通量比对照提高了27.9%,PEP节点处流向Pyr通量比对照降低了57.2%;
(2)不同浓度的维生素B1和硫酸镁对菌体生长及发酵产L-苯丙氨酸均有一定的影响,其中150mg/L维生素B1和3g/L硫酸镁的效果最好。应用代谢通量分析得出,过少或过多的维生素B1削弱了PEP流向L-苯丙氨酸合成的通量,并且过少的维生素B1增强了流向乙酸的通量,过多的维生素B1减弱了流向HMP的通量;硫酸镁浓度过低或过高,流向HMP途径的通量都有所降低。
(3)通过补料分批发酵实验,比较优化前后条件对菌体生长及发酵产L-苯丙氨酸的影响。结果表明,与对照相比,优化后菌体对总葡萄糖的消耗提高了24.49%,菌体终浓度提高了23.50%,L-苯丙氨酸的终浓度提高了62.87%,L-苯丙氨酸的收率提高了30.88%,乙酸的合成降低了56.51%。
| [1] | Johannes B, Marco K, Ulrike M, et al. Metabolic engineering for microbial production of aromatic amino acids and derived compounds. Metab Eng, 2001, 3(4): 289-300. |
| [2] | Park S H, Hong K T, You S J, et al. L-phenylalanine production by auxotrophic regulatory mutants of Escherichia coli—L-phenylalanine production by mutants of E.coli. Korean J Chem Eng, 1984, 1(1): 65-69. |
| [3] | Hwang S O, Gil G H, Cho Y J, et al. The fermentation process for L-phenylalanine production using an auxotrophic regulatory mutant of Escherichia coli. Appl Microbiol Biotechnol, 1985, 22(2):108-113. |
| [4] | 周海岩. L-苯丙氨酸生产菌株的构建、代谢调控和发酵条件优化. 无锡: 江南大学,生物工程学院, 2011. Zhou H Y. Strain Construction, Metabolic Regulation and Process Optimization for L-Phenylalanine Production.Wuxi: Jiangnan University, College of Biological Engineering, 2011. |
| [5] | Wu Y Q, Jiang P H, Fan C S, et al. Co-expression of five genes in E.coli for L-phenylalanine in Brevibacterium flavum. World J Gastroenterol, 2003, 9(2): 342-346. |
| [6] | Mutsumi T, Yoshinori N, Gyuseop O, et al. Control of L-phenylalanine production by dual feeding of glucose and L-tyrosine. Biotechnol Bioeng, 1996, 52(6): 653-660. |
| [7] | Yakandawala N, Romeo T, Friesen A D, et al. Metabolic engineering of Escherichia coli to enhance phenylalanine production. Appl Microbiol Biotechnol, 2008, 78(2): 283-291. |
| [8] | 姜岷, 黄秀梅, 李建, 等. 氧化还原电位调控对产琥珀酸放线杆菌代谢通量分布的影响. 化工学报, 2009, 60(10): 2555-2561. Jiang M, Huang X M, Li J, et al. Effect of redox potential regulation on metabolic flux distribution of succinate production by Actinobacillus succinogenes. J Chem Ind Eng, 2009, 60(10): 2555-2561. |
| [9] | 潘军华, 潘中明, 曾嵋涓, 等. 营养因子对乳酸发酵短杆菌合成赖氨酸的影响. 无锡轻工大学学报, 2002, 21(2): 130-134. Pan J H, Pan Z M, Zeng M J, et al. Effects of nutrition factors on the biosynthesis of lysine in a lysine producer Brevibacterium lactofermentum FP094. J Wuxi Univ Light Ind, 2002, 21(2): 130-134. |
| [10] | Underwood S A, Buszko M L, Shanmugam K T, et al. Flux through citrate synthase limits the growth of ethanologenic Escherichia coli KO11 during xylose fermentation. Appl Environ Microbiol, 2002, 68(3): 1071-1081. |
| [11] | Akshay G, Jinwoon L, Michael M D, et al. Metabolic fluxes, pools, and enzyme measurements suggest a tighter coupling of energetics and biosynthetic reactions associated with reduced pyruvate kinase flux. Biotechnol Bioeng, 1999, 64(2): 129-134. |
| [12] | Bruce E Waygood, Sanwa B D. The control of pyruvate kinases of Escherichia coli. J Biol Chem, 1974, 249(1): 265-274. |
| [13] | Sanwal B D. Regulatory mechanisms involving nicotinamide adenine nucleotides as allosteric effectors. J Biol Chem, 1970, 254(7): 1626-1631. |
| [14] | 黄秀梅, 姜岷, 李建, 等. 外源添加代谢中间体对产L-琥珀酸放线杆菌厌氧发酵制备丁二酸的影响. 生物工程学报, 2010, 26(9): 1249-1256. Huang X M, Jiang M, Li J, et al. Effect of adding intermediate metabolites on succinate production by A.succinogenes. Chin J Biotech, 2010, 26(9): 1249-1256. |
| [15] | Maciek R A, David F K, Lisa A L, et al. Metabolic flux analysis in a nonstationary system: Fed-batch fermentation of a high yielding strain of E.coli producing 1,3-propanediol. Metab Eng, 2007, 9(3): 277-292. |
| [16] | Jens K, Christoph W, Hartwig S, et al. Metabolic pathway analysis for rational design of L-methionine production by E.coli and C.glutamicum. Metab Eng, 2006, 8(4): 353-369. |
| [17] | 陈飞, 冯小海, 吴波, 等. 丙酸杆菌的两种固定化细胞反应器发酵生产丙酸及其代谢通量分析. 化工学报, 2011, 62(4):1034-1041. Chen F, Feng X H, Wu B, et al. Metabolic flux analysis of proponic acid biosysbthesis with two immobilized cell reactor fermentation by Propionibacterium. J Chem Ind Eng, 2011, 62(4):1034-1041. |
| [18] | 陈宁, 刘辉. 柠檬酸钠对L-亮氨酸发酵代谢流分布的影响. 高校化学工程学报, 2008, 22(3): 478-483. Chen N, Liu H. Effects of sodium citrate on metabolic flux distributions of L-Leucine production by Brevibacterium flavumTK0303. J Chem Eng Chin Uni, 2008, 22(3): 478-483. |
| [19] | Muhammad Akram. Citric acid cycle and role of its intermediates in metabolism. Cell Biochem Biophys, 2014, 68(3): 475-478. |
| [20] | Ren L J, Huang H, Xiao A H, et al. Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply in Schizochytrium sp.HX-308. Bioprocess Biosyst Eng, 2009, 32(6): 837-843. |
| [21] | Yoichiro S, Eric M P, James K, et al. Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae for high-level production of isoprenoids. Metab Eng, 2007, 9(2): 160-168. |
| [22] | Guo H W, Catherine M, Du G C, et al. Effects of pyruvate dehydrogenase subunits overexpression on the α-ketoglutarate production in Yarrowia lipolyticaWSH-Z06. Appl Microbiol Biotechnol, 2014, 98(16): 7003-7012. |
| [23] | Waseem R, Yang X M, Wu H S, et al. Evaluation of metal ions (Zn2+,Fe3+and Mg2+) effect on the production of fusaricidin-type antifungal compounds by Paenibacillus polymyxa SQR-21.Bioresour Technol, 2010,101(2):9264-9271. |
| [24] | Jia Y L, Zhong J J. Enhanced production of ansamitocin P-3 by addition of Mg2+ in fermentation of Actinosynnema pretiosum. Bioresour Technol, 2011, 102(2): 10147-10150. |
| [25] | Liu B F, Ren N Q, Ding J, et al. The effect of Ni2+, Fe2+ and Mg2+ concentration on photo-hydrogen production by Rhodopseudomonas faecalis RLD-53. Int J hydrogen Energ, 2009, 34: 721-726. |
 2015, Vol. 35
2015, Vol. 35




