文章信息
- 王鹏, 郑兆鑫, 刘明秋
- WANG Peng, ZHENG Zhao-xin, LIU Ming-qiu
- 猪Mx1和牛Mx1蛋白在PK-15细胞中的表达及其对伪狂犬病病毒的抑制
- Expression and Antiviral Effects of Sus Scrofa Mx1 and Bos taurus Mx1 on PRV
- 中国生物工程杂志, 2015, 35(3): 1-7
- China Biotechnology, 2015, 35(3): 1-7
- http://dx.doi.org/10.13523/j.cb.20150301
-
文章历史
- 收稿日期:2014-12-11
- 修回日期:2015-02-06
伪狂犬病病毒(pseudorabies virus,PRV)属于疱疹病毒科,甲型疱疹病毒亚科,水痘病毒属。病毒基因组为线状双链DNA ,长度约为143kb,至少包含72个基因。此病毒的DNA是由20面体的衣壳包裹,形成核衣壳[1] 。这种病毒可以引起新生猪脑炎、成长发育中的猪呼吸紊乱、繁殖失败等,因此造成巨大的经济损失。在中国过去几十年中,通过使用活疫苗有效地控制了这种疾病并降低了经济损失。但是2012年,在很多免疫过这种基因缺失疫苗的猪场却暴发了PRV,尤其在河南及周边城市[2, 3]。因此,非常有必要找到新的方法控制这种疾病。
Mx基因是真核细胞内Ⅰ型和Ⅲ型干扰素诱导的下游基因之一,其编码的是一种鸟苷三磷酸酶,属于动态超家族成员[4]。在不同的真核细胞中Mx 基因亚型不同,如鱼Mx1、Mx2、Mx3[5],人类Mx-A、Mx-B[6],小鼠Mx1、Mx2[7],等。Mx蛋白可在多种动物细胞内表达,对多种病毒的复制具有一定的抑制作用,表明该蛋白质在抗病毒药物研发方面具有潜在的应用价值。目前,国内外关于Mx抗病毒研究以RNA病毒居多,抗DNA病毒的较少[8],因此,本工作希望通过研究猪Mx和牛Mx两种蛋白在猪PK-15细胞中对PRV的抗病毒能力,为今后在动物体内应用Mx蛋白抗PRV等DNA病毒研究奠定基础。
1 材料与方法 1.1 材 料大肠杆菌TG1菌株、pcDNA3.1/myc-His(-)B质粒(简称为pcDNA3.1)、PRV病毒为本实验室保存;PK-15、IBRS-2、MDBK细胞株由本实验保存;限制性内切核酸酶HindⅢ、XhoⅠ、T4DNA连接酶购于NEB公司;pMD18-T载体、反转录试剂盒:PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit、SYBRPremix Ex TaqTMⅡ (Tli Rnase H Plus)均购于TaKaRa公司;WST-1细胞增殖及细胞毒检测试剂盒购于碧云天生物技术研究所。细胞基因组抽提试剂盒、无内毒素质粒中抽试剂盒、凝胶回收试剂盒以及6孔、24孔、96孔细胞培养板均购于Corning公司;RNA抽提试剂盒购于Qiagen公司;胎牛血清、抗生素(青霉素、链霉素、两性霉素B,货号15240-062)、0.25%胰酶均购于Thermo公司;抗His的单抗、HRP偶联羊抗鼠二抗均来自Abmart公司;Opti-MEM无血清培养基和LipofectamineTM2000购自Invitrogen公司;DNA Marker IV、RNase-Free DNase Ⅰ均购于北京天根生化科技有限公司;EasyPfu DNA聚合酶、TransTaqTM-T DNA聚合酶均购于北京全式金生物技术有限公司;细胞裂解液由复旦大学生命学院李瑶老师实验室赠与。
1.2 方 法 1.2.1 引物合成与设计根据GenBank公布的猪Mx1、牛Mx1的基因序列(猪Mx1:M65087.1;牛Mx1:AF047692.1),按照一般引物设计原则,设计并合成引物。同时设计内参基因β-actin,引物由上海赛百盛公司合成。PRV F: 5′CTCGCCATCGTCAGCAA3′
PRV R: 5′GCTGCTCCTCCATGTCCTT3′
β-actin F:5′CTCCATCATGAAGTGCGACGT3′
β-actin R:5′GTGATCTCCTTGTGCATCCTGTC3′
猪Mx1 F:5′CCGCTCGAGATGGTTTATTCCAGC3′
(下划线处为XhoⅠ酶切位点)猪Mx1 R:5′CCCAAGCTTGCCTGGGAACTTGGCGA
GC3′(下划线处为Hind Ⅲ酶切位点)牛Mx1 F:5′CCGCTCGAGATGGTTCATTCTGACTTG
GGTATCG3′(下划线处为XhoⅠ酶切位点)牛Mx1 R:5′CCCAAGCTTGCCCGGGAACTTGGCCA
GCAGCCGCTGC3′(下划线处为Hind Ⅲ酶切位点) 1.2.2 分离目的基因(1)分别抽提IBRS-2细胞、MDBK细胞总RNA,以其反转录成相应的cDNA为模板进行PCR。将扩增的PCR产物进行凝胶回收之后分别与T载体pMD-18 T进行连接。反应体系:DNA与T载体(摩尔比3∶1)共5μl;solutionⅠ5μl。16℃ 过夜。将上述反应产物转化TG1,筛选阳性克隆并测序。
(2)以测序正确的T-猪Mx1、T-牛Mx1的重组质粒为模板,PCR扩增Mx基因,扩增猪Mx1基因反应条件为:94℃预变性3min;94℃变性1min,60℃退火1min,72℃ 延伸4.5min,30个循环;72℃延伸5min。4℃,20min。扩增牛Mx1基因反应条件为:94℃预变性3min;94℃ 变性1min,64℃退火1min,72℃ 延伸4.5min,30个循环;72℃延伸5min。4℃,20min。
1.2.3 构建真核表达载体将上述PCR产物回收纯化后,用限制性内切核酸酶Hind Ⅲ、XhoⅠ酶切,回收目的片段与经同样酶切并回收的pcDNA3.1载体连接,转化后挑选阳性菌落进行PCR、酶切鉴定及测序验证,将构建正确的重组质粒命名为pSus-Mx1和pBos-Mx1。 1.2.4 重组Mx1基因的表达鉴定(1) mRNA水平检测。以1×105个/ml密度接种PK-15细胞于6孔培养板,待培养至细胞密度为90%左右时用于转染,步骤按照LipofectamineTM2000说明书进行操作;转染重组质粒48h后收集细胞抽提RNA,RT-PCR检测两种重组质粒在PK-15中的mRNA水平。
(2)蛋白质水平检测。裂解转染48h后的细胞进行SDS-PAGE电泳并转移至NC膜,用含有5%脱脂奶粉的TBST(含有0.1% Tween20的TBS)封闭液封闭1h,加入鼠抗his标签的一抗(抗体稀释比为1∶5 000)并4℃孵育过夜,TBS洗膜5min×3次,加入羊抗鼠的二抗(抗体稀释比为1∶6 000)室温孵育1h,TBST洗膜5min×3次,加入显色试剂显色并拍照。
1.2.5细胞毒性检测以2000个细胞100μl铺于96孔板培养细胞,待培养至90%左右的细胞密度时进行转染,每个样品6个重复,分别转染两种重组质粒和载体对照pcDNA3.1。转染后分别于0h、12h、24h、36h、48h将每孔加入10ml WST-1检测液,对照孔只加细胞培养液和WST-1。加入WST-1后,在摇床内摇动2~5min并在培养箱内继续培养1h,测定450nm测定吸光值。吸光值=试验孔吸光值-对照孔吸光值,值越大表明细胞活性越强。
1.2.6 猪Mx1蛋白、牛Mx1蛋白对PRV的抗病毒效果(1)细胞病变检测。将细胞铺入24孔,细胞密度为90%左右开始转染。转染24h后,每孔接种100TCID50 PRV(约300μl),孵育1h,然后将病毒液弃掉,加入400μl的维持液,72h后观察细胞病变程度。
(2)荧光定量PCR检测病毒核酸。将细胞铺入24孔板,细胞密度为90%左右时按照LipofectamineTM2000说明书进行转染,24h后,分别用20TCID50、100TCID50的病毒液进行攻毒。攻毒后1h将上清液弃掉,加入维持液(不含抗生素的2%血清的培养基)。攻毒后24h、48h、72h收集样品,反复冻融后抽提总DNA,每组3个重复,进行荧光定量PCR检测上清液和细胞内总DNA的病毒拷贝数。荧光定量PCR反应条件:预变性95℃ 30s;95℃变性 30s、60℃ 延伸15s,40个循环;采用相对定量,内参采用β-actin[9]。
1.2.7 统计学分析所有数据均采用双尾T检验进行统计分析,数据由平均值±标准方差表示,P<0.05表示具有显著学意义,P<0.01表示极为显著。
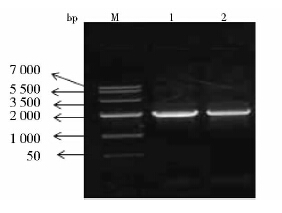
2 结 果 2.1 分离目的基因通过抽提IBRS-2细胞和MDBK细胞RNA,经过反转录以cDNA为模板进行扩增。经1%琼脂糖凝胶电泳验证,目的片段大小与预期2 000bp基本一致(图 1)。
|
| 图 1 猪Mx1基因、牛Mx1基因PCR产物电泳图 Fig. 1 Electrophoresis of PCR products of Mx1 gene of Sus scrofa and Bos taurus M: DNA marker;1:PCR product of Mx1 gene of Sus scrofa;2:PCR product of Mx1 gene of Bos taurus |
将猪Mx1基因和牛Mx1基因分别克隆到表达载体pcDNA3.1上,通过HindⅢ酶切验证后,送到上海美吉生物医药科技有限公司测序,测得猪Mx1有1 989个碱 基,牛Mx1有1 962个碱基。将序列结果与GenBank中公布的序列比对后,发现猪Mx1基因同源性均为98%以上(表 1),牛Mx1同源性均为99%以上(表 2),表明两种Mx1基因克隆成功。
| A.A | N.A | |||
| M65087.1 (GenBank) | 397128 (Gene ID) | AB164037.1 (GenBank) | Sus -Mx1 | |
| M65087.1(GenBank) | # | 100 | 100 | 99.2 |
| 397128(Gene ID) | 100 | # | 100 | 99.2 |
| AB164037.1(GenBank) | 100 | 100 | # | 99.2 |
| Sus -Mx1 | 98.5 | 98.5 | 98.5 | # |
| Note:A.A:Amino acid;N.A:Nucleic acid | ||||
| A.A | N.A | |||
| 280872 (Gene ID) | AF047692.1 (BenBank) | JQ766265.1 (GenBank) | Bos -Mx1 | |
| 280872(Gene ID) | # | 99.8 | 99.9 | 99.8 |
| AF047692.1(GenBank) | 99.7 | # | 99.7 | 99.6 |
| JQ766265.1(GenBank) | 100 | 99.7 | # | 99.7 |
| Bos -Mx1 | 99.5 | 99.5 | 99.5 | # |
| Note:A.A:Amino acid;N.A:Nucleic acid | ||||
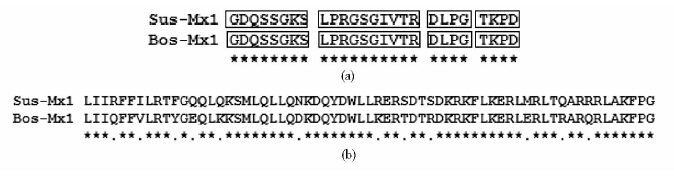
Mx氨基酸序列中含有N端GTPase域、中间域(MD)、C端GTPase效应域(GED)3个功能区。其中N端功能区氨基酸序列和C端中的亮氨酸拉链序列比对较多。N端GTPase域包含3个GTP结合基序(GDXXSGKS、DLPG和TKPD) 和一个动力蛋白标签(LPRXXGXXTR)。通过氨基酸序列比对发现,Sus-Mx1和Bos-Mx1 的N端(动力蛋白氨基酸序列和GTP结合位点)完全一致[图 2(a)],而C端的亮氨酸拉链同源性仅为81.54%[图 2(b)]。另外,猪Mx1蛋白的等电点(pI)为5.5,所带电荷为-14.43,带负电荷;牛Mx1等电点为5.44,所带电荷为-16.04,带负电荷,结合后面的实验结果,推测这种差异可能与Mx1抗病毒能力有关。
|
| 图 2 Sus-Mx2和Bos-Mx2功能区氨基酸序列比对 Fig. 2 Sequence alignment of functional domain of Sus-Mx1and Bos-Mx1 (a)N-terminal GTP-binding domain (b) C-terminal leucine zipper *:The same amino acid residues;.:Mutated amino acid residues |
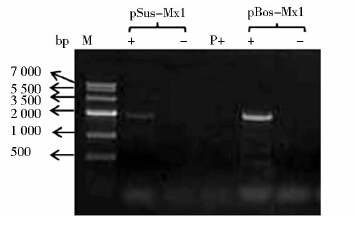
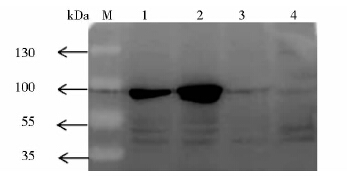
将构建的pSus-Mx1和pBos-Mx1分别转染到PK-15细胞,48h后收集细胞。部分细胞用于提取RNA,并反转录,扩增cDNA ,如图 3所示,目的片段的大小与预期相符,表明重组质粒中Mx1基因已经转录成mRNA。同时,部分细胞用于裂解,进行Western blot 检测,结果显示,细胞内表达了特异性的目的蛋白,大小与预期基本一致(图 4)。
|
| 图 3 重组质粒在PK-15细胞内mRNA水平鉴定 Fig. 3 Identification of mRNA of recombinant plasmids in PK-15 cells by RT-PCR M:DNA marker;+:Reverse transcriptase ; -:Non reverse transcriptase ;P:pcDNA3.1 |
|
| 图 4 重组质粒在PK-15细胞内的蛋白质表达鉴定 Fig. 4 Protein expression of recombination plasmids in PK-15 by Western blot M:Protein marker;1:Transfected pSus-Mx1;2:Transfected pBos-Mx1;3:Transfected pcDNA3.1;4:Non-transfection PK-15 |
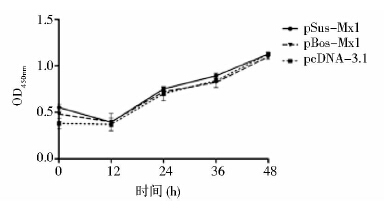
为了验证目的蛋白是否对细胞产生影响,用WST-1细胞增殖及细胞毒检测试剂盒检测细胞活性。分别在转染pSus-Mx1和pBos-Mx1后0h、12h、24h、36h、48h检测细胞的吸光值,结果表明,在不同时间点转染pSus-Mx1和pBos-Mx1的细胞其吸光值均高于或接近于转染对照质粒pcDNA 3.1的细胞的吸光值(图 5),这说明重组质粒在细胞内表达的蛋白质对细胞没有毒性。
|
| 图 5 重组质粒对PK-15细胞毒性检测 Fig. 5 Cytotoxicity assay of recombinant plasmids pSus-Mx1 and pBos-Mx1in PK-15 cells |
PRV感染PK-15细胞的病变特征:早期可见细胞膨大,随之细胞圆缩,继而开始脱落并逐渐形成空斑病灶,并有“拉网”等细胞病变(cytopathic effect,CPE)现象[10]。本文分别转染两种重组质粒24h后,以100TCID50攻毒,72h后放大100倍观察细胞的病变情况(图 6),结果显示,与正常对照细胞PK-15细胞[图 6(e)]相比,转染pcDNA3.1 和未转染pcDNA3.1的细胞病变程度一致,都表现为细胞脱落,同时转染pcDNA3.1 的细胞明显变大,如图 6(c)、(d)所示。因此符合PRV感染PK-15的细胞特征。而转染的两种重组质粒的细胞病变程度基本一致,并未出现细胞膨大和脱落,如图 6(a)、(b)所示。结果表明两种重组质粒在细胞内表达的蛋白质在一定程度上减轻了细胞的病变程度。

|
| 图 6 100TCID50PRV攻毒后72h的PK-15细胞病变(×100) Fig. 6 of PK-15 cells infected with 100TCID50 PRV after 72h(×100) (a) Transfected with pSus-Mx1 (b) Transfected with pBos-Mx1 (c) Transfected with pcDNA3.1 (d) Not-transfected PK-15 cells (e) uninfected PK-15 cells |
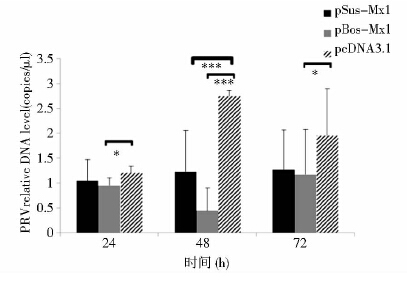
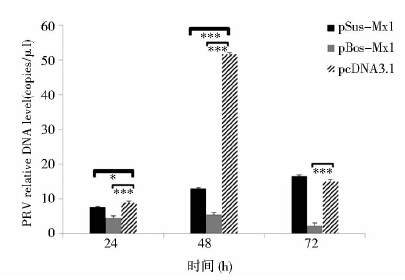
在pSus-Mx1、pBos-Mx1转染24h后,用20TCID50 PRV、100TCID50 PRV攻击细胞,在攻毒后24h、48h和72h取样检测。结果发现,用20TCID50 PRV攻击细胞后,在24h只有牛Mx1蛋白对PRV扩增有显著性的抑制作用(P<0.05)(图 7);48h这两种重组质粒都具有极显著的抑制效果(P<0.001)(图 7),抑制率为75%;用100TCID50 PRV攻击后,在24h只有牛Mx1蛋白对PRV扩增有显著性的抑制作用(P<0.001)(图 8),48h这两种Mx1蛋白都具有极显著的抑制效果(P<0.001)(图 8)抑制率为90%,牛Mx1蛋白在72h也出现极显著的抑制(P<0.001,图 8)。结果可见,这两种外源Mx1蛋白都具有抗病毒作用,但牛Mx1抑制PRV的能力更强。
|
| 图 7 猪Mx1、牛Mx1对20TCID50的PRV抑制效果 Fig. 7 Antiviral effects of Sus Mx1 and Bos Mx1 on PRV of 20TCID50 |
|
| 图 8 猪Mx1、牛Mx1对100TCID50的PRV抑制效果 Fig. 8 Antiviral effect of Sus Mx1 and Bos Mx1 on PRV of 100TCID50 |
Mx蛋白是宿主天然免疫系统抗病毒的重要介质,这种抗病毒能力是由Ι型(α/β)和Ш型(λ)干扰素诱导获得的,是指示I型干扰素及其受体相互作用的标记物。Mx是一种比2′,5′-OAS和PKR更为保守的一种抗病毒蛋白,并与前二者共同完成IFN的抗病毒生物学效应。
在抗动物病毒感染中,常用干扰素作为广谱抗病毒制剂。但是,干扰素的不良反应(如发热、感冒样症状、骨髓抑制、神经系统症状等)限制了它的使用。另外,干扰素虽然是广谱抗病毒制剂,但是存在较为严格的种属特异性,即在同种动物或细胞中活性高,对异种动物或细胞则活性较低或无活性。而Mx蛋白作为执行IFN抗病毒效应的蛋白质之一,是干扰素通路下游的激活基因,比较保守,又没有种属特异性[11]。因此,本文从Mx基因入手,探讨其抗PRV的能力,这既避免了干扰素的不良反应,又克服了IFN的种属特异性。
Mx蛋白具有广谱的抗病毒能力,对许多RNA病毒,如流感病毒、疱疹性口炎病毒、汉坦病毒、狂犬病病毒等都有抗性,甚至对DNA病毒,如乙型肝炎病毒也有一定的作用[8]。目前对Mx基因的研究主要集中在人Mx A和小鼠的Mx1基因,迄今为止Mx1蛋白抗伪狂犬病病毒(PRV)的研究尚未见报道。因此,本文研究两个不同种属的Mx1是否对PRV有抑制作用有着重要的应用价值。
本研究在检测了猪Mx1和牛Mx1蛋白对PK-15细胞、Marc-145细胞和BHK-21细胞没有毒性之后(结果未报道),分别检测了两种Mx1蛋白在PK-15细胞中抗20TCID50、100TCID50 的PRV病毒的能力。结果表明,两种Mx1蛋白在攻毒24h、48h后对不同攻毒剂量PRV的抑制趋势一致,表明这两种Mx1蛋白确实能够抑制PRV在PK-15细胞内的复制,且牛Mx1抗PRV的效果(抑制率为90%)优于猪Mx1(抑制率为75%)。但在72h时,用20TCID50PRV攻击转染了pBos-Mx1的细胞,没有明显的抑制作用,而对100TCID50PRV有抑制能力,出现这种现象的原因尚未清楚。但是从攻毒72h的细胞病变(图 6)可见,细胞内表达的Mx1可以使细胞获得保护。推测可能72h病毒核酸拷贝数检测与Mx1的抗病毒能力不呈正相关。Cai等[12]在BHK-21细胞中研究牛Mx1对口蹄疫病毒(FMDV)的抑制作用时,也采用了荧光定量的方法检测感染后细胞上清液中的病毒拷贝数,但也仅检测到48h 为止。在检测抗病毒效果方面,Huang等[13]只检测了细胞中PRV的拷贝数,而本实验检测了细胞内和上清液总的病毒拷贝数,这样可以更加准确地反映猪Mx1蛋白和牛Mx1蛋白的抗病毒能力。
通过对猪Mx1和牛Mx1蛋白抗PRV能力的检测,为开展这两种Mx1抗其他抗病毒的研究提供了数据支持。这两种有效抗PRV能力的基因也可能成为研究抗病毒转基因动物的候选基因。尽管猪Mx1和牛Mx1在细胞水平上具有明显的保护作用,仍然需要在动物水平上做进一步的验证。
| [1] | Yu X L, Zhou Z, Hu D M, et al. Pathogenic pseudorabies virus, China, 2012. Emerg Infect Dis, 2014, 20(1):102-104. |
| [2] | An T Q, Peng J M, Tian J M, et al. Pseudorabies virus variant in Bartha-K61-vaccinated Sus scrofas,China,2012. Emerg Infect Dis, 2013, 19(11): 1749-1755. |
| [3] | Wu R, Bai C, Sun J, et al. Emergence of virulent pseudorabies virus infection in Northern China.Vet Sci, 2013, 14(3):363-365. |
| [4] | Staeheli P, Pitossi F, Pavlovic J. Mx proteins: GTPases with antiviral activity. Trends Cell Biol, 1993, 3(8):268-272. |
| [5] | Fernández-Trujillo M A, García-Rosadob E, Alonso M C. Different antiviral activity of Mx1, Mx2 and Mx3 proteins from gilthead seabream (Sparusaurata) against infectious pancreatic necrosis virus (IPNV).Molecular Immunology, 2011, 49(1-2):107-114. |
| [6] | Aebi M, Fah J, Hurt N, et al. cDNA structures and regulation of two interferon-induced human Mx proteins. Mol Cell Biol, 1989, 9(11):5062-5072. |
| [7] | Staeheli P, Pravtcheva D, LundinLG,et al. Interferon-regulated influenza virus resistance gene Mx is localized on mouse chromosome 16. Virol, 1986, 58(3):967-969. |
| [8] | Verhelst J, Hulpiau P, Saelens X. Mx proteins: antiviral gatekeepers that restrain the uninvited.Microbiology and Molecular Biology Reviews, 2013, 7(4):551-566. |
| [9] | Fernández-Trujillo M A, García-Rosadob E, Alonso M C, et al. Mx1, Mx2 and Mx3 proteins from the gilthead seabream (Sparus aurata) show in vitro antiviral activity against RNA and DNA viruses. Molecular Immunology, 2013, 56(4): 630-636. |
| [10] | 王岩,杨明凡,崔保安,等.PK15、Vero、BHK、CEF细胞增殖猪伪狂犬病病毒的细胞比较.安徽农业科学,2007, 35(18):5432, 5445. Wang Y, Yang M F, Cui B A, et al. Infectivity titration comparison of PRV multiplied on PK-15, Vero, BKH and CEF. Journal of Anhui Agri Sci, 2007, 35(18):5432, 5445. |
| [11] | Sadler A J, Williams B R. Interferon-inducible antiviral effectors.Nat Rev Immunol, 2008; 8(7):559-568. |
| [12] | Cai K J, Meng Q L, Qiao J, et al. Expression of bovine Mx1 protein inhibits the replication of foot-and-mouth disease virus in BHK-21 cells.Acta Virologica,2013, 57(4):429-434. |
| [13] | Huang L, Cao R B, Wang N, et al. The design and recombinant protein expression of a consensus porcine interferon: CoPoIFN-a. Cytokine, 2012, 57(1):37-45. |
 2015, Vol. 35
2015, Vol. 35




