文章信息
- 王翠翠, 许蕙金兰, 傅达奇
- WANG Cui-cui, XU Hui-jin-lan, FU Da-qi
- 茄属生物碱的研究进展
- The Research Progress of Alkaloids in Solanaceous Crops
- 中国生物工程杂志, 2015, 35(2): 99-104
- China Biotechnology, 2015, 35(2): 99-104
- http://dx.doi.org/10.13523/j.cb.20150215
-
文章历史
- 收稿日期:2014-12-11
- 修回日期:2014-12-24
生物碱(alkaloids)是存在于生物体内的次级代谢物,是一种碱性含氮化合物,多数具有复杂的含氮杂环,具有光学活性和显著的生理学效应[1]。 甾体生物碱又叫做茄属生物碱,尤其在茄属植物中最为常见,甾体生物碱由三萜烯派生而来,经糖基转移酶作用,生成甾体糖苷生物碱。有研究表明甾体生物碱的合成可能发生在细胞溶质中,以胆固醇为前体物质,是氨基醇甾体骨架在C-3β(糖苷配基)上的糖基化形成的甾体生物碱[2,3,4,5,6],甾体糖苷生物碱是茄属植物主要的次级代谢产物,存在于植物组织中,主要包括根、花、叶、果实等[7,8,9]。甾体生物碱糖苷配基和糖部分的不同组合使糖苷生物碱(SGAs)结构多样,而且化学结构决定了它的生物活性,如,对动物的毒性,抗癌特性以及抗菌活性等[10,11,12,13,14]。如a-番茄碱通过裂解细胞膜,使电解质泄露,并去极化,起到抗菌作用[15,16,17,18]。
随着生活水平的提高,我们对食品品质的要求越来越高,提高营养质量,减少抗营养子就显得更加重要,增加食品营养的方法已经相当成熟,现在我们需要关注的是如何减少食品中有害的抗营养因子水平。抗营养物质包括致命的毒素以及阻碍消化、吸收的成分[19]。在作物长期驯化过程中,抗营养物质通过选择与育种,其含量已大大减少,但是,还有一些存在于食物中。目前,广泛采用回交的方法减少这些抗营养因子,但那是一个非常慢又复杂的过程。存在于茄属植物中的甾体糖苷生物碱是一类存在于我们的饮食与食物链当中的抗营养物质。在马铃薯当中,α-茄碱和α-卡茄碱是主要的抗营养因子,这些SGAs影响我们的肠胃消化和造成神经紊乱,浓度较高时能致人死亡。其毒性机制主要包括细胞膜破裂和抑制乙酰胆碱酶的活性。因此,当食物中,总糖苷生物碱含量超过200mg/kg鲜重时(FDA Poisonous Plant Database,www.accessdata.fda.gov/scripts/Plantox/),对人体是不安全的。但当生物碱作为药用时,具有抗肿瘤、抗疟疾、抗病原微生物、降低血浆,低密度脂蛋白 (LDL) 和降低胆固醇等功效,因此,本文对茄属生物碱的结构、分布、生理活性作用、茄属生物碱的合成途径在基因、酶等方面的研究进行综述。 1 茄科植物甾体糖苷生物碱的结构
糖苷生物碱是由疏水性的苷元(配基)和亲水性的寡糖链构成的甾体皂苷的一种,茄科植物糖苷生物碱是一类化合物,而不是一种物质,他们有苷元和糖基上的区别[20]。
苷元部分多是由一个非极性的甾体单元和一个含氮的杂环构成。苷元结构可分为茄次碱烷、螺旋甾碱烷和其他甾体衍生物3类(图 1)。以茄次碱烷为苷元的糖苷生物碱主要有α-茄碱、α-查茄碱和异红介藜芦碱等;以螺旋甾碱烷为苷元的糖苷生物碱主要有α-澳洲茄碱、α-边缘茄碱和番茄碱等。还有以其他甾体衍生物(22,26-缩亚胺胆甾烷等)为苷元的糖苷生物碱,如solanocongestidine以22,26-缩亚胺胆甾烷为苷元,圆锥茄碱、苦茄碱以3-氨基螺甾烷为苷元,大茄碱等以α-表氨基环半缩酮为苷元[5](图 2)。

|
| 图 1 糖苷生物碱苷元的结构 Fig. 1 Structures of aglycones in glycoalkaloid |
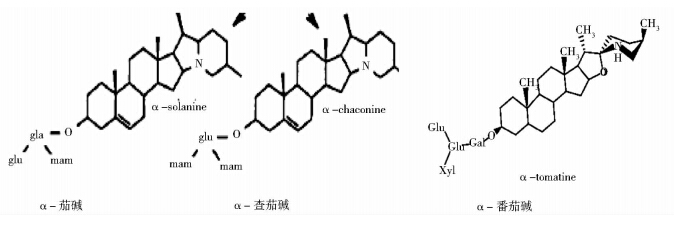
|
| 图 2 部分糖苷生物碱的结构 Fig. 2 Structures of glycoalkaloid |
对于寡糖链部分,它与苷元的“3-"位上以氧糖苷键连接。寡糖链的单糖一般为葡萄糖、半乳糖、鼠李糖、木糖和阿拉伯糖等,连接方式常由三糖或四糖构成分支糖链。下面是一些常见的糖苷生物碱的化学结构和来源[21](表 1)。
| 糖苷生物碱 | 糖链 | 糖苷配基 | 来源 |
| α-茄碱 | 鼠李糖-葡萄糖-鼠李糖 | 茄啶 | 马铃薯、茄子等 |
| α-查茄碱 | 鼠李糖-鼠李糖-葡萄糖 | 茄啶 | 马铃薯、茄子等 |
| α-澳洲茄碱 | 鼠李糖-葡萄糖-半乳糖 | 澳洲茄次碱 | 龙葵、茄子等 |
| α-边缘茄碱 | 鼠李糖-鼠李糖-葡萄糖 | 澳洲茄次碱 | 龙葵等 |
| 番茄碱 | 木糖-葡萄糖2-半乳糖 | 番茄次碱 | 番茄等 |
| α-苦茄碱 β-苦茄碱 | 鼠李糖-葡萄糖-半乳糖 鼠李糖-鼠李糖-葡萄糖 | 番茄烯胺 番茄烯胺 | 白英等 白英等 |
| 属羊泉碱 | 木糖-葡萄糖2-半乳糖 | 属羊泉次碱 | 白英等 |
| 异红介藜芦碱 | 葡萄糖 | 异红介藜芦胺 | 藜芦等 |
复杂的糖苷生物碱结构由HPLC-FTICR测定,在此基础上,通过测定m/z和经MSn(多级质谱联用)得到的裂解规律,分析其结构及分子式。糖苷生物碱复杂的结构多样性是由不同的化学修饰引起的,如糖基化、乙酰化、羟基化、和异构化等。Yoko等[22]在不同种类番茄中,测定其糖苷生物碱(SGAs)的结构特性,发现不同种类番茄中SGAs成分大不相同。尤其在野生型番茄中从α-番茄碱到番茄皂苷A的代谢中间物积累较多,具体的代谢途径还不明确。 2 茄科植物甾体糖苷生物碱的含量和分布
Itkin等[23]测定了甾体生物碱在马铃薯不同组织中、不同发育时期的含量分布,发现在绿熟期,果实、花、叶、花蕾当中含有25种甾体生物碱,如α-番茄碱、水解番茄硷及其同分异构体等。在红熟期(皮、果肉、种子),发现32种甾体生物碱。在花粉中,甾体生物碱含量非常少,只有一种。在根中,发现了两种去氢番茄碱苷的同分异构体。α-番茄碱的前体氨基醇水解番茄硷在绿色组织和根中很少。马铃薯叶子中生物碱的含量和种类是最多的。Alice等[24]研究马铃薯发现,在马铃薯地下部分,块茎、根、茎中SGAs的含量随生长发育变化不大,根的SGAs含量最少,干重约1.0~8.3 μmol/g,马铃薯地上部分,茎含量最少,干重6~13 μmol/g,叶子的含量变化,随生长发育,开始有一个延迟期,含量变化不大,随后,随着生长发育会呈线性积累过程,不断增多,直到叶片发育成熟。 3 茄科植物糖苷生物碱的生理活性
早在1967年Ameson等就已经研究了番茄碱对30种病原菌的抗性作用,发现当番茄碱浓度达到0.1 mg/ml时,可完全抑制白色念球菌,对毛癣菌等皮肤癣菌也有明显抑制作用。John等[25]研究麝香百合中甾体糖苷生物碱的抗真菌活性,发现甾体糖苷生物碱末端葡萄糖的C-6的乙酰化能抑制真菌葡萄孢菌的代谢速率增加抗真菌的活性。Itkin等[23]将GAME1基因沉默植株的提取液(主要是番茄次碱)加入固体培养基中,发现能够明显抑制致病真菌炭疽菌的生长。
带鞭毛的原虫能侵染人类,使人患锥虫病,这种病在拉丁美洲广泛分布。研究表明:卡茄碱、边缘茄碱和番茄碱能够在摩尔浓度抑制病原虫的生长,对锥虫病有很好的预防和治疗效果[26]。Miranda等[27]在番茄提取物对寄生虫毒性评估实验中发现,番茄提取物(20,32,50μg/ml),澳洲边茄碱(32,50μmol/L),澳洲茄碱(50μmol/L)和等摩尔浓度的糖苷生物碱(20,32,50μmol/L)能使100%的寄生虫24h内死亡,澳洲边茄碱20μmol/L使25%的寄生虫蠕虫在24h内死亡。而且发现不同浓度下寄生虫会表现为不同程度的蜕皮现象。并且对蠕虫的卵的孵育有不利影响。他们还发现有马铃薯三糖配基的澳洲边茄碱要比含茄三糖的澳洲茄碱活性高。
Hisen等[28]研究表明,龙葵碱可以通过降低肝脏内羟脯氨酸和一种平滑肌机动蛋白的水平,达到抑制肝脏纤维化的效果。Ding等[29]通过酸萃取和碱沉淀的方法以及多重层析技术从龙葵中提取糖苷生物碱,通过流式细胞术、比色测定和免疫细胞化学法等研究抗肿瘤活性,结果发现,澳洲茄碱、β1-茄碱、边茄碱等六种糖苷生物碱有抗恶性细胞增生的功能,受试细胞为MGC-803人类胃癌细胞,并且发现,有三糖的甾体糖苷生物碱比有二糖或一糖的抗肿瘤活性更高。
Friedman等[30]研究表明,给大鼠喂茄碱可以降低血液中胆固醇和甘油三酸酯的密度。陶永霞等[31]发现将一定量的番茄碱添加到含有黄油的正己烷中,发现溶液中的胆固醇被去除了,可见番茄碱可以降低饮食和体内自身的胆固醇。 4 茄属生物碱合成途径的研究
研究茄属生物碱的合成途径,首先是对其分子结构的研究。2008年,约50个不同的甾体生物碱在土豆块茎中(野生型和培养型),主要是龙葵次碱烷及龙葵次碱烷苷配基[32]。2013年,Yoko等[22]通过多项技术,证明SGAs的结构多样性来源于不同的化学修饰,如糖基化,乙酰化,羟基化和异构化等,发现除了α-番茄碱,番茄皂苷A,还有其他SGAs,如β-番茄碱、γ-番茄碱。
从分子生物学角度研究茄属生物碱的研究还较少。2003年 Arnqvist等[33]采用超表达大豆甾醇甲基转移酶(GmSMT1)cDNA的转基因马铃薯研究甾醇生物合成,证明它与抗营养因子糖苷生物碱的合成有关。糖苷生物碱的合成被转基因马铃薯植株下调,主要是由于游离胆固醇的减少,同时证明胆固醇是糖苷生物碱合成的前体物质。在培养型马铃薯中,α-茄碱和α-卡茄碱占总甾体生物碱约90%,其中与α-茄碱和α-卡茄碱生物合成相关的三个推定糖基转移酶基因已经确定。甾醇生物碱糖基转移酶1基因(SGT1)在体外,作为UDP-Gal:茄啶半乳糖苷转移酶,起作用[34]。沉默马铃薯SGT1导致代谢通路的重新定向,引起的α-茄碱和α-卡茄碱积累减少,它们的糖基单位分别是半乳糖和葡萄糖[35],SGT2编码UDP-GLc:茄啶葡糖苷转移酶,它能够调控α-卡茄碱的生物合成[34]。最后,SGT3编码UDP-Rha:β-茄碱/β-卡茄碱鼠李糖苷转移酶[36]。之后,又对番茄中与SGAs合成相关基因进行研究。2011年,Itkin等[23]对番茄GAME1进行研究,发现GAME1指导合成半乳糖基转移酶,促进糖苷配基水解番茄碱的糖基化,使番茄在绿色组织内产生SGA,GAME1沉默,植物表现为生长阻滞和病害等形态学表型。Ginzberg等[37]将马铃薯中转入3-羟基3-甲基戊而酸单酰辅酶A(HMG1)和鲨烯合酶(SQS1)编码区的基因。HMG1转基因植株甾醇C24-甲基转移酶和茄啶糖基转移酶2的转录物增多,表明甾醇的合成与HMG1转录物合成有关,同时数据表明,类异戊二烯的代谢和糖苷生物碱代谢的协调调节作用。目前,Itkin等[38]通过对番茄与土豆进行对比共表达分析以及化学分析,发现了10个与SGA生物合成相关的基因,分别为GAME1,GAME2,GAME4,GAME6,GAME11等。推断其代谢途径及相关基因调控如图 3所示。
图 3推测出从胆固醇到α-番茄碱的生物合成路径。虚线和实线箭头分别表示多个或单一酶反应的途径。基因GAME1,GAME4和GAME8的活性是通过研究转基因植物推测得到的。而基因GAME11,GAME 12,GAME18的功能是通过病毒诱导的基因沉默(virus-induced gene silencing,VIGS)实验验证的,而GAME1,GAME17,GAME18,GAME2的活性是通过重组酶实验验证的。 4 问题与展望
随着生活水平的提高,我们对食品品质的要求越来越高,提高营养质量,减少食品中甾体糖苷生物碱这些抗营养子就显得更加重要,增加食品营养的方法已经相当成熟,现在我们需要关注的是如何减少食品中这些有害的抗营养因子。尽管在少数茄科植物中糖苷生物碱的合成、代谢方面已有部分研究,但目前仍缺乏对于大部分茄科植物中糖苷生物碱的生物合成及代谢的研究,尤其对各种糖苷生物碱在不同植物中的合成机理,基因调控,酶等方面报道较少。相关基因的研究及合成路径仍是需要重点研究的方向。 糖苷生物碱结构复杂,具有多方面的的生物活性。如抗病原菌,抗肿瘤,降低胆固醇等。随着科技的进步对糖苷生物碱的研究已有了实质性的进展。目前,对于茄科植物糖苷生物碱生理活性的研究进行得比较广泛。但有关糖苷生物碱活性和毒性机制的研究还不够深入,只是涉及一些抑制胆碱酯酶、溶解破坏生物膜等。它们的协同作用及其机制应当引起广泛关注。对糖苷生物碱结构、活性和毒性机制的研究还需重点突破。
只有将甾体糖苷生物碱这类化合物的化学结构、性质,生物活性机制,毒理学效应和合成途径研究清楚了,才能实现对糖苷生物碱的开发利用,使人类更好地利用这些植物资源。造福于人类社会。
| [1] | 南京大学化学系有机化学教研室. 有机化学. 北京:高等教育出版社, 1988. 329. Organic chemistry teaching and reseach section in Nanjing university. Organic Chemistry.Beijing: Higher Education Press. 1988.329. |
| [2] | Bowles D. A multigene family of glycosyltransferases in a model plant, Arabidopsis thaliana. Biochem Soc Trans, 2002, 30(2): 301-306. |
| [3] | Friedman M. Tomato glycoalkaloids: role in the plant and in the diet. J Agric Food Chem, 2002, 50(21): 5751-5780. |
| [4] | Arnqvist L, Dutta P C, Jonsson L, et al. Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA. Plant Physiol, 2003, 131(4): 1792-1799. |
| [5] | Kalinowska M, Zimowski J, Paczkowski C. The formation of sugar chains in triterpenoid saponinsand glycoalkaloids. Phytochem, 2005,4: 237-257. |
| [6] | Bowles D, Lim E K, Poppenberger B, et al. Glycosyltransferases of lipophilic small molecules. Annu Rev Plant Biol, 2006, 57: 567-597. |
| [7] | Friedman M. Potato glycoalkaloids and metabolites: roles in the plant and in the diet. J Agric Food Chem, 2006, 54(23): 8655-8681. |
| [8] | Kozukue N, Yoon K S, Byun G I, et al. Distribution of glycoalkaloids in potato tubers of 59 accessions of two wild and five cultivated Solanum species. J Agric Food Chem, 2008, 56(24): 11920-11928. |
| [9] | Mennella G, Rotino G L, Fibiani M, et al. Characterization of health-related compounds in eggplant (Solanum melongena L.) lines derived from introgression of allied species. J Agric Food Chem, 2010, 58(13): 7597-7603. |
| [10] | Blankemeyer J T, Mcwilliams M L, Rayburn J R, et al. Developmental toxicology of solamargine and solasonine glycoalkaloids in frog embryos. Food Chem Toxicol, 1998, 36(5): 383-389. |
| [11] | Blankemeyer J T, White J B, Stringer B K, et al. Effect of alphatomatine and tomatidine on membrane potential of frog embryos and active transport of ions in frog skin. Food Chem Toxicol, 1997,35(10):639-646. |
| [12] | Friedman M, Levin C E, Lee S U, et al. Tomatine-containing green tomato extracts inhibit growth of human breast, colon, liver, and stomach cancer cells. J Agric Food Chem, 2009, 57(13): 5727-5733. |
| [13] | Ikeda T, Ando J, Miyazono A, et al. Anti-herpes virus activity of Solanum steroidal glycosides. Biol Pharm Bull, 2000, 23(3): 363-364. |
| [14] | Milner S E, Brunton N P, Jones P W, et al. Bioactivities of glycoalkaloids and their aglycones from Solanum species. J Agric Food Chem, 2011, 59:3454-3484. |
| [15] | Mckee R K. Factors affecting the toxicity of solanine and related alkaloids to Fusarium caeruleum. J Gen Microbiol, 1959, 20(3): 686-696. |
| [16] | Steel C C, Drysdale R B. Electrolyte leakage from plant and fungal tissues and disruption of liposome membranes by α-tomatine. Phytochem, 1988, 27:1025-1030. |
| [17] | Keukens E A, de Vrije T, Fabrie C H, et al. Dual specificity of sterol-mediated glycoalkaloid induced membrane disruption. Biochim Biophys Acta, 1992, 1110(2): 127-136. |
| [18] | Keukens E A, de Vrije T, van den Boom C, et al. Molecular basis of glycoalkaloid induced membrane disruption. Biochim Biophys Acta, 1995, 1240(2): 216-228. |
| [19] | Dolan L C, Matulka R A, Burdock G A. Naturally occurring food toxins. Toxins (Basel),2010, 2(9): 2289-2332. |
| [20] | 李志文,周宝利,刘翔,等.茄科植物体内糖苷生物碱的生理生态活性研究进展.上海农业学报,2011,27(3):129-134. Li Z W,Zhou B L,Liu X,et al. The physiological ecology research progress of glycoalkaloids in Solanaceous crops.Acta Agriculturae Shanghai,2011,27(3):129-134. |
| [21] | Norma F H, Luz Maria R V, Daniel G M. Computational note on the calculation of the dipolemoment, polarizability and hyperpolarizability of solanidine. Journal of Molecular Structure, Theochem, 2008, 849(30):122-123. |
| [22] | Yoko I,Bunta W,Ryosuke S,et al. Steroidal glycoalkaloid profiling and structures of glycoalkaloids in wild tomato fruit.Phytochem,2013,95:145-157. |
| [23] | Itkin M, Rogachev I, Alkan N, et al. Glycoalkaloid metabolism1 is required for steroidal alkaloid glycosylation and prevention of phytotoxicity in tomato. Plant Cell, 2011, 23(12): 4507-4525. |
| [24] | Alice M M,Danielle H,Rebecca P,et al, Steroidal glycoalkaloids in Solanum chacoense.Phytochem, 2012,75:32-40. |
| [25] | John P, Munafo J, Thomas J Gianfagna. Antifungal activity and fungal metabolism of steroidal glycosides of easter lily (Lilium longiflorum Thunb.) by the plant pathogenic fungus, Botrytis cinerea.J Agri Food Chem, 2011, 59: 5945-5954 |
| [26] | Christopher A, Hobby H T, Cipollini M. Efficacy and mechanisms of α-solasonine and α-solamargine-induced cytolysis on two strains of Trypanosoma cruzi.Journal of Chemical Ecology, 2004, 32(11):2405-2416. |
| [27] | Miranda M A, Magalh L G, Tiossi R F J. Evaluation of the schistosomicidal activity of the steroidal alkaloids from Solanum lycocarpum fruits. Parasitol Res, 2012,12:257-262. |
| [28] | Hisen C C, Fang H L, Lina W C. Inhibitory effect of Solanum nigrum on thioacetamide-induced liver fibrosis in mice. J Ethnopharmacol, 2008, 119(1): 117-121. |
| [29] | Ding X, Zhu F, Yang Y, et al. Purification, antitumor activity in vitro of steroidal glycoalkaloids from black nightshade (Solanum nigrum L.). Food Chem, 2013, 141(2): 1181-1186. |
| [30] | Friedman M, Fitch T E, Yokoyama W E. Lowering of plasma LDL cholesterol in hamsters by the tomato glycoalkaloid tomatine. Food Chem Toxicol, 2000, 38(7): 549-553. |
| [31] | 陶永霞,刘洪海,王忠民,等. 番茄碱的研究现状及应用前景. 现代食品科技, 2006,22(2):253-256. Tao Y X, Liu H H,Wang Z M,et al.The present research situation and application prospect of tomatine.Modern Food Science and Technology,2006,22(2):253-256. |
| [32] | Shakya R, Navarre D A. LC-MS analysis of solanidane glycoalkaloid diversity among tubers of four wild potato species and three cultivars (Solanum tuberosum). J Agric Food Chem, 2008, 56(16): 6949-6958. |
| [33] | Arnqvist L, Dutta P C, Jonsson L, et al. Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA. Plant Physiol, 2003, 131(4): 1792-1799. |
| [34] | Moehs C P, Allen P V, Friedman M, et al. Cloning and expression of solanidine UDP-glucose glucosyltransferase from potato. Plant J, 1997, 11(2): 227-236. |
| [35] | Rockhold D R, Corsini D L, Davies H V, et al. Metabolic compensation of steroidal glycoalkaloid biosynthesis in transgenic potato tubers: using reverse genetics to confirm the in vivo enzyme function of a steroidal alkaloid galactosyltransferase.Plant Sci, 2005, 168:267-273. |
| [36] | Mccue K F, Allen P V, Shepherd L V, et al. The primary in vivo steroidal alkaloid glucosyltransferase from potato. Phytochem, 2006, 67(15): 1590-1597. |
| [37] | Ginzberg I, Thippeswamy M, Fogelman E, et al. Induction of potato steroidal glycoalkaloid biosynthetic pathway by overexpression of cDNA encoding primary metabolism HMG-CoA reductase and squalene synthase. Planta, 2012, 235(6): 1341-1353. |
| [38] | Itkin M, Heinig U, Tzfadia O,et al. Biosynthesis of antinutritional alkaloids in Solanaceous crops is mediated by clustered.Genes Science, 2013,341:175-179. |
 2015, Vol. 35
2015, Vol. 35





