文章信息
- 佘栋宇, 黄嘉慧, 刘东晨, 张途, 谢秋玲
- SHE Dong-yu, HUANG Jia-hui, LIU Dong-chen, ZHANG Tu, XIE Qiu-ling
- Her2抗体与MMAE偶联物的制备及生物活性研究
- Preparation and Biological Activity of Anti-Her2 Antibody-MMAE Conjugate
- 中国生物工程杂志, 2015, 35(2): 66-71
- China Biotechnology, 2015, 35(2): 66-71
- http://dx.doi.org/10.13523/j.cb.20150210
-
文章历史
- 收稿日期:2014-12-15
- 修回日期:2014-12-29
在肿瘤的治疗中,小分子化合物依然是最重要的一线药物,虽然其对正常组织的毒性一直是值得担心的问题。近二十年来,随着单克隆抗体生产技术的发展,已经逐渐成为临床上治疗肿瘤的另一有效方法。单克隆抗体具有高特异性,能够特异识别抗原位点,不对正常组织和器官造成损伤且半衰期长[1]。这正是化学治疗药物所不具备的优点,但临床试验数据表明,当单克隆抗体作为单独的治疗药物时,疗效较差[2,3]。怎样将单克隆抗体与小分子化合物的优势结合起来,抗体-化合物药物偶联物(Antibody-Drug-Conjugate,ADC)在近年来成为研究热点。
ADC药物是将对肿瘤细胞具有高毒性的小分子毒素通过一个具有连接功能的短肽与单克隆抗体连接起来,形成抗体复合物[4]。ADC药物的抗体部分具有高特异性,作为靶向载体将小分子毒素带到肿瘤组织附近,小分子毒素发挥其高毒性,杀伤肿瘤细胞,同时减少对正常组织和器官的损伤,且能够避免抗体耐药性的产生。
目前,美国FDA共批准了三个ADC药物上市(其中一个药物被撤销),其中包括Genentech公司所生产的治疗转移性乳腺癌药物T-DM1,该药物是将治疗乳腺癌的人类表皮生长因子受体2(Her2)的抗体(Trastuzumab)与小分子毒素(美登素的衍生物DM1)通过不可降解的连接子Sulfo-SMCC偶联形成的,对转移性乳腺癌治疗具有良好的疗效[5]。另一个ADC药物是淋巴瘤治疗药物Brentuximab vedotin,是将CD30抗体与微管抑制剂海兔毒素衍生物(MMAE)相偶联[6]。目前国外有几十个ADC药物进入临床试验阶段,我国对于ADC的研究刚刚起步,关于ADC药物申报临床的信息更是未见报道。
研究表明连接子不同对于药物药效和药代动力学有一定影响[7]。本研究尝试将人表皮生长因子受体2(Her2)抗体(PH)与新的连接子和毒素分子相连接,即与具有高毒性的小分子海兔毒素衍生物(MonomethylAuristain E,MMAE)通过可降解的连接子MC-Val-Cit-PAB连接,制备抗体偶联物。本研究对可降解连接子以及MMAE毒素构成的ADC药物对于乳腺癌细胞的抑制作用和机理进行初步探讨。 1 材料与方法 1.1 ADC药物的制备与检测
本实验所用PH抗体为本实验室自行制备,还原剂[Tris(2-carboxyethy1)phosphine,TCEP]购买自Sigma公司,小分子生物毒素及偶联剂购自美国,所用4%~5%梯度凝胶购买自杭州弗点生物科技有限公司。纯化设备AKTA(avant 25)、分析设备HPLC(Ultimate3000)由基因工程药物国家工程研究中心提供,疏水层析柱(TSKgel Butyl-NPR)购于上海东曹公司,其他试剂均为国产分析纯。
偶联方法见参考文献[8],用适量浓度的还原剂将PH抗体还原,让抗体链间的巯基暴露出来,在适当条件下按照一定比例加入linker和毒素,通过巯基与linker上的马来酰亚胺基团发生加成反应,从而将抗体和毒素小分子偶联在一起。将偶联后的混合物进行脱盐处理,除去残留的小分子毒素,然后利用4%~15%的梯度凝胶进行SDS-PAGE电泳进行定性检测,选用HPLC进行疏水层析定量检测[9,10]。 1.2 ADC药物对肿瘤细胞的抑制
乳腺癌细胞株BT-474和MDA-MB-231用含 1 0% 胎牛血清的RPMI 1640 完全培养基在 37℃、体积分数为 5% 的 CO2条件下进行常规培养。
将对数生长期的细胞消化后,以10 000个/孔铺板于96孔板,加入不同浓度的PH或ADC药物(药物用含10%胎牛血清的1640培养基稀释)终体积为0.1ml,阴性对照孔加0.1ml 含10%的胎牛血清的1640培养基,37℃、5% 的 CO2条件下培养5天。每孔加10μl CCK-8,孵育2h,用酶标仪测定450nm OD值[11]。 1.3 细胞凋亡检测和细胞周期检测
取处于对数生长期的乳腺癌细胞株BT-474,消化后以200 000个/孔铺板于6孔板,过夜固定后,加入不同浓度的PH或ADC药物(药物用含10%的胎牛血清的1640培养基稀释)终体积为2ml,阴性对照孔加含10%胎牛血清的1640培养基,在37℃、5% 的 CO2条件下培养72h。将上清和消化下来的细胞离心,用PBS反复润洗3次后,用Annexin V/PI双染,避光孵育15min,终止反应后,用流式细胞仪(Minipore GUAVA)检测细胞凋亡情况。
细胞周期检测方法同细胞凋亡,染色液为PI。 2 结果与分析 2.1 ADC药物的制备及检测
抗体PH在还原剂作用下,暴露出分子间的自由巯基,在适合条件下,通过与linker上马来酰亚胺基团发生加成反应,从而将PH与毒素分子连接在一起,形成抗体药物偶联物(图 1)。将制备的样品,通过葡聚糖凝胶柱(G-25)除去未被偶联的小分子MMAE,纯化后的样品回收率达90%以上。
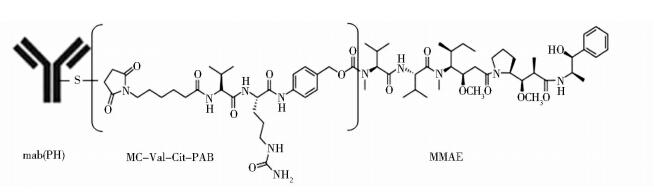
|
| 图 1 抗体药物偶联物的组成及结构 Fig. 1 Structure of antibody drug conjugate |
得到的ADC是一混合物,是含有偶联了不同数量小分子毒素的抗体分子。可通过SDS-PAGE电泳和高效液相色谱(HPLC)方法进行检测,并对ADC的组成成分进行分析。
运用SDS-PAGE电泳,检测制备的ADC,还原电泳条件下,PH被还原成两条条带,分别对应抗体的重链(Heavy Chain,H)和轻链(Light Chain,L);而ADC在电泳中的两条条带均略高于PH的两条条带,表明在ADC的重链和轻链上都分别偶联上了MMAE(图 2)。非还原电泳中则出现多条条带,其中150kDa左右处的条带为完整抗体(H2L2);125kDa,100kDa,75kDa,50kDa处的条带分别对应抗体的(H2L)、(H2)、(HL)、(H)和(L)。与还原电泳的结果一致,ADC在不同位置的条带都略高于抗体条带,说明分子量略大于抗体,表明这些片段均偶联上MMAE(图 2)。
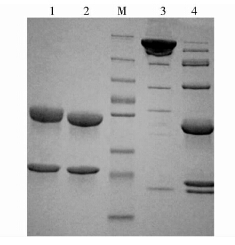
|
| 图 2 SDS-PAGE检测ADC Fig. 2 SDS-PAGE of ADC 1,2:ADC and PH in reducing condition; M:Marker; 3,4:PH and ADC in non-reducing condition |
利用HPLC对纯化后的ADC进行疏水层析(Hydrophobic Interaction Chromatography,HIC)分析,检测偶联率和各组分所占的比例。HPLC图谱(图 3b)显示有5个峰,其中第一个峰与PH出峰时间相同(图 3a),因此是未偶联MMAE的裸抗,后面的4个峰为载药量不同的偶联物。因为抗体含有4对链间二硫键,经还原后能得到最多8个半胱氨酸,理论上其偶联数量应该是2,4,6或8个小分子。偶联条件如投料比、温度、时间等不同,各组分所占的比例也不尽相同。
通过偶联条件优化,我们最终的偶联率,即偶联有小分子的偶联物占整个混合物的比例,可以达到80%。
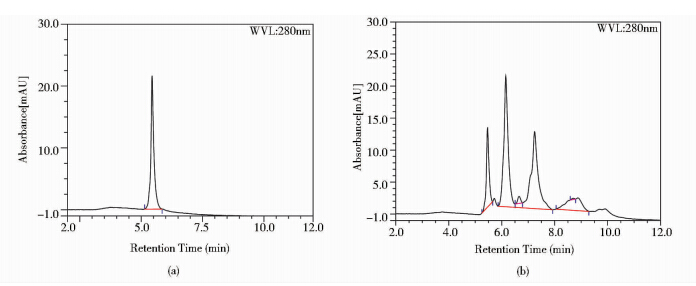
|
| 图 3 HIC检测载药量分布 Fig. 3 Drug loading distribution calculation by HIC (a) PH (b) ADC |
为检测ADC药物的生物学活性,分别选用Her2阳性的BT-474和Her2低表达的MDA-MB-231细胞株作为研究对象,不同剂量给药后,测定细胞生长情况,并与抗体PH进行比较。
图 4a显示在对乳腺癌细胞BT-474给药5天后,ADC药物(■)的IC50较PH药物(▲)的IC50低,表明ADC药物对肿瘤细胞的杀伤活性较单纯的抗体药物高。而Her2低表达的乳腺癌细胞MDA-MB-231因为Her2表达较低,因而对抗体药物(▲)不敏感,但ADC药物(■)对MDA-MB-231细胞的抑制率明显提高。表明对于Her2低表达的MDA-MB-231细胞株,ADC药物具有明显的疗效(图 4b)。
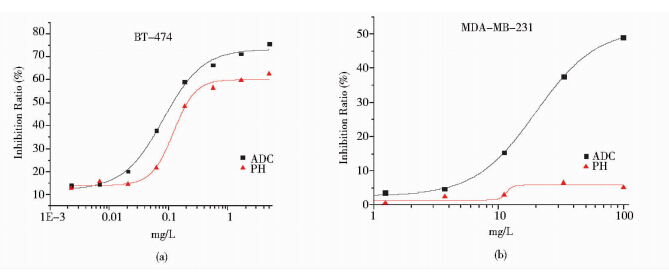
|
| 图 4 ADC对肿瘤细胞的生长影响 Fig. 4 Effect of ADC on tumor cell growth (a) Effect of PH (▲) 和ADC (■) on BT-474 cells (b) Effect of PH (▲) and ADC (■) on MDA-MB-231 cells |
为了解ADC药物诱导乳腺癌阳性细胞凋亡情况,选用乳腺癌阳性细胞BT-474,给药后分别测定ADC药物和PH药物诱导细胞凋亡的效率,并比较两者间的差异。
Annexin V/PI双染结果显示(图 5),PH、ADC均能诱导BT-474细胞凋亡,其中,PH的早凋/晚凋比例为3.32%/15%,ADC则是4.23%/35.2%,ADC处理组诱导细胞凋亡效率较单纯抗体组高近20%,表明ADC药物对乳腺癌阳性细胞BT-474的杀伤能力明显高于PH药物,这与ADC药物抑制肿瘤细胞实验的结果是一致的。
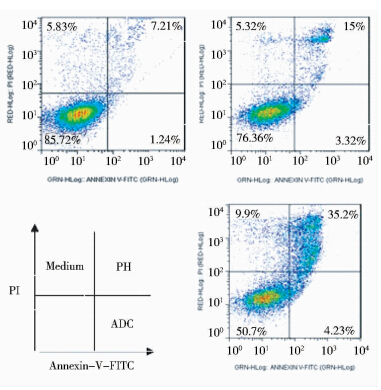
|
| 图 5 ADC药物诱导BT-474细胞凋亡 Fig. 5 Effect of ADC on induction of apoptosis in BT-474 cells |
选择乳腺癌阳性细胞BT-474测定PH、ADC对细胞周期的影响,比较两者之间的差异。结果表明: PH、ADC均能阻滞乳腺癌阳性细胞BT-474的细胞周期进程,与前面所述引起细胞凋亡结果一致。比较两种药物作用下BT-474细胞周期的分布,抗体药物和ADC药物处理组,均出现G1期细胞所占比例减小,S期基本保持稳定,G2期比例增加,两者都是阻滞细胞周期停留在G2期,但ADC药物组,G2期细胞数量明显增多,比PH组高近20%,证明偶联上MMAE的ADC对BT-474细胞周期的影响明显大于裸抗PH(图 6)。
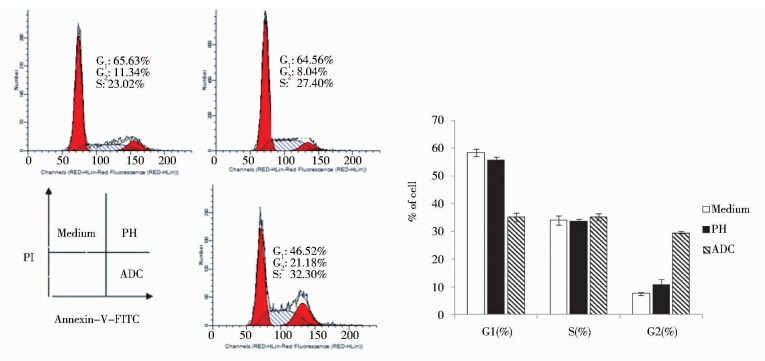
|
| 图 6 ADC药物对BT-474细胞周期的影响 Fig. 6 Effect of ADC on cell cycle of BT-474 |
实验结果显示,Her2抗体与MMAE相偶联所获得的ADC药物与裸抗PH相比,对乳腺癌细胞的抑制作用明显增强,诱导细胞凋亡能力显著提高。不仅对Her2高表达的肿瘤细胞有毒性作用,对于抗体抑制作用不明显的Her2低表达的肿瘤细胞,同样有很强的抑制作用。这与其他ADC药物的报道相一致。已经上市的T-DM1对于Her2阳性的乳腺癌细胞SK-BR-3具有比Her2抗体-曲妥珠单抗更强的生长抑制作用[4]。其他的ADC药物也展现了同样的结果,而且偶联小分子的数量也会影响ADC的生物活性[11]。
目前最常用于ADC合成中的小分子毒素是微管抑制剂。例如T-DM1中所使用的小分子化合物—美登素及其衍生物[12]。另一种是海兔毒素及其衍生物,这是一类最早从印度洋海兔Dolabella auricularia中提取的具有抗肿瘤活性的物质,目前所使用的多为人工合成的物质。其中的两种小分子化合物已应用于多种ADC药物的合成,包括目前已批准上市的霍杰金淋巴瘤治疗药物Brentuximab vedotin,这种ADC药物是将CD30抗体与MMAE相偶联所获得的[6,13]。本研究将MMAE与Her2抗体相偶联所获得的ADC药物也展现了很好的肿瘤抑制效果。
ADC药物虽然展现了很好的治疗肿瘤的前景,但其制备以及临床前的研究还面临着很多难题需要解
决,例如本实验所用ADC为含有裸抗和偶联MMAE分子数目不同的抗体药物偶联物,为一混合物,如何能将偶联MMAE分子数量不等的ADC分离,制定相应的质量标准将是工艺中的关键问题。而且ADC药物的药代动力学和毒理学既不同于抗体,也不同于小分子化合物,将会更为复杂,这些问题都是我们目前和将来要进行研究的内容。
| [1] | Carter P J. Introduction to current and future protein therapeutics: a protein engineering perspective. Experimental Cell Research, 2011, 317(9): 1261-1269. |
| [2] | Scott A M, Wolchok J D, Old L J. Antibody therapy of cancer. Nature Reviews Cancer, 2012, 12(4): 278-287. |
| [3] | Sapra P, Hooper A T, O'Donnell C J, et al. Investigational antibody drugconjugates for solid tumors. Expert Opinion on Investigational Drugs, 2011, 20(8): 1131-1149. |
| [4] | Junttila T T, Li G, Parsons K, et al. Trastuzumab-DM1 (T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Breast Cancer Research and Treatment, 2011, 128(2): 347-356. |
| [5] | Wu A M, Senter P D. Arming antibodies: prospects and challenges for immunoconjugates. Nature Biotechnology, 2005, 23(9): 1137-1146. |
| [6] | Bradley A M, Devine M, DeRemer D. Brentuximab vedotin: An anti-CD30 antibody-drug conjugate. American Journal of Health-System Pharmacy, 2013, 70(7): 589-597. |
| [7] | Gerber H P, Koehn F E, Abraham R T. The antibody-drug conjugate: an enabling modality fornatural product-based cancer therapeutics.Natural Product Reports, 2013, 30(5): 625-639. |
| [8] | Sun M M C, Beam K S, Cerveny C G, et al. Reduction-alkylation strategies for the modification of specific monoclonal antibody disulfides. Bioconjugate Chemistry, 2005, 16(5): 1282-1290. |
| [9] | Wagner-Rousset E, Janin-Bussat M C, Colas O, et al. Antibody-drug conjugate model fast characterization by LC-MS following IdeS proteolytic digestion [C]//MAbs. Landes Bioscience, 2014, 6(1): 173. |
| [10] | Zein N, Poncin M, Nilakantan R, et al. Calicheamicin gamma 1I and DNA: molecular recognition process responsible for site-specificity. Science, 1989, 244(4905): 697-699. |
| [11] | Hamblett K J, Senter P D, Chace D F, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate. Clinical Cancer Research, 2004, 10(20): 7063-7070. |
| [12] | Mandelbaum-Shavit F, Wolpert-DeFilippes M K, Johns D G. Binding of maytansine to rat brain tubulin. Biochemical and Biophysical Research Communications, 1976, 72(1): 47-54. |
| [13] | Sapra P, Hooper A T, O'Donnell C J, et al. Investigational antibody drug conjugates for solid tumors. Expert Opinion on Investigational Drugs, 2011, 20(8): 1131-1149. |
 2015, Vol. 35
2015, Vol. 35




