文章信息
- 褚晓杰, 李杨, 龙琼, 姚宇峰, 孙文佳, 黄惟巍, 杨旭, 刘存宝, 马雁冰
- CHU Xiao-jie, LI Yang, LONG Qiong, YAO Yu-feng, SUN Wen-jia, HUANG Wei-wei, YANG Xu, Liu Cun-bao, MA Yan-bing
- 基于HPV16 E7蛋白CTLs抗原肽的病毒样颗粒治疗性疫苗的构建
- Development of a HPV16 E7 CTLs Peptides-based Virus-like Particle Therapeutic Vaccine
- 中国生物工程杂志, 2015, 35(2): 45-51
- China Biotechnology, 2015, 35(2): 45-51
- http://dx.doi.org/10.13523/j.cb.20150207
-
文章历史
- 收稿日期:2014-11-26
- 修回日期:2014-12-18
2. 云南省重大传染病疫苗研发重点实验室 昆明 650118;
3. 云南省重大传染病疫苗工程技术研究中心 昆明 650118
2. Yunnan Key Laboratory of Vaccine Research&Development on Severe Infectious Disease, Kunming 650118, China;
3. Yunnan Engineering Research Center of Vaccine Research and Development on Severe Infectious Disease, Kunming 650118, China
宫颈癌是危害妇女健康最为严重的疾病之一,在女性肿瘤发病率中占第二位。在全世界范围内,每年大约有49.3万个新发病例和27.4万个死亡病例[1],我国宫颈癌患者以每年14万人的速度增长,死亡人数在5万左右。而在所有的宫颈癌病例中几乎都可检测到HPV的存在。HPV感染还引起肛门癌,外阴癌,阴道癌和阴茎癌[2],此外,HPV感染也是头颈癌等非生殖道癌发生的重要原因。现在已经明确高危型HPV的持续感染是宫颈癌发生和存在的必要因素。而在高危型HPV中,16、18型与70%的宫颈癌相关,而16型与超过50%的宫颈癌相关。国际上已商业化的预防性HPV疫苗对于已经建立的HPV感染或肿瘤,没有明显治疗作用。由于其价格昂贵等原因造成目前疫苗接种率还很低;现有疫苗无法对其它约30%的宫颈癌起到预防保护;宫颈筛查普及率低等,这些因素造成HPV感染引起的宫颈癌前病变(CIN)及宫颈癌发病率仍然很高。因此,研制治疗性HPV疫苗,针对癌前病变和肿瘤进行免疫治疗,具有对HPV相关疾病治疗控制的广阔应用前景。
研究表明,HPV的早期蛋白E6和E7在HPV慢性感染及肿瘤的发生发展过程中起到了重要的作用。E6蛋白使P53蛋白失活,并通过与E6-AP相互作用,从而抑制IL-1β的分泌,导致caspase-1功能紊乱,从而导致对感染缺失免疫监视[3];E7蛋白与低磷酸化Rb结合,破坏Rb-E2F复合物,导致E2F活性失调,使早期有丝分裂抑制子1(EMI1)累积,从而导致其作用底物细胞周期后期促进复合物(APC/C)异常紊乱,最终使细胞周期紊乱,导致组织增生[4]。E6、E7在感染的上皮细胞中持续高表达使得其成为控制和清除HPV慢性感染并阻止癌化的免疫治疗的理想靶标。治疗性HPV疫苗的研究主要致力于通过构建疫苗诱导强的E6和E7特异的细胞免疫应答。目前针对HPV16 E6和E7抗原的小鼠和人的一些T细胞表位已经鉴定,如E6 43-57[5]、E7 11-20、E7 49-57、E7 86-93[6]等CTLs表位、E7 1-12、E7 48-62、E7 62-75 等Th表位,以及既是CTLs表位又为Th表位的E7 44-62[7]。在Ⅰ期或Ⅱ期临床试验中,应用E7 11-22和86-93多肽疫苗对于HPV16引起的早期的宫颈疾病产生了一定的肽特异性的免疫应答,但未达到显著临床治疗意义[8]。增强基于抗原肽的疫苗的免疫原性,诱导更强的Th1/CTLs免疫应答,对于临床获得理想效果具有重要意义。
乙肝核心抗原(HBcAg)具有很强的免疫原性,其特点包括(1)病毒样颗粒结构以及抗原表位的高度有序、重复排列,显著增加了抗原免疫原性;(2)可介导Th1偏向的免疫应答,有助于诱导CTLs细胞免疫应答。本研究旨在构建呈现E7抗原表位的HBcAg病毒样颗粒候选疫苗,探讨其作为治疗性疫苗载体的潜能,为开展HPV治疗性疫苗研究提供基础。 1 材料与方法 1.1 实验动物
雌性6~8周龄C57BL/6,体重16~18g,购自北京维通利华实验动物技术有限公司[编号:SCXK(京)2012-0001],饲养于清洁级动物房。 1.2 质粒、菌株及细胞
质粒pThioHisA-HBcAg,简称NP,由本室构建,是将改造过的乙型肝炎核心抗原(HBcAg)基因克隆于pThioHisA表达载体,通过改造允许外源蛋白或肽插入HBcAg优势抗原表位;大肠杆菌(E.coli)DH5α购自北京全式金生物技术有限公司;TC-1细胞,即转染了ras基因、HPV16 E6和E7基因的肿瘤细胞,购自中国医学科学院肿瘤细胞库。 1.3 实验试剂
质粒提取试剂盒、胶回收试剂盒和纯化试剂盒购自上海华舜生物技术有限公司;限制性内切酶BamHⅠ、EcoRⅠ、NdeⅠ、T4 DNA连接酶购自宝生物工程(大连)有限公司; 抗鼠 IFN-γ捕获抗体(编号E05491-1631)与生物素化抗鼠IFN-γ 检测抗体(编号E03266-1631)购自eBioscience公司;亲和素偶联碱性磷酸酶,碱性磷酸酶底物购自Sigma-Aldrich公司;Sephadex G25填料购自美国GE公司;SRT SEC-1000 HPLC凝胶过滤色谱柱购自SHIMADZU公司;RPMI1640细胞培养液购自HyClone公司;Basement Membrane Matrix购自BD Biosciences公司;淋巴细胞分离液购自北京达科为生物技术有限公司。 1.4 HPV16 E7抗原表位寡核苷酸序列的合成
HPV16 E7抗原表位选自文献报道过的有效表位,分别为E7 11-20(ref#)、49-57(ref#)、83-95(ref#)。分别命名为B1、B4、B8。 三个表位的寡核苷酸序列由生工生物工程(上海)股份有限公司合成(表 1)。
| 抗原肽 | 表位位置 | 氨基酸序列 | 核酸序列 |
| B1 | 11-20 | ymldlqpett | 正链gatctTACATGTTAGACCTGCAGCCAGAAACCACCggatccggtg 负链aattcaccggatccGGTGGTTTCTGGCTGCAGGTCTAACATGTAa |
| B4 | 49-57 | ahynivtf | 正链gatctGCTCACTACAACATCGTTACCTTCggatccggtg 负链aattcaccggatccGAAGGTAACGATGTTGTAGTGAGCa |
| B8 | 83-95 | lmgtlgivcpics | 正链gatctCTGATGGGTACCTTAGGTATCGTTTGTCCAATCTGCTCTggatccggtg 负链aattcaccggatccAGAGCAGATTGGACAAACGATACCTAAGGTACCCATCAGa |
将合成的寡核苷酸用TE缓冲液溶解,配成50μmol/L储存液。在10 μl的体系内,正负寡核苷酸片段以0.1mmol/L的浓度1∶1混合,在95℃的条件下变性30s,缓慢直至冷却至室温退火复性,从而形成编码抗原肽的双链DNA片段。 1.5.2 重组表达质粒的构建
将质粒NP在50μl的体系内应用BamHⅠ和EcoRⅠ进行双酶切,胶回收载体片段,T4 DNA连接酶与制备的双链DNA片段 在16℃过夜连接,得到的连接产物转化DH5α,并涂布于含氨苄西林的LB平板上,过夜培养后挑取单菌落,摇菌并提取质粒,将提取的质粒用EcoRⅠ和NdeⅠ进行双酶切鉴定,鉴定正确的质粒送至生工生物工程(上海)股份有限公司进行测序。 1.6 目的基因的诱导表达
将鉴定正确的重组表达质粒转化感受态DH5a,挑取单菌落并接种至LB液体培养基中,37℃、280 r/min过夜培养,然后将菌液按5%转接至新的LB液体培养基内,培养至菌液OD600值为0.4~0.6时,加入浓度为1mmol/L的IPTG诱导 4h,表达产物经12%的SDS-PAGE进行分离鉴定。 1.7 病毒样颗粒的纯化及鉴定 1.7.1 硫酸铵盐析法初步纯化重组蛋白
将培养的菌液离心收集菌体,经超声波破碎后离心,13 000 g,4℃,10min。收集的上清液用40%饱和度的硫酸铵室温沉淀30 min,12 000g室温离心10min,离心后的沉淀用20%饱和度的硫酸铵洗涤3次后,用PBS缓冲液重悬,离心取上清,进行下一步纯化。 1.7.2 蔗糖密度梯度离心进一步纯化重组蛋白
预先铺好蔗糖浓度梯度,从上至下蔗糖浓度分别为10%、20%、30%、40%和50%,每层1.8ml,将硫酸铵初步纯化后的蛋白2 ml加至蔗糖梯度最上层,40 000g、4℃离心4h,离心后的样品从上至下逐层取样,每层1ml,每层的样品进行SDS-PAGE分析。随后应用Sephadex G25凝胶层析柱进行脱盐。 1.7.3 病毒样颗粒的高效液相色谱(HPLC)分析
将密度梯度离心后的每层样品取20μl进行HPLC分析,柱子为SRT SEC-1000,流速0.2ml/min,流动相为PBS。根据出峰时间鉴定病毒样颗粒及其纯度。 1.7.4 电镜观察
将密度梯度离心后的样品经磷钨酸负染后,电镜观察病毒样颗粒(VLPs)。 1.8 病毒样颗粒的免疫效果评价 1.8.1 肿瘤细胞培养及移植肿瘤模型建立
应用含10%胎牛血清、3%谷氨酰胺和1%青霉素/链霉素的RPMI1640培养基在37℃、5% CO2培养箱内培养TC-1细胞,随后用PBS润洗细胞2~3次后,胰酶消化并用PBS重悬计数,将细胞悬液和Basement Membrane Matrix按1∶1的比例配制成浓度为1×106/ml 的细胞悬液,小鼠右侧腹皮下注射100 μl细胞悬液,建立小鼠HPV感染肿瘤模型。 1.8.2 小鼠VLPs免疫干预
小鼠肿瘤长至4~5mm时,将纯化的VLPs以50 μg的剂量皮下免疫小鼠,共3次,间隔为1周。小鼠肿瘤大小每隔2~3d测量一次,并根据公式0.4×a×b2计算肿瘤体积(a,b分别为肿瘤的最长直径和最短直径)。 1.8.3 脾细胞的抗原肽刺激
小鼠第三次免疫后一周取脾脏,在平皿中加入5ml淋巴细胞分离液研磨,将悬有脾脏细胞的分离液转移至15ml离心管中,覆盖500 μl的RPMI1640培养基;室温,800g离心30min,吸出淋巴细胞层,再加入10ml RPMI1640培养基,颠倒洗涤,室温250g离心10min收集细胞,倾倒上清液后用含10%胎牛血清的RPMI1640培养基重悬细胞并进行细胞计数。计数后以每孔细胞数为3×105个在96孔细胞培养板内进行体外刺激,短肽浓度为5μg/ml,并在37℃、5% CO2培养箱内培养,刺激72h后取细胞培养上清进行ELISA检测IFN-γ水平。 1.8.4 ELISA检测INF-γ表达
将IFN-γ捕获抗体(1∶250稀释)加入96孔板中,50μl/孔,4℃湿盒包被过夜;PBST(含0.5%Tween20的PBS缓冲液)洗涤3次,加入2%BSA室温封闭2h;PBST洗涤3次,加入细胞培养上清,室温孵育1h;PBST洗涤3次,加入碱性磷酸酶标记的IFN-γ检测抗体(1∶250稀释),室温孵育1h;PBST洗涤3次,加入 亲和素-碱性磷酸酶(1∶10 000稀释)室温孵育1h;PBST洗涤5次,加入碱性磷酸酶底物溶液,反应30min后,酶标仪检测A405值。 2 结 果 2.1 重组质粒的酶切鉴定
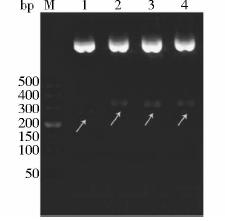
质粒NP和重组质粒NP-B1、NP-B4、NP-B8用EcoRⅠ和NdeⅠ进行双酶切,预计产物大小分别为273bp、303bp、297bp和312bp。2%琼脂糖凝胶电泳分析结果显示,所获得的目的条带大小与预期相符。见图 1。经测序后证明,插入的抗原肽的DNA片段序列正确。
|
| 图 1 重组质粒的酶切鉴定 Fig. 1 Identification of recombinant plasmids by restriction enzyme digestionM:DNA Marker DL500;1:Plasmid NP digested by EcoRⅠ/ NdeⅠ;2~4:Recombinant plasmids NP-B8,B1,B4 digested by EcoRⅠ/ NdeⅠrespectively |
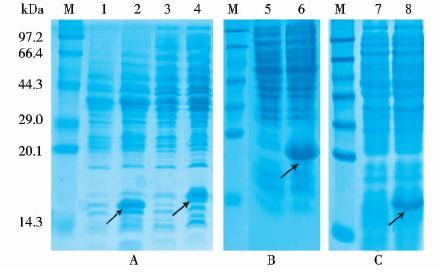
NP蛋白理论分子质量约为17.5kDa,重组蛋白NP-B1、NP-B4、NP-B8的相对分子质量分别约为18.7kDa、18.4kDa、18.8kDa。经SDS-PAGE分析表明,对比诱导前菌体蛋白,IPTG诱导后有特异蛋白表达,其相对分子量大小与预期的目的蛋白相符,见图 2。
|
| 图 2 SDS-PAGE分析目的蛋白经IPTG诱导后的表达Fig. 2 The expression of recombinant protein by SDS-PAGEM:Protein Marker;1:NP induced by IPTG for 0h;2:NP induced by IPTG for 4h;3:NP-B8 induced by IPTG for 0h;4:NP-B8 induced by IPTG for 4h;5:NP-B1 induced by IPTG for 0h;6:NP-B1 induced by IPTG for 4h;7:NP-B4 induced by IPTG for 0h;8:NP-B4 induced by IPTG for 4h |
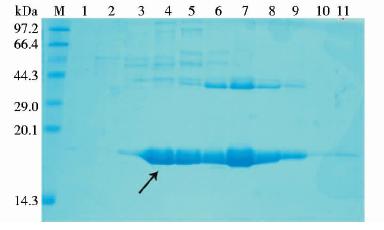
重组蛋白经硫酸铵盐析法和后续的蔗糖密度梯度离心后,用12%的SDS-PAGE分析显示,目的蛋白主要集中在4~9层,见图 3。
|
| 图 3 蔗糖密度梯度离心的SDS-PAGE分析Fig. 3 Sucrose density gradient centrifugation analysis of recombinant proteinM:Protein Marker;1~11:11 pipe solution of Sucrose density gradient centrifugation from top to bottom |
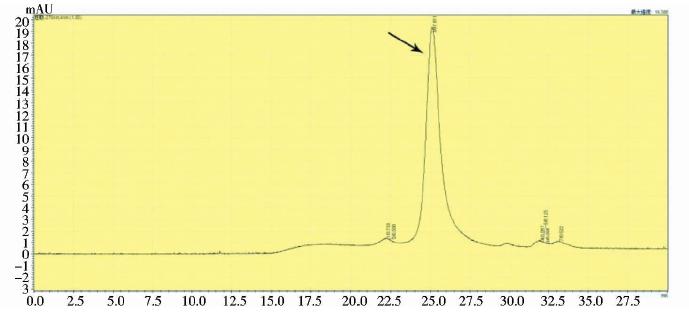
将蔗糖梯度离心后的每层含有蛋白的样品利用SRT SEC-1000柱进行HPLC分析,结果显示,成病毒样颗粒的目的蛋白主要集中在蔗糖密度梯度离心的7~9层。在0.2ml/min流速下,颗粒的洗脱时间在25min左右,见图 4。
|
| 图 4 病毒样颗粒的HPLC凝胶过滤分析Fig. 4 HPLC analysis of VLPs |
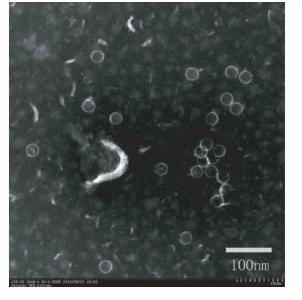
经电镜观察,携带抗原表位的重组HBcAg形成直径约30nm的病毒样颗粒,形态与HBcAg形成的颗粒类似,见图 5。
|
| 图 5 病毒样颗粒的电镜观察Fig. 5 Electronic microscopy of VLPs |
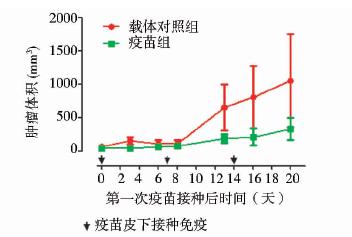
应用治疗性策略,探讨在小鼠肿瘤模型中的疫苗干预效果。结果显示,三个VLPs混合的疫苗免疫组相比NP载体对照组,在第二次免疫后显示了明显的抑制TC-1肿瘤生长的效应。需要指出的是,对照组出现了较大的组内个体差异,其中有1只小鼠由于肿瘤过大,在最后一个时间点前安乐死,未获取该时间点肿瘤大小数据。见图 6。
|
| 图 6 混合病毒样颗粒免疫对肿瘤模型干预后的肿瘤大小变化Fig. 6 The anti-tumor effect of mixed VLPs |
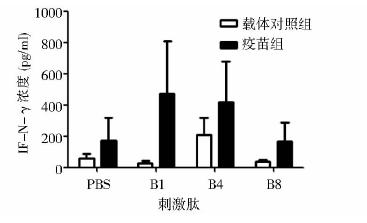
混合VLPs免疫小鼠后取脾脏分离脾细胞,利用三个抗原肽分别在体外刺激72h后,经ELISA检测细胞上清液中IFN-γ的水平,从而反映VLPs疫苗免疫引起抗原特异细胞免疫应答的效果。结果显示,对照组因为接种肿瘤,脾细胞对3个抗原肽的刺激具有一定的应答,其中,对B4肽的反应较强,产生了较高的IFN-γ。与对照组比较,VLPs疫苗免疫后的小鼠脾细胞产生的IFN-γ水平明显升高。见图 7。
|
| 图 7 脾细胞经体外抗原肽刺激后的IFN-γ的表达分析Fig. 7 IFN-γ expression level of spleen cells after antigen stimulation in vitro |
治疗性疫苗干预这样的肿瘤免疫治疗被寄予厚望,但其研发面临极大挑战,除了基于自体抗原呈递细胞体外激活策略的前列腺疫苗在临床上或许有轻微作用外,其余肿瘤治疗疫苗几无临床成功案例。HPV E6、E7是导致细胞发生转化的关键因子,且在宫颈癌细胞中持续表达。因此,治疗性HPV疫苗的研究主要致力于靶向E6和E7,诱导强的特异性T细胞免疫应答以有效杀伤肿瘤细胞。目前主要的策略包括:(1)表位氨基酸修饰以增强与MHC分子的亲合力;(2)抗原修饰改造以指导其加工呈递途径与效率;(3)引入细胞因子、趋化因子,共刺激分子以增强及控制免疫应答向所需类型发展[9];(4)采用多重抗原如HPV L1,E2,E6和E7而不是单一抗原;以及(5)利用抗原肽/蛋白、细菌与病毒活载体、核酸、以及细胞[10]等不同疫苗形式。研究结果显示,目前各种疫苗策略在HPV感染动物模型中可有效抑制移植肿瘤的生长,甚至成功消除已建立的肿瘤。但在临床试验中,效果并不理想。因此,进一步研究探讨新型的治疗性疫苗形式,探讨肿瘤微环境下疫苗免疫效应机制,揭示抗肿瘤免疫应答的有效调控策略与手段,对于临床疫苗获得成功具有重要意义。
在预防性疫苗的研究中,VLPs形式有效保证了重组亚单位疫苗的免疫原性,其重要原因之一是VLPs的高度有序的纳米颗粒结构,有利于促进抗原呈递细胞对抗原的高效摄入和加工呈递。本研究重点在于初步探讨VLPs基于其独特结构,作为新型治疗性疫苗载体在激发细胞免疫应答方面的潜能。因此,本研究仅以文献报道为参考,选用了HPV16 E7的11-20[11]、49-57[12]、83-95[13]这三个证明有效的CTLs表位作为模式抗原以方便考察载体免疫特点。
研究建立了应用高效液相凝胶过滤色谱鉴定目的蛋白纯度及是否形成VLPs的有效方法,为VLPs疫苗制备提供了一种简单快速的质量控制手段,充分保证了研究中针对VLPs而非其它结构形式蛋白的免疫学性质考察的严谨性。TC-1细胞移植肿瘤模型是目前普遍采用的HPV感染肿瘤模型,本研究以基因重组制备的VLPs免疫TC-1肿瘤模型小鼠,通过检测肿瘤的大小初步评价疫苗效果。尽管未达到统计学意义,几个理由使我们相信基于VLPs的疫苗展示了明显的抗原特异细胞免疫应答趋势,值得基于其开展进一步的深入研究:(1)VLPs未采用任何常规佐剂就显现了激发细胞免疫应答及一定肿瘤抑制作用的能力,显著改善了肽表位的免疫原性;(2)未干预的模型组尽管有小鼠的肿瘤自然消退,但存在肿瘤较大以及因肿瘤增长过快而死亡的小鼠,而疫苗干预组未出现任何肿瘤快速增长小鼠;(3)肿瘤模型组由于个体差异,导致所设计实验动物数目不足以显现统计意义,提高试验动物质量以及增加动物数将有助于获取理想数据;(4)疫苗接种时肿瘤大小已超过常规治疗干预研究所采用的2~4mm,当疫苗应答建立时(两次免疫后),肿瘤已长至6~7mm,实际本研究疫苗治疗性干预的是已建立的较大肿瘤,因此,挑战了更严重的肿瘤微环境,而仍然显示了一定的有效作用。此外,本研究借助体外抗原肽刺激脾细胞实验,通过检测IFN-γ表达水平,表明所构建的HPV治疗性VLPs疫苗在小鼠肿瘤模型中成功激发了E7抗原特异的细胞免疫应答。 综上所述,本研究主要意义是展示了呈现抗原表位的VLPs的构建制备,并显示其可激发抗原特异细胞免疫应答并具有肿瘤生长抑制潜能。为进一步深入VLPs载体的性质优化、特点发掘,以及基于VLPs探讨肿瘤微环境与疫苗免疫效应机制,研发新型有效HPV治疗性疫苗提供了基础。可开展的工作包括:引入强的T辅助表位、引入促抗原递呈效率与类型元素、呈现修饰改造的抗原、应用新型佐剂、包裹免疫刺激物,以及采用粘膜免疫等,探讨这些手段是否能够有效调控免疫应答类型、突破肿瘤抑制微环境、加强特异细胞免疫应答,从而提升疫苗临床干预潜能。
致谢 感谢协和青年基金和中央高校基本科研业务费专项资金(33320140081)对本研究的资助。
| [1] | Parkin D M, Bray F, Ferlay J, et al.Global cancer statistics, 2002.CA Cancer J Clin,2005,55(2): 74-108. |
| [2] | Bolhassani A, Mohit E, Rafati S.Different spectra of therapeutic vaccine development against HPV infections.Hum Vaccin,2009,5(10): 671-689. |
| [3] | Niebler M, Qian X, Hofler D, et al.Post-translational control of IL-1beta via the human papillomavirus type 16 E6 oncoprotein: a novel mechanism of innate immune escape mediated by the E3-ubiquitin ligase E6-AP and p53.PLoS Pathog,2013,9(8): e1003536. |
| [4] | Yu Y, Munger K.Human papillomavirus type 16 E7 oncoprotein inhibits the anaphase promoting complex/cyclosome activity by dysregulating EMI1 expression in mitosis.Virology,2013,446(1-2): 251-259. |
| [5] | Jemon K, Young V, Wilson M, et al.An enhanced heterologous virus-like particle for human papillomavirus type 16 tumour immunotherapy.PLoS One,2013,8(6): e66866. |
| [6] | Monroy-Garcia A, Gomez-Lim M A, Weiss-Steider B, et al.Immunization with an HPV-16 L1-based chimeric virus-like particle containing HPV-16 E6 and E7 epitopes elicits long-lasting prophylactic and therapeutic efficacy in an HPV-16 tumor mice model.Arch Virol,2014,159(2): 291-305. |
| [7] | Pokorna D, Polakova I, Kindlova M, et al.Vaccination with human papillomavirus type 16-derived peptides using a tattoo device.Vaccine,2009,27(27): 3519-3529. |
| [8] | Ressing M E, van Driel W J, Brandt R M, et al.Detection of T helper responses, but not of human papillomavirus-specific cytotoxic T lymphocyte responses, after peptide vaccination of patients with cervical carcinoma.J Immunother,2000,23(2): 255-266. |
| [9] | Berzofsky J A, Ahlers J D, Janik J, et al.Progress on new vaccine strategies against chronic viral infections.J Clin Invest,2004,114(4): 450-462. |
| [10] | Bolhassani A,Mohit E,Rafati S.Different spectra of therapeutic vaccine development against HPV infections.Hum Vaccin,2009,5(10):671-689. |
| [11] | Schreurs M W, Kueter E W, Scholten K B, et al.A single amino acid substitution improves the in vivo immunogenicity of the HPV16 oncoprotein E7(11-20) cytotoxic T lymphocyte epitope.Vaccine,2005,23(31):4005-4010. |
| [12] | Song Y C, Cheng H Y, Leng C H, et al.A novel emulsion-type adjuvant containing CpG oligodeoxynucleotides enhances CD8+ T-cell-mediated anti-tumor immunity.J Control Release,2014,173: 158-165. |
| [13] | Klencke B, Matijevic M, Urban R G, et al.Encapsulated plasmid DNA treatment for human papillomavirus 16-associated anal dysplasia: a Phase I study of ZYC101.Clin Cancer Res,2002,8(5):1028-1037. |
 2015, Vol. 35
2015, Vol. 35




