文章信息
- 陶文娜, 夏立秋, 丁学知, 唐滢
- TAO Wen-na, XIA Li-qiu, DING Xue-zhi, TANG Ying
- 刺糖多孢菌中铵载体蛋白基因amtS的克隆及功能研究
- Cloning and Function Study of amtS Gene from Saccharopolyspora spinosa
- 中国生物工程杂志, 2015, 35(2): 25-30
- China Biotechnology, 2015, 35(2): 25-30
- http://dx.doi.org/10.13523/j.cb.20150204
-
文章历史
- 收稿日期:2014-12-03
- 修回日期:2014-12-22
剌糖多孢菌(Saccharopolyspora spinosa)经有氧发酵后能产生对多种害虫具有很好的杀灭效果的次级代谢产物——多杀菌素(spinosad)。多杀菌素是一种大环内酯类化合物,由一个四环结构连接两个不同类型的六碳糖——福乐糖胺和鼠李糖组成。
有报道证实:微生物次级代谢产物的合成受限于前体和辅助因子,增加聚酮合成前体如乙酰辅酶A、丙二酰辅酶A或甲基丙二酰辅酶A的供给,能够提高聚酮类化合物的合成量[1]。在天蓝色链霉菌(Streptomyce coelicolor)中同时异源表达二羧酸转运蛋白编码基因和丙二酰辅酶A合成酶编码基因,能不断补充辅酶A硫酯的合成量,使得大环内酯化合物的合成量提高了300%[2]。最近,Luo 等[3, 4] 通过对刺糖多孢菌比较蛋白质组学的研究,发现在刺糖多孢菌高产菌株内多杀菌素合成所需的前体的合成代谢的几个关键酶显著上调,这为增加前体供给的基因工程策略应用于刺糖多孢菌的定向遗传改造提供了理论依据。
而前体和辅助因子的合成与微生物细胞内的氮素代谢有密切联系,微生物细胞中的氮源被分解为氨、铵离子(NH4+)或谷氨酸,这些物质是细胞内合成各种核酸、氨基酸和辅因子等含氮化合物的重要原料。铵载体蛋白是一类存在于细胞膜上主动转运NH4+的载体,普遍存在于真核生物或原核生物细胞膜上,可将细胞所处环境中的微量铵离子转运到细胞内,确保细胞内的铵库稳定和细胞氮代谢的正常运行。第一个被克隆的铵载体蛋白基因是来自酵母(Saccharomyces cerevisiae)中的低亲合高容量铵载体基因mep。研究表明,mep1、mep2、mep3这3个基因在酵母基因组中表达铵转运蛋白,它们之间的协同作用能够影响酵母吸收环境中的铵离子,当外界环境中唯一的氮源只有铵离子,且铵离子浓度低于5 mmol/L时,同时缺失这3个基因的酵母突变体不能生长[5]。原核生物中第一个被克隆的铵载体基因是来自枯草芽胞杆菌(Bacillus subtilis)中的nrgA基因。大肠杆菌(E. coli)中的铵载体编码基因amtB编码产物由401个氨基酸组成,与NrgA具有42%同源性。此外,从棕色固氮菌(Azotobacter vinelandii)、巴西固氮螺菌(Azospirillum brasilense)和根瘤菌(Rhizobium etli)中也克隆出铵载体蛋白编码基因。至今未见放线菌中铵载体蛋白的相关报道。
本研究克隆了刺糖多孢菌(S. spinosa)S04-41菌株的铵载体蛋白基因(amtS),并将该基因导入天蓝色链霉菌(S. coelicolor)M145菌株和变铅青链霉菌(Streptomyces lividans)TK24菌株中进行异源表达,通过比较分析重组菌株的形态、产孢能力、色素产量变化,初步探讨了S. spinosa S04-41菌株中amtS基因的功能,为研究该基因对刺糖多孢菌中多杀菌素合成的作用奠定了基础。 1 材料与方法 1.1 菌株和质粒
本实验所用菌株和质粒见表 1。其中,S. spinosa S04-41菌株是本研究室选育的刺糖多孢菌野生型菌株;S. coelicolor M145菌株和S. lividans TK24菌株为amtS异源表达宿主菌;E.coli Top10为基因克隆宿主菌;E.coli ET12567(pUZ8002)为接合转移菌株。pMF质粒为本研究室构建的E.coli-Streptomyces穿梭载体,为amtS基因在链霉菌中异源表达载体。
| Strains and plasmids | Characterization | Resource |
| Strains | ||
| E.coli Top10 | Cloning host | Lab Store |
| E.coli ET12567(pUZ8002) | Dam,dcm,and hsdM containing a nontransmissible oriT mobilizing plasmid | Prof. Bibb M.J |
| S. coelicolor M145 | Wild-type S. coelicolor A3(2) | Prof. Deng Zixin |
| S. lividans TK24 | Spc-6 SLP2- SLP3- | Hopwood et al. |
| Saccharopolyspora spinosa S04-41 | Wild-type derivative with increased yield | Lab Store |
| Plasmids | ||
| pMD18-T | E.coli cloning vector,AmpR | TaKaRa Co. |
| pMF | E.coli-Streptomyces shuttle vector | Lab Store |
| pMF-amtS | pMF plasmid carry amtS gene from S. spinosa S04-41 | This study |
E. coli培养温度为37℃,培养基为LB。链霉菌液体培养基为TSBS[6](TSB培养基另加10%蔗糖),产色素固体培养基为R4C[7],大肠杆菌-链霉菌接合转移培养基为MS[8],接合子转移培养基为BHI[9]。在E. coli中,氨苄青霉素使用终浓度为100 mg/L,阿泊拉霉素为100 mg/L,氯霉素为25 mg/L,卡那霉素为50 mg/L;在链霉菌中,阿泊拉霉素使用终浓度为50 mg/L,萘啶酮酸为40 mg/L。PCR试剂、T4 DNA连接酶、限制性内切酶、pMD-18T载体、DNA分子量标准均购自TaKaRa 公司;生化试剂均购自上海生物工程有限公司。 1.3 刺糖多孢菌amtS基因的克隆
根据红色糖多孢菌(Saccharopolyspora erythraea)NRRL 2338中铵载体蛋白基因序列设计引物对扩增amtS基因:AMTS-F(TCACACATATGGTGAATTCAGGCGACACCGC)和AMTS-R:(TATTATCATGCGCGGCTGCCCTCCAG)。提取S. spinosa S04-41菌株总DNA作为模板,利用引物对AMTS-F / AMTS-R进行PCR扩增,扩增条件为:94 ℃预变性10 min;94 ℃ 1 min,59 ℃ 退火1.5 min,72 ℃ 1min,30个循环,72 ℃延伸10 min,20 ℃终止PCR反应。纯化PCR产物,TA克隆,获得载体pMD18-amtS。 1.4 amtS基因链霉菌异源表达载体的构建
用限制性内切酶NdeⅠ和XbaⅠ分别对载体pMF和质粒pMD18-amtS进行双酶切,连接,重组获得amtS基因链霉菌异源表达载体pMF-amtS。pMF和pMF-amtS分别转化E.coli ET12567(pUZ8002),获得E.coli ET12567(pUZ8002,pMF)、E.coli ET12567(pUZ8002,pMF-amtS)。 1.5 amtS基因在链霉菌中的异源表达
E.coli ET12567(pUZ8002,pMF)、E.coli ET12567(pUZ8002,pMF-amtS)作为供体菌,通过接合转移导入S. coelicolor 145和S. lividans TK24 中。接合子转接到含100 mg/L阿泊拉霉素和50 mg/L萘啶酮酸的BHI平板上生长,至少转接2次,挑取接合子至含100 mg/L阿泊拉霉素的TSB液体培养基中,通过PCR鉴定,获得重组菌株M145/pMF、M145/pMF-amtS、TK24/pMF、TK24/pMF-amtS。 1.6 amtS基因表达对链霉菌产孢量及抗生素产量的影响
将M145、M145/pMF、M145/pMF-amtS、TK24、TK24/pMF、TK24/pMF-amtS菌株分别接种入TSBS培养基中(按需要添加50 μg/ml 阿泊拉霉素),30 ℃振荡培养3 d,取菌液涂布R4C和GYM固体培养基,30 ℃培养2 d,观察孢子和抗生素的产生情况。
放线紫红素的测定:各链霉菌按10%的接种量转接入50 ml GYM发酵培养基,培养5~8 d,取20 ml GYM液体发酵液,加入1/10体积1 mol/L KOH,混合均匀后室温下放置1 h后离心,取上清液测定OD633值[10]。 1.7 amtS基因在链霉菌工程菌中遗传稳定性检测
将M145/pMF-amtS和TK24/pMF-amtS菌株接种入TSB液体培养基中,30 ℃培养1 d,连续转接入新鲜TSB液体培养基(无抗生素)中7次,取菌液涂布TSB固体平板(无抗生素),30 ℃培养2 d在平板上形成单菌落,挑取单菌落分别进行阿泊拉霉素抗性检测和PCR扩增amtS基因鉴定,研究amtS基因在链霉菌工程菌中的遗传稳定性。 2 结果与分析 2.1 铵载体蛋白编码基因amtS的克隆及表达载体构建
PCR扩增S. spinosa S04-41菌株中的amtS基因(图 1a),进行TA克隆,挑取转化子进行测序。S. spinosa S04-41 amtS基因ORF为1284bp,编码427个氨基酸与S. erythraea NRRL2338菌株中的铵载体编码基因的ORF具有87%的同源性,氨基酸序列具有88%的同源性(图 2)。
对pMF和pMD18-amtS载体进行XbaI和NdeI的双酶切,回收酶切产物,连接,转化大肠杆菌ET12567(pUZ8002),构建amtS基因链霉菌异源表达载体pMF-amtS(图 1b)。

|
| 图 1 铵载体蛋白基因amtS的PCR扩增(a)和链霉菌表达载体pMF-amtS的双酶切鉴定(b) Fig. 1 PCR product of amtS(a)and restriction analysis of plasmid pMF-amtS(b) (a) M:100bp DNA ladder;1:PCR product of amt (b) M:DL2000 Marker; 1:Restriction analysis of plasmid pMF- amtS |

|
| 图 2 S. spinosa中的铵载体蛋白与S. erythraea中铵载体蛋白的同源性比较 Fig. 2 The homology comparison of ammonium carrier protein between S. spinosa and S. erythraea |
将M145、M145/pMF、M145/pMF-amtS和TK24、TK24/pMF、TK24/pMF-amtS分别接种到GYM和R4C固体培养基上,30 ℃培养2d,观察孢子和抗生素产生情况。
从GYM平板和R4C平板正面观察,发现amtS基因的导入使得M145菌株的产孢量有所增加。在GYM平板上,工程菌株 M145/pMF-amtS平板背面颜色明显深于M145/pMF和M145菌株,表明amtS基因的转入提高了M145菌株中十一烷基灵菌红素的产量(图 3a)。同样在R4C平板上,M145/pMF-amtS菌株背面颜色深于M145/pMF和M145菌株,产孢量也有所提高,表明amtS基因的转入也提高了M145菌株中放线紫红素的产量(图 3b)。不同M145/pMF-amtS重组菌株间产孢能力和次级代谢产物产量统计学上无显著性差异。
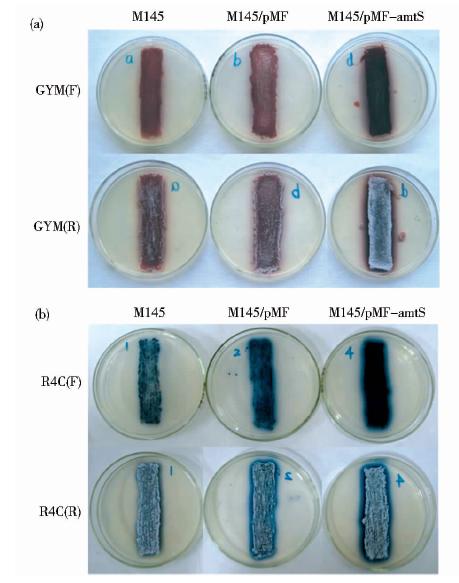
|
| 图 3 S. coelicolor M145中异源表达amtS基因对孢子和抗生素产生的影响 Fig. 3 Effects of heterologous expression of amtS gene in S. coelicolor M145 on the production of spores and antibiotics (a) Strains were inoculated on GYM agar medium GYM(F): The front side of plate; GYM(R): The reverse side of plate (b)Strains were inoculated on R4C agar medium R4C(F): The front side of plate; R4C(R): The reverse side of plate |
从GYM平板上,TK24/pMF-amtS菌株的产孢量和十一烷基灵菌红素的产量和原始菌株TK24比较均没有明显差异。在R4C平板上,TK24/pMF-amtS菌株产孢量较TK24有所增加,而且背面颜色也明显深于对照菌株,这表明amtS基因的转入也提高了TK24菌株中放线紫红素的产量。不同TK24/pMF-amtS重组菌株间产孢能力和次级代谢产物产量统计学上无显著性差异。 2.3 铵载体蛋白的异源表达对链霉菌中放线紫红素产量的影响
为了定量比较放线紫红素产量,将链霉菌接种到 GYM液体培养基中培养,取上清液进行OD633测定。M145/pMF空载体对照以及原始菌M145相比,其放线紫红素产量变化不大,M145/pMF-amtS放线紫红素产量比原始菌株提高了2.85 倍(图 4a);原始菌株TK24和空载体对照菌株TK24/pMF放线紫红素产量极低,但TK24/pMF-amtS菌株产生了大量的放线紫红素,产量是原始菌株的30.02 倍(图 4b)。

|
| 图 4 amtS基因的导入对S. coelicolor M145菌株(a)和S.lividans TK24菌株(b)中放线紫红素产量的影响 Fig. 4 Effect of introduction of the amtS gene on the production of Act in S. coelicolor M145 (a) and S.lividans TK24 (b) |
工程菌M145/pMF-amtS和TK24/pMF-amtS菌株在TSB液体培养基中连续转接培养7次,挑取的单菌落均具有阿泊拉霉素抗性,且菌落PCR扩增amtS基因都出现阳性信号,表明amtS基因在链霉菌工程菌中遗传稳定性很好。 3 讨 论
多杀菌素是一种新型生物杀虫剂,因其能高效灭杀靶标害虫,而对非靶标生物低毒,正成为一种环境友好型生物农药。但是,刺糖多孢菌的多杀菌素含量低。其野生菌株生长缓慢、发酵生长周期长,限制了多杀菌素产量的提高和在农田的大面积推广应用。通过常规理化诱变技术、基因工程技术等,研究关键调控因子,提高多杀菌素产量、试图缩短其发酵周期是当前一个研究热点。
我们通过本研究分析了刺糖多孢菌中的amtS基因对M145菌株和TK24菌株的孢子和次级代谢产物产量的影响。amtS基因异源表达使M145菌株和TK24菌株中放线紫红素和十一烷基灵菌红素的产量都得到提高,其中放线紫红素的产量分别提高了2.85倍和30.02倍,而且amtS基因在链霉菌工程菌中具有很好的遗传稳定性。增加链霉菌细胞内amtS的拷贝数,过量表达铵载体蛋白,改善了细菌的营养状况,提高了对环境中氮源的利用率,有效保证了次级代谢产物合成时能量和氮源的充足供应。与放线紫红素生物合成相似,多杀菌素的合成也属于PKS合成途径,增加刺糖多孢菌中amtS的拷贝数,有可能增加各类正向调控蛋白的数量,从而加速多杀菌素的合成。此外,合成多杀菌素的底物之一——福乐糖胺上连接有一个氨基,加大细胞内氮源的供应,也有利于福乐糖胺的合成,提高多杀菌素的产量。
致谢 此研究受到湖南省教育厅一般项目(13C554)及湖南师范大学青年基金项目(31303)资助,特表感谢。
| [1] | Tang Y, Xia L, Ding X, et al. Duplication of partial spinosyn biosynthetic gene cluster in Saccharopolyspora spinosa enhances spinosyn production. FEMS Microbiol Lett, 2011,325(1):22-29. |
| [2] | Waldron C,Matsushima P,Rosteck P R. Cloning and analysis of the spinosad biosynthetic gene cluster of Saccharopolyspora spinosa. Chemistry and Biology,2001,8(5):487-499. |
| [3] | Luo Y, Ding X, Xia L, et al.Comparative proteomic analysis of Saccharopolyspora spinosa SP06081 and PR2 strains reveals the differentially expressed proteins correlated with the increase of spinosad yield. Proteome Sci,2011, 9:40. |
| [4] | Luo Y, Kou X, Ding X, et al.Promotion of spinosad biosynthesis by chromosomal integration of the Vitreoscilla hemoglobin gene in Saccharopolyspora spinosa. Sci China Life Sci, 2012,55(2):172-180. |
| [5] | 邓若磊, 徐海荣, 曹云飞, 等.植物吸收铵态氮的分子生物学基础. 植物营养与肥料学报,2007,13 (3):512-519. Deng R L, Xu H R, Cao Y F, et al. The molecular basis of ammonium transporters in plant. Plant Nutrition and Fertilizer Science, 2007,13 (3):512-519. |
| [6] | Van Wezel G P, Van der Meulen J, Kawamoto S, et al. SsgA is essential for sporulation of Streptomyces coelicolor A3(2) and affects hyphal development by stimulating septum formation. J Bacteriol, 2000,182(20):5653-5662. |
| [7] | Shima J, Hesketh A, Okamoto S, et al. Induction of actinorhodin production by rpsL (encoding ribosomal protein S12) mutations that confer streptomycin resistance in Streptomyces lividans and Streptomyces coelicolor A3(2). J Bacteriol,1996,178(24):7276-7284. |
| [8] | Kesier T, Bibb M J, Butter M J, et al. Practical Streptomyces Genetics. Norwich (United K):John Innes Foundation,2000, 488(1):25-37. |
| [9] | Chinping Chng, Amy M L, Jonathan A Vroom, et al. A key developmental regulator controls the synthesis of the antibiotic erythromycin in Saccharopolyspora erythraea. PNAS,2008, 105,(32):11346-11351. |
| [10] | Zhang Q, Zhu B Q, Hu H F. Activated antibiotic production by inducing resistance to capreomycin in Streptomyces lividans and Streptomyces coelicolor.Chinese Journal of Natural Medicines,2008,6:57-62. |
 2015, Vol. 35
2015, Vol. 35




