文章信息
- 赵瑞媛, 刘春霞, 李慧鹏, 王申元, 周欢敏
- ZHAO Rui-yuan, LIU Chun-xia, LI Hui-peng, WANG Shen-yuan, ZHOU Huan-min
- 饲养层细胞对绵羊胚胎干细胞体外培养的影响
- The Impacts of Feeder Cells on Culture in vitro of Sheep Embryonic Stem Cells
- 中国生物工程杂志, 2015, 35(2): 18-24
- China Biotechnology, 2015, 35(2): 18-24
- http://dx.doi.org/10.13523/j.cb.20150203
-
文章历史
- 收稿日期:2014-11-04
- 修回日期:2014-12-29
胚胎干细胞(embryonic stem cell,ES细胞)建立的原理是将囊胚内细胞团体外培养,使其大量增殖的同时,抑制其分化。目前仅在小鼠[1]、 恒河猴[2, 3]及人[4]上ES细胞建系成功,在猪、牛、羊等家畜也获得了类ES细胞。不同的研究,其培养方法不同。
在解剖学、生理和免疫上,人类和羊之间的相似性较高,使得这种动物成为最佳的实验模型。Dattena M等(2006)用免疫外科法分离绵羊囊胚,得到的细胞克隆最多可传至5 代;Zhao 等(2011)报道了体外受精绵羊囊胚,体外能传至30 代,细胞的增殖对碱性成纤维细胞生长因子(basic fibroblast growth factors,bFGF)有一定的依赖性[5]。白昌明(2009),任卫青等(2012)对绵羊类ES 细胞进行了分离培养并探讨了其影响因素,在添加bFGF 的培养液中,最多可传至8 代。周川等[6](2012)报道随着绵羊ES 细胞传代次数的增加,凋亡因子Bax 的表达水平逐渐上升,15 代后,Bcl-2 水平下降,不能有效抑制Bax 的活化,表明绵羊ES 样细胞在体外长期培养过程中逐步走向凋亡。已报道的其他家畜类ES 细胞在体外均不能长期传代,这就制约了家畜ES 细胞的研究。虽然围绕绵羊ES细胞建系进行了大量的研究,但迄今为止仍未建立适于绵羊ES细胞建系的环境条件,这项技术尚不成熟,影响ES细胞建系的因素还有待进一步研究。所以探索一种适合于绵羊ES细胞生长的饲养层具有重要的意义。
本研究在绵羊体外受精发育体系基础上,摸索了饲养层(Feeder)细胞对绵羊ES细胞生长的影响,包括在一定的丝裂霉素浓度下Feeder的处理时间、细胞种类、代数、接种密度及新鲜制备和冷冻复苏后的Feeder细胞,通过比较研究,旨在筛选合适的饲养层细胞,为能建立绵羊ES细胞体外增殖培养体系奠定基础。 1 材料与方法 1.1 试 剂
基础盐、丝裂霉素C、胰蛋白酶、EDTA、细胞外基质(ECM)、明胶、β-巯基乙醇、NEAA、L-谷氨酰胺、Insulin、VC购自Sigma公司;高糖DMEM、胎牛血清(FBS)购自Gibco公司;DMEM/F12购自Hyclone;Pronase购自Roche;鼠源LIF、鼠源bFGF和人源SCF购自Millipore公司;青霉素、链霉素购自华北制药厂;TRIzolRNA抽提试剂盒购自Invitrogen,DNA聚合酶反转录试剂盒购自TaKaRa。 1.2 饲养层细胞的制备
C57小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)及绵羊胚胎成纤维细胞(sheep embryonic fibroblast,SEF)为本实验室自存。待1~3代的MEF或1~5代的SEF长满培养皿底后,在含有丝裂霉素C(10μg/ml)的培养液中孵育2 h(条件为37℃、5%CO2、饱和湿度)。之后弃去孵育液,用DMEM/F12原液清洗数遍处理的细胞,0.25%胰蛋白酶消化处理过的MEF和SEF,2 min后镜下观察细胞,待回缩后,等体积加入细胞培养液以终止消化。以1600 r/min 离心5min,弃上清后加入培养液,以1×105~1×106个/ml细胞密度接种到培养皿中(ECM或0.1%明胶包被),37℃,5%CO2,饱和湿度条件下培养,第二日便可使用,制作好的Feeder于一周内使用。 1.3 Feeder细胞的冷冻与解冻
将收集的新鲜Feeder细胞用冻存液(含70%DMEM/F12,20%FBS,10%DMSO)制成一定浓度的细胞悬液转入冻存管,置于冻存盒,然后放于-80℃低温冰箱,次日投入液氮。使用时37℃解冻,离心以去除DMSO,用ES细胞培养液(高糖DMEM + 15% FBS + 0.1 mmol/L β-巯基乙醇 + 0.1 mmol/L NEAA + 2mmol/L L-Glu + 1000 IU/ml LIF + 20 ng/ml bFGF + 10 ng/ml SCF + 20 μg/ml Insulin + 50 μg/ml VC)稀释到一定浓度后接种于包被过的培养皿中,37℃、5%CO2、饱和湿度下培养(在囊胚接种前1d制作即可)。 1.4 绵羊囊胚的获得
从呼和浩特市北亚屠宰场采集本地绵羊卵巢,2~3h内运回实验室。清洗后抽吸卵巢表面2~6mm大小的表面卵泡,将收集的卵母细胞置于成熟液中成熟培养。22~24h后,置于受精液中,加入适量附睾精液(Percoll分离)进行体外受精。精卵共培养22~24h之后,去除死精子及卵丘细胞,置于第一阶段发育液中继续发育培养。精卵混合时间记为第0天,受精48h后,将未卵裂的胚胎及死卵弃掉,半量换10% FBS 的第二阶段发育液,于标准三气(5% CO2、5% O2、90% N2)中培养,之后每48h 半量换液一次,培养至第6d~第9d后收集囊胚。 1.5 绵羊囊胚ICM的分离培养
将囊胚置于0.25%链酶蛋白酶中,37℃消化处理1~3min,透明带变薄后用细玻璃针反复吹吸,直至彻底去掉透明带,将脱带囊胚切成两半,含有ICM的一半接种到Feeder细胞上;对于扩张囊胚,用细针将透明带划破,吸取ICM后接种培养;对于孵化囊胚,用细玻璃针直接吸取后接种培养。接种的培养皿在3d内禁止翻动。 1.6 绵羊ES细胞的传代培养
当贴壁ICM周围出现少量分化细胞时即可传代。将贴壁ICM剥离后,机械分离成数小块儿后,接种于Feeder细胞上,之后每48h 换ES细胞培养液一次,每天观察细胞生长情况。 1.7 绵羊ES细胞的初步鉴定 1.7.1 形态学观察
显微镜下观察绵羊ES细胞的形态特征及生长状况。 1.7.2 碱性磷酸酶染色
4%多聚甲醛固定需鉴定的绵羊类ES细胞集落,按照试剂盒说明书进行碱性磷酸酶染色鉴定,照相。 1.7.3 RT-PCR鉴定
选用干细胞多能性基因为标志基因,设计合成引物,在Genbank中没有绵羊Sox2 mRNA序列,根据人、牛、小鼠Sox2 mRNA保守区序列,参照绵羊Sox2 DNA序列,用Primer5.0软件设计Sox2基因上下游引物;参照Genbank中绵羊Nanog RNA部分序列设计Nanog基因上下游引物;Oct4,Rex1,Kit引物的设计同Sox2和Nanog。以试剂盒提供的GAPDH引物为阳性对照。引物由上海生工生物工程公司合成,详细信息见表 1。参照TaKaRa TRNzol 总RNA 提取试剂产品说明书,从绵羊ES细胞中提取总RNA,反转录合成cDNA第一链。PCR反应,条件为94℃ 5 min预变性;94℃ 30s,56~59℃ 30s,72℃ 40s,30个循环;最后72℃ 10 min,4℃ 1h。反应结束后,0.8%琼脂糖凝胶电泳检测产物,Marker判断目的片段大小。
| 参考序列号 | 基因 | 引物序列(5′-3′) | 产物大小(bp) | 退火温度(℃) |
| AM293661 | Kit | F: 5′-CCCAAgTCTgAgAATgAAAg-3′ R: 5′-CTgCTCggTTCCTggACAAA-3′ | 258 | 56.9 |
| FJ269033 | Rex1 | F: 5′-ACAGCCCCGGCCCGTCCTCTACCC-3′ R: 5′-ACCCCCGCACCCTCCACCCACAA -3′ | 297 | 56.8 |
| X96997 | Sox2 | F: 5′-ggCggAAAACCAAgACgCTCAT-3′ R: 5′-CTggAgTgggAAgAAgAggTAA-3′ | 448 | 56.6 |
| FJ970651 | Nanog | F: 5′-CCACAAgCCCCAgAgTgAAACCA-3′ R: 5′-gTTgCTCCAAgACTgACTgTTC-3′ | 449 | 58.8 |
| FJ970649 | Oct4 | F: 5′-GCGCCGCAGGTTGGAGTGG-3′ R: 5′-GCTGCTGGGCGATGTGGCTAAT-3′ | 571 | 58.1 |
| NM_001190390 | GAPDH | F: 5′-TCCACGGCACAGTCAAGG-3′ R: 5′-TCAGCACCAGCATCACCC-3′ | 112 | 56.0 |
将绵羊ES细胞接种于培养7d以上的Feeder细胞上,使用普通细胞培养液,每3d换液,观察ES细胞的自发分化现象。 1.8 数据统计
实验均重复三次以上,卡方检验处理数据。 2 结 果 2.1 Feeder细胞的优化 2.1.1 丝裂霉素C处理时间的筛选
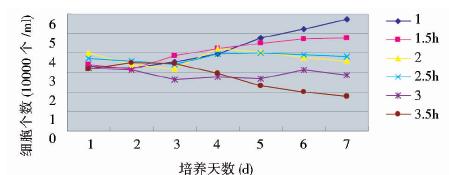
用丝裂霉素C(10 μg/ml)处理1~5代的SEF,培养箱中温育处理时间梯度分别为1h、1.5h、2h、2.5h、3h和3.5h。结果表明,处理时间短(1h和1.5h),不能有效控制Feeder细胞的生长;处理时间稍长(3h和3.5h),死亡细胞较多;处理时间为2~2.5h时,细胞数变化不明显,见图 1,图 2。处理1~3代MEF后,生长趋势同SEF。所以,处理2~2.5h效果较好。
|
| 图 1 Feeder细胞(SEF)生长曲线图 Fig. 1 The growth curve of feeder cells |
|
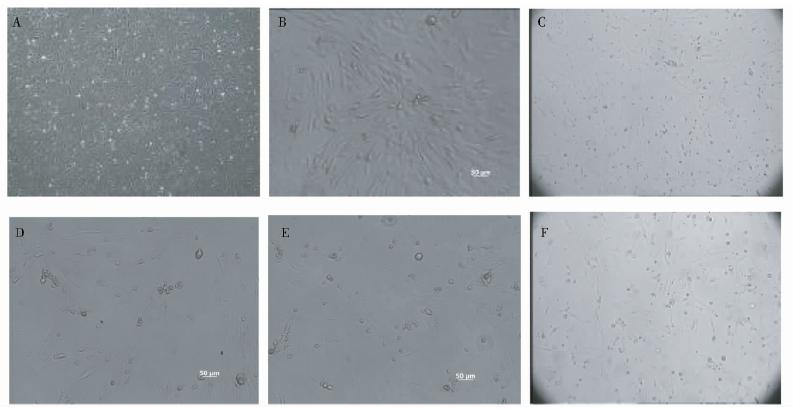
| 图 2 SEF、MEF及Feeder细胞生长情况(×100) A:P3的SEF生长1d;B:P4的SEF生长3d;C:P5的Feeder细胞(SEF)生长7d;D:P2 MEF细胞生长3d的状况;E:P3 MEF Feeder细胞生长1d(0.1%明胶铺底);F:P3 MEF Feeder细胞生长1d(ECM铺底) Fig. 2 Growth of sheep embryonic fibroblast,mouse embryonic fibroblast and feeder |
接种新鲜或冷冻解冻的Feeder细胞于培养皿中(0.1%明胶或ECM处理)。结果表明,同样的细胞接种于两种包被物处理过的培养皿中,ECM包被皿中Feeder细胞均匀贴壁,且数量较多,生长状况较明胶组好,见图 2-E,F。可见较之0.1%明胶,ECM更适于培养皿的包被用以接种MEF和SEF Feeder细胞。 2.2 不同饲养层对囊胚ICM贴壁及增殖的影响
将获得的体外受精囊胚置于0.25%链酶蛋白酶中,37℃消化处理1~3min,待透明带变薄后,用细玻璃针反复吹吸,直到完全去掉透明带,将脱带囊胚切成两半,含有ICM的一半接种到饲养层细胞上。对于扩张囊胚,用细针将透明带划破,轻柔吹打使透明带脱落,然后接种培养;对于孵化囊胚,用细玻璃针直接吸取接种培养。接种于SEF、MEF及SEF和MEF 1∶1混合的Feeder细胞上,接种的培养皿在3d内禁止翻动。囊胚ICM的贴壁及增殖情况见表 2。可知,ICM的贴壁率以SEF组最低(36.8%),SEF与MEF 1∶1混合组次之(37.1%),MEF组最高(42.0%),但囊胚ICM的贴壁率在三组间差异不显著(P﹥0.05),各组的最高代数相近,其中MEF组最高(11代)。
| Feeder来源 | 囊胚接种数(个) | 贴壁数(个) | 贴壁率(%) | 最高传代数(代) |
| SEF | 38 | 14 | 36.8(14/38)a | 8 |
| MEF | 50 | 21 | 42.0(21/50)a | 11 |
| SEF:MEF=1:1 | 35 | 13 | 37.1(13/35)a | 10 |
| 注:卡方检验,肩注字母a相同表示组间差异不显著(P﹥0.05) | ||||
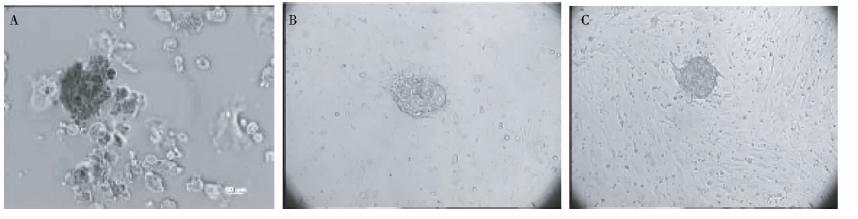
囊胚ICM接种后,大多数接种囊胚4d左右能部分贴壁,个别囊胚持续扩张,因浮力因素不能贴壁(图 3-A)。贴壁的ICM细胞向上生长,呈柱状(图 3中箭头所示),随着培养时间的增长,细胞克隆显著增大,形成典型克隆,与周围细胞(滋养层细胞)能清楚区分出来。贴壁的ICM克隆培养7d左右即可传代。原代贴壁ICM生长情况见图 3。传代生长情况见图 4。并不是获得的所有细胞克隆都能生长增殖,部分细胞克隆逐渐分化。

|
| 图 3 原代贴壁ICM生长情况 (其中A ×40;B,C ×100;箭头所指为形成的类ES细胞克隆。) Fig. 3 The growth of ICM attached on the feeders(A,magnification: 40 fold;B and C magnification: 100 fold;the arrow shows the ES clone ) |
|
| 图 4 酶消化后形成的类ES细胞团块及其贴壁后生长情况(×100) A:酶消化后类ES细胞团块;B:酶消化后P2类ES细胞贴壁生长3d;C:P5 Feeder(SEF),P8 类ES细胞生长4d Fig. 4 The small sESClike cell masses and their growth after adherence(magnification: 100 fold) |
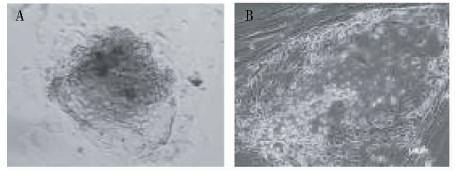
绵羊类ES细胞之间连接紧密,与周围Feeder细胞形成明显界限;细胞呈圆形或椭圆形,且细胞体积比周围的大。贴壁3~5d后,可形成典型的鸟巢状集落,不规则岛屿状,细胞集落隆起,呈柱状(图 5)。
|
| 图 5 绵羊类ES细胞集落(×100,箭头所示) A:贴壁后囊胚ICM的生长;B:P6类ES细胞克隆 Fig. 5 The clones of sESClike cells(magnification: 100 fold,as the arrows show) |
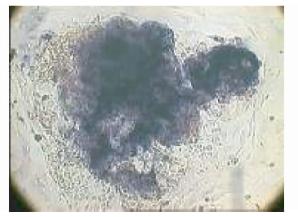
将第11代绵羊ES细胞经AKP染色后,呈现蓝紫色,而周围细胞着色较浅或不着色,在细胞克隆周围有个别阳性单细胞存在,见图 6。
|
| 图 6 AKP染色阳性的绵羊ES细胞(×100) Fig. 6 The sESClike cells positive to alkaline phosphatase(magnification: 100 fold) |
以第7代绵羊类ES细胞中提取的总RNA为模板,RT-PCR扩增Sox2、Nanog等多能性基因cDNA序列,同时以内参引物GAPDH基因为阳性对照,以Feeder细胞为阴性对照细胞,取10μl扩增产物进行0.8%琼脂糖凝胶电泳分析,电泳结果见图 7。结果表明,获得了约258bp(Kit)、297bp(Rex1)、448bp(Sox2)、449bp(Nanog)和571bp(Oct4)的片段,与预期大小一致,即绵羊类ES细胞表达了Kit、Rex1、Nanog、Sox2和Oct4这些多能性基因,而阴性对照Feeder细胞未表达。

|
| 图 7 绵羊类ES细胞RT-PCR鉴定电泳图 M:DL2000 Marker Fig. 7 The RTPCR identification of sESClike cells |
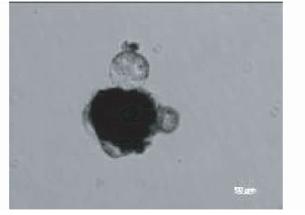
绵羊类ES细胞在培养液中极易分化,并随着传代次数的增加,可自发形成囊状体(图 8)。
|
| 图 8 绵羊类ES细胞自发分化形成的囊状体(×100) Fig. 8 The cystidium from spontaneous differentiation of sESClike cells(magnification: 100 fold) |
在体外培养时,如何有效地使ICM细胞继续增殖并阻止其分化,是从ICM细胞分离得到ES细胞的关键。Feeder细胞是常用的,通常将贴壁培养的细胞阻断其有丝分裂(丝裂霉素C或γ射线照射),使其仍保持分泌活性。所以好的Feeder细胞对于ES细胞的增殖及保持未分化状态具有非常重要的作用。
在本试验的预实验中,曾以20μg/ml的丝裂霉素C处理细胞1~3.5h内,设置了6个时间梯度,对处理后的细胞进行计数并绘制生长曲线。结果发现随着培养时间的延长,细胞数量急剧下降,所有处理组细胞死亡严重。所以本试验以10μg/ml的丝裂霉素C为基准,摸索出最佳处理时间为2~2.5h,细胞既保持了不增殖的状态,也不会与ES细胞造成营养竞争,又能保持应有的活力,可作为Feeder细胞为ES细胞提供营养。
Feeder细胞因被人为地阻断了其有丝分裂,保持活力,但不增殖,不能很好地贴附于组织培养皿表面,通常通过添加0.1%明胶,ECM,层粘连蛋白等粘附底物来解决这一问题[7]。ECM包括多种细胞外基质及生长因子,成分比较复杂,很多研究者用其包被培养皿,培养ES细胞时即使在无Feeder细胞的条件下,也取得了较好的效果[8, 9, 10]。本试验选用0.1%明胶和ECM包被培养皿,接种同样的Feeder细胞,结果显示在ECM包被的皿中Feeder细胞贴壁较多,生长均匀,培养一周左右仍贴壁较好,能很好地支持类ES细胞的贴壁与生长。
MEF作为Feeder细胞培养非鼠类动物ES细胞出现的异源性污染问题影响了ES细胞的深入研究,之后人们开始着手研究同源Feeder细胞。有些研究者认为:同源成纤维细胞所模拟的体外培养体系与胚胎在体内生长的环境最为接近,其分泌物更有助于激活靶细胞,促进ES细胞的增殖及保持其未分化状态,从而有利于ES细胞系的建立[11, 12]。所以选择合适的Feeder细胞种类对于ES细胞的分离培养至关重要。本试验选用取材方便的SEF、MEF及两者的混合物作为Feeder细胞,比较了绵羊ICM的贴壁及传代情况。结果表明,新鲜制作或冷冻解冻的1~3代MEF、1~5代SEF及等比例混合的MEF和SEF三种Feeder细胞都能较好地支持绵羊类ES细胞的贴壁及传代,贴壁率在三组间差异不明显(P>0.05),但以MEF组效果最好,这与许多学者在培养其它动物ES细胞的研究上结果相似[13, 14, 15, 16, 17]。1~5代的SEF、1~3代的MEF及两者的1∶1混合细胞都可较好地支持绵羊ES细胞的生长。如考虑异源性污染问题,1~5代的SEF可代替MEF作为mES细胞的Feeder细胞。 3.2 绵羊ES细胞的鉴定
绵羊类ES细胞在形态上更像已建系的小鼠ES细胞[1],多呈岛状克隆,与人ES细胞[4](扁平克隆)明显不同。本研究对第11代绵羊类ES细胞集落进行了AKP染色,结果均为阳性,而周围的成纤维细胞和已分化的细胞呈阴性,且随着传代次数的增高,集落染色变浅,说明随着代数的增加,AKP活性逐渐在降低。在Zhao 等[5]进行绵羊类ES细胞鉴定时,发现绵羊类ES 细胞AKP染色阳性,与本试验结果一致。说明我们培养的绵羊类ES细胞仍保持未分化状态。Nanog、Sox2 和Oct4 等转录因子对ES 细胞的基因转录起到关键的调控作用,是ES 细胞保持多潜能性和未分化状态的核心标志基因[18, 19]。本试验选用Nanog、Kit、Rex1、Sox2 及Oct4 这5 个多能性基因进行RT-PCR 检测,从转录水平证明绵羊类ES 细胞的多潜能性和自我更新能力。本试验将绵羊类ES细胞置于普通细胞培养液中,可自发分化为囊状结构和各胚层细胞,说明所获得的绵羊类ES细胞具有分化潜力。
| [1] | Evans M J, Kaufman M H. Establishment in culture of pluripotential cells from mouse embryos. Nature, 1981, 292: 154-156. |
| [2] | Thomson J A, Kalishman J, Golo T G, et al. Isolation of a primate embryonic stem cell line. Proc Natl Acad Sci USA, 1995, 92(17): 7844-7848. |
| [3] | Thomson J A, Kalishman J, Golos T G, et al. Pluripotent cell lines derived from common marmoset (Callithrix jacchus) blastocysts. Biol Reprod, 1996, 55:254-259. |
| [4] | Thomson J A, Itskovits-Eldor J, Shapiro S S, et al. Embryonic stem cell lines derived from human blastocysts. Science, 1998, 282: 1145-1147. |
| [5] | Zhao YunCheng, Jiapeng Lin, Liqin Wang, et al. Derivation and characterization of ovine embryonic stem-like cell lines in semi-defined medium without feeder cells. J Exp Zool, 2011, 315: 639-648. |
| [6] | 周川,赵云程,林嘉鹏,等.绵羊类胚胎干细胞长期培养中增殖、凋亡、多能性相关基因的表达动力学.中国生物化学与分子生物学报, 2012, 28(6): 574-579. Zhou C, Zhao Y C, Lin J P, et al. The proliferation, apoptosis, and expression kinetics of pluripotency genes of sheep embryonic stem-like cells in long-term cultures. Chinese Journal of Biochemistry and Molecular Biology, 2012, 28 (6): 574-579. |
| [7] | 薛庆善.体外培养的原理与技术.北京:科学出版社,2001 Xue Q S. Principles and Technology in vitro Culture, Beijing: Science Press, 2001. |
| [8] | Carpenter M K, Rosler E S, Fisk G J. Properties of four human embryonic stem cell lines maintained in a feeder-free culture system. Dev Dyn, 2004, 229(2): 243-258. |
| [9] | Rosler E S, Fisk G J, Ares X. Long-term culture of human embryonic stem cells in feeder-free conditions. Dev Dyn, 2004, 229(2): 259-274. |
| [10] | Amit M, Shariki C, Margulets V. Feeder layer and serum-free culture of human embryonic stem cells. Biol Reprod, 2004, 70(3): 837-845. |
| [11] | Stojek R M, Reed M A, Hoover J L. A method for cultivating morphologically undifferentiated embryonic stem cell from porcine blastocysts. Theriogenology, 1990, 33(4):912-913. |
| [12] | Richards M, Fong C Y, Chan W K. Human feeders support prolonged undifferentiated growth of human inner cell masses and embryonic stem cells. Nat Biotechnol, 2002, 20(9): 933-936. |
| [13] | 任卫青,陈亮,和小娥,等.绵羊类胚胎干细胞的分离与克隆.中国兽医学报, 2012,32(5):788-792. Ren W Q,Chen L,He X E,et al.The isolation and cloning of sheep embryonic stem-like cells. China J Vet Sci, 2012,32(5):788-792. |
| [14] | 赖良学. 影响体外培养兔胚发育和兔类ES细胞分离的若干因素.中国兽医学报,1996,16(1):16-21. Lai X L. Factors of influencing the embryo development and separation of its ES cell from in vitro cultured rabbits embryo. China J Vet Sci,1996,16(1):16-21. |
| [15] | 刘羿羿. 山羊类胚胎干细胞和PGCs 的培养与鉴定. 呼和浩特:内蒙古农业大学,2010. Liu Y Y. Culture and Identification of Goat Embryonic Stem Like Cells and PGCs. Huhhot:Inner Mongolia Agricultural University, 2010. |
| [16] | Dharmendra Kumar, Anand T, Singh K P. Derivation of buffalo embryonic stem-like cells from in vitro produced blastocysts on homologous and heterologous feeder cells. J Assist Reprod Genet, 2011, 28: 679-688. |
| [17] | Jozefczuk J, Drews K, Adjaye J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments, 2012, 64:e3854. |
| [18] | Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell, 2003, 113:631-642. |
| [19] | 夏金超, 陈凌. Nanog基因及其传导通路在保持胚胎干细胞多能性中的作用.中华临床医师杂志,2012,8:2156-2158. Xia J C, Chen L. Function of nanog and its pathway in maintaining the pluripotency of embryonic stem cells. Chin J Clinicians, 2012,8:2156-2158. |
 2015, Vol. 35
2015, Vol. 35




