文章信息
- 孟树林, 马步云, 张新敏, 葛云, 张蓉, 黄盼盼, 王毅刚
- MENG Shu-lin, MA Bu-yun, ZHANG Xin-min, GE Yun, ZHANG Rong, HUANG Pan-pan, WANG Yi-gang
- 硫利达嗪对肝癌干细胞的杀伤作用研究
- Killing Effects of Thioridazine on Liver Cancer Stem Cell
- 中国生物工程杂志, 2015, 35(2): 8-17
- China Biotechnology, 2015, 35(2): 8-17
- http://dx.doi.org/10.13523/j.cb.20150202
-
文章历史
- 收稿日期:2014-11-18
- 修回日期:2014-12-12
目前肝癌(hepatocellular carcinoma,HCC)的发病率居全球第五,但其致死率为全球第三[1]。然而,全世界人口的8%长期被肝炎B或C型病毒感染,这更加剧了肝癌在全球进一步发展的风险[2]。肝癌是我国常见的恶性肿瘤,它的发病率和死亡率已占我国部分地区肿瘤的第一、二位,且每年呈上升趋势,是严重影响我国人民健康的重大疾病,因此展开对肝癌治疗的研究意义重大[3]。
肿瘤干细胞首先在血液病肿瘤中被发现[4],随后其在实体瘤,如乳腺癌、直肠癌和脑癌中陆续被证实[5, 6, 7]。肿瘤干细胞占肿瘤组织细胞中很小的比例,其具有自我更新、无限增殖及多向分化的能力,在肿瘤的多步骤转移、耐药复发过程中起着关键性的作用[8, 9]。肿瘤干细胞的提出不仅为肿瘤发生发展和转移复发机制带来了新的研究思路,而且为肿瘤临床诊断和治疗带来了新的理论基础。肝癌干细胞的研究近年也有了很大的进展,肝癌干细胞在肝癌的发生发展及耐药的过程中起了非常重要的作用[10]。晚期的肝癌组织细胞中干细胞特性的转录因子NANOG,OCT4和SOX2的表达量明显增多,说明肝癌干细胞的存在与肝癌的恶性程度密切相关,可能在肝癌的耐药、复发及恶化机制中起决定性的作用[11, 12]。
肿瘤细胞的悬浮培养是在体外富集肿瘤干细胞的一种培养方法[13, 14, 15]。肿瘤细胞的悬浮培养法,即在无血清及特定的生长因子的培养条件下,将肿瘤细胞铺在超低吸附的培养板上进行培养;正常贴壁的肿瘤细胞在这种培养条件下重编程形成具有干细胞特性的肿瘤细胞。经过这种特定培养的肿瘤细胞,在一定程度上表现了肿瘤干细胞的特征,比如干细胞相关转录因子表达增多,对传统的化疗药物具有耐受性及其细胞周期发生改变等[16, 17, 18, 19]。
硫利达嗪(thioridazine,THO)是一种吩噻嗪类化合物,为多巴胺受体拮抗剂,在临床上用于精神疾病的治疗[20, 21, 22]。近年,有文献报道THO对肿瘤干细胞具有很好的杀伤作用[23, 24]。THO在体内能通过结合多巴胺受体而特异性地靶向白血病干细胞,而对正常的造血干细胞却没有任何损伤[25]。THO很可能是一种极具潜力的抗肿瘤干细胞的药物,但它对肝癌干细胞的杀伤效果还没有相关报道。因此,本文利用肿瘤细胞的悬浮培养富集PLC/PRF/5肝癌干细胞(PLC/PRF/5-CSC),然后探讨THO分别对正常培养的贴壁肝癌细胞(PLC/PRF/5)和悬浮培养的肝癌干细胞(PLC/PRF/5-CSC)的干细胞相关因子表达、耐药性能、细胞周期变化及其杀伤效应等。 1 材料与方法 1.1 材 料
人肝癌细胞株 PLC/PRF/5由本实验室保存;细胞培养液为含10% FBS的DMEM (Dulbeccos Modified Eagle Smedium),DMEM购自Thermo Fisher Scientific Co.Lt;FBS、Accutase消化液、B27和ITS-X购自GIBCO公司;DMEM/F12和HEPES购于吉诺生物科技有限公司;细胞生长因子EGF,bFGF和IGF1购于peprotech公司;MTT染料购自Ameresco公司;盐酸阿霉素(DOX)、5FU购于生工生物工程股份公司;硫利达嗪(thioridazine)购于Sigma公司;Cleaved Caspase-3、GAPDH、STAT3、P-STAT3抗体及XIAP抗体购于Cell Signaling Technology 公司,NANOG和Abumin抗体购于 AR 公司; 二抗购于 Earthox 公司; Hoechst33342,细胞裂解液和胰酶购于碧云天生物技术公司;超低吸附6孔板购于Corning公司。 1.2 方 法 1.2.1 肝癌干细胞的悬浮培养
人肝癌细胞系PLC/PRF/5在含有10%FBS的DMEM培养基中进行正常的贴壁培养。PLC/PRF/5细胞的悬浮培养是在无血清的DMEM/F12培养基中于超低吸附的6孔板中进行非贴壁培养,每孔铺5×104个细胞;并添加100 IU/ml青霉素,100 μg/ml链霉素,20 ng/ml人重组生长因子EGF,bFGF和IGF1,2% B27,1% ITS-X和10mmol/L HEPES等无血清添加剂。PLC/PRF/5细胞悬浮培养约4天,培养第2天添加一次新鲜的含无血清添加剂的DMEM/F12。在培养的第4天收集PLC/PRF/5微球,将六孔板中的PLC/PRF/5微球细胞吸入离心管中离心500 r/min,5 min;弃上清,用PBS洗一次,加1 ml的Accutase消化液消化3~5 min,将消化成单个细胞的PLC/PRF/5进行后续实验。 1.2.2 MTT 检测药物对肝癌细胞的杀伤作用
取正常贴壁和悬浮培养的PLC/PRF/5细胞用胰酶或Accutase将其消化成单个细胞,计数并以每孔4×103个细胞接种于96孔板,5% CO2,37℃培养12 h后分别在相应孔中加入不同浓度梯度的药物,实验组与对照组分别设6个复孔,37℃培养48 h后,每孔加入15μl MTT(50 mg/ml)继续培养 4 h 后,弃去孔内细胞培养液,每孔加入150μl二甲基亚砜,置于摇床上低速振荡 10 min,使结晶物充分溶解,在酶标仪 OD490 nm 处测量各孔的吸光值,同时设置调零孔,实验重复3次。细胞生存率 = (处理组吸光值-调零孔吸光值)/(对照孔吸光值-调零孔吸光值)×100%。 1.2.3 流式检测细胞周期
分别取大约5×105个正常贴壁和悬浮培养的PLC/PRF/5细胞2000 r/min离心3 min,PBS洗1次,加入75%的酒精至EP管,4℃固定30 min,2000 r/min离心3 min,PBS洗1次,加入RNase A(工作浓度为20μg/ml)于500 μl PBS中,37℃孵育30 min。PBS洗1次,加PI(工作浓度50μg/ml)于500 μl PBS中,室温避光孵育30 min。在流式细胞仪上检测正常贴壁和悬浮培养的PLC/PRF/5细胞周期。
1.2.4 克隆形成实验
分别取正常贴壁和悬浮培养的PLC/PRF/5细胞以每孔1000个细胞铺于6孔板中进行正常贴壁培养;37℃,5% CO2约培养10天后用结晶紫染色并拍照,对大于20个细胞的克隆进行计数统计。 1.2.5 结晶紫染色观察细胞活性
将对数期生长的正常贴壁PLC/PRF/5细胞和悬浮培养的PLC/PRF/5细胞以 5×104/孔密度铺于 24孔板,贴壁培养12 h后,加入硫利达嗪(1、5、10、15、20μmol/L),继续培养48 h后,弃掉培养基,每孔加入500 μl 结晶紫染色液(2%结晶紫溶于20%甲醇溶液)染色30 min,用清水洗去染色液并拍照记录。 1.2.6 Hoechst33342 染色法检测细胞凋亡
取正常贴壁和悬浮培养的PLC/PRF/5细胞以每孔5×104个细胞铺于24孔板,正常贴壁培养12 h后,相应孔中加入不同浓度的硫利达嗪(1,5,10,20μmol/L),以DMSO组为对照,培养48 h 后,加入1 mg/ml 的 Hoechst33342,37℃孵育30 min后在荧光显微镜下观察PLC/PRF/5细胞核的凋亡情况。 1.2.7 流式细胞术检测细胞凋亡
取正常贴壁和悬浮培养的PLC/PRF/5细胞以每孔3×105个细胞接种于6孔板中;37℃,5% CO2贴壁培养12 h 后,分别使用DMSO,10 和15μmol/L的Thioridazine或联合DOX处理正常贴壁和悬浮培养的PLC/PRF/5细胞,48h后收集6孔板中的细胞培液和细胞加入离心管中,参照 AnnexinⅤ/PI 双染细胞凋亡检测试剂盒操作说明书,用预冷的 PBS 洗涤收集的细胞 2遍,然后用 500μl 的 1×结合缓冲液重悬细胞,每孔中分别加入5μl Annexin-Ⅴ和5μl PI,室温下避光孵育 10 min 后,流式细胞仪分析。 1.2.8 Western blot 检测相关目的蛋白及细胞凋亡蛋白
分别取正常贴壁和悬浮培养的PLC/PRF/5细胞直接进行Western blot,分析其相关肿瘤干细胞转录因子表达情况或进行药物处理后检测凋亡相关蛋白Caspase-3活化形式的表达情况。按照Western blot 收集总蛋白的操作方法裂解细胞并用 ThermoFisher 公司 BCA 蛋白定量试剂盒定量收集总蛋白的浓度。以每孔加入等体积蛋白样品进行 SDS-PAGE 电泳,电泳结束后进行转膜(PVDF膜),5% 的 BSA 室温封闭 1h,一抗(1∶1000 稀释)4℃ 孵育过夜,TBST洗膜 3 次,每次10 min,然后加入二抗(1∶10000 稀释),室温摇床孵育1 h,TBST洗膜 3 次,每次15 min,对蛋白进行拍照分析。 1.2.9 实验数据的统计学分析所有实验结果的数据均采用 SigmaPlot 11.0软件进行统计学分析,本文中所有实验都在相同样条件下重复3次,全部实验结果用(均值±标准差)表示,P<0.05。 2 结 果 2.1 体外悬浮培养富集肝癌干细胞
肿瘤细胞体外悬浮培养富集肿瘤干细胞已有文献报道[15, 26],结合文献和实验平台利用悬浮培养方法来富集肝癌细胞系PLC/PRF/5中的肿瘤干细胞(见本文材料与方法)。EGF及bFGF在无血清培养基中可以促进细胞的增值;Insulin-Transferrin-Selenium-X Supplement(ITS-X)是DMEM/F12培养液的无血清营养添加剂;B27是悬浮培养肿瘤细胞的干性添加剂,有利于肿瘤干细胞的富集。肝癌细胞PLC/PRF/5悬浮培养前后的形态学观察如图 1所示,经富集后的肝癌干细胞呈微球状,直径大约100~200μm,其由几十到几百个具肿瘤干细胞特性的细胞相互粘连在一起形成。
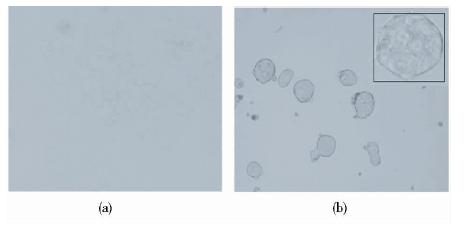
|
| 图 1 肝癌干细胞的形态学观察 Fig. 1 Morphology observation of liver cancer stem cells The cells undergone an attached and suspension culture were observed with inverted microscopes (×100) (a)PLC/PRF/5 (b)PLC/PRF/5-CSC Amplified regions are shown in the square frame,×200 |
已知磷酸化的转录因子STAT3(STAT3-P)、NANOG和XIAP等在肿瘤干细胞中发挥着重要的作用[27, 28];而Albumin是成熟肝癌细胞的标志物,在肝癌干细胞中呈低表达[12]。通过悬浮培养富集的肿瘤干细胞会诱导相关干细胞转录因子的高表达,而成熟肝癌细胞标志物的低表达。我们对上述相关因子进行Western blot检测发现,STAT3-P,NANOG和XIAP都有显著的上调,而Albumin显著下调(图 2)。结果表明悬浮富集培养的PLC/PRF/5细胞在一定程度上呈现出肿瘤干细胞状态。
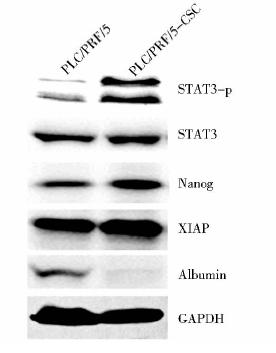
|
| 图 2 Western blot检测肝癌干细胞相关蛋白的表达 Fig. 2 The proteins associated with liver cancer stem cells were determined by Western blot analysis |
研究表明肿瘤干细胞对传统的化疗药物具有很强的耐受性。5FU和DOX为常规临床用化疗药物,我们分别用不同浓度5FU(10,50,75,100μg/ml)和DOX(0.5,1,3,5μg/ml)处理正常贴壁的PLC/PRF/5细胞和悬浮培养的PLC/PRF/5细胞,检测其对化疗药物的耐药程度。结果如图 3所示,在DOX处理组中,随着药物浓度的增加,相对于正常贴壁培养PLC/PRF/5细胞,悬浮培养PLC/PRF/5-CSC细胞的存活率显著增高,即耐药性增强;而在5FU各个浓度的处理组中,PLC/PRF/5-CSC细胞的存活率均显著高于正常贴壁培养的PLC/PRF/5细胞,PLC/PRF/5-CSC细胞对5FU具有更强的耐药性。这些结果说明经过悬浮培养富集的PLC/PRF/5-CSC细胞比PLC/PRF/5细胞具有更显著的耐药性。
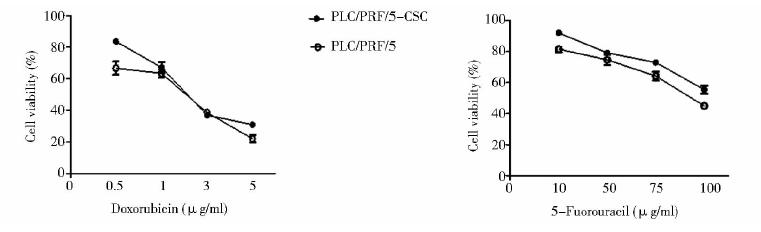
|
| 图 3 悬浮培养的肝癌干细胞对传统化疗药物的耐受性 Fig. 3 Suspension culture of liver cancer stem cells resistant to conventional chemotherapy drugs |
我们运用细胞流式仪和细胞克隆形成实验来分析正常贴壁的PLC/PRF/5细胞和悬浮培养PLC/PRF/5干细胞的生长速率。结果如图 4a所示,与正常贴壁的PLC/PRF/5细胞相比,经过悬浮培养PLC/PRF/5-CSC细胞更多地处于细胞周期的G0~G1期(PLC/PRF/5-CSC细胞大约56.8%; PLC/PRF/5细胞大约44.5%);此外PLC/PRF/5-CSC细胞克隆形成数也相对较少(PLC/PRF/5-CSC细胞的51对 PLC/PRF/5细胞的90)(图 4b)。以上数据说明经过悬浮培养获得的PLC/PRF/5-CSC细胞更多的处于细胞周期的静息状态(G0~G1期),具有更缓慢的生长速率以耐受化疗抵抗。
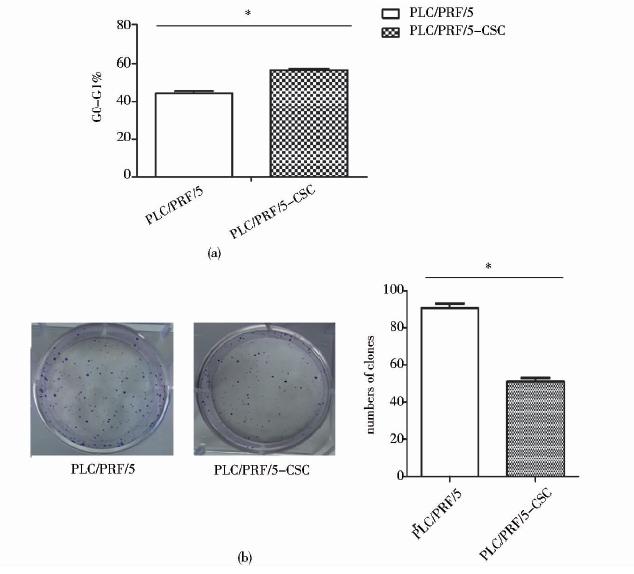
|
| 图 4 肝癌干细胞具有更缓慢的生长速率 Fig. 4 A slower growth rate for liver cancer stem cells (a) Cell cycles of PLC/PRF/5 and PLC/PRF/5-CSC was measured by flow cytometry assay (b) Colony-formation assay The number of clones containing more than 20 cells was counted.(* P<0.05) |
分别用浓度为1、5、10、20μmol/L的thioridazine(THO)处理正常贴壁培养的PLC/PRF/5细胞和悬浮培养的PLC/PRF/5-CSC细胞48h,MTT实验检测其杀伤效果。实验数据显示,用10μmol/L和20μmol/L的THO药物浓度处理时,正常贴壁培养的PLC/PRF/5细胞存活率分别约为88.7%和33.0%,而悬浮培养的PLC/PRF/5-CSC细胞存活率大约分别是70.5%和18.5%(图 5a)。当THO浓度为10μmol/L时,PLC/PRF/5-CSC细胞存活率约为正常贴壁培养PLC/PRF/5细胞存活率的0.8倍;而处理浓度为20μmol/L时,PLC/PRF/5-CSC细胞的存活率是PLC/PRF/5细胞存活率的0.5倍(图 5b);说明随着THO药物处理浓度的增加,其对肿瘤干细胞的杀伤效率在显著增高。结果显示,相对于正常贴壁培养的PLC/PRF/5细胞,THO对悬浮培养的PLC/PRF/5-CSC细胞具有更强的杀伤作用。
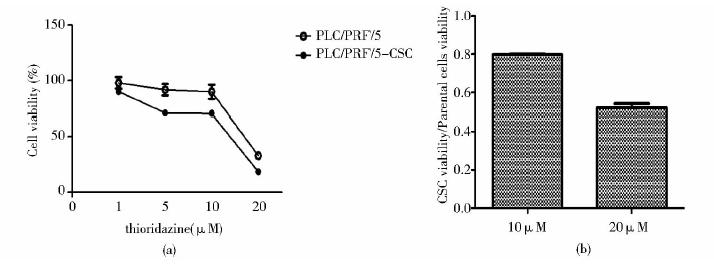
|
| 图 5 MTT检测细胞活性实验 Fig. 5 MTT viability assay (a)Assessment of the cell viability of PLC/PRF/5 and PLC/PRF/5-CSC cells following treatment with THO at concentrations of 1,5,10,20μmol/L after 48 h (b) CSC viability versus parental cells viability |
进一步利用结晶紫染色检测了THO对肝癌细胞的杀伤效果,分别用浓度为1、5、10、15、20μmol/L的THO处理24孔板中的PLC/PRF/5细胞和PLC/PRF/5-CSC 细胞48h后进行结晶紫染色。如图 6显示,当THO的浓度达到20μmol/L,其对PLC/PRF/5细胞和PLC/PRF/5-CSC 细胞的杀伤作用均较强。
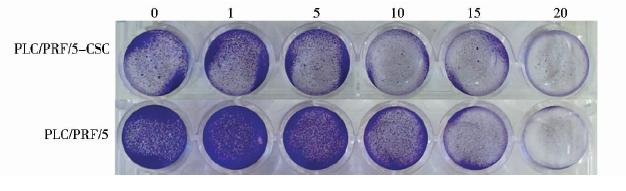
|
| 图 6 结晶紫实验检测thioridazine对PLC/PRF/5和PLC/PRF/5-CSC细胞的杀伤效果 Fig. 6 Measurement of the cytotoxicity of THO on PLC/PRF/5 and PLC/PRF/5-CSC cells by crystal violet staining |
首先利用Hoechst33342染色实验检测THO是否诱导PLC/PRF/5细胞和PLC/PRF/5-CSC细胞发生凋亡。分别用1、5、10、20 μmol/L的THO处理PLC/PRF/5细胞和PLC/PRF/5-CSC 细胞48h后Hoechst33342进行染色。实验结果如图 7所示,随着THO药物浓度的增加,PLC/PRF/5细胞和PLC/PRF/5-CSC细胞发生凋亡的现象越来越明显;但相对于PLC/PRF/5细胞,PLC/PRF/5-CSC细胞凋亡得更明显。
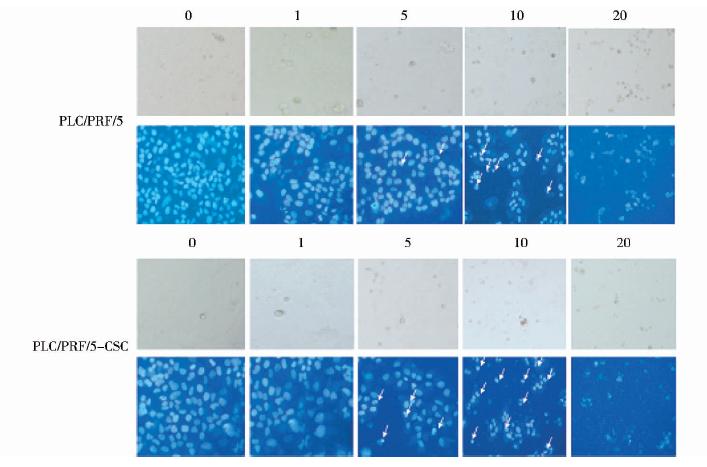
|
| 图 7 Hoechst33342染色检测细胞凋亡 Fig. 7 Apoptosis detection by Hoechst33343 staining |
进一步利用细胞流式检测THO是通过哪种途径实现对PLC/PRF/5和PLC/PRF/5-CSC细胞的杀伤作用。分别用0、5、10μmol/L的THO处理PLC/PRF/5和PLC/PRF/5-CSC细胞。结果如图 8显示,随着THO浓度的增加,PLC/PRF/5和PLC/PRF/5-CSC细胞发生了越来越明显的早期和晚期凋亡,同时也发生了少量的坏死现象。总之,THO对PLC/PRF/5-CSC细胞诱导凋亡的作用更明显。

|
| 图 8 细胞流式检测细胞凋亡现象 Fig. 8 Apoptosis detection by flow cytometry assay PLC/PRF/5 and PLC/PRF/5-CSC cells were treated with THO at 0,5,10 μmol/L for 48 h and were tested by flow cytometry assay |
凋亡信号通路中的Caspase-3的活化形式即Cleaved Caspase-3是细胞凋亡发生的关键执行者,因此我们用Western blot检测10 μmol/L THO处理PLC/PRF/5和PLC/PRF/5-CSC细胞凋亡过程中Cleaved Caspase-3的表达量。如图 9示,当用10 μmol/L 的THO处理PLC/PRF/5-CSC细胞时,Cleaved Caspase-3表达量明显增高,说明PLC/PRF/5-CSC细胞发生了更加显著的凋亡现象。
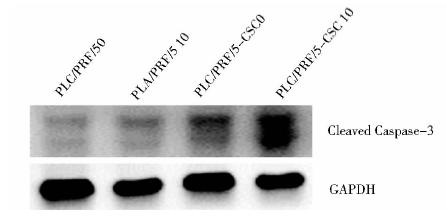
|
| 图 9 Western blot检测凋亡相关蛋白caspase-3的活性 Fig. 9 The activation of apoptosis-associated caspase-3 proteins by Western blot analysis |
上述结果表明THO对肿瘤干细胞具有更强的杀伤效应,因此我们拟进一步检测是否THO联合化疗药物(如DOX)能对肝癌细胞具有显著的增强杀伤作用。5μmol/L THO分别联合0.25、0.5、1.5、2.5 μg/ml的DOX检测其对PLC/PRF/5细胞的杀伤效果;另外用5 μmol/L THO联合1 μg/ml的DOX处理细胞后利用细胞流式仪检测其杀伤作用。结果显示,虽然THO联合DOX对正常贴壁肿瘤细胞具有增强的杀伤作用,但其对肿瘤干细胞的杀伤作用效果更显著(图 10a);而细胞流式分析显示联合DOX和THO诱导了PLC/PRF/5细胞和PLC/PRF/5-CSC细胞分别发生凋亡和坏死,且杀伤作用均明显增强,而对PLC/PRF/5细胞和PLC/PRF/5-CSC细胞的杀伤效果相似(图 10b)。

|
| 图 10 THO联合DOX增强了细胞杀伤作用 Fig. 10 Combination of THO and DOX increased the cytotoxicityn for PLC/PRF/5 and PLC/PRF/5-CSC cells (a) Cell viability of PLC/PRF/5 and PLC/PRF/5-CSC cells handled with 5μmol/L THO combined with DOX at 0.25,0.5,1.5,2.5μg/ml after 48h (b) PLC/PRF/5 and PLC/PRF/5-CSC cells was treated by 5μmol/L THO and 1μg/ml DOX and then was determined by flow cytometry assay |
肿瘤干细胞在肿瘤的复发、转移和耐药性方面起着关键作用,是导致癌症病死率高的根本原因;因此研发针对靶向肿瘤干细胞的抗癌药物十分必要,具有重大的临床意义[29, 30]。本文首先利用悬浮培养富集了肝癌干细胞,并探讨了THO对体外培养的肝癌干细胞的杀伤作用;实验结果表明THO对肝癌干细胞具有较强的特异性杀伤效果,THO联合传统化疗药物无论是对正常分化的肝癌细胞还是对肝癌干细胞均具有显著的杀伤能力。
相对于分化的肿瘤细胞,肿瘤干细胞中相关干细胞特性的转录因子表达上调;肿瘤干细胞对传统的化疗药物具有耐受性;另外肿瘤干细胞大多数处于静息状态(即细胞周期的G0~G1期)等等。悬浮培养的PLC/PRF/5-CSC细胞对传统的化疗药物5-FU和DOX均具有明显的耐受性;干细胞相关的转录因子STAT3无论是在正常的干细胞还是肿瘤干细胞中都发挥着十分重要的作用,它与肿瘤细胞体内的转移,肿瘤干细胞的调控,肿瘤的耐药性等等都有十分密切的联系[31, 32];NANOG在正常干细胞和肿瘤干细胞中是一个非常重要的转录因子,它在调控肿瘤干细胞的自我更新方面发挥着关键作用,与肿瘤的恶性程度直接相关[33, 34, 35];这两个关键的肿瘤干细胞因子在我们培养的肝癌干细胞中的表达都是明显上调的,但是成熟肝细胞的标志蛋白Albumin在我们培养的PLC/PRF/5-CSC细胞中却是下调的[12];另外PLC/PRF/5-CSC细胞的细胞周期较多地处于细胞周期的G0~G1期,其生长速率较正常细胞明显变慢。这些实验结果充分说明了我们利用体外悬浮培养富集的肝癌干细胞在一定程度上具备了真正意义上的肿瘤干细胞特征[8]。
我们运用MTT,Western blot和细胞流式等实验充分证明了THO对肿瘤干细胞具有很强的杀伤效果。相对于传统的化疗药物,THO对PLC/PRF/5-CSC细胞具有特异的杀伤作用,且随着药物浓度的增加其杀伤效率也明显增加。已有文献表明THO对肿瘤的杀伤作用依赖于肿瘤细胞的凋亡,我们从Hoechst3334实验,细胞流式实验还有凋亡蛋白水平方面验证了THO明显诱导了肿瘤细胞凋亡的发生,且对PLC/PRF/5-CSC细胞诱发凋亡的能力更强。从我们的实验结果可以看出,THO对PLC/PRF/5-CSC细胞的杀伤效果明显比对PLC/PRF/5细胞杀伤的强;传统的化疗药物对肿瘤干细胞杀伤作用比较弱,而对分化的肿瘤细胞却具有较强的杀伤作用。于是,我们联合了THO和DOX这两种药物来处理PLC/PRF/5-CSC细胞和PLC/PRF/5细胞。实验表明这两种药物的联合对肿瘤细胞和肿瘤干细胞都具有很强的杀伤作用,并且对肿瘤干细胞的杀伤效果更加明显,也为以后开发肿瘤的新型治疗策略打下一定的基础。
总之,体外悬浮培养富集的肿瘤干细胞可以用来快速评价靶向肿瘤干细胞药物的杀伤效果,本文即探讨了THO体外对此方法培养的肝癌干细胞的杀伤作用,并有效验证了THO是一种特异性的针对肝癌干细胞的杀伤药物,具有重要的临床应用价值。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA,2014,64(1):9-29. |
| [2] | He G, Dhar D, Nakagawa H, et al. Identification of liver cancer progenitors whose malignant progression depends on autocrine IL-6 signaling,Cell,2013,155(2):384-396. |
| [3] | 吴孟超,沈锋. 肝癌研究的现状和展望. 国外医学肿瘤学分册,2000, 27(1):17. Wu M C, Shen F. The present situation and prospects of research on liver cancer. Foreign Medical Sciences(cancer section), 2000, 27 (1): 17. |
| [4] | Bonnet D, Dick J E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nature Medicine,1997,3(7):730-737. |
| [5] | Al-Hajj M, Wicha M S, Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences, 2003, 100(7):3983-3988. |
| [6] | O'Brien C A, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature,2006,445(7123):106-110. |
| [7] | Singh S K, Hawkins C, Clarke I D, et al. Identification of human brain tumour initiating cells. Nature,2004, 432(7015):396-401. |
| [8] | Reya T, Morrison S J, Clarke M F, et al. Stem cells, cancer, and cancer stem cells. Nature,2001, 414(6859):105-111. |
| [9] | Visvader J E, Lindeman G J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell,2012,10(6):717-728. |
| [10] | Yamashita T, Wang X W. Cancer stem cells in the development of liver cancer. The Journal of Clinical Investigation,2013,123(5):1911-1918. |
| [11] | Huang P, Qiu J, Li B, et al. Role of Sox2 and Oct4 in predicting survival of hepatocellular carcinoma patients after hepatectomy. Clinical Biochemistry,2011,44(8):582-589. |
| [12] | Shan J, Shen J, Liu L, et al. Nanog regulates self-renewal of cancer stem cells through the insulin-like growth factor pathway in human hepatocellular carcinoma. Hepatology (Baltimore, Md),2012, 56(3):1004-1014. |
| [13] | Singh S K, Clarke I D, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors. Cancer Research,2003, 63(18):5821-5828. |
| [14] | Kai K, Nagano O, Sugihara E, et al. Maintenance of HCT116 colon cancer cell line conforms to a stochastic model but not a cancer stem cell model. Cancer Science,2009,100(12):2275-2282. |
| [15] | Tsuchiya A, Heike T, Fujino H, et al. Long-term extensive expansion of mouse hepatic stem/progenitor cells in a novel serum-free culture system. Gastroenterology,2005,128(7):2089-2104. |
| [16] | Collura A, Marisa L, Trojan D, et al. Extensive characterization of sphere models established from colorectal cancer cell lines. Cellular and Molecular Life Sciences,2013, 70(4):729-742. |
| [17] | Qiu X, Wang Z, Li Y, et al. Characterization of sphere-forming cells with stem-like properties from the small cell lung cancer cell line H446. Cancer Letters,2012,323(2):161-170. |
| [18] | Zhang L, Jiao M, Li L, et al. Tumorspheres derived from prostate cancer cells possess chemoresistant and cancer stem cell properties. Journal of Cancer Research and Clinical Oncology,2012,138(4):675-686. |
| [19] | Alimperti S, Lei P, Wen Y, et al. Serum-free spheroid suspension culture maintains mesenchymal stem cell proliferation and differentiation potential. Biotechnology Progress,2014,30(4):974-983. |
| [20] | Reilly J, Ayis S, Ferrier I, et al. Thioridazine and sudden unexplained death in psychiatric in-patients. The British Journal of Psychiatry, 2002, 180(6):515-522. |
| [21] | Huq Z U, Investigators R G. A trial of low doses of risperidone in the treatment of patients with first-episode schizophrenia, schizophreniform disorder, or schizoaffective disorder. Journal of Clinical Psychopharmacology, 2004, 24(2):220-224. |
| [22] | Potkin S G, Thyrum P T, Alva G, et al. The safety and pharmacokinetics of quetiapine when coadministered with haloperidol, risperidone, or thioridazine. Journal of Clinical Psychopharmacology, 2002, 22(2):121-130. |
| [23] | Choi A R, Kim J H, Yoon S. Thioridazine specifically sensitizes drug-resistant cancer cells through highly increase in apoptosis and P-gp inhibition. Tumor Biology, 2014,35(10):9831-9838. |
| [24] | Kang S, Dong S M, Kim B R, et al. Thioridazine induces apoptosis by targeting the PI3K/Akt/mTOR pathway in cervical and endometrial cancer cells. Apoptosis: An International Journal on Programmed Cell Death, 2012, 17(9):989-997. |
| [25] | Sachlos E, Risueño R M, Laronde S, et al. Identification of drugs including a dopamine receptor antagonist that selectively target cancer stem cells. Cell, 2012, 149(6):1284-1297. |
| [26] | Cao L, Zhou Y, Zhai B, et al. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines. BMC Gastroenterology, 2011, 11(1):71. |
| [27] | Lee T K W, Castilho A, Cheung V C H, et al. CD24+ Liver tumor-initiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation. Cell Stem Cell, 2011, 9(1):50-63. |
| [28] | Bilim V, Kasahara T, Hara N, et al. Role of XIAP in the malignant phenotype of transitional cell cancer (TCC) and therapeutic activity of XIAP antisense oligonucleotides against multidrug-resistant TCC in vitro. International Journal of Cancer, 2003, 103(1):29-37. |
| [29] | Yu Z, Pestell T G, Lisanti M P, et al. Cancer stem cells. The International Journal of Biochemistry & Cell Biology, 2012, 44(12):2144-2151. |
| [30] | Hanahan D, Weinberg R A. Hallmarks of cancer: the next generation. Cell, 2011, 144(5):646-674. |
| [31] | Yang J, van Oosten A L, Theunissen T W, et al. Stat3 activation is limiting for reprogramming to ground state pluripotency. Cell Stem Cell, 2010, 7(3):319-328. |
| [32] | Chen W, Shen X, Xia X, et al. NSC 74859-mediated inhibition of STAT3 enhances the anti-proliferative activity of cetuximab in hepatocellular carcinoma. Liver International,2012,32(1):70-77. |
| [33] | Sun C, Sun L, Jiang K, et al. NANOG promotes liver cancer cell invasion by inducing epithelial-mesenchymal transition through NODAL/SMAD3 signaling pathway. Int J Biochem Cell Biol, 2013, 45(6):1099-1108. |
| [34] | Silva J, Nichols J, Theunissen T W, et al. Nanog is the gateway to the pluripotent ground state, Cell, 2009, 138(4):722-737. |
| [35] | Johansson H, Simonsson S. Core transcription factors, Oct4, Sox2 and Nanog, individually form complexes with nucleophosmin (Npm1) to control embryonic stem (ES) cell fate determination. Aging-Us, 2010,2(11):815-822. |
 2015, Vol. 35
2015, Vol. 35




