文章信息
- 李明, 王永飞, 焦金霞, 杨洋, 张宁, 邢象斌, 马三梅
- LI Ming, WANG Yong-fei, JIAO Jin-xia, YANG Yang, ZHANG Ning, XING Xiang-bin, MA San-mei
- OPCML在胃癌中的表达及对胃癌细胞生物学的作用
- The Expression of OPCML in Gastric Cancer and Role of OPCML in Biological Function of Gastric Cancer Cell
- 中国生物工程杂志, 2015, 35(2): 1-7
- China Biotechnology, 2015, 35(2): 1-7
- http://dx.doi.org/10.13523/j.cb.20150201
-
文章历史
- 收稿日期:2014-11-13
- 修回日期:2014-12-04
2. 中山大学附属第一医院 广州 510080;
3. 广州医科大学附属第一医院 广州 510120
2. Department of Gastroenterology, First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China;
3. First Affiliated Hospital, Guangzhou Medical University, Guangzhou 510120, China
胃癌是最常见的人类恶性肿瘤之一,虽然目前胃癌的全球发病率和死亡率呈现下降的趋势[1],但胃癌每年的新发病例仍高居全球第四,死亡人数仍占全球癌症死亡原因的第二位[2]。超过70% 的新发病例和死亡发生在发展中国家,一半发生在东亚国家(主要是中国)[3]。近年来,胃癌的研究虽然取得了很大进展,但因其发病率高,80%以上的诊断发生在疾病的中晚期阶段[4],患者术后5年生存率仍较低,仅有30%左右[5]。因此,研究与胃癌发生、发展及转移相关的分子标志物,探讨其作用机制对胃癌的早期诊断、治疗及预后评估具有极其重要的意义。
OPCML(Opioid-binding protein/cell adhesion molecule-like),为鸦片受体类的细胞黏附因子,定位于人类染色体11q25,表达的蛋白位于细胞膜,最早于1989年由中国学者从大鼠脑组织中分离纯化[6],分子量约为60 kDa,广泛存在于神经系统细胞中,在调节鸦片受体和信号传导上具有重要的作用,并能促进细胞分化以及改变细胞膜性质[7]。研究发现OPCML基因的表达与多种肿瘤的关系非常密切[8, 9, 10, 11, 12, 13]。本研究结合临床病例资料,探讨OPCML在胃癌组织中的表达,将有可能为改善晚期胃癌患者预后提供新的思路和方法。 1 材料与方法 1.1 材 料 1.1.1 细胞和组织来源
118例胃癌组织、18例癌旁组织标本及正常胃黏膜组织来源于中山大学附属第一医院手术病例。其中,男98例,女20例。胃癌TNM分期:T1+T2 20例,T3+T4 98例;N0+N1 37例,N3+N4 81例;无远处转移69例,有远处转移49例。病理分型:高-中分化腺癌45例,低分化腺癌73例。所有病例术前未接受放、化疗。人胃癌系7901、AGS、BGC823、MKN28、N87、KATO、SNU1细胞株来自Rike细胞库(Tsukuba,Japan)和ATCC细胞库(ATCC,Rockville,MD)。除AGS细胞为含10%胎牛血清(Hyclone)的DMEM培养基(Hyclone),其它六种均为含10%胎牛血清的RPMI-1640培养基(Hyclone)。 1.1.2 质粒与菌种
pcDNA3.1-OPCML重组质粒及pcDNA3.1空载体购自北京泛基诺科技有限公司。感受态大肠杆菌DH5ɑ购自TaKaRa公司。 1.1.3 主要试剂及工具酶
Lipofectamine 2000转染试剂、新霉素(G418)、Opti-MEM 和RNA提取试剂盒购自Invitrogen公司。逆转录试剂盒购自Fermentas公司。PCR 试剂盒购自TaKaRa公司。质粒提取试剂盒购自MN公司。CCK-8购自广州奕源生物科技有限公司。一抗购自Abcam公司。 1.2 方 法 1.2.1 免疫组化
采用免疫组化SP法。组织切片经脱蜡水化,微波抗原热修复,滴加3%过氧化氢消除内源性过氧化酶,一抗4 ℃过夜,二抗室温30 min,PBS 漂洗3次,DAB显色,苏木素复染,脱水、封片、镜检。其中,PBS代替一抗作为阴性对照。
请两位病理学专家双盲法观察切片。每张切片在高倍镜下观察10个有代表性的视野,每个视野记数100个细胞,共计数1000个细胞。采用半定量积分法判定[14]:染色强度无特异着色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性细胞占计数细胞百分比:0分(无着色)、1分(<10%)、2分(≤10%~50%)、3分(>50%)。最终结果按染色强度和阳性细胞所占的百分比乘积得分。为便于统计,4 分以下为低表达,4 分以上为高表达。 1.2.2 细胞培养
所有细胞均置于5%CO2、37℃的培养箱中培养,贴壁生长细胞以0.25%的胰蛋白酶消化,每2~3天传代1次,取对数期生长细胞用于试验。
1.2.3 RT-PCR检测OPCML基因的mRNA表达
参照试剂盒说明书进行正常胃粘膜组织及7株人胃癌细胞的RNA提取、逆转录反应及RT-PCR扩增反应[12, 15]。上游引物:5′-GACCCTCGTGTGATCATCCT-3′,下游引物: 5′-GCCCATACAATGTGATGCTG-3′,目的片段大小688bp。内参S12上游引物:5′-GCATTGCTGCTGGAGGTGTAAT-3′,下游引物:5′-CTGCAACCAACCACTTTACGG-3′。整个RT-PCR反应体系为25μl,RT-PCR 反应条件为:热启动95℃ 5 min,95℃变性1 min,60℃退火30 s,72℃延伸40 s,38个循环,最后72℃聚合7 min。扩增产物用2%琼脂糖凝胶电泳检测。 1.2.4 pcDNA3.1 OPCML质粒DNA的制备
按照质粒转化操作说明书,将制备好的菌液涂布于含有Amp的LB固体培养基所倒置的平板上,37℃过夜培养。挑取阳性单克隆菌落置于含Amp的LB液体培养基中进行扩大培养,37℃恒温摇床振荡培养16~20h,用质粒DNA提取试剂盒(大量)按操作说明提取质粒DNA。使用紫外分光计测定质粒浓度和OD260/OD280比值。 1.2.5 细胞转染
用胰酶消化处于对数生长期的细胞,细胞计数后,接种于6孔板中,每孔细胞铺30×104个细胞,待细胞密度长至80%~90%时,按照LipofectaminTM2000试剂说明书进行操作,用提取好的pcDNA3.1-OPCML表达载体及pcDNA3.1空载体转染胃癌细胞株AGS,48 h后,按照试剂盒提取总RNA,逆转录成cDNA 进行 RT-PCR 扩增检测转染水平。 1.2.6 细胞平板克隆形成实验
胃癌细胞株AGS转染了pcDNA3.1-OPCML表达载体和pcDNA3.1空载体稳定筛选后,用0.25%胰蛋白酶消化并进行细胞计数,以 100、200、300个细胞的梯度密度分别接种于6孔板中,5% C02、37℃条件下,用0.5 mg/ml的G418筛选培养10~14 d 后,用甲醇固定10~15min,再用5%结晶紫溶液染色10 min。 超过50 个细胞计数为1个集落。 1.2.7 细胞生长曲线
按照CCK8试剂盒操作说明书,稳定转染后,设置pcDNA3.1-OPCML表达上调细胞组和pcDNA3.1空载体对照组分别以3×104个/ml细胞浓度接种于96孔板,5%CO2、37℃培养箱进行培养,24 h后每孔加10μl的CCK8,培养箱培养2 h后用酶标仪测波长450nm吸光度值。每组细胞铺5个复孔,连续检测4 d 的OD值,实验重复三次,绘制细胞生长曲线。 1.3 统计学处理
应用SPSS13.0软件进行统计学分析,实验数据均以均数±标准差(mean±SD)表示,组间比较采用t检验,生存分析用Log-Rank进行假设检验,P<0.05为差异有统计学意义。 2 结 果 2.1 OPCML基因的表达与胃癌组织临床病理特征的关系
OPCML蛋白主要表达于胞浆和胞膜,以黄色、棕黄色着色为主(图 1)。118例胃癌组织中OPCML有81例(68.6%)呈低表达,OPCML的表达与胃癌浸润深度和分化程度有关,OPCML的低表达率在T3/T4和T1/T2中分别为74.5%(73/98)和40%(8/20),差异具有显著性(P<0.05);低分化胃癌患者OPCML的低表达率90.4%(66/73)明显高于高分化或中分化的 33.3%(15/45),差异具有显著性 (P<0.05); OPCML的表达与患者的性别、年龄、淋巴结转移及远处转移都无明显关系(P>0.05),见表 1。
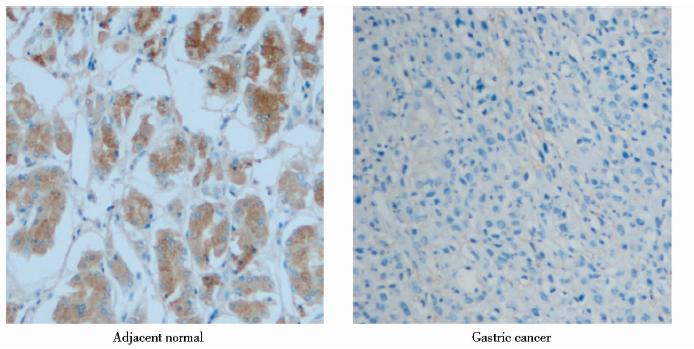
|
| 图 1 免疫组织化学检测OPCML在人胃癌组织中的表达 Fig. 1 Representative images of OPCML protein expression in gastric cancer and their adjacent non-tumour tissues determinded by immunohistochemistry |
| Variable | OPCML expression | P value | |||
| Low(81) | % | High(37) | % | ||
| Age(years) | 56.4±12.0 | 62.1±8.8 | 0.11 | ||
| Male | 65 | 66.3 | 33 | 30.7 | 0.23 |
| Female | 16 | 80.0 | 4 | 20.0 | |
| T | 0.002 | ||||
| 1/2 | 8 | 40.0 | 12 | 60.0 | |
| 3/4 | 73 | 74.5 | 25 | 25.5 | |
| N | |||||
| 0/1 | 23 | 62.2 | 14 | 37.8 | 0.305 |
| 2/3 | 58 | 71.6 | 23 | 28.4 | |
| M | |||||
| 0 | 47 | 68.1 | 22 | 31.9 | 0.883 |
| 1 | 34 | 69.4 | 15 | 30.6 | |
| Grading | <0.0001 | ||||
| Moderate/or high | 15 | 33.3 | 30 | 66.7 | |
| Low | 66 | 90.4 | 7 | 9.6 | |
由表 2可知,胃癌浸润深度、淋巴结转移、远处转移和OPCML的表达是影响胃癌患者预后生存率的重要因素(P<0.05)。T3/T4 和T1/T2期胃癌患者的平均生存率分别为(26.0±2.7)和(49.8±8.4)个月,差异具有显著性(P<0.01);N2/N3和 N0/N1分别为(24.9±3.0)和(40.9±5.6)个月,差异具有显著性(P<0.05);无远处转移的患者生存率(38.4±3.7)明显高于有远处转移(17.2±3.1)个月(P<0.0001);OPCML低表达者的生存率(25.7±2.9)低于高表达者(39.7±5.8)个月(P<0.05)。患者预后的生存率与年龄和分化程度无明显关系(P>0.05)。
| Cases | Events | Mean survival (months) | SE | Log-rank test (P value) | |
| Age | |||||
| >65 | 35 | 27 | 28.3 | 4.5 | 0.923 |
| 65 | 83 | 62 | 30.2 | 3.4 | |
| T | |||||
| 1/2 | 20 | 0 | 49.8 | 8.4 | 0.007 |
| 3/4 | 98 | 80 | 26.0 | 2.7 | |
| N | |||||
| 0/1 | 37 | 23 | 40.9 | 5.6 | 0.011 |
| 2/3 | 81 | 66 | 24.9 | 3.0 | |
| M | |||||
| 0 | 69 | 48 | 38.4 | 3.7 | <0.0001 |
| 1 | 49 | 41 | 17.2 | 3.1 | |
| Grading | |||||
| Moderate/or high | 45 | 30 | 36.7 | 5.1 | 0.068 |
| Low | 73 | 59 | 24.5 | 2.7 | |
| OPCML expression | |||||
| Low | 81 | 67 | 25.7 | 2.9 | 0.029 |
| High | 37 | 22 | 39.7 | 5.8 |
用MN公司的试剂盒抽提正常胃粘膜和胃癌细胞的总RNA,以逆转录的cDNA为模板,通过PCR扩增内参S12,在688bp处出现特异性条带,表明cDNA质量良好。加入OPCML引物后,琼脂糖凝胶电泳结果显示OPCML在正常胃黏膜中表达上调,在7901、AGS、BGC823、MKN28、N87、KATO、SNU1胃癌细胞株中表达下调(图 2)。
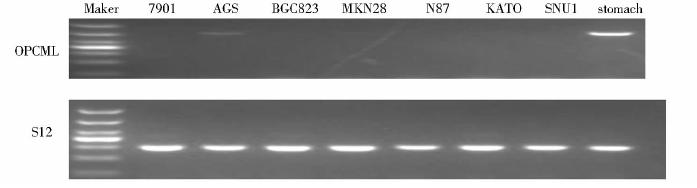
|
| 图 2 RT-PCR检测OPCML的表达 Fig. 2 The OPCML expression was detected by RT-PCR |
pcDNA3.1-OPCML表达载体和pcDNA3.1空载体转染胃癌细胞株AGS后,RT-PCR检测显示OPCML呈高表达(图 3)。

|
| 图 3 转染后OPCML mRNA水平的变化 Fig. 3 The expression level changes of OPCML mRNA after transfection |
与空载体相比,转染了pcDNA3.1-OPCML表达载体的胃癌细胞形成的集落克隆数少而且体积较小(图 4)。通过计数发现,转染空质粒和OPCML的AGS细胞相对克隆形成率差值为72%,两者差异有统计学意义(P<0.05)。
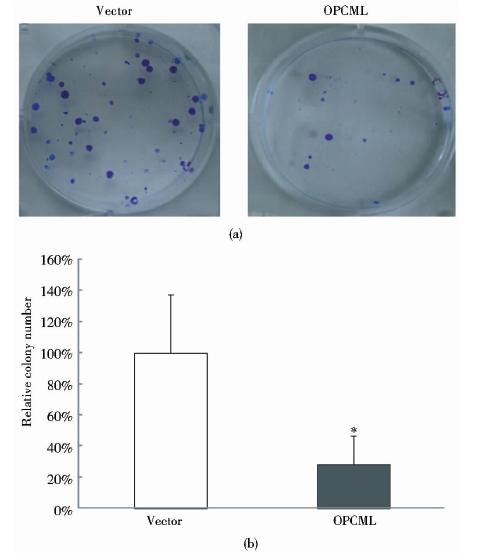
|
| 图 4 OPCML对胃癌细胞株AGS克隆形成能力的影响 Fig. 4 Effect of OPCML on AGS colony formation ability (a) The representative images of the colony formation in AGS transfected with pcDNA3.1/OPCML or empty vector(pcDNA3.1) (b) Quantitative analysis of colony numbers. Data are mean±SD; * P<0.05 |
细胞生长曲线显示AGS-OPCML组随着时间的增加,细胞的生长速度明显下降,而对照组AGS-vector生长曲线在4d后呈现持续升高的趋势,表明AGS细胞转染OPCML基因后,细胞增殖能力明显下降(P<0.05)(图 5)。
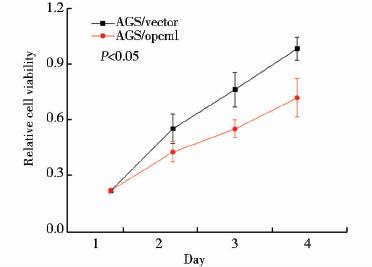
|
| 图 5 OPCML对胃癌细胞生长的影响 Fig. 5 Effect of OPCML gene on the growth of gastric cancer cells (P<0.05) |
胃癌的发生、发展是一个多因素、多步骤的过程,它与患者的环境饮食、癌前状态、遗传因素和幽门螺旋杆菌感染等因素密切相关。此外,原癌基因的激活,抑癌基因的失活、突变,凋亡基因的失调以及转移相关基因的激活作用均可使细胞增殖失控而导致恶性转化,共同参与肿瘤的发生和发展[16]。McKie等[17]在上皮性卵巢癌细胞中发现OPCML通过结合特定受体酪氨酸激酶(RTKs)胞外区域,受体介导的胞吞作用和多聚泛素化-蛋白酶体途径而负向调节RTKs。OPCML属于IgLON 家族成员之一,该家族在细胞黏附以及相互识别中发挥重要作用。李金平等[13]、覃宇翔等[7]显示OPCML可能通过Wnt信号传导通路在肿瘤细胞浸润转移中发挥负调节作用。
本研究发现118例胃癌患者中,OPCML低表达多于高表达者,OPCML的表达与肿瘤浸润深度及分化程度密切相关,随着分化程度变差、浸润深度加深,OPCML低表达率有增加趋势,提示其在胃癌发展过程中起着一定的作用,可能与预后相关。与肿瘤预后相关因素很多,我们发现OPCML的表达、胃癌浸润深度、淋巴结转移和远处转移与胃癌的预后相关,较之OPCML高表达、T1/T2、N0/N1和无远处转移的患者,OPCML低表达、T3/T4、N2/N3和有远处转移的患者预后较差。除了在胃癌中发现OPCML的表达与临床病理特征和预后相关外,也有有关其它肿瘤的文献报道。李金平等[13]发现人乳腺癌组织中OPCML蛋白表达明显低于癌旁组织和乳腺腺病组织,并且与组织学分级、病理分期和淋巴结转移密切相关,是影响乳腺癌预后的重要因素。童红洲等[18] 通过对72例上皮性卵巢癌组织中OPCML蛋白表达情况的检测发现不同的临床分期及病理分级中 OPCML 蛋白表达差异明显,临床早期及分化好的肿瘤组织 OPCML 蛋白阳性率及相对含量较高,临床晚期及分化差的肿瘤组织中较低,OPCML 蛋白的表达量与癌恶性程度关系密切,这对卵巢癌基因治疗有一定的指导意义。
本研究通过7株胃癌细胞和正常胃黏膜的mRNA表达水平检测显示,胃癌细胞中OPCML出现低表达现象。参考文献[8, 9, 10, 11, 12, 13]指出基因的表达下调往往与其启动子甲基化有着密切的联系,而甲基化往往与疾病的发生和发展联系紧密。张宁等[12]指出由于OPCML基因启动子区的高甲基化状态使得该基因发生了失活,丧失了其功能,从而进一步导致在胃癌细胞株中的失表达。
细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。通过检测平板克隆形成数目,转染pcDNA3.1-OPCML的AGS细胞组的克隆数明显低于对照组细胞,说明了OPCML基因转染降低了胃癌细胞AGS的集落形成能力,对AGS细胞的增殖有抑制作用。
目前,对肿瘤的研究己经深入到基因分子水平。使用不同技术来改变某基因在某肿瘤细胞中表达后,观察对肿瘤生物学行为的影响。细胞生长、增殖能力是判定细胞活力的重要指标,是细胞生物学特性的基本参数之一。本研究中采用了细胞计数和CCK8法检测OPCML基因表达发生改变后对细胞生长、增殖能力的影响。通过CCK8法证实,转染AGS-OPCML组细胞生长缓慢,OD值明显低于对照组细胞,说明OPCML基因对AGS细胞的生长具有抑制作用。
通过对OPCML基因在胃癌组织中表达和临床意义,及胃癌细胞中生物学功能的研究,对于胃癌的早期诊断、早期治疗并提高治疗效果、确立新的治疗靶点、改善预后有着极其重要的作用。
| [1] | 徐飚, 王建明. 胃癌流行病学研究. 中华肿瘤防治杂志, 2006, 13(1): 1-7. Xu B, Wang J M. Epidemiological study of gastric cancer. Chinese Journal of Cancer Prevention and Treatment, 2006, 13(1):1-7. |
| [2] | Jemal A, Bray F, Center M M, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61: 69-90. |
| [3] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer, 2010, 127: 2893-2917. |
| [4] | Han-Shao Liu, Hua-Sheng Xiao. MicroRNAs as potential biomarkers for gastric cancer. World J Gastroenterol, 2014, 20(34):12007-12017. |
| [5] | Hartgrink H H, Van de Velde C J. Status of extended lymph node dissection: Locoregional control is the only way to survive gastric cancer. J Surg Oncol, 2005, 90(3): 153-165. |
| [6] | Schofield P R, McFarland K C, Hayflick J S, et al. Molecular characterization of a new immunoglobulin superfamily protein with potential roles in opioid binding and cell contact. The EMBO Journal, 1989, 8:489-495. |
| [7] | 覃宇翔, 姚德生. OPCML基因与肿瘤关系的研究进展. 广西医科大学学报, 2011, 28 (3): 490-492. Jia Y X, Yao D S. Study on the relationship between OPCML gene and tumor. Journal of Guangxi Medical University, 2011, 28 (3): 490-492. |
| [8] | Zhou F, Ma M, Tao G, et al. Detection of circulating methylated opioid binding protein/cell adhesion molecule-like gene as a biomarker for ovarian carcinoma. ClinLab, 2014, 60(5): 759-765. |
| [9] | Duarte-Pereira S, Paiva F, Costa V L, et al. Prognostic value of opioid binding protein/cell adhesion molecule-like promoter methylation in bladder carcinoma. Eur J Cancer, 2011, 47(7): 1106-1114. |
| [10] | Ye F, Zhang S F, Xie X, et al. OPCML gene promoter methylation and gene expression in tumor and stroma cells of invasive cervical carcinoma. Cancer Invest, 2008, 26(6): 569-574. |
| [11] | Reed J E, Dunn J R, du Plessis D G, et al. Expression of cellular adhesion molecule ‘OPCML’ is down-regulated in gliomas and other brain tumours. Neuropathol Appl Neurobiol, 2007, 33(1): 77-85. |
| [12] | 张宁, 许继德, 元刚,等. 启动子甲基化致 OPCML 基因失活在胃癌发病中的作用. 广东医学, 2012, 33 (16): 2367-2371. Zhang N, Xu J D, Yuan G, et al. Promoter methylation-induced OPCML expression silence in progression of gastric cancer. Guangdong Medical Journal, 2012, 33 (16): 2367-2371. |
| [13] | 李金平, 王昇, 李宏,等. 候选抑癌基因 OPCML 在人乳腺癌中的表达及其临床意义. 第三军医大学学报, 2013, 35(23): 2565-2568. Li J P, Wang S, Li H, et al. Expression and clinical significances of candidate tumor suppressor gene OPCML in human breast cancer tissues. Journal of Third Military Medical University, 2013, 35(23): 2565-2568. |
| [14] | Meng F, Li H, Shi H, et al. MACC1 down-regulation inhibits proliferation and tumourigenicity of nasopharyngeal carcinoma cells through Akt/β-catenin signaling pathway. PLoS One, 2013, 8(4): e60821. |
| [15] | Xu L, Li X, Chu E S, et al. Epigenetic inactivation of BCL6B, a novel functional tumour suppressor for gastric cancer, is associated with poor survival. Gut, 2012, 61(7):977-985. |
| [16] | Dhar D K, Udagawa J, Ishihara S, et al. Expression of regeneration gene I in gastric adenocarcinomas:correlation with tumor differentiation status and patient survival. Cancer, 2004, 100(6): 1130-1136. |
| [17] | McKie A B, Vaughan S, Zanini E, et al. The OPCML tumor suppressor functions as a cell surface repressor-adaptor, negatively regulating receptor tyrosine kinases in epithelial ovarian cancer. Cancer Discov, 2012, 2(2): 156-171. |
| [18] | 童红洲, 胡宾, 沈敬华. OPCML蛋白在上皮性卵巢癌中的表达及意义. 内蒙古医科大学学报, 2013, 35(2): 142-145. Tong H Z, Hu B, Shen J H. The expression and significance of OPCML protein in primary epithelial ovarian cancer. Journal of Inner Mongolia Medical University, 2013, 35(2): 142-145. |
 2015, Vol. 35
2015, Vol. 35




