文章信息
- 蒋延超, 蒋世云, 傅凤鸣, 黄凯, 康星欣, 徐丹
- JIANG Yan-chao, JIANG Shi-yun, FU Feng-ming, HUANG Kai, KANG Xing-xin, XU Dan
- 透明质酸生物合成途径及基因工程研究进展
- Advance in Research on HA Biosynthesis and Gene Engineering
- 中国生物工程杂志, 2015, 35(1): 104-110
- China Biotechnology, 2015, 35(1): 104-110
- http://dx.doi.org/10.13523/j.cb.20150115
-
文章历史
- 收稿日期:2014-10-29
- 修回日期:2014-11-24
透明质酸(hyaluronic acid,HA)又名玻尿酸、玻璃酸,是一种由β(1-3)-N-乙酰基-D-葡萄糖胺和β(1-4)-D-葡萄糖醛酸的双糖单位聚合而成的线性大分子酸性黏多糖,分子质量为1×104~6×106 Da,双糖单位数为2 000~25 000,是构成皮肤真皮层的物质,也是组成细胞间基质的主要成分[1, 2, 3, 4, 5]。HA广泛存在于人和脊椎动物的各种组织细胞间质中。部分细菌,如A、B、C族链球菌,多杀巴斯德氏菌,新型隐球菌,蜡样芽胞杆菌等[6, 7, 8, 9]的荚膜中也含有HA。由于独特的流变学特性、特殊的生理作用、极强的持水保湿能力和良好的生物相容性,HA在临床治疗、医学研究、化妆品工业和食品添加剂等领域有广泛的应用。
HA的工业生产主要有两种方法,即动物组织提取法和微生物发酵法,目前发酵法已成为工业化生产HA的主要方式。虽然近年来发酵法生产HA发展迅速,但是也存在许多不足,如链球菌传统诱变效率低、工作量大,对营养和发酵工艺要求苛刻,且发酵菌株含有大量毒力因子,存在潜在的致病性等。因此,通过基因工程手段构建安全、高效的HA生产工程菌是亟待解决的难题。
1 HA微生物合成的分子生物学研究进展鉴于构建HA高产菌株的需要,人们对HA的生物合成途径及其基因表达调控的方式进行了深入的研究。其中研究最多、了解最清楚的是链球菌。下面以链球菌为例对HA的生物合成途径、合成相关基因表达的调控方式及目前的研究进展进行介绍。
HA是由N-乙酰氨基葡萄糖和葡萄糖醛酸组成的双糖单位聚合而成的直链酸性黏多糖,HA的生物合成过程在各类微生物中基本一致。目前对链球菌中的HA合成途径了解的比较清楚。在链球菌中HA的合成从葡萄糖(Glc)开始共10步反应,如图 1所示。
尽管不同种类链球菌的HA产量及质量不同,但其编码与HA合成相关酶类的基因是高度保守的。在链球菌中HA的合成共涉及5种酶蛋白(HAS、UGD、UGP、GlmU、Pgi)。其中,GlmU为双功能酶,GlmU同时具有乙酰转移酶和尿苷酰转移酶活性。因此,它一方面起着磷酸葡萄糖胺乙酰化的作用;另一方面还可以催化乙酰磷酸葡萄糖胺生成尿苷二磷酸-N-乙酰葡萄糖胺。UGD、UGP催化前体尿苷二磷酸葡萄糖醛酸(UDP-GlcA)的合成,Pgi催化磷酸葡萄糖生成磷酸果糖为另一个前体尿苷二磷酸-N-乙酰氨基-葡萄糖(UDP-GlcNAC)合成提供底物,HAS则催化两个前体合成HA(图 1)。目前,链球菌中所有与HA合成相关的酶及其基因均已被鉴定出来,如表 1所示。
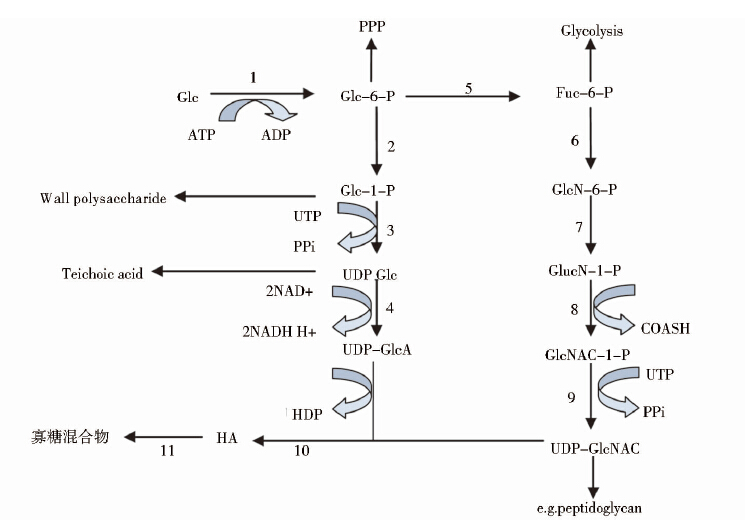
|
| 图 1 透明质酸生物合成途径简图 Fig. 1 The simplified pathway for hyaluronic acid biosynthesis 1: Hexokinase; 2: Phosphoglucomutase; 3: UDP-glucose pyrophosphorylase; 4:UDP-glucose dehydrogenase; 5: Phosphoglucoisomerase; 6: Amidotransferase; 7:Mutase; 8: Acetyltransferase; 9: Pyrophosphorylase; 10: Hyaluronic acid synthase; 11: Hyaluronidase |
| 基因 | 所表达的酶及功能 | 长度(aa) |
| hasA | 透明质酸合酶hyaluronic acid synthase HAS | 419 |
| hasB | 尿苷二磷酸-葡萄糖-6-脱氢酶 UDP-glucose-6-dehydrogenase UGD | 402 |
| hasC | 尿苷二磷酸-葡萄糖焦磷酸化酶 UDP-glucose pyrophosphorylase UGP | 304 |
| glmU | N-乙酰葡萄糖胺-1-磷酸尿苷酰转移酶/葡萄糖胺-1-磷酸乙酰转移酶 N-acetylglucosamine-1-phosphate uridyltransferase/glucosamine-1-phosphate acetyltransferase GlmU | 460 |
| pgi | 葡萄糖-6-磷酸异构酶 glucose-6-phosphate isomerase Pgi | 449 |
| glmS | 葡萄糖胺-6-磷酸果糖转氨酶 glucosamine-fructose-6-phosphate aminotransferase GlmS | 604 |
| hylP | 透明质酸酶 hyaluronidase HylP | 336/td> |
| Note:Data in the table from NCBI database | ||
链球菌中HA合成基因的组织形式随链球菌种属不同而有所差异。兽疫链球菌(Streptococcus equi subsp.zooepidemicus、 S.zooepidemicus)中参与HA合成的几个基因(hasA、hasB、hasC、glum、pgi)是串联在一起的,位于一个操纵子上。而A族链球菌和类马疫链球菌(Streptococcus equi subsp.equi、 S.equi)中参与HA合成的几个基因(hasA、hasB、hasC、glum、pgi)位于两个操纵子上。其中hasA、hasB、hasC位于一个操纵子上,具有共同的启动子和调控序列,可以转录出一条多顺反子mRNA,进而转译出所需的酶蛋白,人们将其称为hasABC operon(简称has operon)。
has operon中只存在一个启动子,位于第一个结构基因(hasA)初始密码子(GUG)上游约35bp处[10, 11]。在has operon 5′端的非转译区内存在一段非常特殊的DNA序列。其功能是参与HA合成基因的表达调控,长度为200bp左右。该区最初被认为是阻遏蛋白结合的位点,因为如果在该区发生基因突变就会导致HA合成基因的超量表达。21世纪初期,研究者发现该区域内存在5个CovR结合位点,且每个结合位点包含一个ATTARA模式片段。CovR与CovS组成CovS/CovR双组分调节系统调控多种毒力因子表达,属于OmpR/EnvZ双组分信号转导家族。其中,CovS是传感器、CovR是效应器、CovS感受外界刺激被Mg2+激活发生磷酸化诱导CovR磷酸化并聚合成二聚体生成活性CovR,然后活性CovR与has operon的启动子结合,负调节has operon的转录[12, 13, 14, 15, 16, 17]。CovR的活性与环境中的Mg2+浓度成正比,CovR的表达受自身抑制。随着研究的深入,又发现另外几个基因的突变也可以导致HA合成基因的表达异常。这几个基因分别为rivR、ralp3、rgg/ropb、nra、codY、msmR、rofA、sptRS,这些基因位于距HA合成基因较远的位置[18, 19, 20, 21, 22]。其中,RivR、RalP3、Rgg/RopB、Nra负调节HA合成基因的转录表达,而CodY、MsmR、RofA、SptRS正调节HA合成基因的转录表达。但它们调控HA合成基因转录的机制尚不清楚。此外,HA合成相关酶类翻译水平的表达也受多种调节系统的调控,如LuxS、CvfA等调控系统。研究发现,HA合成相关酶类的翻译表达受温度调节。CvfA,一个膜结合内切核糖核酸酶,是涉及HA合成温度调节的关键蛋白质,低温下它使HA合成相关酶类过量表达。Kang等[23]推测其可能通过影响HA合成相关mRNA阻遏物的降解来调控HA合成酶类翻译水平的表达。此外,luxS基因失活在翻译水平抑制HA的合成,LuxS通过调节信号分子自诱导物-2(AI-2)的合成调控HA的合成[24]。
除了研究HA合成基因的表达调控之外,近年来一部分人开始着手研究与HA跨膜运输相关的基因。研究者认为,HA跨膜运输方式根据透明质酸合酶类型可分为两种方式。I类透明质酸合酶不依赖其他转运蛋白直接通过透明质酸合酶跨膜区域形成的孔通道将HA转运至胞外,而II类透明质酸合酶需要多个转运蛋白参与才能将HA转运至胞外[25, 26, 27]。但II类菌株中与HA跨膜运输相关的转运蛋白及其基因尚不清楚。
2 基因工程技术在HA生产中的应用在利用微生物发酵法合成HA的工业生产中,筛选优良的微生物发酵菌种是增加HA产量、提高经济效益的首要条件。随着分子生物学技术的迅速发展及对HA合成相关基因了解的不断深入,人们开始采用基因工程手段构建HA生产菌。目前,基因工程技术在HA生产中的应用主要从三个角度进行:①提高HA安全性;②提高HA产量;③调控HA分子质量。
目前,HA工业生产菌株主要是C族链球菌,由于该种菌有一定的致病性[28, 29]。因此,利用该种菌发酵生产的HA的安全性一直是人们担心的问题。通过代谢工程手段解决HA安全性问题有切除原产菌的毒力因子和代谢改造公认安全菌种两种方法。早期,由于对原产菌中HA合成分子调控机制不清楚,一般通过切除原产菌中的毒力因子的方式来提高所产HA的安全性。李尧等[30]用温度敏感基因毃除载体系统pJR700成功构建了链球菌血红素受体基因缺失突变株用于HA生产。但原产菌中毒力因子过多且尚未完全测定,因此通过切除原产菌中毒力因子的方式进展缓慢,逐渐被改造公认安全菌种方式取代。代谢改造安全菌种是通过基因工程手段转化HA合成相关基因,构建工程菌株。目前,在HA工程菌的应用中多采用大肠杆菌、乳酸乳球菌、枯草杆菌、土壤杆菌等[4, 31]安全菌种。Widner[32]将hasA及几个与前体合成相关的基因导入枯草杆菌成功构建了工程菌用于HA生产。Mao等[33]将唯一的II类透明质酸合酶(pmHAS)和E.coli K5菌株的尿苷二磷酸葡萄糖脱氢酶基因导入E.coli JM109中,发酵生产HA,产量达到2.0~3.8g/L。
近年来,HA的市场需求越来越大,因此提高HA产量成为提高经济效益的重要手段。基于提高HA产量的分子生物学改造根据改造途径可分为基于前体合成的分子生物学改造、基于HA合成转运的分子生物学改造和基于补充途径的分子生物学改造。
早期研究人员认为,HA的前体合成量越多,HA产量越大。因此,可通过调控两种前体合成相关酶类的过量表达,提高HA的前体合成量,进而提高HA产量。最近的研究发现,UDP-GlcA是微生物合成HA产量的限制因素,而UDP-GlcNAc不是HA产量的限制因素,因为各类微生物自身合成的UDP-GlcNAc已足以满足HA的合成[10, 32, 34]。毫无疑问,疏通UDP-GlcA合成途径,是提高前体合成量所必需,进而才能提高HA的产量。生物合成UDP-GlcA时,有研究发现UGD催化尿苷二磷酸-葡萄糖生成UDP-GlcA是该途径的关键步骤。也有人认为UGP是限制HA产量的关键酶[4]。因此,在改造策略上,一方面要提高从Glc-1-P向UDP-GlcA方向流路上UGP基因(hasC)和UGD基因(hasB)的表达量和酶活力,即疏通该流路;另一面要减弱或切断分支点往其它支路的流量。Izawa等[34]将嗜热链球菌的hasA、hasB基因用链球菌-埃希氏大肠杆菌穿梭载体pBE31导入嗜热链球菌中,发现导入hasA和hasB的重组菌HA产量达到1.2g/L,比只导入hasA重组菌提高了1倍。Prasad等[4]发现导入hasA、hasB、hasC的重组菌HA产量比只导入hasA、hasB的重组菌提高了119%。此外,目前还未见通过截断其他分支代谢来构造工程菌的报道。
与其他杂多糖不同,HA的合成不需要引物和其他糖基转移酶参与,仅在HAS的作用下即可完成HA的合成。研究表明,HA合成转运过程的调控位点是HAS。提高HAS活性,加快HA转运速率,是运用代谢工程手段提高HA产量的一个重要方向。由于HAS具有心磷脂依赖性[35, 36, 37],且其部分保守氨基酸残基与其活性有关,故通过代谢工程手段提高HAS活性的方法包括:一是定点突变HAS活性区域的特殊氨基酸残基;二是修饰与HAS有关的磷脂。当前,研究人员一般通过定点突变HAS活性区域的特殊氨基酸残基来提高HAS活性。Weigel等[38]对seHAS中的cys367定点突变为Ala,发现HAS活性提高了26%。但HAS中的特殊氨基酸影响HAS活性的机制尚不清楚,揭示HAS中特殊氨基酸影响HAS活性的机制仍是HAS的一个研究重点。目前,尚未有报道通过修饰HAS酶结合的心磷脂来提高HAS产量的研究。
由于HA合成和能量代谢密切相关[39],且UDP-GlcA合成途径中需要消耗NAD+,而链球菌中不具有完整的TCA循环,只能通过乳酸代谢来补给NAD+,造成约80%的碳源被浪费,甚至乳酸积累会导致pH下降,抑制HA合成。因此,在代谢工程菌中构建新的NAD+补给途径和能量补给途径可作为一种提高HA产量的新方法。张晋宇[40]以质粒pEU308为载体,将Wantersia entropha的PHB合成基因phbCAB在兽疫链球菌中表达,在工程菌中构建了一个新的NAD+补给途径,乳酸合成从64g/L降低到41g/L,同时透明质酸产量达到7.29g/L,比野生菌提高了1g/L以上。Wu等[41]将聚羟基丁酸(PHB)合成酶系统基因phbCAB利用pEUHB载体导入兽疫链球菌,摇瓶水平HA产量提高了29%,乳酸产量降低了29%。Chong等[42]发现,在兽疫链球菌中超表达NADH氧化酶(NOX)可降低乳酸合成,调高ATP合成。
HA的多种生物活性具有分子质量依赖性,低分子HA的某些生物活性,高分子HA不具有甚至具有相反的作用。因此,利用代谢工程手段生产可调控分子质量的HA很有必要。目前,对HA分子质量调控机制尚无统一的结论。2000年,Heldermon等[43]提出了保留-释放模型:保留力增大,合成高分子质量HA;释放力增大,合成低分子质量HA。Pummill等[44]首次证明了HAS催化活性与HAS底物结合能力之间的相对强度是调节HA分子质量的主要手段之一。Jing和DeAngelis[45]首次在体外证明了HAS合成HA的分子质量大小分布及均一程度受合成过程中前体短糖链的浓度、底物浓度及其二者与HAS浓度的比率。根据保留-释放模型通过代谢工程手段人为调控HA分子质量的方法包括:一是修饰HAS调控保留力;二是调节两种前体表达量调控释放力。Weigel等[38]对seHAS中的4个Cys进行定点突变,发现Cys262和Cys281突变为Ala时,HA分子质量仅为野生型的62%。Medina[46]发现对seHAS的Lys48残基进行修饰(突变成Glu或Phe)可降低HA分子质量。Kumari[47]发现对seHAS中Lys48和Glu327进行突变可以降低HA分子质量,最低分子质量约为0.6MDa,仅为野生型的17%。但由于基于HAS基因的突变来调节HA分子质量尚有许多不确定性,基于该调控机制的代谢工程研究进展缓慢。Sheng等[48]将兽疫链球菌HAS基因szhasA和UGD基因szhasB置于两个不同的诱导启动子调控下,并将其导入乳酸乳球菌(Lactococcus lactis)中,首次在活细胞体内验证了Jing和DeAngelis[45]提出的生物合成HA分子质量的大小受底物浓度与HAS浓度之间比率影响的假设,并得到微生物合成HA的分子质量与该比率量正相关的结论。Chen等[49]的研究发现,在兽疫链球菌中,当两种底物达到平衡时,合成HA的分子质量最大,超表达与UDP-GlcA合成有关的基因会降低HA分子质量,超表达与UDP-GlcNAc合成有关的基因可增大HA分子质量,且超表达磷酸葡萄异构酶基因(pgi)可以增大HA分子质量。Yu和Stephanopoulos[50]证实在重组大肠杆菌中高分子质量HA的合成过程中pgi起了重要作用。Marcellin等[51]的研究发现,兽疫链球菌中上调1-磷酸葡萄糖胺乙酰转移酶/UDP-N-乙酰葡萄糖胺焦磷酸化酶(GlmU)的表达水平,下调UDP-N-乙酰葡萄糖胺-1-羧基乙烯转移酶(MurA)的表达水平可以使HA分子质量增加。
3 展 望HA的合成是比较简单的代谢网络,仅由两个前体物的合成和HA的合成转运构成,但其涉及的相关代谢十分复杂,构建高产代谢工程菌的方法十分复杂。当前,使用公认安全菌种来重组生产HA已成为HA生产的一个焦点。但当前HA代谢工程研究还有诸多难点。目前以下三个焦点还需进一步研究:①所有I类HAS的底物结合位点的同源性、数目及性质,了解这些细节有助于理解HAS的调控及新型药物靶点的设计;②深入研究识别外源HA的作用机制,为病毒防护作准备;③探索合成HA的分子级过程,并扩大研究真核透明质酸合酶的分子序列及调控机制,为人类健康和研究疾病的使用机制作准备。
| [1] | Chong B F, Nielsen L K. Aerobic cultivation of Streptococcus zooepidemicus and the role of NADH oxidase. Biochemical Engineering Journal, 2003, 16(2):153-162. |
| [2] | Jagannath W, Ramachandran K B. Influence of competing metabolic processes on the molecular weight of hyaluronic acid synthesized by Streptococcus zooepidemicus. Biochemical Engineering Journal, 2010, 48(2):148-158. |
| [3] | Liu L, Du G C, Chen J, et al. Microbial production of low molecular weight hyaluronic acid by adding hydrogen peroxide and ascorbate in batch culture of Streptococcus zooepidemicus. Bioresource Technology, 2009, 100(1):362-367. |
| [4] | Prasad S B, Jayaraman G, Ramachandran K B. Hyaluronic acid production is enhanced by the additional co-expression of UDP-glucose pyrophosphorylase in Lactococcus lactis. Appl Microbiol Biotechnol, 2010, 86(1):273-283. |
| [5] | Hoffmann J, Altenbuchner J. Hyaluronic acid production with Corynebacterium glutamicum: effect of media composition on yield and molecular weight. Journal of Applied Microbiology, 2014, 117(3):663-678. |
| [6] | Blank L M, Hugenholtz P, Nielsen L K. Evolution of the hyaluronic acid synthesis (has) operon in Streptococcus zooepidemicus and other pathogenic streptococci. J Mol Evol, 2008, 67(1):13-22. |
| [7] | 马晓菁. 致犊牛肺炎多杀性巴氏杆菌的分离鉴定及部分生物学特性研究. 石河子:石河子大学, 动物科技学院,2010:2-4. Ma X J. Isolation and Identification and Parts of Biological Characteristics of Pasteurella multocida Inducing Pneumonia of Calf. Shihezi:Shihezi University,College of Animal Science & Technology, 2010:2-4. |
| [8] | Jong A, Wu C H, Chen H M, et al. Identification and characterization of CPS1as a hyaluronic acid synthase contributing to the pathogenesis of Cryptococcus neoformans infection. Eukaryotl Cell, 2007, 6(8):1486-1496. |
| [9] | Young O S, Budzik J M, Garufi G, et al. Two capsular polysaccharides enable Bacillus cereus G9241 to cause anthrax-like disease. Mol Microbiol, 2011, 80(2): 455-470. |
| [10] | Alberti S, Ashbaugh C D, Wessels M R. Structure of the has operon promoter and regulation of hyaluronic acid capsule expression in group A streptococcus. Molecular Microbiology,1998,28(2):343-353. |
| [11] | Dougherty B A, Rijn I V D. Molecular characterization of hasA from an operon required for hyaluronic acid synthesis in group A streptococci. The Journal of Biological Chemist, 1994,269(1):169-175. |
| [12] | Heath A, Dirita V J, Barg N L, et al. A two-component regulatory system, CsrR-CsrS, represses expression of three Streptococcus pyogenes virulence factors, hyaluronic acid capsule, streptolysin S,and pyrogenic exotoxin B. Infection And Immunity,1999, 67(10):5298-5305. |
| [13] | Liang Z, Zhang Y L, Agrahari G, et al. A natural inactivating mutation in the CovS component of the CovRS regulatory operon in a pattern D Streptococcal pyogenes Strain influences virulence-associated genes. The Journal of Biological Chemistry, 2013,288(9): 6561-6573. |
| [14] | Federle M J, Scott J R. Identification of binding sites for the group A streptococcal global regulator CovR. Molecular Microbiology, 2002,43(5):1161-1172. |
| [15] | Kreikemeyer B, McIver K S, Podbielski A. Virulence factor regulation and regulatory networks in Streptococcus pyogenesand their impact on pathogen-host interactions. Trends in Microbiology, 2003,11(5):224-232. |
| [16] | Roberts S A, Churchward G G, Scott J R. Unraveling the regulatory network in Streptococcus pyogenes: the global response regulator CovR represses rivR directly. Journal of Bacteriology, 2007,189(4):1459-1463. |
| [17] | Trevino J, Perez N, Ramirez P E, et al. CovS simultaneously activates and inhibits the CovR mediated repression of distinct subsets of group A streptococcus virulence factor-encoding genes. Infection and Immunity, 2009,77(8):3141-3149. |
| [18] | Trevino J, Liu Z Y, Cao T N, et al. RivR is a negative regulator of virulence factor expression in Group A streptococcus. Infection and Immunity, 2013,81(1):364-372. |
| [19] | Kwinn L A, Khosravi A, Aziz R K, et al. Genetic characterization and virulence role of the RALP3/LSA locus upstream of the streptolysin S operon in invasive M1T1 group A streptococci. Journal Bacteriology, 2007,189(4):1322-1329. |
| [20] | Kreikemeyer B, Nakata M, Koller T, et al. The Streptococcus pyogenes serotype M49 Nra-Ralp3 transcriptional regulatory network and its control of virulence factor expression from the novel eno ralp3 epf sagA pathogenicity region. Infection and Immunity, 2007, 75(12):5698-5710. |
| [21] | Malke H, Steiner K, McShan W M, et al. Linking the nutritional status of Streptococcus pyogenesto alteration of transcriptional gene expression:the action of CodY and RelA. International Journal of Medical Microbiology, 2006, 296(4 5):259-275. |
| [22] | Shelburne S A, Sumby P, Sitkiewicz I, et al. Central role of a bacterial two-component gene regulatory system of previously unknown function in pathogen persistence in human saliva. PNAS, 2005, 102(44):16037-16042. |
| [23] | Kang S O, Wright J O, Tesorero R A, et al.Thermoregulation of capsule production by Streptococcus pyogenes. PLoS One, 2012,7(5):1-15. |
| [24] | Marouni M J, Sela S. The luxS Gene of Streptococcus pyogenes regulates expression of genes that affect internalization by epithelial cells. Infection and Immunity, 2003, 71(10):5633-5639. |
| [25] | Weigel P H, DeAngelis P L. Hyaluronan synthases: a decade-plus of novel glycosyltransferases. J Biol Chem, 2007, 282:36777-36781. |
| [26] | Jing W, DeAngelis P L. Dissection of the two transferase activities of the pasteurella multocida hyaluronan synthase: two active sites exist in one polypeptide. Glycobiology, 2000,10(9):883-889. |
| [27] | Thomas N K, Brown T J. ABC transporters do not contribute to extracellular translocation of hyaluronan in human breast cancer in vitro. Experimental Cell Research, 2010, 316(7):1241-1253. |
| [28] | Chong B F, Blank L M, Mclaughlin R, et al.Microbial hyaluronic acid production. Applied Microbiology and Biotechnology, 2005, 64(4): 341-351. |
| [29] | 范红结, 陆承平. 链球菌兽疫亚种毒力因子. 国人兽共患病学报, 2006,22(3):279-281. Fan H J, Lu C P. Streptococcus equi ssp. zooepidemicus virulence factor. Chinese Journal of Zoonoses, 2006,22(3):279-281. |
| [30] | 李尧, 蓝小玲, 李学如,等. 一种构建马链球菌兽疫亚种血红素受体基因缺失突变株的方法.微生物学报, 2010, 50(6):822-827. Li Y, Lan X L, Li X R, et al. Construction of in-frame deletion streptococcal hemoprotein receptor gene mutant in Streptococcus equi subsp. zooepidemicus. Acta Microbilogica Sinica, 2010,50(6):822-827. |
| [31] | Mao Z, Chen R R. 土壤杆菌重组合成透明质酸.食品与药品, 2013, 15(3):4-6. Mao Z,Chen R R. Agrobacterium restructuring hyaluronic acid synthesis. Food and Drug, 2013,15(3):4-6. |
| [32] | Widner B, Behr R, Dollen S V, et al. Hyaluronic acid production in Bacillus subtilis. Appl Environ Microbiol, 2005,71(7):3747-3752. |
| [33] | Mao Z C, Shin H D, Chen R. A recombinant E. coli bioprocess for hyaluronan synthesis. Appl Microbiol Biotechnol, 2009, 84(1):63-69. |
| [34] | Izawa N, Serata M, Sone T, et al. Hyaluronic acid production by recombinant Streptococcus thermophilus. Journal of Bioscience and Bioengineering, 2011, 111(6):665-670. |
| [35] | Simmons V L T, Kempner E S, Baggenstoss B A, et al. The Active streptococcal hyaluronan synthases (HASs) contain a single HAS monomer and multiple cardiolipin molecule. J Biol Chem, 1998, 273(40):26100-26109. |
| [36] | Weigel P H, Kyossev Z, Torres L C. Phospholipid dependence and liposome reconstitution of purified hyaluronan synthase. J Biol Chem, 2006, 281(48):36542-36551. |
| [37] | Simmons V L T, Baron C A, Weigel P H. Characterization of the purified hyaluronan synthase from Streptococcus equisimilis. Biochemistry, 2004, 43(28): 9234-9242. |
| [38] | Weigel P H, Baggenstoss B A. Hyaluronan synthase polymerizing activity and control of product size are discrete enzyme functions that can be uncoupled by mutagenesis of conserved cysteines. Glycobiology, 2012, 22(10):1302-1310. |
| [39] | Kumari K, Weigel P H. Identification of a membrane-localized cysteine cluster near the substrate binding sites of the Streptococcus equisimilis hyaluronan synthase. Glycobiology, 2005, 15(5):529-539. |
| [40] | 张晋宇. 表达phbCAB基因对兽疫链球菌中乳酸及透明质酸产量的影响. 北京:清华大学,生命科学学院,2005: 52-55. Zhang J Y. Effect of Expressing PHB Synthesis Genes phbCAB Gene on Production of Latate and Hyaluronic Acid by Streptococcus zooepidemicus. Beijing, School of Life Science, Tsinghua University, 2005: 52-55. |
| [41] | Wu X M, Gao H J, Tian G, et al. Transformation of Streptococcus zooepidemicus with genes responsible for polyhydroxybutrate synthesis.Tsinghua Science and Technology, 2002,7(4):387-392. |
| [42] | Chong B F, Blank L M, Mclaughlin R, et al. Microbial hyaluronic acid production. Appl Microbiol Biotechnol, 2005, 66(4): 341-351. |
| [43] | Heldermon C, Kumari K, Simmons V L T, et al. Streptococcal hyaluronan synthases and the synthesis of designer hyaluronan. Elsevier Science, 2009, 7(1):41-50. |
| [44] | Pummill P E, DeAngelis P L. Alteration of polysaccharide size distribution of a vertebrate hyaluronan synthase by mutation.J Biol Chem,2003, 278(22):19808-19814. |
| [45] | Jing W, DeAngelis P L. Synchronized chemoenzymatic synthesis of monodisperse hyaluronan polymers. J Biol Chem, 2004, 279:42345-42349. |
| [46] | Medina A P, Lin J L, Weigel P H. Hyaluronan synthase mediates dye translocation across liposomal membranes. BMC Biochemistry, 2012, 13(2):1-9. |
| [47] | Kumari K, Baggenstoss B A, Parker A L, et al. Mutation of two intramembrane polar residues conserved within the hyaluronan synthase family alters hyaluronan product size. J Biol Chem, 2006, 281(17):11755-11760. |
| [48] | Sheng J Z, Ling PX, Zhu X Q, et al. Use of induction promoters to regulate hyaluronan synthase and UDP-glucose-6-dehydrogenase of Streptococcus zooepidemicus expression in Lactococcus lactis:a case study of the regulation mechanismof hyaluronic acid polymer. J Appl Microbiol, 2009, 107(1):136-144. |
| [49] | Chen W Y, Marcellin E, Hung J, et al. Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentration in Streptococcus zooepidemicus. The Journal of Biological Chemstry, 2009, 284(27):18007-18014. |
| [50] | Yu H, Stephanopoulos G. Metabolic engineering of Escherichiacoli forbiosynthesis of hyaluronic acid. Metab.Eng, 2008, 10(1):24-32. |
| [51] | Marcellin E, Chen W Y, Nielsen L K. Understanding plasmid effect on hyaluronic acid molecular weight produced by Streptococcusequi subsp. Zooepidemicus. Metabolic Engineering, 2010,12(1):62-69. |
 2015, Vol. 35
2015, Vol. 35




