文章信息
- 汤玉兰, 陈缵光, 成志毅
- TANG Yu-lan, CHEN Zuan-guang, CHENG Zhi-yi
- 多酶共固定化反应体系的研究进展
- Research Progress in Multi-enzyme Co-immobilization Reaction Systems
- 中国生物工程杂志, 2015, 35(1): 82-87
- China Biotechnology, 2015, 35(1): 82-87
- http://dx.doi.org/10.13523/j.cb.20150112
-
文章历史
- 收稿日期:2014-10-21
- 修回日期:2014-11-20
生物催化由于其高效的催化机制、独特的底物选择性以及反应的可控性,使其在化学、生物工程学及药品生产等领域具有广阔的应用前景[1]。在自然界中,存在许多级联生物催化反应,这些反应通常需要不同类型的酶高度有序地自组装成的多酶复合体(multienzyme complexes,MECs)参与,其通过提高中间产物在不同酶之间的转运浓度从而高效地完成催化反应[2, 3]。
受自然界中MECs的启发,越来越多的研究者运用单酶固定技术成功地在各种载体上固定多种酶。体外多酶共固定化体系可明显提高酶的稳定性,缩小酶与反应物之间的距离,增大酶周围的反应物浓度,并将不同酶的催化特性结合起来,从而提高酶催化效率[4];此外,多酶体系也适用于原位辅酶再生反应过程,极大的降低了大规模生物催化反应的成本[5]。然而,基于单酶固定化技术的多酶共固定化技术仍存在许多挑战:首先,多酶共固定化技术需要考虑单个酶的结构和功能,优化出最佳条件保持每个酶的活性及稳定性;其次,载体应具有良好的兼容性从而不影响酶活性,并且保证载体具有最大载酶量;最后,有效控制不同酶在载体中的位置,减少固有的内在扩散限制[6]。
近年来,随着酶工程技术的不断发展,多酶共固定化技术的研究正在迅速堀起,并在生物、医药、环境等领域取得了许多新成果。本文对多酶反应体系的类别进行了归纳,重点讨论了多酶共固定化技术及其特点,并简单介绍其相关应用。 1 多酶反应体系的分类
在自然界中,我们可以在细胞内不同代谢途径中发现大量的多酶级联反应,这些反应通常需要两种或两种以上的酶参与完成,由于这些反应体系具备独特的优点,如反应条件温和、催化效率高、专属性强等倍受关注[7],其中Ricca等[8]对体外多酶级联反应体系进行研究,并将多酶生物催化反应体系分为四类(如图 1):(1)线性级联反应,即单个底物经酶催化为一个或多个中间物后转化为单个最终产物(a);(2)正交级联反应,即酶将底物转化为产物后在辅助底物存在时参与酶2反应以便辅因子或辅助底物再生,或者移除生成的副产物,使反应向正方向进行(b);(3)并行级联反应,即两种底物经两种不同生物催化反应体系在辅酶或辅助底物的协同下转化为两种产物(c);(4)循环级联反应,即多个底物可选择性地被转化为一个中间物,随后又转化为最初原料进行重复循环反应(d)。早期,这些多酶级联反应体系就广泛应用于化学有机合成和生物合成中,酶催化合成既可单个酶催化一个反应,也可充分使用多个酶并行或连续地合成更多复杂的化合物[9]。
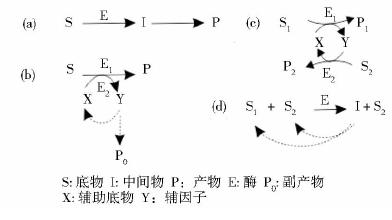
|
| 图 1 四类酶级联反应示意图 Fig. 1 Four different “designs” of enzymatic cascade processes (a) Linear cascade (b) Orthogonal cascade (c) Parallel cascade (d) Cyclic cascade |
在归纳以上四种不同多酶反应体系的基础上,不少酶工程专家对其生物催化体系进行了体外模拟,其中多酶共固定化技术也逐渐得到完善。常见的多酶共固定化形式主要有两类,即多种不同类别的酶固定在相同或不同的载体上和酶与酶之间交联聚集,其中共固定化方法通常建立在单酶固定技术的基础上,包括多位点共价键和、物理包埋、物理吸附、位点特异性亲和作用、DNA定向自组装固定,交联酶聚集,如图 2所示,还可多种技术混合使用。
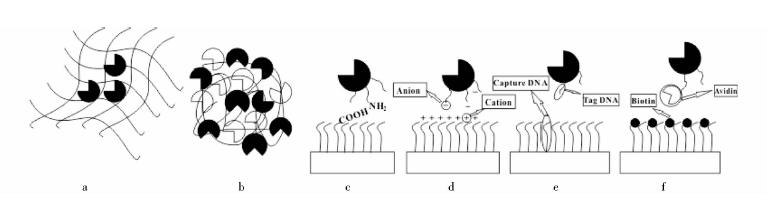
|
| 图 2 常见固定化技术示意图Fig. 2 Illustration of representative examples of immobilization technique(a) Physical entrapment (b) Cross-linked enzyme aggregates (c) Covalent binding (amide bond formed by carboxyl and amine groups) (d) Physical adsorption (ionic interaction) (e) DNA hybridization directed self-assembly of enzymes on carriers (f) Affinity binding (biotin-streptavidin interaction) |
共固定在相同的载体上有利于缩小酶与酶之间的距离,容易从混合物中分离出酶,增加其重复使用率,并有利于提高酶的稳定性[10]。常用的共固定化方法主要为化学或物理机制,常见的载体主要有二氧化硅、琼脂糖凝胶、壳聚糖膜、多孔玻璃微珠、纤维素、硅藻土和环氧树脂等。 2.1.1 共价固定法
化学固定法一般是通过酶上的氨基、羧基、巯基、羰基等功能基团将酶固定在载体表面,多位点共价键是酶固定中最强的化学键之一,该固定方法可防止载体上的酶脱落,增强酶的稳定性,但比较难实现。Li等[11, 12]将医疗毛细管内表面修饰上醛基,通过与酶上的氨基键和,将硫酸化胆汁酸水解酶和β-羟基类固醇脱氢酶共固定在管内壁,用于定量检测尿液中微量磺酸化胆汁酸,便于肝胆管疾病的诊断;随后,该团队用类似的方法将葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)同时固定在管壁内,实现了血清葡萄糖含量检测并用于糖尿病的诊断。共价固定法由于酶上多位点耦合对酶结构的取向缺乏可控性,因此该技术具有相对随机性,同时固定化过程易导致酶结构改变,影响酶活性。 2.1.2 物理包埋法
物理包埋固定技术适用于那些通过共价固定化技术易失活的酶,该方法固定条件温和,不易破坏酶的结构,但由于酶包埋在凝胶薄膜、微珠、纤维素等载体内,因此在转运过程中易导致底物或中间产物浓度扩散限制。Betancor等[13]运用包埋法将硝基苯硝基还原酶和葡萄糖-6-磷酸脱氢酶同时包埋在二氧化硅微球内,这两种酶固定在同一区室中,利于还原型辅酶Ⅱ(NADPH)循环反应,从而可有效地将硝基苯连续转化为苯基羟胺。同样,Nakane等[14]将苹果酸和丙氨酸脱氢酶包埋固定在醋酸纤维素和醇盐锆混合凝胶纤维上,伴随着NADPH再生反应,用于食品、药品及化妆品常用原材料L-丙氨酸的生产,尽管该反应体系整体酶活性大约是自由酶活性的五分之一,但多次使用其生产率却仍然很高。这种基于多酶共固定化辅酶再生反应体系在生化合成中可极大的提高产物的纯度和产率,降低生产成本。 2.1.3 吸附法
吸附法主要是通过分子间作用力、疏水作用、离子键将酶固定在载体上,该法可以很好地保持酶结构的整体性,对酶活性和稳定性损伤较小,但载体上的酶容易脱落[15],并且和共价键和法相似,在吸附过程中,酶与载体的相互作用可控性较低,吸附具有随机性。Mandizadeh等[16]以干酵母细胞为模版采用溶胶-凝胶法合成了多孔纳米二氧化硅,并将GOx和过氧化氢酶吸附在生物合成的多孔纳米硅上,成功地用于除去水溶解氧。He等[17]利用酶上的负电荷与聚醚酰亚胺(PEI)上的正电荷,通过静电引力将乙酰胆碱酯酶(AChE)和胆碱氧化酶(ChOx)固定在PEI修饰的整体材料上,制备了简单的整体柱微反应器用于评估农药对酶的抑制作用。这种方法相比传统物理包埋和表面固定化方法具有反应条件温和、对空间取向可控等优点,将是酶固定技术深入研究的热点之一。 2.2 微通道上的连续固定化
微全分析体系(μ-TAS)随着微制备技术的发展不断得到广泛的应用,由于反应器微型化具有死体积小、试剂消耗少、分析时间缩短、低成本、高灵敏度等优点,因此长期吸引人们的广泛关注,并对其相关研究及应用不断深入,而微流控反应器与酶反应相结合正是发展方向之一[18]。
意识到在固定化过程中酶取向的重要性,专家们已对固定化酶取向的可控性进行了研究,其主要表现在线性级联反应体系中。Logan等[19]将蔗糖酶(INV)、GOx和HRP共固定在经修饰的微通道上,蔗糖经INV水解为葡萄糖和果糖,随后经GOx部分产生H2O2,最后在HRP作用下氧化Amplex Red产生较强荧光物质试卤灵,从而进行高灵敏度检测。氧化酶的顺序是随机的,微通道内酶是否以正确的顺序固定对最终产量起着关键性作用。Vong等[20]设计了一种可逆的生物催化微反应器,该体系是将脂酶CalB和HRP分别与DNA耦合后连续地固定在经DNA寡聚核苷酸修饰的微通道上,而GOx混合在流动相中,成功地在微反应器内实现了三酶级联反应,这种微反应器重复性较好,可将失活的酶洗脱下来用新酶重新固定而不需要更换毛细管,其操作简便可行,大大降低了生产的成本。 2.3 DNA定向固定化酶
在多酶共固定化过程中,每个酶的空间取向是很重要的,因为这直接决定酶与酶之间是否足够靠近用于协同地催化反应。DNA定向固定(DDI)法是一种可逆性和位点选择性的酶固定化技术,早期Niemeyer等[21]就对DDI技术的特点及应用作了详细的阐述。
DDI技术主要是利用DNA结构上特殊序列与酶上特异性碱基配对从而实现定向定位固定[22]。该方法可最大限度地保持酶活性,具有很好的应用前景。Wilner等[23]设计了一个由DNA条带自组装成的DNA骨架,并将GOx和HRP吸附固定在类似六边形的骨架上(图 3),有效地进行了酶级联催化反应,该体系的反应活性与DNA骨架的拓扑结构有关,合理的设计DNA条带可控制酶固定的相对位置,从而保持酶整体最大催化活性。
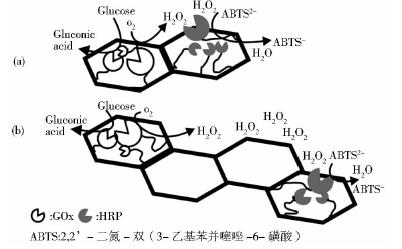
|
| 图 3 GOx和HRP组装固定在2个类六边形DNA条带和4个类六边形DNA条带上的酶级联反应示意图Fig. 3 Assembly of the GOx and HRP enzymes cascades on four-hexagon strips and two-hexagon(a) Two-hexagon strips (b) Four-hexagon strips |
生物亲和技术是另一种用于选择性、定向固定酶的方法,包括硼酸基亲和技术、固定化金属离子亲和技术、亲和素-生物素标记技术,后两者使用得较多[24]。Miyazaki等[25]利用组氨酸标记物特异性地与蛋白质N末端或C末端结合,然后吸附在镍(Ni2+)螯合的载体上,设计出一种可逆的酶固定化微反应器,只要使用还原剂或乙二胺四乙酸(EDTA)处理微通道即可将失活的酶洗脱下来用新的酶替换。Ganesana等[26]将组氨酸标记的乙酰胆碱酯酶固定在Ni/NiO纳米粒上,构建了稳定、灵敏的电化学丝网印刷生物传感器用于检测有机磷农药。Liu等[27]也将这种技术应用于UDP-半乳糖的生物合成中,这个合成途径中涉及到七种酶,所有酶都通过它们的六聚组氨酸标签固定在镍琼脂糖珠上,由于固定化酶生物催化的稳定性,因此相比溶液中的反应,该方法可获得较高的产率。尽管在固定过程中酶的空间结构无法控制,但固定的位点是可控的,所有的酶都可以通过N末端固定,从而避免了非特异性固定产生的酶失活。 2.5 交联酶固定化法
以上介绍的多酶共固定化技术都需要载体,然而,载体材料的存在可能会由于物质浓度扩散限制造成体系中部分物质不能被催化,并且有些载体材料较昂贵,生产成本大,因此无载体酶固定化技术成为研究的热点之一,目前,这种技术广泛用于酶固定主要为交联酶晶体(CLECs)和交联酶聚集(CLEAs)。CLECs涉及到酶的结晶且过程复杂,对酶纯度要求较高,很难实现多酶的固定化,限制了其应用[28]。Roessl等[29]对无载体固定化酶的制备条件、操作稳定性等作了较为全面的综述,为后续酶固定化技术的深入研究具有一定的指导意义。Talekar等[30]将α-淀粉酶、葡糖淀粉酶和普鲁兰酶同时交联聚集,制备了一个三酶生物催化体系,用于一锅法淀粉水解反应,该共固定化体系提高了酶热稳定性,相比自由酶淀粉水解率更高。Ba等[31]使用蛋白质亲和力强、可生物降解的壳聚糖作为交联剂将真菌漆酶和蘑菇酪氨酸酶交联聚集,交联聚集酶在较高的pH、温度条件下仍表现出较好的稳定性和活性,并将污水中酚类物质对乙酰氨基酚几乎完全转化为低聚物,该体系为处理污水中的酚类物质提供了一种重要的工具。 3 多酶共固定化反应体系的应用
体外模拟的共固定化多酶反应体系不仅具有类似体内生物催化的诸多优点如:缩小酶与酶之间的距离、增大了中间物的反应浓度、反应效率高等,同时也克服了体内生物催化体系的局限性如:体外模拟多酶反应体系更容易控制反应条件、可自由地选择反应底物、可得到高纯度的最终产物等[4, 32]。基于多酶反应体系的独特优势,其不仅用于化学有机合成和生物合成[13, 14, 27],也广泛应用于医药、食品及环境等领域中。
使用多酶共固定化反应体系可快速灵敏地检测体内物质如血糖、胆固醇等,为临床诊断提供了有用的依据。Yang等[33]以戊二醛为交联剂将GOx和HRP同时固定在醛基修饰的单分散的纳米SiO2颗粒上以测定血糖,该方法可达到0.22μmol/L检测限。此外,Zhang等[34]用碳纳米管修饰的玻碳电极固定胆固醇氧化酶和碱性磷酸酶,构建了一个选择性好,抗干扰力强的电化学生物传感器用于胆固醇分析,在临床诊断中人体血胆固醇水平的评估具有很好的应用前景。
同样,多酶共固定化体系对食品生产过程和环境污染程度起到监控的目的。Pal等[35]用交联剂16-膦酰基十六烷酸将胆碱氧化酶和过氧化物酶共价固定在实验室合成的氧化锌纳米膜(ZnONR)上,构建了可重复使用的化学发光胆碱纳米生物传感器,并成功应用于牛奶中添加剂胆碱含量检测。Odaci等[36]通过戊二醛将α-葡萄糖苷酶和吡喃糖氧化酶在壳聚糖的辅助下固定在石墨电极上,并用于啤酒中麦芽糖含量的分析,该双酶体系不需要样品前处理,操作简单、快速,结果可靠,可实时监测啤酒发酵过程。相似地,Gonzalez-Pombo等[37]在载体Eupergit C上构建的β-葡糖苷酶、α-阿拉伯糖苷酶和α-鼠李糖苷酶三酶共固定化体系被广泛用于葡萄酒生产业。基于酶结构和载体表面修饰性能,Zhao等[38]将ChOx和AChE固定在预先制备好的PDMS-PDDA(聚二烯基丙二甲基氯化铵)/AuNPs复合膜上,该传感器具有很好的稳定性且对剧毒有机磷类农药有独特的选择性,可快速检测环境中残留农药。 4 展 望
在过去的几十年里,多酶共固定化技术不断得到了发展,这些技术在提高酶的整体性能方面具有潜在的价值。多酶共固定化技术与单酶固定化方法有许多相同的特点,甚至有些单酶固定化方法被运用到多酶共固定化上,这直接影响了酶的取向和整体活性。在未来的多酶固定化研究中,我们必需考虑到每个酶的结构以及功能,合理的选择固定化方法和载体材料,优化出最佳的固定化条件从而保持酶最高的整体活性。同时,也期待多酶共固定化反应体系能走出实验室,设计出更多的多酶生物催化体系应用到附加值产品的工业化大生产中如生物柴油、药品、化妆品、营养品等,促使生产过程向环境友好型转化,进而降低生产成本,提高利润。今后,多酶共固定化技术仍面临着巨大的挑战,将多酶共固定化技术进一步完善,设计出可重复使用、耐受性好的多酶反应体系将成为科学界的热点之一。
| [1] | Tao J H,Xu J H.Biocatalysis in development of green pharmaceutical processes.Curr Opin Chem Biol,2009,13(1):43-50. |
| [2] | Reed L J.Multienzyme complexes.Accounts Chem Res,1974,7:40-45. |
| [3] | Najdi T S,Hatfield G W,Mjolsness E D.A 'random steady-state' model for the pyruvate dehydrogenase and alpha-ketoglutarate dehydrogenase enzyme complexes.Phys Biol,2010,7(1):1-8. |
| [4] | Rodrigues R C,Ortiz C,Berenguer-Murcia A,et al. Modifying enzyme activity and selectivity by immobilization.Chem Soc Rev,2013,42(15):6290-6307. |
| [5] | Wichmann R,Vasic-Racki D.Cofactor regeneration at the lab scale.Adv Biochem Eng Biot,2005,92:225-260 |
| [6] | Jia F,Narasimhan B,Mallapragada S.Materials-based strategies for multi-enzyme immobilization and co-localization: a review.Biotechnol Bioeng,2014,111(2):209-222. |
| [7] | Xue R,Woodley J M.Process technology for multi-enzymatic reaction systems.Bioresource Technol,2012,115:183-195. |
| [8] | Ricca E,Brucher B,Schrittwieser J Multi-Enzymatic Cascade Reactions: Overview and Perspectives.Adv Synth Catal,2011,353(13):2239-2262. |
| [9] | Bruggink A,Schoevaart R,Kieboom T.Concepts of nature in organic synthesis: Cascade catalysis and multistep conversions in concert.Org Process Res Dev,2003,7(5):622-640. |
| [10] | Zubiolo C,Santos R C A,Carvalho N B,et al.Encapsulation in a sol-gel matrix of lipase from Aspergillus niger obtained by bioconversion of a novel agricultural residue.Bioproc Biosyst Eng,2014,37(9):1781-1788. |
| [11] | Li Y S,Liu W P,Gao X F,et al.Immobilized enzymatic fluorescence capillary biosensor for determination of sulfated bile acid in urine.Biosens Bioelectron,2008,24(4):538-544. |
| [12] | Li Y S,Du Y D,Chen T M,et al.A novel immobilization multienzyme glucose fluorescence capillary biosensor.Biosens Bioelectron,2010,25(6):1382-1388. |
| [13] | Betancor L,Berne C,Luckarift H R,et al.Coimmobilization of a redox enzyme and a cofactor regeneration system.Chem Commun,2006,(34):3640-3642. |
| [14] | Nakane K,Suye S I,Ueno T,et al.Coimmobilization of malic enzyme and alanine dehydrogenase on organic-inorganic hybrid gel fibers and the production of L-alanine from malic acid using the fibers with coenzyme regeneration.J Appl Polym Sci,2010,116(5):2901-2905. |
| [15] | Gupta R,Chaudhury N K.Entrapment of biomolecules in sol-gel matrix for applications in biosensors: problems and future prospects.Biosens Bioelectron,2007,22(11):2387-2399. |
| [16] | Mandizadeh F,Eskandarian M.Glucose oxidase and catalase co-immobilization on biosynthesized nanoporous SiO2 for removal of dissolved oxygen in water: corrosion controlling of boilers.J Ind Eng Chem,2014,20(4):2378-2383. |
| [17] | He P,Davies J,Greenway G,et al.Measurement of acetylcholinesterase inhibition using bienzymes immobilized monolith micro-reactor with integrated electrochemical detection.Anal Chim Acta,2010,659(1-2):9-14. |
| [18] | Koh W G,Pishko M. Immobilization of multi-enzyme microreactors inside microfluidic devices.Sensor Actuat B-Chem,2005,106(1):335-342. |
| [19] | Logan T C,Clark D S,Stachowiak T B,et al.Photopatterning enzymes on polymer monoliths in microfluidic devices for steady-state kinetic analysis and spatially separated multi-enzyme reactions.Anal Chem,2007,79(17):6592-6598. |
| [20] | Vong T,Schoffelen S,van Dongen S F M.A DNA-based strategy for dynamic positional enzyme immobilization inside fused silica microchannels.Chem Sci,2011,2(7):1278-1285. |
| [21] | Niemeyer C M,Boldt L,Ceyhan B,et al.DNA-directed immobilization: Efficient, reversible, and site-selective surface binding of proteins by means of covalent DNA-streptavidin conjugates.Anal Biochem,1999,268(1):54-63. |
| [22] | Vidotti M,Carvalhal R F,Mendes R K,et al.Biosensors based on gold nanostructures. Journal of the Brazilian Chemical Society,2011,22(1):3-20. |
| [23] | Wilner O I,Weizmann Y,Gill R,et al.Enzyme cascades activated on topologically programmed DNA scaffolds.Nat Nanotechnol,2009,4(4):249-254. |
| [24] | Turkova J.Oriented immobilization of biologically active proteins as a tool for revealing protein interactions and function.J Chromatogr B,1999,722(1-2):11-31. |
| [25] | Miyazaki M,Kaneno J,Kohama R,et al.Preparation of functionalized nanostructures on microchannel surface and their use for enzyme microreactors.Chem Eng J,2004,101(1-3):277-284. |
| [26] | Ganesana M,Istarnboulie G,Marty J L,et al.Site-specific immobilization of a (His)6-tagged acetylcholinesterase on nickel nanoparticles for highly sensitive toxicity biosensors.Biosens Bioelectron,2011,30(1):43-48. |
| [27] | Liu Z Y,Zhang J B,Chen X,et al.Combined biosynthetic pathway for de novo production of UDP-galactose: Catalysis with multiple enzymes immobilized on agarose beads.Chembiochem,2002,3(4):348-355. |
| [28] | Garcia-Galan C,Berenguer-Murcia A,Fernandez-Lafuente R,et al.Potential of different enzyme immobilization strategies to improve enzyme performance.Adv Synth Catal,2011,353(16):2885-2904. |
| [29] | Roessl U,Nahalka J,Nidetzky B. Carrier-free immobilized enzymes for biocatalysis.Biotechnol Lett,2010,32(3):341-350. |
| [30] | Talekar S,Pandharbale A,Ladole M,et al.Carrier free co-immobilization of alpha amylase, glucoamylase and pullulanase as combined cross-linked enzyme aggregates (combi-CLEAs): A tri-enzyme biocatalyst with one pot starch hydrolytic activity.Bioresource Technol,2013,147:269-275. |
| [31] | Ba S,Haroune L,Cruz-Morato C,et al.Synthesis and characterization of combined cross-linked laccase and tyrosinase aggregates transforming acetaminophen as a model phenolic compound in wastewaters.Sci Total Environ,2014,487:748-755. |
| [32] | Schoffelen S,van Hest J C M.Multi-enzyme systems: bringing enzymes together in vitro.Soft Matter,2012,8(6):1736-1746. |
| [33] | Yang H,Wei W,Liu S Q.Monodispersed silica nanoparticles as carrier for co-immobilization of bi-enzyme and its application for glucose biosensing.Spectrochim Acta A,2014,125:183-188. |
| [34] | Zhang H F,Liu R X,Zheng J B.Selective determination of cholesterol based on cholesterol oxidase-alkaline phosphatase bienzyme electrode.Analyst,2012,137(22):5363-5367. |
| [35] | Pal S,Sharma M K,Danielsson B,et al. A miniaturized nanobiosensor for choline analysis.Biosens Bioelectron,2014,54:558-564. |
| [36] | Odaci D,Telefoncu A,Timur S.Maltose biosensing based on co-immobilization of alpha-glucosidase and pyranose oxidase.Bioelectrochemistry,2010,79(1):108-113. |
| [37] | Gonzalez-Pombo P,Farina L,Carrau F,et al.Aroma enhancement in wines using co-immobilized Aspergillus niger glycosidases.Food Chem,2014,143:185-191. |
| [38] | Zhao W,Ge P Y,Xu J J,et al.Selective detection of hypertoxic organophosphates pesticides via PDMS composite based acetylcholinesterase-inhibition biosensor.Environ Sci Technol,2009,43(17):6724-6729. |
 2015, Vol. 35
2015, Vol. 35




