文章信息
- 薛玉文, 李铁军, 周家名, 陈莉
- XUE Yu-wen, LI Tie-jun, ZHOU Jia-ming, CHEN Li
- 多靶向RNA干扰技术在基因治疗中的应用与前景
- The Application and Perspectives of Multi-target RNAi in the Research and Development of Gene Therapy
- 中国生物工程杂志, 2015, 35(1): 75-81
- China Biotechnology, 2015, 35(1): 75-81
- http://dx.doi.org/10.13523/j.cb.20150111
-
文章历史
- 收稿日期:2014-10-30
- 修回日期:2014-11-24
2. 南通大学小核酸技术与应用研究所 南通 226016
2. Small RNA Technology and Application Institute, Nantong University, Nantong 226016, China
RNA干扰是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的同源mRNA(message RNA)高效特异性降解的现象。RNAi的发现为基因治疗开拓了一种新的途径。很多疾病的发生、发展是多因素、多基因、多条信号转导通路参与的结果,故要确定治疗疾病的有效分子靶点并非易事。RNAi技术的发现拓宽了研究者在疾病机制研究和基因治疗药物开发上的新思路并取得了一定进展。同时,随着RNAi技术的快速发展,靶向多种基因的siRNA可以用于治疗复杂因素导致的疾病,因此多靶向RNAi策略更多地被应用于RNAi的治疗研究中。本文将围绕RNAi技术的研究进展及RNAi治疗现状,特别是多靶siRNA目前的发展态势及其各种结构性修饰展开综述。 1 RNAi技术 1.1 RNAi的作用机制与技术优势
RNAi的作用机制为:不同来源的长dsRNA在细胞内被Dicer酶切割成19~23个碱基对(base pair,bp)的小干扰RNA,并与相关蛋白质分子形成RNA诱导沉默复合体(RNA-inducing silence complex,RISC),最终导致特异性转录后基因沉默效应(posttranscriptional gene siliencing,PTGS)[1]。RNAi技术在疾病治疗和新药开发中具有显著优势:①高特异性:siRNA严格按照碱基互补配对原则与mRNA位点结合,降解与之互补的单个内源性mRNA;②高效性:RNAi有级联放大效应,少量dsRNA分子就能产生强烈的RNAi效应;③高稳定性:dsRNA可被细胞内的Dicer酶切割为siRNA,由于siRNA 3′端悬垂TT或UU碱基的化学性质稳定,即使不进行化学修饰也能避免细胞内核酸酶类的降解[2]。 1.2 siRNA结构性修饰
经典的siRNA结构是由Dicer酶自然切割而产生的dsRNA,但为了提高siRNA的沉默效率,不同结构性修饰的siRNA已广泛应用于研究中,如平端19bp siRNA[3]、短发夹siRNA[4]、不对称短双链siRNA[5]及哑铃形siRNA[6]等。还有另外一种是设计成长链siRNA的结构用于模拟Dicer酶底物,被称为“Dicer底物siRNA”[7]。 2 RNAi药物与临床应用
RNAi技术的发现大大缩短了药物研发的时间,目前一些全球性大制药公司,如诺华和默克都在积极地进行基于RNAi技术的药物开发。但RNAi药物的应用必须依赖于安全、高效且无毒副作用的传输系统。在过去几年中,RNAi药物传输系统的研发进展迅速[8],已从局部的体外研究发展到局部和全身的体内研究。临床试验证明这些传输系统能有效地将siRNA药物传递到组织和细胞中。例如,第一个应用于临床治疗年龄相关性黄斑变性(age-related macular degeneration,AMD)和糖尿病性眼病的siRNA,通过玻璃体内直接注射使这些siRNA药物可直接输送到眼部组织[9],从而抑制血管增生、水肿和渗出。自2011年以来约有30种至少治疗16种疾病的候选siRNA药物处于临床和临床前试验阶段[10, 11](表 1)。
| 药物 | 治疗疾病 | 传输方式 | 用药路径 | 靶基因 | 临床 |
| siRNA-EphA2-DOPC | 进展期实体瘤、癌 | 中性脂质体 | 静脉注射 | EphA2 | I期 |
| iPsiRNA | 转移性黑色素瘤 | 电穿孔 | 间接体内注射、皮肤 | LMP2、LMP7、MECL1 | I期 |
| SV40 vectors carrying siRNA | 慢性粒细胞白血病 | SV40载体 | 静脉注射 | BCR-ABL | I期 |
| CALAA-01 | 实体癌 | RONDEL | 静脉注射 | RRM2 | I期 |
| Atu027 | 进展期实体癌 | AtuPLEX | 静脉注射 | PKN3 | I期 |
| QPI-1007 | 视神经萎缩 | 裸siRNA | 玻璃体内 | Caspase-2 | I期 |
| PRO-040201 | 高胆固醇血症 | SNALP | 静脉注射 | Apo B | I期 |
| TKM-080301 | 癌症 | SNALP | 静脉注射 | PLK1 | I期 |
| ND-L02-s0201 Injection | 肝硬化 | 耦合维生素A脂质体 (VA-lip) | 介入性 | HSP47 | I期 |
| TD101 | 先天性厚甲症 | 裸siRNA | 介入性 | Keratin 6a (N171K) | I期 |
| ALN-TTR01 | 淀粉样变性 | SNALP | 静脉注射 | TTR | I期 |
| EZN-2968 | 癌,淋巴瘤 | 裸LNA | 静脉注射 | HIF-1a | I期 |
| EZN-2968 | 肿瘤,肝转移 | 裸LNA | 静脉注射 | HIF-1a | I期 |
| ALN-PCS02 | 高胆固醇血症 | SNALP | 静脉注射 | PCSK9 | I期 |
| PRO-040201 | 高胆固醇血症 | SNALP | 静脉注射 | Apo B | I期 |
| ALN-VSP02 | 肝癌/实体瘤 | SNALP | 静脉注射 | KSP和 VEGF | I/II期 |
| I5NP | 急性肾损伤/移植肾功能延迟恢复 | 裸siRNA | 静脉注射 | P53 | I/II期 |
| SYL1001 | 眼痛/干眼症 | 裸siRNA | 眼药点滴 | TRPV1 | I/II期 |
| I5NP | 移植肾功能延迟恢复/其他肾移植并发症 | 裸siRNA | 静脉注射 | P53 | I/II期 |
| AGN211745/ Sirna-027 | 年龄相关黄斑变性 | 裸siRNA | 玻璃体内 | VEGF-R1 | II期 |
| Bevasiranib/Cand5 | 糖尿病性黄斑水肿 | 裸siRNA | 玻璃体内 | VEGF | II期 |
| SYL040012 | 高眼压症/开角型青光眼 | 裸siRNA | 眼药点滴 | ADRB2 | II期 |
| siG12D LODER | 胰腺导管腺癌/胰腺癌 | LODER | EUS活探针 | KRASG12D | II期 |
| PF-04523655 | 糖尿病性黄斑水肿 | 裸siRNA | 玻璃体内 | RTP801 | II期 |
| ALN-RSV01 | 肺移植后呼吸道合胞病毒感染 | 裸siRNA | 雾化 | RSV Nucleocapsid | II期 |
| PF-04523655 | 年龄相关黄斑变性 | 裸siRNA | 玻璃体内 | RTP801 | II期 |
| FANG vaccine | 卵巢癌/结肠癌 | 电穿孔 | 介入性 | Furin和GM-CSF | II/III期 |
| Bevasiranib | 年龄相关黄斑变性 | 裸siRNA | 玻璃体内 | VEGF | III期 |
| ALN-TTR02 | 淀粉样变性 | SNALP | 静脉注射 | TTR | III期 |
| Note:RONDEL.RNA/oligonucleotide nanoparticle delivery system;SNALP.Stable nucleic acid lipid particle;VA-lip.耦合维生素A脂质体;LNA.Locked nucleic acid;TTR.Transthyretin;ADRB2.β-2 adrenergic receptor | |||||
在过去5年中,传输途径已经从局部发展到全身,此类物质具有更多优点而被用于全身给药,其中包括稳定核酸脂质颗粒[12]及RNA/寡核苷酸纳米[13]。在体内已证明了这些技术的有效性并在临床试验中(PRO-040201、TKM-080301、ALN-TTR01、ALN-PCS02、ALN-VSP02、CALAA-01等)也取得了显著的进步(表 1)。 3 多靶RNAi药物的研发与现状
靶向单个分子的RNAi药物通常不能满足如癌症等多基因或多因素引起的疾病,也不能满足如糖尿病、免疫性疾病等影响多个组织或细胞类型疾病的治疗。因此,有必要设计同时抑制疾病相关的多个关键基因的多靶siRNA以调控疾病的多个节点[14]。 3.1 多靶siRNA组合物
目前,用不同方法设计的多种siRNA的组合物已在治疗动脉粥样硬化[15]、癌症[16]、抑郁症[17]及神经退行性病[18]等方面进行了广泛研究。靶向趋化因子受体4(CXC chemokine receptor type 4,CXCR4)和脂肪酸合成酶配体(fatty acid synthase ligand,FasL)的多靶siRNA首次用于预防人类免疫缺陷病毒1(human immunodeficiency virus-1,HIV-1)的感染,多靶siRNA不仅在蛋白质和mRNA水平增强基因沉默效果,而且在基因功能上有更强的抗HIV-1感染能力,下调FasL介导的细胞凋亡能力强于单靶siRNA[19]。在抗肿瘤研究中,多靶SiRNA可同时干扰d 癌细胞中高表达,特别是对增殖或转移起正调控作用的基因,或对细胞凋亡负调控作用的基因。Menendez等[20]用RNAi技术同时沉默脂肪酸合成酶(fatty acid synthase,FAS)和人表皮生长因子2(erbB-2,HER2)原癌基因来研究两者之间的关系,发现HER2过表达的肿瘤细胞中用联合靶向FAS和HER2双基因的siRNA能同时抑制了Fas和HER2,诱导细胞凋亡。双靶向HER2和血管内皮生长因子(vascular endothelial growth Factor,VEGF)基因的siRNA能抑制乳腺癌和胃癌细胞的迁移、黏附及增殖[21]。有研究表明,相比单独沉默基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)或黏着斑激酶(focal adhesion kinase,FAK),联合沉默MMP9和FAK可明显降低小鼠黑色素瘤B16F10细胞的体外迁移、侵袭能力[22]。 3.2 基于Dicer底物的多靶siRNA
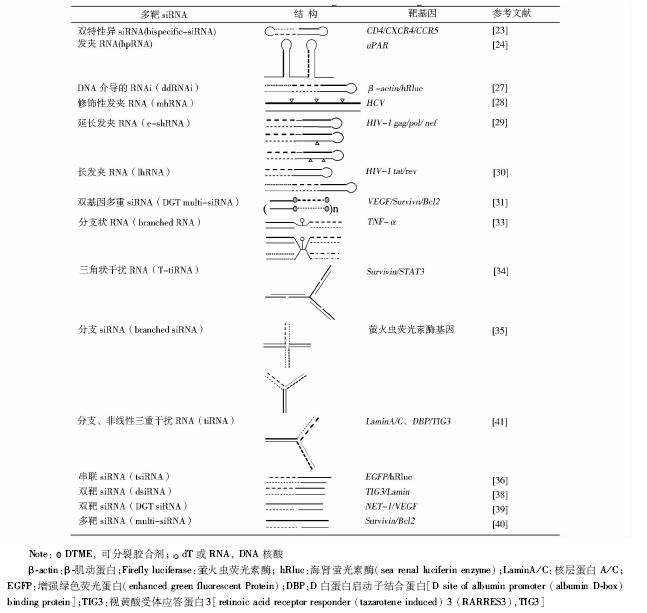
基于Dicer底物的多靶siRNA的特定结构与siRNA的功能密切相关,研究者设计了多种Dicer底物siRNA(表 2),主要有以下几类。
发夹RNA(hairpin RNA,hpRNA)是最简单的RNA二级结构,由单链RNA成环状形成双链,因此hpRNA也称为茎环结构RNA。Anderson等[23]用中间8个核苷酸间隔的双特异性hpRNA有针对性的抑制HIV-1感染细胞表面CXCR4、分化抗原4(cluster of differentiation 4,CD4)和CC趋化因子受体5(C-C chemokine receptor type 5,CCR5),hpRNA能显著下调细胞表面相应受体。在胶质瘤模型中直接瘤内注射针对MMP9和组织蛋白B(Cathepsin B)的hpRNA,抑制了MMP9和Cathepsin B的表达,显著抑制肿瘤生长并降低其侵袭能力,在腹腔内注射也可大大抑制肿瘤的生长,并能维持较长的作用时间。Gondi等[24]用靶向尿激酶型纤溶酶原激活剂受体(receptor of urokinase-type plasminogen activator,uPAR)和Cathepsin B的多靶shRNA,在体内模型瘤内注射的实验结果表明shRNA通过抑制uPAR和Cathepsin B发挥抑瘤作用。靶向uPAR、MMP9和其他尿激酶型纤溶酶原激活(urokinase-type plasminogen activator,uPA)等靶点的hpRNA也可用于评估脑膜瘤[25]和乳腺癌[26]的疗效。 3.2.2 长发夹siRNA
靶向多个基因的长发夹siRNA(long hairpin siRNA,lhRNA)可实现持续的基因沉默。DNA介导的RNAi(DNA-directed RNAi,ddRNAi)是lhRNA的一种,即通过ddRNAi载体将lhRNA转入细胞[27],已成功用于抗丙型肝炎病毒(hepatitis C virus,HCV)的临床试验。近年来报道了多种lhRNA的结构[28, 29],其中一种修饰性发夹RNA(modified hairpin-RNA,mhRNA)的长度超过100bp,其特点是在正义链中存在多个特异性的点突变[28],此mhRNA诱导的RNAi有效抑制了HCV的扩增,但未诱导干扰素效应。Liu等[29]设计了称为延长的发夹RNA(extended shRNA,e-shRNA),用携带两种有效siRNA的e-shRNA来对抗不同突变的HIV-1。lhRNA的另一类似结构称为启动子表达的长发夹RNA[30],lhRNA进入细胞后可被加工成多个siRNA,从而有效地治疗如HIV等快速变异型病毒性疾病。随着化学合成和修饰技术的快速发展,化学合成的siRNA比DNA载体介导的siRNA更广泛地用于RNAi的研究,化学合成的多靶siRNA还可与其他分子通过共轭键连接。Lee等[31]用靶向双基因的siRNA聚合物(dual gene targeting multimeric siRNA,DGT)形成双基因多重siRNA(DGT multi-siRNA),通过化学方法裂解成二硫键,具有比相应单靶siRNA或单靶siRNA混合物更高的基因沉默效应。针对生存素(Survivin)和B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl2)基因的DGT siRNA也可通过类似的方式增强细胞凋亡作用[31]。 3.2.3 分支siRNA
分支siRNA(branched siRNA)是通过对称折叠的双亚磷酰胺(phosphoramidite)形成2个或4个支链[32]。在肿瘤坏死因子-α(TNF-α)基因沉默的实验中证明了分支siRNA有类似于未经修饰的siRNA的抑制能力[33]。另一种分支siRNA称为三角状干扰RNA(tripodal interfering RNA,T-tiRNA)[34],即三角状亚磷酰胺核心结构与短DNA连接,T-tiRNA可携带3种siRNA或RNA拮抗剂同时沉默3个不同的mRNA或miRNA,在哺乳动物细胞中T-tiRNA可有效触发RNAi,获得较强的基因沉默效应,并且T-tiRNA比经典的siRNA传输效率高很多。此外,还有报道3或4分支的siRNA[35],这些独特的T-tiRNA进入细胞后通过Dicer酶切割形成20bp的siRNA从而诱导基因沉默。 3.2.4 线性多靶siRNA
线性多靶siRNA与上述hpRNA、分支siRNA结构不同,如用H1和U6启动子表达载体介导的串联siRNA(Tandem siRNA,tsiRNA)[36],携带两个siRNA的双链RNA,用于靶向HCV的治疗[37]。改良的tsiRNA可被细胞内的Dicer酶切割成功能性的siRNA靶向不同的基因,体外tsiRNA抑制HCV与普通siRNA相比更有效,且不会引起类miRNA的干扰素反应。Chang等[38]用合成的双靶siRNA(dual-target siRNA,dsiRNA)或38bp长度的dsiRNA均能特异性沉默两个靶基因而不引起非特异性干扰素效应。另外,结构设计成一条链上带缺口的长链双靶siRNA(DGT-siRNA)或多靶siRNA(multi-siRNA)[39, 40]同样可诱导序列特异性的基因沉默,而不引起显著的免疫反应。 4 结论与展望
RNAi沉默机制的高效性、特异性及稳定性使这项技术成为生物医学领域一次划时代的革命。运用多靶RNAi技术对疾病的基因治疗已取得了可喜的研究成果,部分研究已从体外试验过渡到体内试验,为疾病的临床治疗开辟了新的途径。本文总结RNAi的特点和RNAi疗法的现状,特别是多靶siRNA目前的发展态势及其Dicer底物的各种结构性修饰,通过使用这些结构修饰的siRNA,使基因沉默的效率得到了提高,避免了细胞毒性作用,降低或不引起非特异性内源免疫反应。近年来已开发的靶向疾病病理过程中多种靶基因的siRNA新药已进入临床试验阶段,临床研究表明基于siRNA技术的靶向治疗已取得了实质性的疗效和安全的结果。许多siRNA的药物已被成功地传递到多种组织器官中,如眼球、皮肤、肝及肺组织。另外,单靶或多靶siRNA也可以通过与其他生物药物和/或化学药物,如单克隆抗体药物和/或化疗药物联合用于疾病的治疗。我国研究者也在RNAi领域开展了广泛而深入的研究[42, 43],在多靶RNAi技术的研究中也取得了一定的进展[22, 39, 40, 44],为RNAi药物的应用提供了理论基础,也为复杂疾病的基因治疗供了新的思路。
但在这项技术广泛应用于临床前,仍存在一些问题亟待解决。目前主要面临的挑战有:①如何将siRNA安全及有效地导入细胞,并使其在体内稳定表达,即需要确保体内递送siRNA的安全性和有效性。②对于多基因疾病,如何选择合适的靶分子,既将协同效应发挥到最大,又不互相干扰,不影响正常表达的基因,不产生长双链RNA所引起的干扰素效应。③siRNA是否能完全关闭靶基因的表达,细胞是否存在内在的RNAi现象,从而对外源性导入的siRNA产生抵抗。④尽管siRNA结构修饰已取得成功,但更进一步的研究和发展不同修饰的作为治疗剂的功能化siRNA仍需进一步验证。随着RNAi技术的不断成熟,多靶siRNA的作用机制、有效性和安全性等问题将逐一被解决,该项技术一定能在疾病基因治疗的核酸药物开发中得到更广泛的应用。
致谢 感谢江苏省南通市社会发展课题(HS2014011)对本研究的资助。
| [1] | Wu J, Huang W, He Z. Dendrimers as carriers for siRNA delivery and gene silencing: a review. Scientific World Journal, 2013(2013):630 654. |
| [2] | Snøve O Jr, Rossi J J. Expressing short hairpin RNAs in vivo. Nat Methods, 2006, 3(9):689-695. |
| [3] | Czauderna F, Fechtner M, Dames S,et al. Structural variations and stabilising modifications of synthetic siRNAs in mammalian cells. Nucleic Acids Res, 2003, 31(11):2705-2716. |
| [4] | Ge Q, Ilves H, Dallas A, et al. Minimal-length short hairpin RNAs: the relationship of structure and RNAi activity. RNA, 2010, 16(1):106-117. |
| [5] | Seo M, Lee S, Kim J H, et al. RNAi-based functional selection identifies novel cell migration determinants dependent on PI3K and AKT pathways. Nat Commun, 2014,5:5217. |
| [6] | Abe N, Abe H, Ito Y. Dumbbell-shaped nanocircular RNAs for RNA interference. J Am Chem Soc, 2007, 129(49):15108-15109. |
| [7] | Sørensen D R, Sioud M. Systemic delivery of synthetic siRNAs. Methods Mol Biol, 2010, 629:87-91. |
| [8] | Kaiser P K, Symons R C, Shah SM, et al. RNAi-based treatment for neovascular age-related macular degeneration by Sirna-027. Am J Ophthalmol, 2010, 150(1):33-39. |
| [9] | Heidel J D, Yu Z, Liu J Y, et al. Administration in non-human primates of escalating intravenous doses of targeted nanoparticles containing ribonucleotide reductase subunit M2 siRNA. Proc Natl Acad Sci U S A, 2007, 104(14):5715-5721. |
| [10] | Leachman S A, Hickerson R P, Schwartz M E, et al. First-in-human mutation-targeted siRNA phase Ib trial of an inherited skin disorder. Mol Ther, 2010, 18(2):442-446. |
| [11] | Burnett J C, Rossi J J, Tiemann K. Current progress of siRNA/shRNA therapeutics in clinical trials. Biotechnol J, 2011, 6(9):1130-1146. |
| [12] | Zimmermann T S, Lee A C, Akinc A, et al. RNAi-mediated gene silencing in non-human primates. Nature, 2006, 441(7089):111-114. |
| [13] | Davis M E, Zuckerman J E, Choi C H, et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature, 2010, 464(7291):1067-1070. |
| [14] | Efferth T, Koch E. Complex interactions between phytochemicals. the multi-target therapeutic concept of phytotherapy. Curr Drug Targets, 2011, 12(1):122-132. |
| [15] | Lahoute C, Herbin O, Mallat Z, et al. Adaptive immunity in atherosclerosis: mechanisms and future therapeutic targets. Nat Rev Cardiol, 2011, 8(6):348-358. |
| [16] | Lu J J, Pan W, Hu Y J, et al. Multi-target drugs: the trend of drug research and development. PLoS One, 2012, 7(6):e40262. |
| [17] | Maes M, Fiar Z, Medina M, et al. New drug targets in depression: inflammatory, cell-mediated immune, oxidative and nitrosative stress, mitochondrial, antioxidant, and neuroprogressive pathways. And new drug candidates Nrf2 activators and GSK-3 inhibitors. Inflammopharmacology, 2012, 20(3):127-150. |
| [18] | Flight M H. Neurodegenerative diseases: new kinase targets for Alzheimer's disease. Nat Rev Drug Discov, 2013, 12(10):739. |
| [19] | Ji J, Wernli M, Klimkait T, et al. Enhanced gene silencing by the application of multiple specific small interfering RNAs. FEBS Lett, 2003, 552(2-3):247-252. |
| [20] | Menendez J A, Vellon L, Mehmi I, et al. Inhibition of fatty acid synthase (FAS) suppresses HER2/neu (erbB-2) oncogene overexpression in cancer cells. Proc Natl Acad Sci U S A, 2004, 101(29):10715-10720. |
| [21] | Tai W, Qin B, Cheng K. Inhibition of breast cancer cell growth and invasiveness by dual silencing of HER-2 and VEGF. Mol Pharm, 2010, 7(2):543-556. |
| [22] | 汤禾静, 唐照勇, 刘隆兴,等. siRNA联合沉默MMP9和FAK基因对小鼠黑色素瘤高转移细胞B16F10体外侵袭和迁移的影响. 中国生物工程杂志, 2014, 34(9):40-47. Tang H J, Tang Z Y, Liu L X, et al. Effect of siRNA combined silencing MMP-9 and FAK on invasion and migration of mouse melanoma highly metastatic cells B16F10 in vitro. China Biotechnology, 2014, 34(9):40-47. |
| [23] | Anderson J, Banerjea A, Akkina R. Bispecific short hairpin siRNA constructs targeted to CD4, CXCR4, and CCR5 confer HIV-1 resistance. Oligonucleotides, 2003, 13(5):303-312. |
| [24] | Gondi C S, Lakka S S, Dinh D H, et al. RNAi-mediated inhibition of cathepsin B and uPAR leads to decreased cell invasion, angiogenesis and tumor growth in gliomas. Oncogene, 2004, 23(52):8486-8496. |
| [25] | Kargiotis O, Chetty C, Gogineni V, et al. uPA/uPAR downregulation inhibits radiation-induced migration, invasion and angiogenesis in IOMM-Lee meningioma cells and decreases tumor growth in vivo. Int J Oncol, 2008, 33(5):937-947. |
| [26] | Kunigal S, Lakka S S, Gondi C S, et al. RNAi-mediated downregulation of urokinase plasminogen activator receptor and matrix metalloprotease-9 in human breast cancer cells results in decreased tumor invasion, angiogenesis and growth. Int J Cancer, 2007, 121(10):2307-2316. |
| [27] | Rice R R, Muirhead A N, Harrison B T, et al. Simple, robust strategies for generating DNA-directed RNA interference constructs. Methods Enzymol, 2005, 392:405-419. |
| [28] | Akashi H, Miyagishi M, Yokota T, et al. Escape from the interferon response associated with RNA interference using vectors that encode long modified hairpin-RNA. Mol Biosyst, 2005, 1(5-6):382-390. |
| [29] | Liu Y P, Haasnoot J, Berkhout B. Design of extended short hairpin RNAs for HIV-1 inhibition. Nucleic Acids Res, 2007, 35(17):5683-5693. |
| [30] | Sano M, Li H, Nakanishi M, et al. Expression of long anti-HIV-1 hairpin RNAs for the generation of multiple siRNAs: advantages and limitations. Mol Ther, 2008, 16(1):170-177. |
| [31] | Lee S H, Mok H, Jo S, et al. Dual gene targeted multimeric siRNA for combinatorial gene silencing. Biomaterials, 2011, 32(9):2359-2368. |
| [32] | Frieden M, Aviñó A, Tarrasón G, et al. Synthesis of oligonucleotide-peptide conjugates carrying the c-myc peptide epitope as recognition system. Chem Biodivers, 2004, 1(6):930-938. |
| [33] | Aviñó A, Ocampo S M, Perales J C, et al. Branched RNA: a new architecture for RNA interference. J Nucleic Acids, 2011, 2011(2011),ID586935. |
| [34] | Chang C I, Lee T Y, Kim S, et al. Enhanced intracellular delivery and multi-target gene silencing triggered by tripodal RNA structures. J Gene Med. 2012, 14(2):138-146. |
| [35] | Nakashima Y, Abe H, Abe N, et al. Branched RNA nanostructures for RNA interference. Chem Commun (Camb), 2011, 47(29):8367-8369. |
| [36] | Shin D, Lee H, Kim S I, et al. Optimization of linear double-stranded RNA for the production of multiple siRNAs targeting hepatitis C virus. RNA, 2009, 15(5):898-910. |
| [37] | Suhy D A, Kao S C, Mao T, et al. Safe, long-term hepatic expression of anti-HCV shRNA in a nonhuman primate model. Mol Ther, 2012, 20(9):1737-1749. |
| [38] | Chang C I, Kang H S, Ban C, et al. Dual-target gene silencing by using long, synthetic siRNA duplexes without triggering antiviral responses. Mol Cells, 2009, 27(6):689-695. |
| [39] | Wu Y Y, Chen L, Wang G L, et al. Inhibition of hepatocellular carcinoma growth and angiogenesis by dual silencing of NET-1 and VEGF. J Mol Histol, 2013, 44(4):433-445. |
| [40] | Peng W, Chen J, Qin Y, et al. Long double-stranded multiplex siRNAs for dual genes silencing. Nucleic Acid Ther, 2013, 23(4):281-288. |
| [41] | Chang C I, Lee T Y, Yoo J W, et al. Branched, tripartite-interfering RNAs silence multiple target genes with long guide strands. Nucleic Acid Ther, 2012, 22(1):30-39. |
| [42] | 蒋婷婷, 温晓霞, 陈尧. 沉默 c2orf68 基因对结直肠癌细胞增殖的影响. 中国生物工程杂志, 2014, 34(2):7-13. Jiang T T, Weng X X, Chen Y. Effect of silencing c2orf68 gene on the proliferation of colorectal adenocarcinoma cells. China Biotechnology, 2014, 34(2):7-13. |
| [43] | 王鑫, 陈玲, 陆航,等. RNAi沉默CXCR7对人结肠癌细胞 SW620特异性靶向抑制的实验研究.中国生物工程杂志, 2014, 34(2):14-20. Wang X, Chen L, Lu H, et al. Experimental study of specific targeted inhibition from RNAi silencing CXCR7 to human colon cancer cell SW620. China Biotechnology, 2014, 34(2):14-20. |
| [44] | Qin J, Xu Y, Li X, et al. Effects of lentiviral-mediated Foxp1 and Foxq1 RNAi on the hepatocarcinoma cell. Exp Mol Pathol, 2014, 96(1):1-8. |
 2015, Vol. 35
2015, Vol. 35