文章信息
- 唐德平, 毛爱红, 王芳, 张虹, 王黎, 廖世奇
- TANG De-ping, MAO Ai-hong, WANG Fang, ZHANG Hong, WANG Li, LIAO Shi-qi
- 适配体介导脂质体靶向递送siRNA的研究
- Targeted Delivery of siRNA Mediated by Aptamer Modified Liposome
- 中国生物工程杂志, 2015, 35(1): 54-60
- China Biotechnology, 2015, 35(1): 54-60
- http://dx.doi.org/10.13523/j.cb.20150108
-
文章历史
- 收稿日期:2014-06-27
- 修回日期:2014-08-11
2. 甘肃省医学科学研究院 兰州 730050
2. Institute of Gansu Medical Science Research, Lanzhou 730050, China
RNA干扰(RNA interference,RNAi)是一种由小干扰RNA(small interfering RNA,siRNA)介导的序列特异性转录后基因沉默现象[1]。RNAi在阐明基因功能、鉴定药物靶点、开发靶向治疗药物等方面具有广泛应用。自2004年第一个siRNA类治疗药物进入临床试验以来,现已证明与基因相关的疾病都可能成为siRNA潜在的靶点,如恶性肿瘤、病毒感染、遗传疾病、代谢紊乱等,siRNA类治疗药物在临床上有着广泛的应用前景[2]。但siRNA存在血液稳定性差,半衰期短,易降解等缺陷,siRNA特异、有效递送是siRNA类药物广泛应用的主要障碍之一[3]。
核酸适配体(aptamer)是一类可形成特异三维结构的DNA或RNA寡核苷酸分子,可与其靶分子高亲和力、高特异性结合。适配体具有分子量小、免疫原性低,可体外合成、改造与标记,被广泛研究用于临床检测、诊断及药物靶向递送[3]。目前,已有多种细胞表面膜蛋白特异的适配体被开发应用于药物靶向递送[4]。 A10适配体可与前列腺癌细胞膜表面抗原(prostate-specific membrane antigen,PSMA)的胞外域特异性结合[5],已被研究用于将化疗药物、siRNA靶向递送到前列腺癌细胞[6, 7, 8, 9, 10, 11, 12]。但A10适配体是含有71碱基的RNA分子,化学合成较为困难,限制了其在药物靶向递送中的应用。适配体A10-3.2是A10适配体从71到39碱基的截短体,更易化学合成,活性与特异性更高,是A10适配体的优化形式[13,14]。
为探讨PSMA特异性适配体介导的脂质体靶向递送siRNA的可行性,本研究将适配体A10-3.2的3′-末端连接胆固醇使其具有亲脂性,构建适配体-脂质体靶向递送体系,递送pEGFP-N1质粒和Bcl2 siRNA到前列腺癌细胞LNCaP(PSMA+)和PC-3(PSMA-),验证该体系靶向递送siRNA的可行性。 1 材料与方法 1.1 材 料
前列腺癌细胞系LNCaP(PSMA+)和PC-3(PSMA-) 购自中国科学院上海生命科学研究院细胞资源研究中心; PSMA特异性适配体A10-3.2、Bcl2 siRNA、CON siRNA和Bcl2、GADPH引物由TaKaRa合成,序列见表 1;Lipofectamine 2000购自Invitrogen,RPMI 1640、Ham’s F12-K培养基、胎牛血清购自Gibco公司;鼠抗人Bcl2单克隆抗体、鼠抗人β-actin单克隆抗体、HRP-山羊抗鼠IgG购自 Santa Cruz生物技术有限公司;TaKaRa MiniBEST Universal RNA Extraction Kit 和One Step SYBR PrimeScript Plus RT-PCR kit购自TaKaRa;RIPA细胞裂解液购自碧云天生物技术公司;Hochest 33258,PSMF购自Sigma公司;无内毒素质粒提取试剂盒购自天根生化科技(北京)有限公司。
| Name | Sequences | |
| AptamerA10-3.2 | 5′-GGGAGGACGAUGCGGAUCAGCCAUGUUU | |
| ACGUCACUCCU-Cholesterol with 2′- Fluor pyrimidines | ||
| Bcl2 siRNA | sense | 5′-AAGUGAAGUCAACAUGCCUGC-3′ |
| antisense | 5′-GCAGGCAUGUUGACUUCACUU-3′ | |
| CON siRNA | sense | 5′-AAUUCUCCGAACGUGUCACGU-3′ |
| antisense | 5′-ACGUGACACGUUCGGAGAAUU-3′ | |
| Bcl2 Primer | F | 5′-ATGTGTGTGTGGAGAGCGTCAA-3′ |
| R | 5′-ACAGTTCCACAAAGGCATCC-3′ | |
| GAPDH Primer | F | 5′-TCGCTCTCTGCTCCTCCTGTTC-3′ |
| R | 5′-CGCCCAATACGACCAAATCC-3′ | |
LNCaP(PSMA+)和PC3(PSMA-)分别培养在含10%胎牛血清的RPMI 1640和Ham’s F12-K培养基中,培养条件:37℃,5% CO2。 1.2.2 pEGFP-N1质粒转化与提取
pEGFP-N1质粒转化:pEGFP-N1质粒10μl 加入到200μl的感受态大肠杆菌DH5α中,混匀,冰浴30min,42℃水浴90s,冰浴5min后涂布含有氨苄青霉素的LB培养板,37℃正置1h后反置培养16h,挑取阳性克隆、扩增、按无内毒素质粒提取试剂盒说明书提取质粒,酶切电泳鉴定。 1.2.3 适配体-脂质体- pEGFP-N1靶向递送体系的构建
将提取好的pEGFP-N1质粒(1 000ng/μl)和脂质体各5μl分别稀释到250μl 转染培养基中,室温静置5min。将脂质体稀释液加入到pEGFP-N1质粒稀释液中,混合均匀,室温静置15min,形成脂质体-pEGFP-N1质粒复合物。将胆固醇修饰的PSMA适配体A10-3.2 与脂质体- pEGFP-N1复合物按摩尔比10∶1混合,37℃孵育1h,形成适配体-脂质体- pEGFP-N1质粒(Apt-LP-pEGFP-N1)复合物。 1.2.4 适配体-脂质体-siRNA靶向递送体系的构建
将Bcl-2 siRNA(20pmol/μl) 与Lipofectamine 2000按Invitrogen说明书推荐的比例进行混合,室温静置30min,形成脂质体-siRNA复合物。将胆固醇化的PSMA适配体A10-3.2 与脂质体-siRNA复合物按摩尔比10∶1混合,37℃孵育1h,形成适配体-脂质体-siRNA(Apt-LP- siRNA)复合物。 1.2.5 适配体-脂质体- pEGFP-N1质粒转染实验
LNCaP和PC-3分别接种于6孔细胞培养板中,接种细胞密度为1×105个/ml,当细胞融合度为60%左右时,去除培养基,PBS洗3次,分别加入适配体-脂质体(Apt-LP),脂质体- pEGFP-N1质粒(LP- pEGFP-N1)复合物,适配体-脂质体- pEGFP-N1质粒(Apt-LP- pEGFP-N1)复合物,37℃,5% CO2培养箱内共孵育6h,PBS洗细胞2次,换成含10%胎牛血清的相应培养基,继续培养48h,荧光倒置显微镜观察绿色荧光蛋白表达情况。以绿色荧光蛋白表达量表示转染效率,每组设三个平行。 1.2.6 适配体-脂质体-siRNA复合物转染实验
同1.2.5 ,PBS洗后的细胞中加入适配体-脂质体- Bcl2 siRNA复合物(Apt-LP-Bcl2 siRNA)、适配体-脂质体(Apt-LP),适配体-脂质体-Con siRNA (Apt-LP-Con siRNA),脂质体-Bcl2 siRNA (LP-Bcl2 siRNA)分别转染LNCaP(PSMA+)和PC-3(PSMA-)细胞6h后,PBS洗细胞2次,换成含10%胎牛血清的相应培养基,37℃,5% CO2条件下继续培养48h后,qRT-PCR检测Bcl2 mRNA表达水平,Western blot分析Bcl2蛋白表达水平。以未转染的LNCaP和PC-3为对照组(untreated),每组设三个平行。 1.2.7 qRT-PCR检测Bcl-2 mRNA表达水平
总RNA提取:参照TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒;Bcl2 mRNA表达水平的检测:qRT-PCR操作按One Step SYBR PrimeScript Plus RT-PCR kit试剂盒说明进行,以GAPDH为内参,反应条件如下: 42℃,5min,95℃,10s;95℃ 5 s,55℃,30 s,72℃,30s(40个循环)。Bcl2、GAPDH引物见表 1。 1.2.8 Western blot 分析Bcl-2 蛋白表达水平
取变性后的蛋白裂解液(蛋白含量约为20μg)进行SDS-PAGE电泳(分离胶为10%、浓缩胶4%、恒压80V电泳3h);冰浴,转PVDF膜(恒流150mA,2h);含5%奶粉的PBST室温封闭3h;加入鼠抗人Bcl2单克隆抗体(1∶1 000),4℃,摇床震荡,孵育过夜;PBST洗膜3次,加入HRP-山羊抗鼠IgG二抗(1∶1 000),室温孵育2h;PBST洗膜3次,加反应底物,显色成像,以β-actin为内参。 1.2.9 适配体-脂质体- Bcl2 siRNA 体外抗肿瘤效应分析
适配体-脂质体- Bcl2 siRNA复合物(Apt-LP-Bcl2 siRNA)、适配体-脂质体(Apt-LP)、适配体-脂质体-Con siRNA (Apt-LP-Con siRNA)、脂质体-Bcl2 siRNA(LP-Bcl2 siRNA)分别与LNCaP和PC-3细胞在37℃,5% CO2培养箱内共孵育6h,PBS洗细胞2次,换成含10%胎牛血清的完全培养基,继续培养48h后,加入1ml 4%多聚甲醛室温固定30min,PBS洗涤2次,加Hoechst 33258 染液(50ng/ ml)400μl,避光染色30min,荧光显微镜观察细胞凋亡。以未转染的LNCaP 和PC-3为对照组(untreated)。 2 结 果 2.1 适配体-脂质体靶向递送体系的递送效率分析
为验证适配体-脂质体的递送效率,以绿色荧光蛋白为报告基因,利用A10-3.2-脂质体靶向递送体系递送pEGFP-N1质粒到LNCaP 和PC-3细胞,48h后,荧光显微镜观察绿色荧光蛋白的表达情况(图 1A)。在LNCaP(PSMA+)细胞中,适配体-脂质体靶向递送体系递送效率(89.2%)显著高于单独的脂质体递送(56.8%),而在PC-3 (PSMA-)细胞中,适配体-脂质体体系递送效率(59.2 %)与单独脂质体的递送效率(56.6%)无显著差别(图 1B)。表明:适配体可以特异性提高脂质体-pEGFP-N1质粒转染靶细胞的效率,而不能提高脂质体-pEGFP-N1质粒转染非靶细胞的效率。
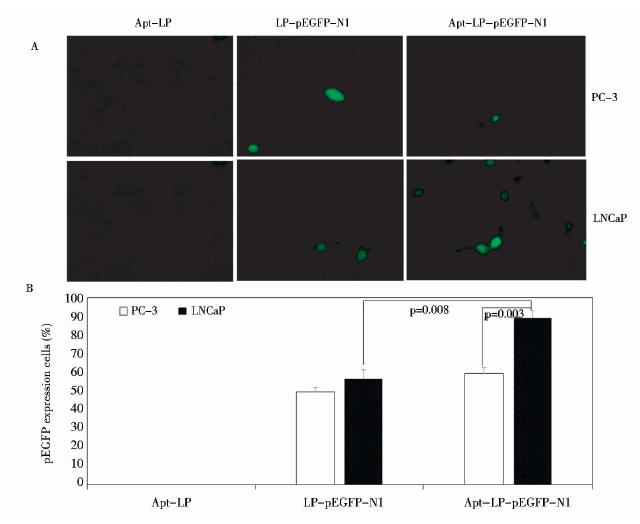
|
| 图 1 适配体-脂质体递送pEGFP-N1质粒效率分析 Fig. 1 The cellular uptake of Apt-LP-pEGFP-N1 in LNCaP(PSMA+)and PC-3(PSMA-)cells by fluorescence microscopyA Fluorescence microscopy images (10×) B The percent of green fluorescence protein expression cells |
为检验适配体-脂质体递送siRNA及诱导靶基因的沉默效应,将适配体-脂质体- Bcl2 siRNA复合物、适配体-脂质体(Apt-LP)、适配体-脂质体-Con siRNA (Apt-LP-Con siRNA)、脂质体-Bcl2 siRNA(LP-Bcl2 siRNA)分别转染LNCaP和PC-3细胞系,以未转染的LNCaP 和PC3为对照组(untreated)。37℃,5% CO2条件下培养48h后,提取总RNA,实时定量PCR分析Bcl-2 mRNA 的表达水平(图 2A),Western blot 分析Bcl2 蛋白表达水平(图 2B)。结果表明:与对照转染非靶siRNA(Apt-LP-Con siRNA)相比,LNCaP 和PC-3细胞系通过脂质体或适配体-脂质体转染Bcl2 siRNA后,Bcl2 mRNA及蛋白表达水平受到显著抑制;表明Bcl2 siRNA能够有效沉默Bcl2基因的表达。与单独脂质体转染Bcl2siRNA相比,Apt-LP- Bcl2 siRNA转染LNCaP(PSMA+)细胞后,显著抑制Bcl2 mRNA及蛋白表达水平,而Apt-LP- Bcl2 siRNA转染PC-3(PSMA-)细胞后,Bcl2 mRNA及蛋白表达水平无显著变化。表明适配体能特异性的提高脂质体-Bcl2 siRNA转染靶细胞的效率。
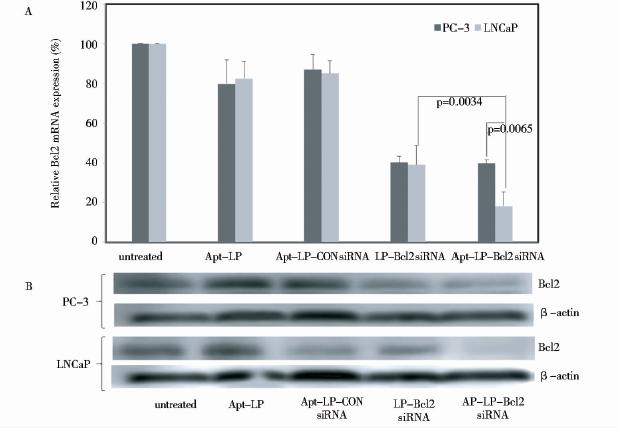
|
| 图 2 适配体-脂质体递送Bcl2 siRNA诱导的靶基因沉默效应分析Fig. 2 Apt-LP-siRNA mediated gene silencing (A)Bcl2 mRNA expression was analyzed by qRT-PCR at 48 h post-transfection of Bcl-2 siRNA. GAPDH as a reference gene (B)Bcl2 knocks down following LP-siRNA or Apt-LP-siRNA complexes delivery to LNCaP cells and processed for immunoblotting with anti-Bcl2 antibodies at 48 post-transfection. β-actin as a loading control |
为检验适配体-脂质体-Bcl2 siRNA体外抗肿瘤效应,采用了Hoechst 33258核染法分析适配体-脂质体-Bcl2 siRNA诱导的细胞凋亡(图 3)。与转染对照非靶siRNA(Apt-LP-Con siRNA)相比,LNCaP和PC-3细胞系通过脂质体或适配体-脂质体转染Bcl2 siRNA后,均有细胞凋亡发生(图 3A),表明Bcl2 siRNA能够有效诱导前列腺癌细胞凋亡。与单独脂质体转染Bcl2 siRNA相比,Apt-LP- Bcl2 siRNA转染高表达PSMA的LNCaP(PSMA+)细胞后,LNCaP(PSMA+)发生细胞凋亡的现象更加明显(图 3A),其结果与Apt-LP- Bcl2 siRNA 具有更高的Bcl2基因沉默效率相一致。而在低表达PSMA的PC-3(PSMA-)细胞系,靶向递送的Apt-LP- Bcl2 siRNA和非靶向递送的LP-Bcl2 siRNA,Bcl2 siRNA诱导的细胞凋亡无显著差异(图 3B)。表明适配体能特异性的提高脂质体-Bcl2 siRNA诱导靶细胞凋亡的比率。
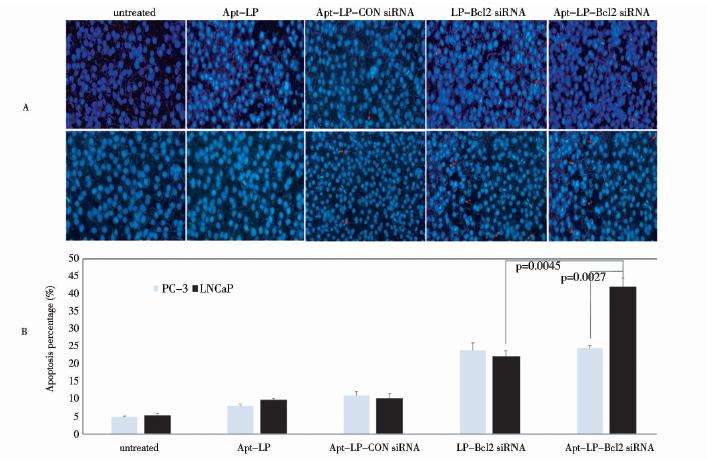
|
| 图 3 适配体-脂质体递送Bcl-2 siRNA体外诱导细胞凋亡分析Fig. 3 The apoptosis of LNCaP(PSMA+)and PC-3(PSMA-)cells treated with LP-siRNA or Apt-LP-siRNA complexesA The nuclear morphological changes by Hoechst staining were assessed. Control cells normally contained single round nuclei B The apoptotic rate of cell population was calculated as the ratio of apoptotic cells to total cells counted 100. The red arrows represent the apoptotic body |
PSMA是一种特异表达于前列腺上皮的膜蛋白,PSMA能够选择性吞噬PSMA配基,利用此特性可将外源功能性物质通过PSMA定向转入前列腺癌细胞内发挥作用[15]。PSMA适配体A9和A10可结合在纳米颗粒或多聚体体表面形成靶向递送复合物,高特异性地与细胞表面PSMA结合,靶向递送药物、毒素、纳米颗粒、siRNA、microRNA到LNCaP细胞[6, 7, 12, 16, 17, 18, 19];适配体也可直接与修饰或未修饰的siRNA嵌合,形成aptamer-siRNA嵌合体,Chu等[5, 12]利用抗生蛋白链菌素作为载体,将生物素化的siRNA和生物素化的PSMA适配体A9连接到载体蛋白,形成A9-抗生蛋白链菌素-siRNA复合物,此复合物能够在30分钟内进入细胞,并产生由siRNA介导的基因沉默,其靶基因抑制效应与转染质粒相当,但并不清楚复合物入胞后如何解离并发挥作用。McNamara等[10]将PSMA适配子A10与PlK-1和Bcl2基因的siRNA嵌合,形成A10 aptamer-siRNA嵌合体,该嵌合体可多次给药且被很好耐受,但由于该嵌合体转录产物的三维空间结构较难控制,无法得到普遍应用。
脂质体是一类较好的递送siRNA的载体。siRNA与脂类分子连接或包裹到脂质体中,能保护siRNA不被RNase降解,并提高siRNA膜通透性,从而促进细胞摄取。阳离子脂质体Transfectam和98N12-5作为递送载体已被成功应用于临床药物递送[2]。2009年,Cao等[20]成功构建了适配体功能化脂质体 (Apt-LP)递送化疗药物顺铂到乳腺癌细胞。本文利用A10-3.2作为靶向配基构建了适配子(A10-3.2) -脂质体-siRNA,可靶向递送siRNA到LNCaP细胞,与单纯的脂质体转染相比,转染效率提高,基因沉默效率增强,更有效的诱导靶细胞凋亡。表明适配子-脂质体是一种有效的药物靶向递送体系,具有潜在的临床应用价值。
| [1] | Boutros M, Ahringer J. The art and design of genetic screens: RNA interference. Nature Reviews Genetics, 2008. 9(7): 554-566. |
| [2] | Lares M R, Rossi J J, Ouellet D L, RNAi and small interfering RNAs in human disease therapeutic applications. Trends in Biotechnology, 2010. 28(11):570-579. |
| [3] | Bunka D H, Platonova O, Stockley P G. Development of aptamer therapeutics. Current Opinion in Pharmacology, 2010. 10(5): 557-562. |
| [4] | Yan A C, Levy M. Aptamers and aptamer targeted delivery. RNA Biol, 2009. 6(3): 316-320. |
| [5] | Lupold S E, Hicke B J, Lin Y,et al. Identification and characterization of nuclease-stabilized RNA molecules that bind human prostate cancer cells via the prostate-specific membrane antigen. Cancer Research, 2002. 62(14): 4029-4033. |
| [6] | Farokhzad O C, Jon S, Khademhosseini A,et al. Nanoparticle-aptamer bioconjugates a new approach for targeting prostate cancer cells. Cancer Research, 2004. 64(21): 7668-7672. |
| [7] | Cheng J, Teply B A, Sherifi I,et al. Formulation of functionalized PLGA-PEG nanoparticles for in vivo targeted drug delivery. Biomaterials, 2007. 28(5): 869-876. |
| [8] | Dhar S, Gu F X, Langer R,et al. Targeted delivery of cisplatin to prostate cancer cells by aptamer functionalized Pt (IV) prodrug-PLGA-PEG nanoparticles. Proceedings of the National Academy of Sciences, 2008.105(45): 17356-17361. |
| [9] | Dhar S, Kolishetti N, Lippard S J,et al. Targeted delivery of a cisplatin prodrug for safer and more effective prostate cancer therapy in vivo. Proceedings of the National Academy of Sciences, 2011. 108(5): 1850-1855. |
| [10] | McNamara J O, Andrechek E R, Wang Y, et al. Cell type-specific delivery of siRNAs with aptamer-siRNA chimeras. Nature Biotechnology, 2006. 24(8): 1005-1015. |
| [11] | Kim E, Jung Y, Choi Het al. Prostate cancer cell death produced by the co-delivery of Bcl-xL shRNA and doxorubicin using an aptamer-conjugated polyplex. Biomaterials, 2010. 31(16): 4592-4599. |
| [12] | Chu T C, Twu K Y, Ellington A D,et al. Aptamer mediated siRNA delivery. Nucleic Acids Research, 2006. 34(10): e73. |
| [13] | Wu X, Ding B, Gao J, et al. Second-generation aptamer-conjugated PSMA-targeted delivery system for prostate cancer therapy. Int J Nanomedicine, 2011. 6: 1747-1756. |
| [14] | Dassie J P, Liu X Y, Thomas G S, et al. Systemic administration of optimized aptamer-siRNA chimeras promotes regression of PSMA-expressing tumors. Nature Biotechnology, 2009. 27(9): 839-849. |
| [15] | Ghosh A, Heston W D. Tumor target prostate specific membrane antigen (PSMA) and its regulation in prostate cancer. Journal of Cellular Biochemistry, 2004. 91(3): 528-539. |
| [16] | Chu T C, Marks J W 3rd, Lavery L A, et al. Aptamer: toxin conjugates that specifically target prostate tumor cells. Cancer Research, 2006. 66(12): 5989-5992. |
| [17] | Farokhzad O C, Cheng J, Teply B A, et al. Targeted nanoparticle-aptamer bioconjugates for cancer chemotherapy in vivo. Proceedings of the National Academy of Sciences, 2006. 103(16): 6315-6320. |
| [18] | Pastor F, Kolonias D, Giangrande P H, et al. Induction of tumour immunity by targeted inhibition of nonsense-mediated mRNA decay. Nature, 2010. 465(7295): 227-230. |
| [19] | Wullner U, Neef I, Eller A, et al. Cell-specific induction of apoptosis by rationally designed bivalent aptamer-siRNA transcripts silencing eukaryotic elongation factor 2. Current Cancer Drug Targets, 2008.8(7): 554-565. |
| [20] | Cao Z, Tong R, Mishra A, et al. Reversible Cell-Specific Drug Delivery with Aptamer-Functionalized Liposomes. Angewandte Chemie International Edition, 2009. 48(35): 6494-6498. |
 2015, Vol. 35
2015, Vol. 35




